纤细席藻对重金属镍胁迫的响应研究
陈兰洲,汪 静,武艳芳,柯 檀,梁亚楠,刘思瑶
(1 武汉大学 资源与环境科学学院,湖北省环境修复技术研究中心,武汉430072;2武汉文科生态环境有限公司,武汉 430000)
纤细席藻对重金属镍胁迫的响应研究
陈兰洲1,汪 静1,武艳芳2,柯 檀1,梁亚楠2,刘思瑶1
(1 武汉大学 资源与环境科学学院,湖北省环境修复技术研究中心,武汉430072;2武汉文科生态环境有限公司,武汉 430000)
实验研究了纤细席藻Phormidiumtenue对重金属镍胁迫的光合生理响应及外源抗氧化剂的保护作用, 结果发现:在不同浓度Ni2+短期处理纤细席藻时,其荧光产量随处理时间先发生急剧下降,随后有所回升;荧光产量随着Ni2+浓度的增加而明显降低,在100 mg/L Ni2+浓度下荧光曲线的O、J、I、P相完全消失,光合活性(Fv/Fm)丧失. 经抗氧化剂抗坏血酸(ASC)和N-乙酰半胱氨酸(NAC)分别预处理的纤细席藻荧光产量有一定程度恢复,且ASC抗氧化作用相比NAC更加明显,但其保护作用均随着时间增加而逐渐减弱. 在不同浓度的Ni2+长期胁迫时,1 d内抑制作用显著,叶绿素a、光合活性及电子传递链光合参数(ET0/ABS、ET0/TR0、RC/CS0)下降显著,SOD活性升高. 实验结果表明:镍对纤细席藻的光合生理活性具有较强的抑制作用,而外源抗氧化剂可以短期内有效缓解重金属镍胁迫造成的损伤,因此在吸附去除重金属时可有效提高藻类的吸附效率和循环利用.
纤细席藻;镍;叶绿素荧光动态;抗氧化系统
镍是生物体的必需微量元素,可增加脲酶活性,调节氮代谢,刺激氮素和钾素积累,刺激植物生长. 缺Ni2+时会造成小球藻生长受阻,细胞缺绿,生物量减少[1]. 镍在自然界中以化合物的形式广泛存在,随着采矿、冶炼、电镀等工业的发展,大量镍进入到环境当中,引起水体、土壤及大气重金属污染. 重金属通过食物链发生生物富集,破坏生物体的正常生理代谢和功能甚至造成死亡. 通过各种途径进入水体的重金属首先会影响藻类生物,藻类对环境变化具有指示作用[2]. 当镍离子浓度≤2 mg/L小球藻和栅藻生长正常,而当镍浓度达到10 mg/L时,藻类生长几乎停止[3].
纤细席藻是光合自养型丝状蓝藻,藻丝发达,胞外多糖丰富,藻多糖为负电荷的多聚大分子,含有羧基、羟基、巯基等多种功能团,为重金属提供了大量的吸附位点,因此可以用泌糖蓝藻来吸附污水中的重金属[4]. 研究纤细席藻对重金属镍胁迫的响应机制,是研究纤细席藻吸附去除重金属作用机制的生理基础,能够进一步完善纤细席藻作为新型生物吸附剂在重金属环境治理上的应用.
1 材料与方法
1.1 实验材料
纤细席藻分离于宁夏沙坡头,经分离、纯化,保种于淡水培养物保藏中心(FACHB). 培养物于无菌操作台匀浆后接种到灭菌冷却至室温的BG-11培养基中,置于光照培养箱光强50 μE/(m2·s),25±1 ℃,24 h 持续光照,通气培养至对数期.
1.2 实验方法
将培养至生长对数期的纤细席藻转移至已灭菌的250 mL锥形瓶中,加入Ni2+储备液,使藻液中Ni2+最终浓度为0、5、10、20、50、100 mg/L. 在10、30、60、120、240、480 min测定纤细席藻的荧光参数. 同时在0、24、48、72 h时测定纤细席藻的叶绿素a含量、MDA含量、SOD活性以及荧光参数.
将培养至生长对数期的纤细席藻转移至已灭菌的250 mL锥形瓶中,分别加入ASC和NAC两种抗氧化剂使其终浓度为0.5 mol/L,预处理2 h后加入Ni2+储备液,终浓度为50 mg/L,在10、30、60、120、240、480 min测定纤细席藻的荧光参数.
1.2.1 荧光参数测定
取经不同浓度Ni2+处理后的纤细席藻藻液2 mL,置于暗盒中暗适应15 min后采用便携式植物效率分析仪(PEA,HanasatechR,UK)于室温下测定,激发光强为最大光强的50%(约1500 μE/(m2·s)),记录时间为5 s. 经处理后可获得叶绿素荧光诱导动力学曲线(O-JI-P)及其他荧光参数[5].
1.2.2 叶绿素a含量测定
取5 mL藻液,冷冻离心机离心(8000 r/min,10 min),弃上清液,收集藻体,加入5 mL 95 %乙醇,置4 ℃冰箱抽提浸取24 h,中间摇荡2~3 次以使叶绿素a充分溶出. 离心(8000 r/min,10 min)取上清液,分光光度计测定吸光度值D665和D649,经计算得叶绿素a含量[6].
1.2.3 丙二醛(MDA)含量测定
丙二醛含量测定采用硫代巴比妥酸法:取新鲜藻液5 mL,离心后倒去上清液,收集藻体,加入2 mL 10 %三氯乙酸(TCA),2 mL 0.6 %硫代巴比妥酸(TBA)(用碱溶液助溶,10 % TCA定容),混合均匀,100 ℃水浴20 min,冷却至室温后离心(8000 r/min,10 min),取上清液用紫外可见分光光度计分别测定其在450、532和600 nm处的吸光度,计算MDA含量[7].
1.2.4 SOD酶活性测定
SOD酶活性采用氮蓝四唑法:取新鲜藻液5 mL,离心(8000 r/min,10 min),收集藻体分别用磷酸缓冲液(0.1 mol/L,pH 7.8)洗涤藻细胞3次,加入5 mL磷酸缓冲液(0.1 mol/L,pH 7.8),冰浴超声破碎,低温离心,上清液即为粗酶提取液.加入粗酶液1.0 mL,分别加入3.1 mL磷酸缓冲液(50 mmol/L,含100 μmol/L EDTANa2),0.3 mL甲硫氨酸溶液(220 mmol/L),0.3 mL氯化硝基四氮唑蓝溶液(1.25 mmol/L),0.3 mL核黄素溶液(33 μmol/L). 混匀后,将一只对照管置于暗处,另取两支对照管和待测样品置于4000 Lux日光灯下反应20 min,反应结束后用黑布罩遮盖试管终止反应,具体计算方法见文献[8].
2 结果与讨论
2.1 Ni2+短期胁迫对纤细席藻叶绿素荧光动力曲线的影响
经过Ni2+处理后,纤细席藻的叶绿素荧光强度和荧光各相均发生了明显的变化(图1). 当体系中Ni2+浓度为50 mg/L时,随着胁迫时间的增加,纤细席藻的荧光动力曲线呈现出荧光强度及J、I、P各相先下降后有所恢复的趋势,在处理10 min时下降到最低,随后荧光动力学曲线出现一定程度的恢复. 在480 min时荧光强度较空白对照组降低,曲线形状良好,J、I、P各相均明显存在,表明电子传递链受阻并未中断. 由图1B可以看出,当不同浓度的Ni2+处理2 h后纤细席藻的叶绿素荧光诱导动力学曲线出现不同程度的变化. 5 mg/L Ni2+与20 mg/L处理下相对空白对照组的荧光强度几乎没有变化,P相稍有下降;10 mg/L时,其荧光可变强度和各相均出现上升;20 mg/L以上处理时,纤细席藻的荧光可变强度出现明显下降,J、I、P相均下降甚至完全消失,完全失去光合活性,电子传递链受阻严重而中断.
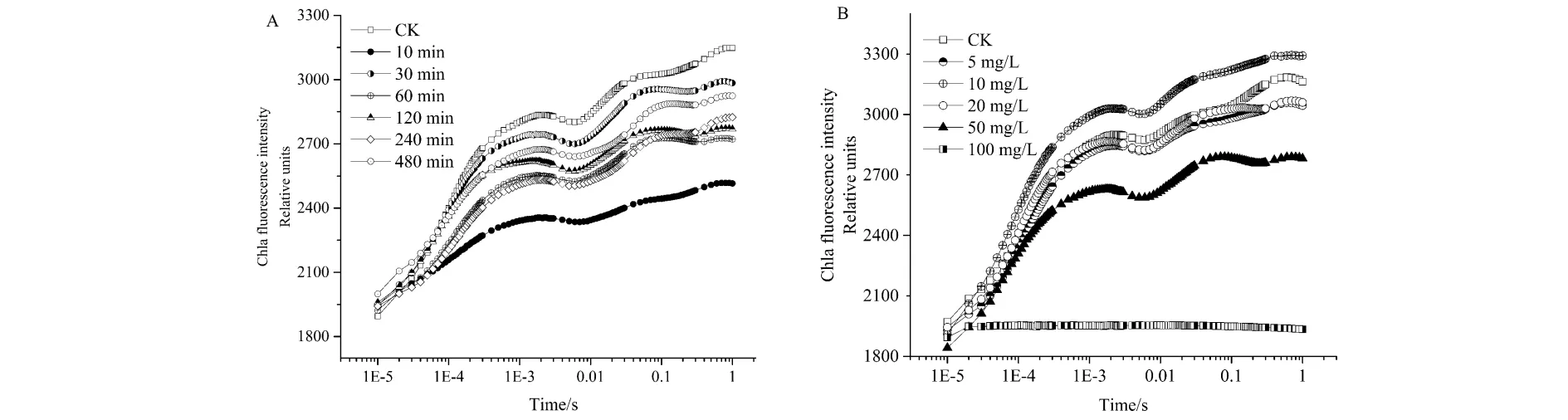
(A)50 mg/L Ni2+胁迫纤细席藻;(B)不同浓度Ni2+处理纤细席藻2 h图1 Ni2+对纤细席藻叶绿素荧光诱导动力学曲线的影响Fig.1 Effect of Ni2+ stress on the chlorophyll a fluorescence transients of Phormidium tenue
2.2 Ni2+短期胁迫下抗氧化剂对纤细席藻叶绿素荧光动力学曲线及光合活性(Fv/Fm)的影响
由图2可以看出,两种抗氧化剂预处理过的纤细席藻相对未处理过的,叶绿素荧光诱导动力曲线可变强度增大,J、I及P相荧光值均升高,但仍然低于空白对照组,表明Ni2+破坏了QA→QB传递过程,但抗氧化剂能够在一程度上减轻重金属对纤细席藻的胁迫影响,使电子传递不中断,光合系统PS Ⅱ能够正常进行光量子传递.Fv/Fm代表的是PS II的最大光化学量子产量,它的高低直接反映了PS II反应中心的光能转换效率,也称为最大PS II的光能转换效率. 图2B显示抗氧化剂预处理组的Fv/Fm值明显高于未处理组,甚至略高于空白对照组,而在240 min后发生明显下降,这可能是因为抗氧化剂的保护作用具有一定的时效性,随着时间的延长可能发生代谢分解.

(A) 叶绿素荧光诱导动力学曲线;(B)Fv/Fm图2 两种抗氧化剂对50 mg/LNi2+处理下纤细席藻叶绿素荧光诱导动力学曲线及Fv/Fm的影响Fig.2 Effects of two antioxidants treatment on the chlorophyll a fluorescence transients and Fv/Fm of Phormidium tenue stressed by 50 mg/L Ni2+
ET0/ABS代表反应中心吸收光能用于电子传递的量子产额,在Ni2+胁迫下纤细席藻用于电子传递的量子减少,抗氧化剂预处理过的纤细席藻即便受到相同浓度Ni2+的胁迫,其用于电子传递的量子增加明显,甚至高于空白对照组(表1). 50 mg/L Ni2+胁迫下纤细席藻ET0/TR0活性反应中心开放程度降低,而抗氧化剂预处理过的藻细胞活性反应中心开放有明显恢复.抗氧化剂预处理过的纤细席藻RC/CS0(单位面积内反应中心数量)较未处理过的增加18%左右,对比空白对照组却有所减少. 因此ASC和NAC均对纤细席藻的光合系统发挥了保护作用,缓解了逆境胁迫下藻细胞的氧化损伤.
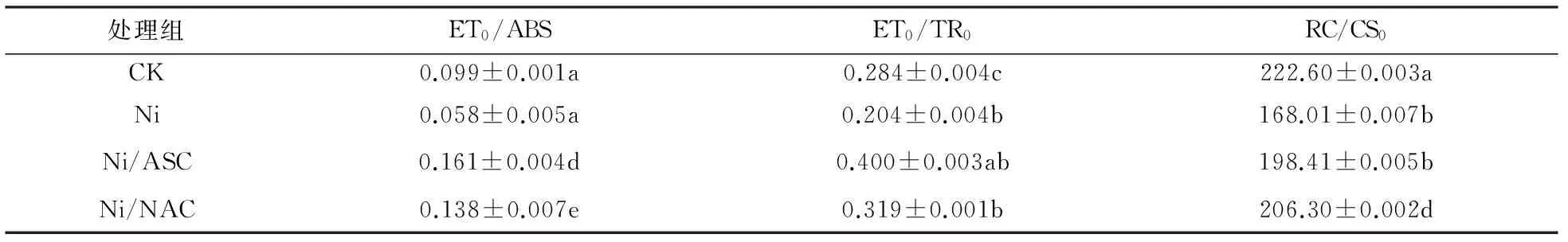
表1 抗氧化剂对Ni2+短期胁迫纤细席藻光合性能指数的影响Tab.1 Effects of Ni2+ on the photosynthetic parameters of Phormidium tenue
注:a、b、c、d、e表示使用单因素方差分析中在p<0.05的置信区间内数据之间的差异显著性
2.3 Ni2+长期对胁迫纤细席藻后叶绿素荧光动力曲线及Fv/Fm的变化
随胁迫时间的增加,Ni2+对纤细席藻光合效应的影响显著(图3). 5 mg/L Ni2+处理1 d后,纤细席藻的荧光强度降低不明显,J、P相发生下降. 5 mg/L及以上浓度处理时,可变强度逐渐降低,O、J、I、P各相下降. 100 mg/L Ni2+处理纤细席藻1 d时,叶绿素荧光诱导动力学曲线强度降到最低点,各相完全消失,表明积累的QA-完全被氧化,反应中心无法再接受光量子而失活. 随着时间的增加,各浓度处理组下QA→QB电子传递链受损程度加剧,在3 d时,高浓度(>50 mg/L)处理组的荧光强度明显下降,各相强度显著降低甚至消失. 图3D显示的是Ni2+长期胁迫下纤细席藻最大光化学效率(Fv/Fm)的变化.随着时间的延长和浓度的增加,Fv/Fm显著降低. 在1 d时,各处理组的Fv/Fm明显低于空白对照组(p<0.05),在3 d后Fv/Fm极显著降低(p<0.01). 100 mg/L处理组在1 d时Fv/Fm已下降到最低,光合系统失活.
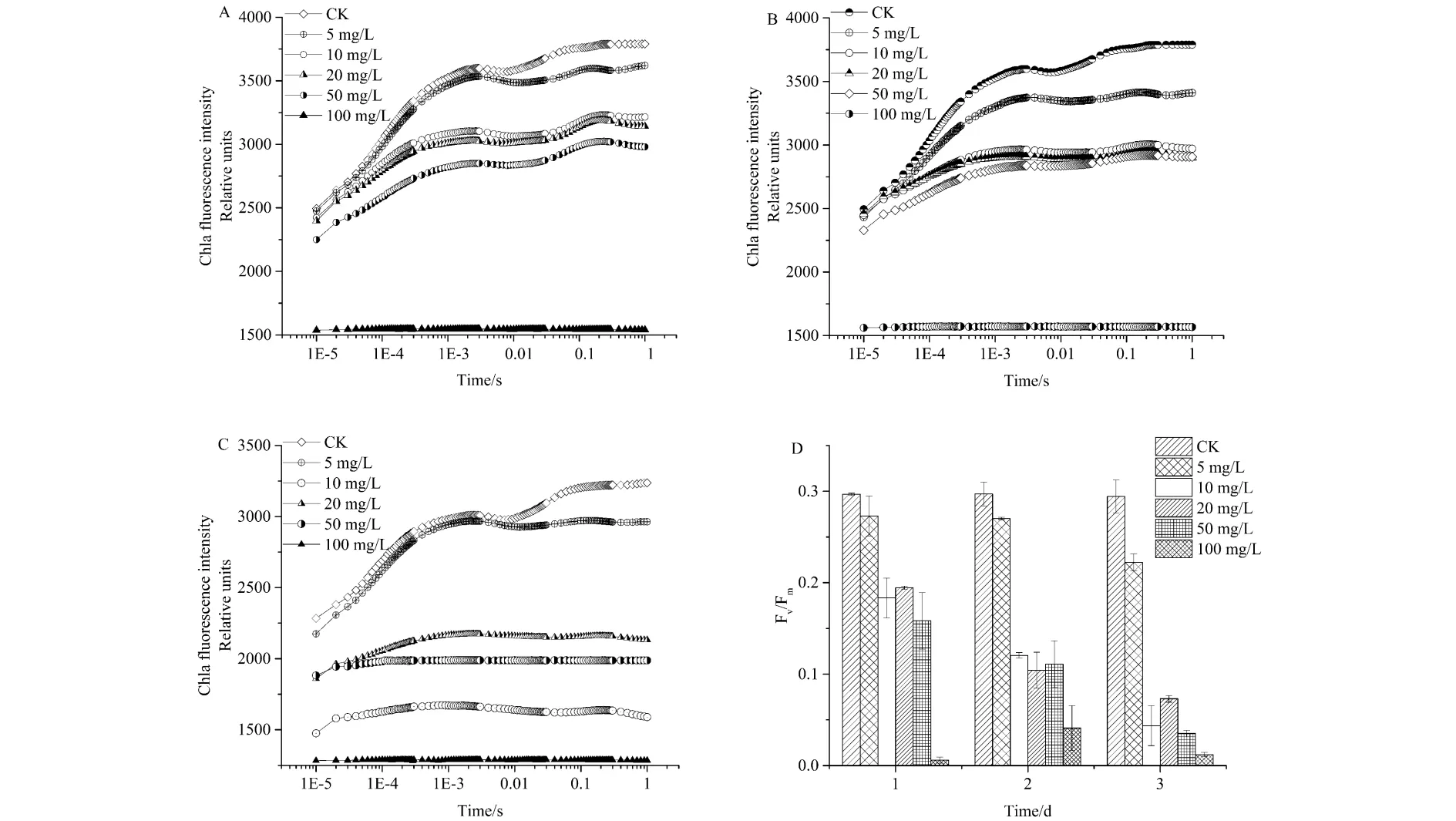
A)1d;B)2d;C)3d;D)Fv/Fm图3 Ni2+长期胁迫下纤细席藻叶绿素荧光诱导动力学曲线及Fv/Fm的变化Fig.3 Effects of Ni2+ stress on the chlorophyll a fluorescence transients and Fv/Fm of Phormidium tenue
外源加入不同浓度的Ni2+处理3 d后,纤细席藻的PS Ⅱ反应中心电子传递链受阻,反应活性降低(表2). 随着重金属浓度的增加及处理时间的延长,反应中心吸收光能用于电子传递的量子逐渐减少,具活性反应中心的开放程度和单位面积内反应中心的数量均持续降低,100 mg/L处理组的反应中心完全关闭,纤细席藻完全丧失光合活性.
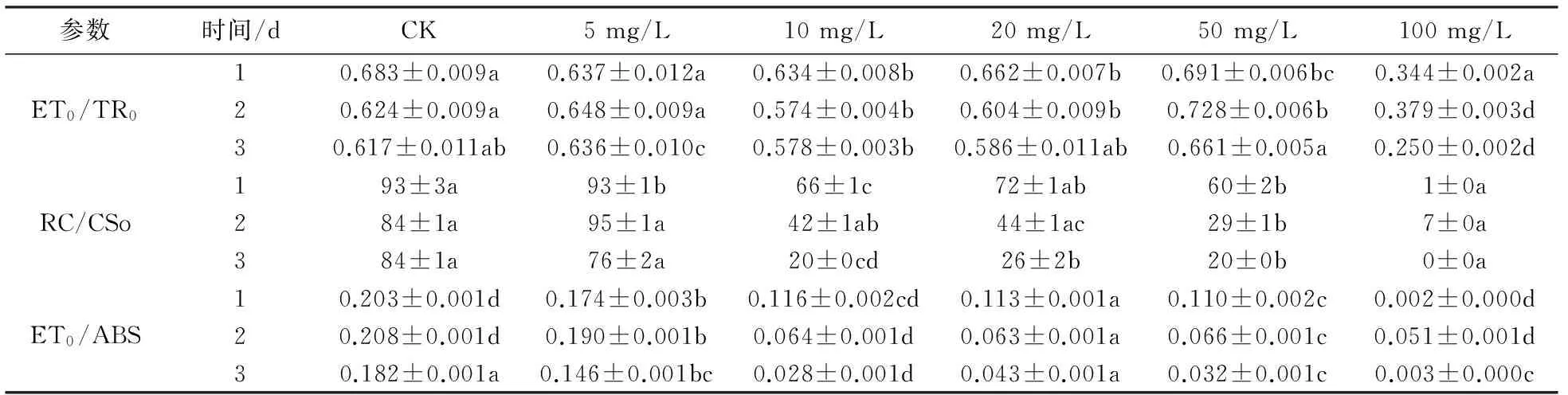
表2 不同浓度Ni2+胁迫下纤细席藻光合性能指数的变化Tab.2 Effects of Ni2+ on photosynthetic parameters of Phormidium tenue
注:a、b、c、d、e表示使用单因素方差分析中在p<0.05的置信区间内数据之间的差异显著性
2.3 Ni2+长期胁迫下纤细席藻叶绿素a、SOD、MDA含量的变化
在加入Ni2+后,随处理时间的延长和Ni2+浓度的增加,纤细席藻的叶绿素a含量逐渐降低(图4A). 5 mg/L Ni2+处理3 d后,纤细席藻的叶绿素a含量相对对照组并未发生显著下降. 10~100 mg/L处理组的叶绿素a在1 d后即发生明显下降,3 d后相对同期对照组下降10.67%、20.07%、25.28%、50.74%.
图4B显示了Ni2+长期胁迫下纤细席藻MDA含量的变化. 在加入Ni2+后,随着时间的增加,藻体MDA含量总体呈现下降的趋势,随着Ni2+浓度的升高,其MDA含量出现相比同期对照组先上升再下降的趋势,但总体并未增加. 5、10、20、50 mg/L处理组在1 d时相对同期对照组MDA含量降低12.47%、19.88%、5.62%、4.49%,而最高浓度100 mg/L处理下纤细席藻MDA含量低于对照组39.07%,此后3 d均无明显变化,藻细胞已经失去活性.
由图4C可以看出,随着处理时间的延长和Ni2+浓度的增加,纤细席藻SOD活性呈现出逐渐下降的趋势. 在处理1 d后,低浓度(<100 mg/L)处理组的SOD活性相对对照组分别上升了43.32%、37.78%、35.80%、21.53%,而100 mg/L处理组的SOD活性在1、2、3 d胁迫下均低于同期对照组60%以上,细胞损伤加剧. 在经过2 d和3 d处理后,SOD酶活性降低,但基本保持不变,这可能跟机体的适应性有关.
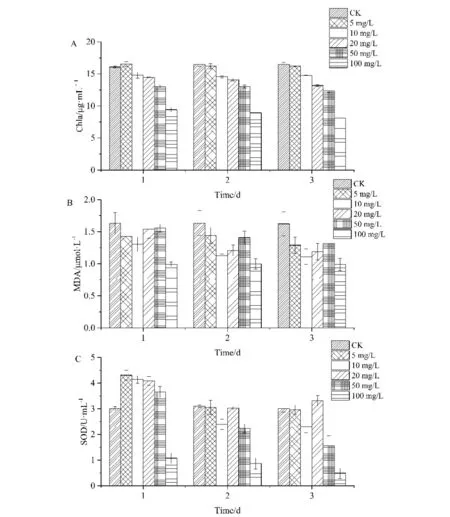
A)叶绿素a;B)MDA;C)SOD图4 Ni2+长期胁迫下纤细席藻叶绿素a、MDA、SOD含量的变化Fig.4 Effects of Ni2+ stress on the cellular chlorophyll a, MDA and SOD content of Phormidium tenue
3 讨论
藻类在遭受环境胁迫时,其光合作用首先受到影响. 光合电子传递是在PSⅠ和PSⅡ两个光化学系统串联进行,当光能被光合色素吸收后传递至PSⅡ系统反应中心,激发叶绿素P680,引起电荷分离,产生的电子将质醌(PQ)还原后,又传递至细胞色素b6f复合体,再由电子载体质蓝素(PC)转移至PSⅠ,这种电子传递过程中产生的光合膜两侧的质子浓度差推动合成ATP和NADPH[9]. 而叶绿素荧光(O-J-I-P test)能够直观反映植物光合作用的情况,因此常用来研究和探测环境胁迫对植物光合作用生理的影响[10].
Ni2+胁迫下,纤细席藻的OJIP曲线形状改变,荧光产量下降,J、P相降低,当Ni2+达到100 mg/L时,J、I、P相完全消失,纤细席藻完全丧失光合活性. 而外源添加细胞保护剂ASC和NAC能够一定程度地缓解环境胁迫对植物造成的损伤.NAC是维持细胞正常生理代谢的含巯基化合物,能够在DNA损伤、UV辐射损伤、重金属胁迫等方面发挥保护作用,其解毒机制可能表现在直接清除ROS、补充减少的GSH两方面[11]. 实验表明在外源ASC和NAC预处理纤细席藻后,相比未经预处理的处理组,叶绿素荧光诱导曲线荧光产量和各J、I、P相下降不明显,曲线形状良好,ASC和NAC均对Ni2+胁迫下的纤细席藻的电子传递链产生缓解损伤作用,反应中心活性甚至有所上升.Ni2+胁迫纤细席藻时,叶绿素a含量随着Ni2+浓度和时间的增加而呈现下降趋势,其他研究也表明高浓度Ni2+抑制叶绿素的合成[5,12],影响光合作用.
重金属胁迫不仅引起光合作用的变化,还会导致自由基积累造成细胞氧化损伤. MDA是膜脂过氧化的产物之一,反映了细胞氧化损伤的程度. SOD是清除活性氧的第一道防线,是抗氧化系统重要的保护酶之一. Ni2+胁迫纤细席藻时,所有处理组的MDA含量均低于空白组,并随着处理时间的延长而逐渐降低,同时,SOD活性在低浓度处理1 d后大幅上升,最高高于空白组43.32%,随着处理时间的延长呈现下降趋势,表现了在低浓度Ni2+胁迫下纤细席藻的抗氧化酶活性升高,清除了自由基,因而MDA含量下降,而高浓度Ni2+胁迫纤细席藻在第1 d处理后已经失去细胞活性. Tian等[13]研究发现杜氏盐藻随着在UV-B辐射胁迫时间延长,其SOD、CAT和POD活性均发生先升高后降低的现象.
[1] 刘国栋. 植物营养元素-Ni[J]. 植物营养与肥料学报,2001,7(1):103-108.
[2] 裴国凤,胡 江,王 青,等.东湖围隔与主体湖区浮游植物群落结构的比较研究[J]. 中南民族大学学报(自然科学版),2016,35(3):21-25
[3] 金 琎. 锰、镍、铬对藻类生长影响的初步研究[J]. 苏州科技学院学报,1991,8(2):37-42.
[4] 谢作明, 陈兰洲, 李敦海, 等. 土壤丝状蓝藻在荒漠治理中的作用研究[J].水生生物学报,2007,31(6):886-890.
[5] 吴赛君, 周香君, 赵 剑, 等. 镍和砷对铜绿微囊藻光合效应的影响[J]. 环境科学与技术,2015,38(10):27-31.
[6] 李合生, 孙 群, 赵世杰, 等. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000:134-138.
[7] Alexieva V, Sergiev I, Mapelli S, et al. The effect of drought and ultraviolet radiation on growth and stress markers in pea and wheat [J]. Plant Cell Environ, 2001, 24(12):1337-1344.
[8] Giannopolitis C N, Ries S K. Superoxide dismutases: occurrence in higher plants [J]. Plant Physiol, 1977, 59(2): 309-314.
[9] 高坤山.藻类固碳-理论、进展、方法[M]. 北京:科学出版社,2014:18-21.
[10] Chen L,Xie M,Bi Y,et al. The combined effects of UV-B radiation and herbicides on photosynthesis,antioxidant enzymes and DNA damage in two bloom-forming cyanobacteria [J]. Ecotoxicology and Environmental Safety,2012,80:224-230.
[11] Hur J M, Hyun M S, Lim S Y, et al. The combination of berberine and irradiation enhances anti-cancer effects via activation of p38 MAPK pathway and ROS generation in human hepatoma cells [J]. J Cell Biochem. 2009, 107(5): 955-964.
[12] 鲁 艳, 李新荣, 何明珠, 等. 重金属对盐生草光合生理生长特性的影响[J].西北植物学报, 2011,31 (2) :370-376.
[13] Tian J Y, Yu J. Changes in ultrastructure and responses of antioxidant systems of algae(Dunaliellasalina) during acclimation to enhanced ultraviolet-B radiation [J].Journal of Photochemistry and Photobiology B:Biology,2009,97(3):152-160.
TheResponsesofPhormidiumtenueontheStressofHeavyMetalNickel
ChenLanzhou1,WangJing1,WuYanfang2,KeTan1,LiangYanan2,LiuSiyao1
(1 School of Resource & Environmental Science,Hubei Research Center of Environment Remediation Technology, Wuhan University,Wuhan 430072, China;2 Wuhan Wenke Ecological Environment Ltd.,Wuhan 430000,China)
The effects of nickel onPhormidiumtenue, including photosynthetic activity, antioxidant enzymes and carbohydrate metabolism were investigated. It was found that fluorescence intensity decreased rapidly in the first 10 min after Ni2+was added into the system, and partly recovered to the normal. Ni2+contents could inhibit the fluorescence production ofP.tenueand aggravated as the increase of Ni2+concentration, even O-I-J-P phases of chlorophyll a fluorescence transients disappeared absolutely as well asFv/Fmwith 100 mg/L Ni2+. The two antioxidants, ASC and NAC, were able to relieve the stress of Ni2+onP.tenue, and ASC was better at protecting capacity, while the anti-oxidation effects decreased as extension of treatment time. The chlorophyll a content,Fv/Fmand photosynthetic parameters(ET0/ABS、ET0/TR0、RC/CS0) decreased significantly after Ni2+stressing for 24 h, meanwhile SOD activity oppositely increased to defend against stress of Ni2+. The results indicated that Ni2+had an inhibitory effect on photosynthesis ofP.tenue, and antioxidants could relieve effectively the inhibition, which could increase the absorption efficiency and recycling utilization of algae as bio-adsorbents.
Phormidiumtenue; Ni; chlorophyll a fluorescence transients; antioxygen system
2017-09-12
陈兰洲(1976-),男,教授,博士生导师,博士,研究方向:环境生物学,E-mail:chenlz@whu.edu.cn
国家自然科学基金资助项目(31370421);湖北省技术创新专项(重大项目,2016ACA162)
X172
A
1672-4321(2017)04-0045-06

