纳米二氧化锰负载钴锰催化K2S2O8/NaHCO3降解甲基橙
, ,
(1.齐齐哈尔大学 化学与化工学院,黑龙江 齐齐哈尔 161006; 2.齐齐哈尔市环境监测中心站,黑龙江 齐齐哈尔 161005)
纳米二氧化锰负载钴锰催化K2S2O8/NaHCO3降解甲基橙
孙宏1,张泽2,王玉峰1
(1.齐齐哈尔大学化学与化工学院,黑龙江齐齐哈尔161006;2.齐齐哈尔市环境监测中心站,黑龙江齐齐哈尔161005)
为了去除碱性水溶液中的染料,采用纳米二氧化锰负载钴锰(Co(II)-Mn(II)-MnO2)催化K2S2O8/NaHCO3氧化降解染料。对Co(II)-Mn(II)-MnO2催化剂进行形貌和结构表征。考察了溶液初始pH值、反应温度、催化剂投加量、甲基橙(MO)、过硫酸钾摩尔比及碳酸氢钠浓度等因素对Co(II)-Mn(II)-MnO2催化氧化MO的影响,并对MO氧化过程结构变化进行分析。实验结果表明:在优化条件下Co(II)-Mn(II)-MnO2催化MO(40mg/L)的降解率达到 82.61%,MO降解反应动力学为一级反应。该体系适合处理中性和弱碱性MO废水。
Co(II)-Mn(II)-MnO2; 纳米催化; 负载; K2S2O8/NaHCO3; MO
1 引 言
染料主要包括偶氮、蒽醌、芳香烃和硝基苯等种类,其中偶氮染料是染料市场中品种数量上最多的一种染料,它是通过-N=N-将稳定的芳环结构键合在一起,为增加其水溶性,还在芳环上引入助色基团(-SO3H,-OH,-COOH等),所以偶氮染料易溶水,毒性强,很难生物降解。本实验中以偶氮化合物MO作为目标污染物,尝试采用过硫酸盐高级氧化法降解碱性溶液中的MO。过硫酸盐氧化反应速度慢,据报道利用过渡金属离子的催化方法有均相[1-3]和非均相两种[2,4],都是在酸性或弱酸性溶液中氧化污染物效果很好,而在中性和弱碱性(pH<10)降解污染物的能力较弱。另外,还有利用纳米TiO2和ZnO掺杂金属降解中性和弱碱性水中染料的报道[5-7],但需要在紫外光照射下进行降解。本文采用纳米MnO2负载钴锰(Co(II)-Mn(II)-MnO2)催化K2S2O8/NaHCO3氧化降解MO。目前在过硫酸盐体系中,引入NaHCO3的报道有Co(II)均相催化过一硫酸氢盐(KHSO5)降解酸性橙7[8],而均相催化剂存在难分离回用的缺陷。本文所采用的Co(II)-Mn(II)-MnO2非均相催化K2S2O8并加入NaHCO3来提高氧化效能的报道并不多,因此该工作具有一定的理论研究价值,对实际处理中性和弱碱性甲基橙废水有指导意义。
2 实 验
2.1 仪器与试剂
场发射扫描电子显微镜(S-4300),X射线光电子能谱(ESCALAB 250 Xi),原子吸收分光光度计(AA320N),紫外可见分光光度计(TU-1901),傅里叶变换红外光谱仪(NICOLET-380)。所用试剂均为分析纯,试验用水为去离子水。
2.2 纳米催化剂的制备
纳米MnO2按参考文献[9]制备,其平均粒径为350nm。将纳米MnO2用蒸馏水洗涤至中性后干燥。把纳米MnO2加入到CoCl2和MnSO4溶液中摇匀,静态吸附72h后抽滤,反复洗涤至无氯离子,在105℃烘干备用。利用原子吸收分光光度计测得Co(II)吸附率为99.07%,Mn(II)吸附率为97.51%。
2.3 催化性能试验
在MO水溶液中加入一定量的催化剂,调节体系初始pH值和反应温度,加入适量的K2S2O8和NaHCO3,进行氧化试验,每间隔30min,移取上层清液离心,稀释后用分光光度计测定MO 在464 nm处的吸光度,根据郎伯-比尔定律计算水中MO的含量和降解率。
降解率D按照下式计算:
D(%)=(C0-Ct)/C0×100%
其中:C0,Ct分别代表初始和反应后的MO浓度。
3 实验结果与分析
3.1 催化剂的表征分析
3.1.1XPS 分析 从表1和图1可以看出,负载后Mn 2p的吸收峰明显增强,在780eV附近出现了新的Co 2p的吸收峰,结合实验2.2节原子吸收分光光度法测定结果,说明Mn(II)和Co(II)已经负载于载体表面。
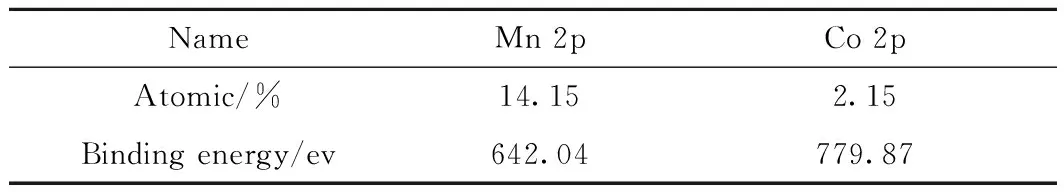
表1 催化剂表面元素含量及结合能
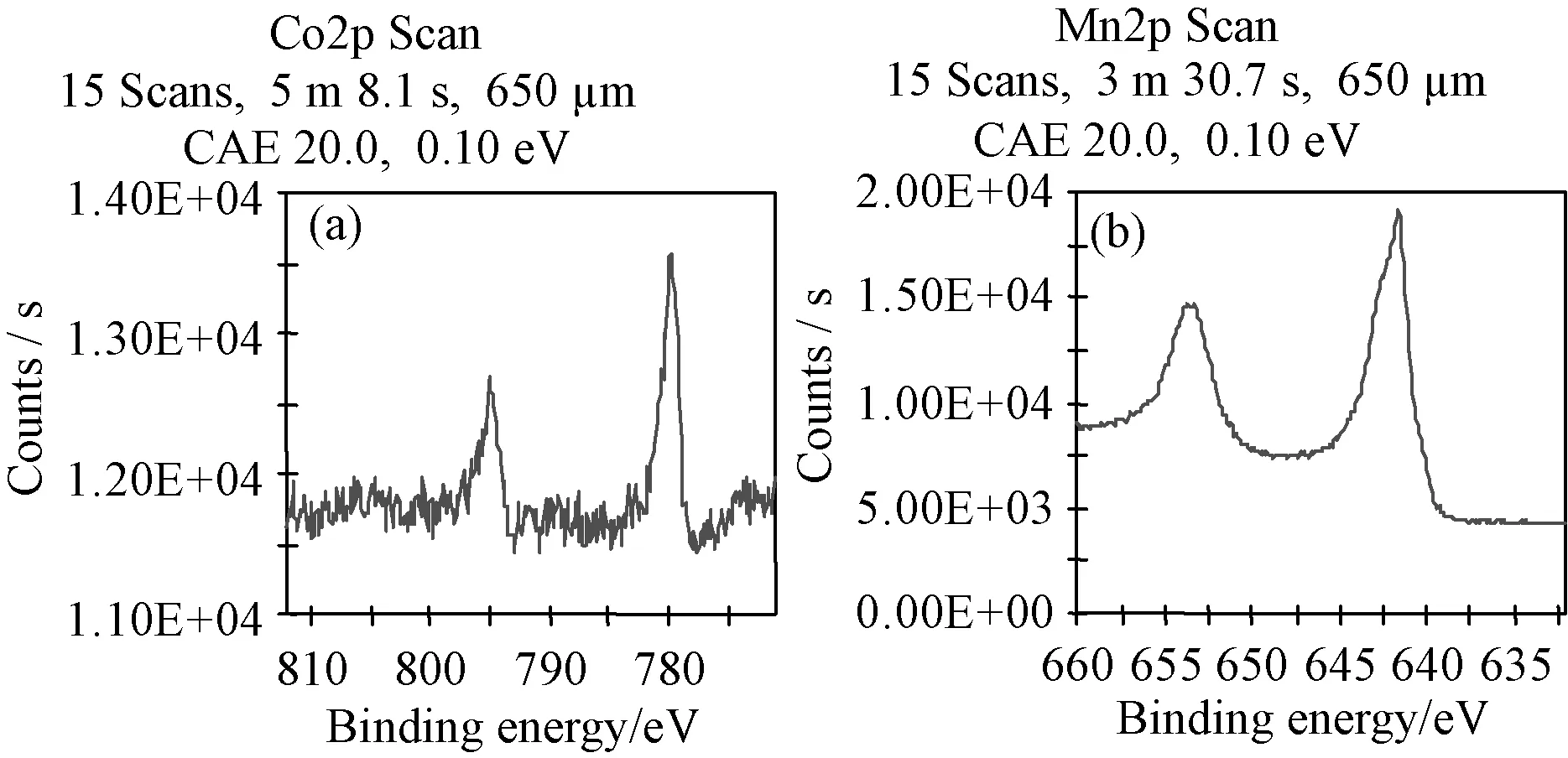
图1 样品XPS谱图(a) 钴谱; (b) 锰谱Fig.1 XPS spectra of sample: Co element (a) and Mn element(b)
3.1.2SEM 分析 图2为催化剂的SEM照片,从图中清晰可见样品为层状的纳米片,龟裂的细纹和颗粒均匀密布在孔隙表面,凹凸不平。这些纳米层片边缘圆滑,层叠交错堆积,中间存在空隙,构成多孔隙的层状结构,增加催化剂的活性位点,对K2S2O8的催化分解产生活性组分起重要作用。
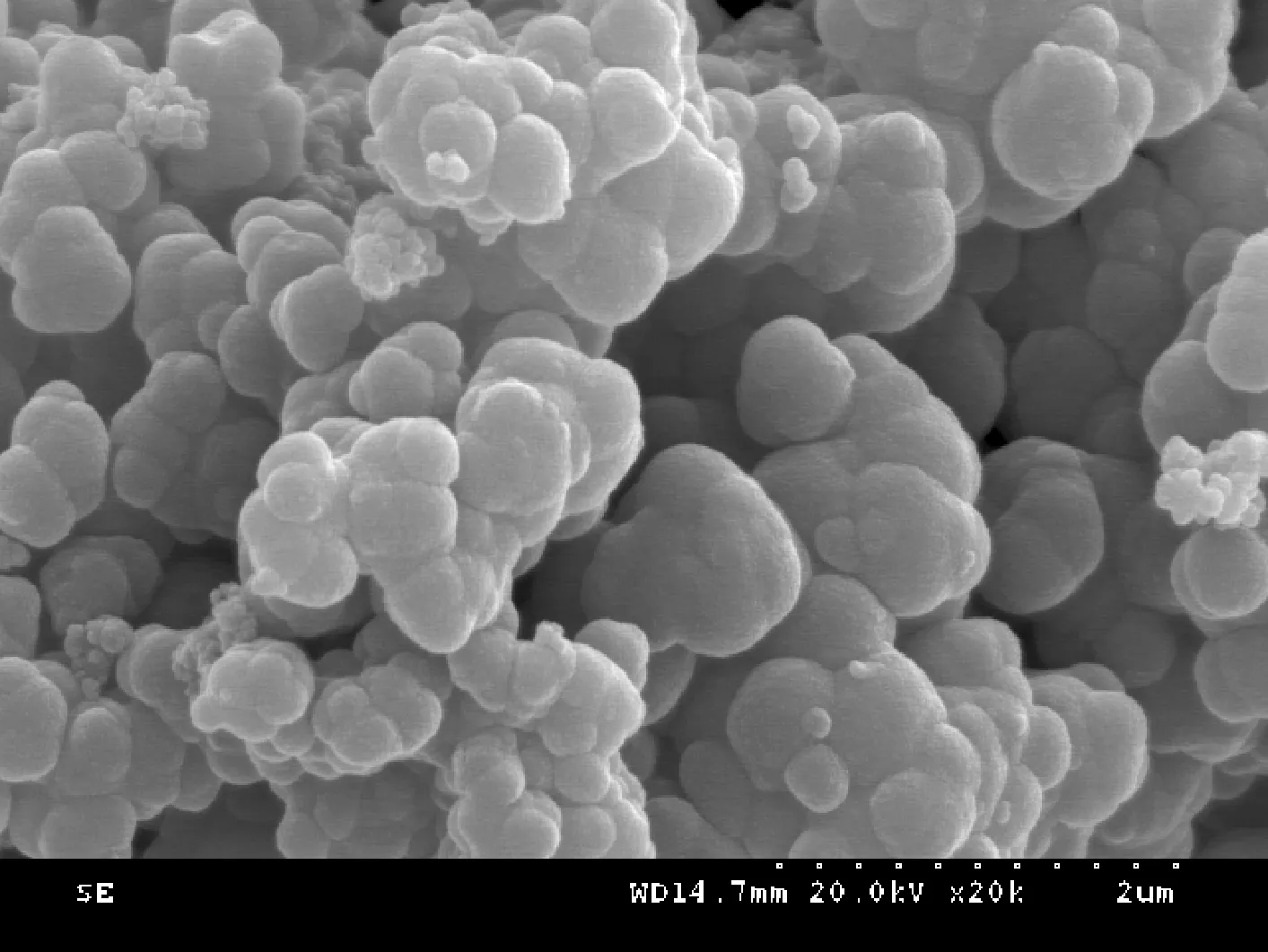
图2 Co(II)-Mn(II)-MnO2 SEM照片Fig.2 SEM images of Co(II)-Mn(II)-MnO2
3.2 纳米催化剂的氧化MO试验结果分析
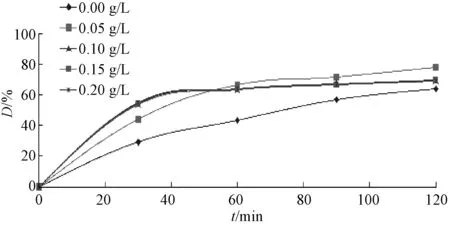
图3 催化剂用量对降解的影响Fig.3 Effect of the catalystdosageon degradation
3.2.1纳米催化剂的用量影响 试验温度35℃,溶液初始pH值为8.62,MO初始浓度为40mg/L,K2S2O8的浓度为2.44mM,NaHCO3的浓度为30.6mM,考察催化剂的用量对MO氧化性能的影响,结果见图3。纳米MnO2对在中性和弱碱性水中的染料几乎没有去除作用。根据以往报道[1-2,8],推测氧化反应机理如下:
(1)
(2)
S-M(n+1)+MO→MO·+S-Mn+
(3)
(4)
(5)
(6)
(7)
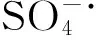
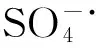
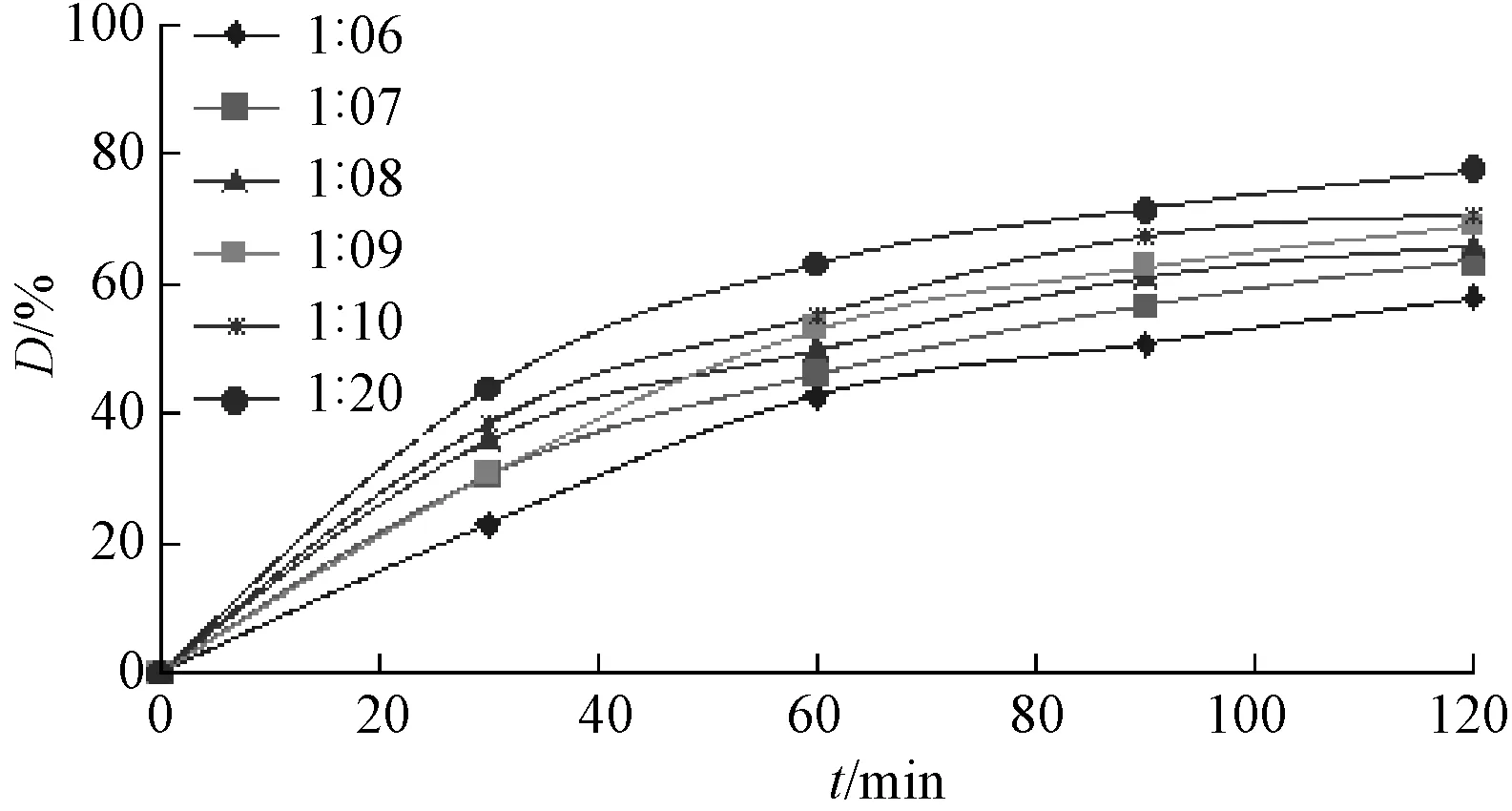
图4 MO与K2S2O8摩尔比对降解的影响Fig.4 Effect of the molar ratio of MO and K2S2O8
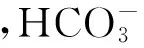
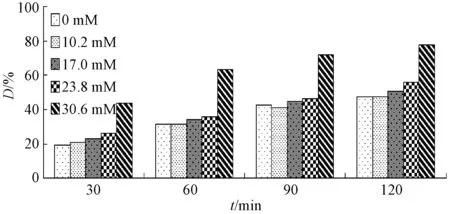
图5 NaHCO3浓度对降解的影响Fig.5 Effect of the concentration of NaHCO3
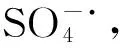
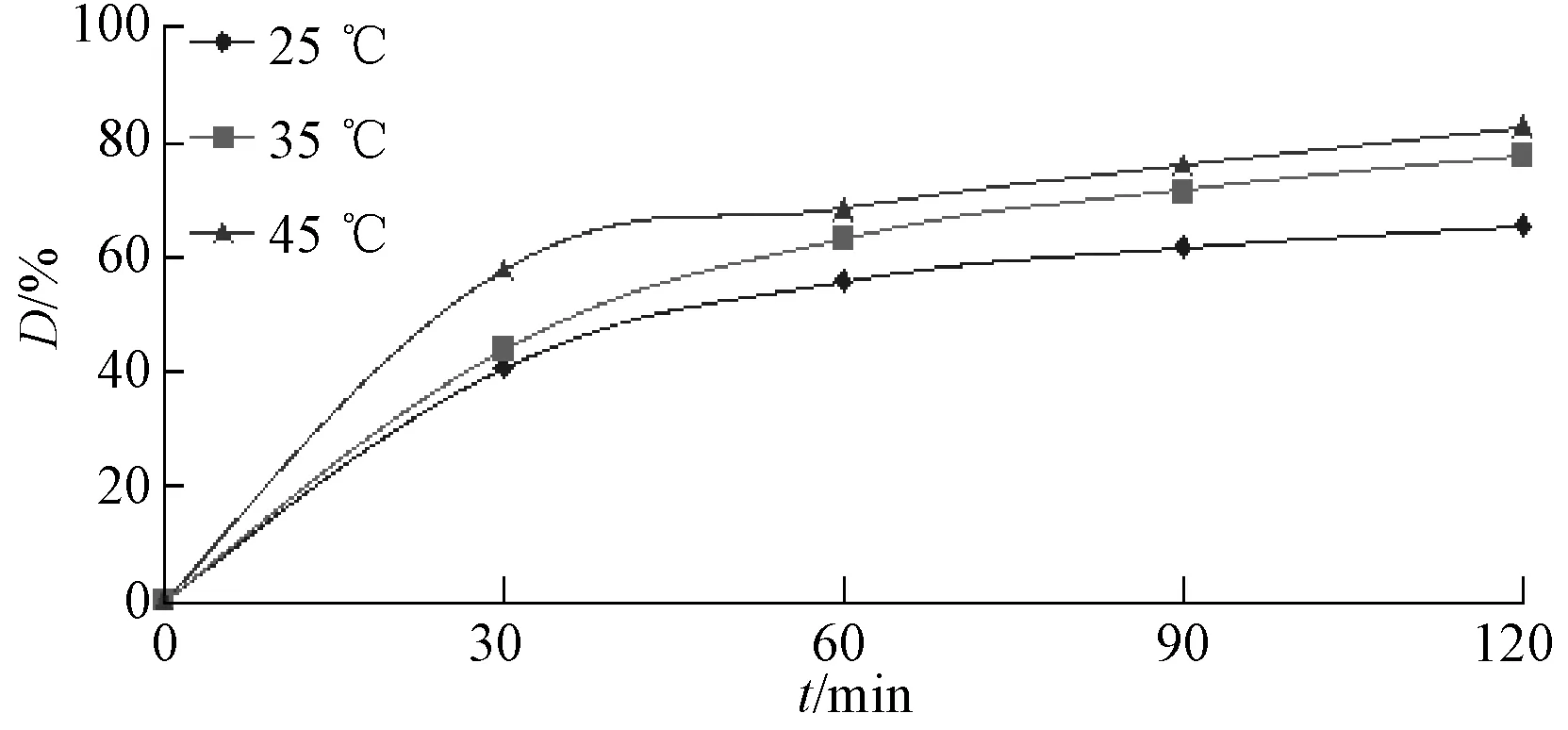
图6 反应温度对降解的影响曲线Fig.6 Effect of the reaction temperature
改变反应体系初始pH值为6.5~10.4,其它条件同3.2.1节。初始pH值对MO降解的影响并不明显,表明该体系适合在该pH范围内氧化MO 废水。
在试验温度45℃,溶液初始pH值为8.62,MO初始浓度为40mg/L,K2S2O8的浓度为2.44mM,NaHCO3的浓度为30.6mM,催化剂用量为0.05g/L这些最优条件下每隔30min测定该体系吸光度。将所得实验数据以ln(Ct/C0)对时间 t作图,进行动力学拟合,发现实验数据与一级反应拟合程度最好,表观反应速率常数为0.0094min-1,相关系数R2为0.999。表明该体系对MO的降解遵循一级反应动力学。
3.2.5MO降解过程的初步分析 在同样的最优条件下每隔30min取上清液进行UV-vis光谱扫描,具体见图7,图中发现MO的-N=N-特征吸收峰(464nm)随着反应的进行,吸光度迅速下降但峰位不变,表明MO分子-N=N-首先解离,共轭体系直接受破坏。而MO的苯环特征吸收峰(278nm)吸光度下降缓慢,表明MO分子解离成小分子苯的衍生物。
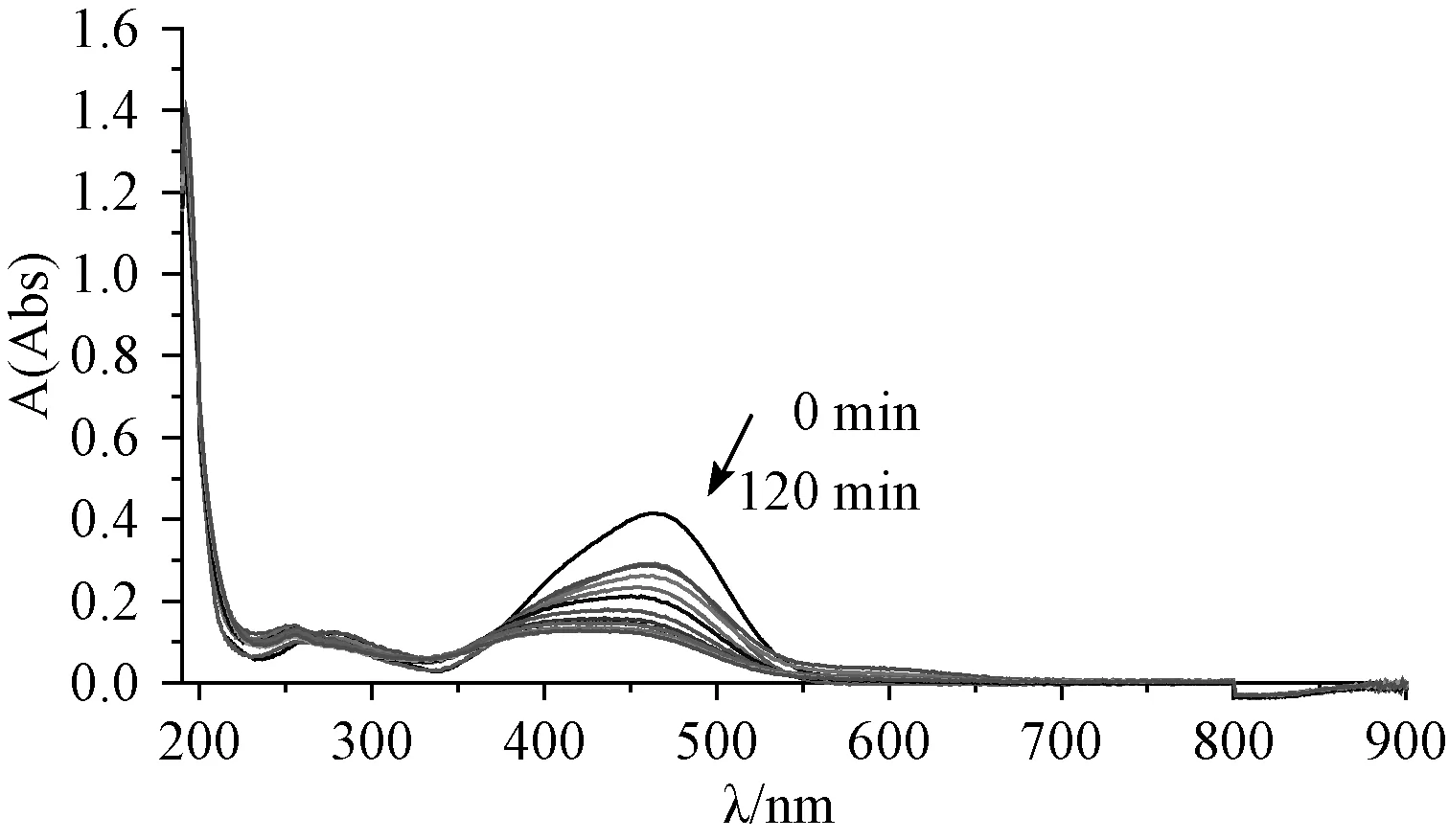
图7 MO降解过程的UV 光谱Fig.7 UV spectrum of MO degradation process
监测反应过程的pH值变化,发现pH值基本为8.6左右。说明MO被降解生成中性或弱碱性的小分子化合物。
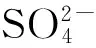
4 结 论
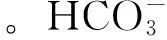
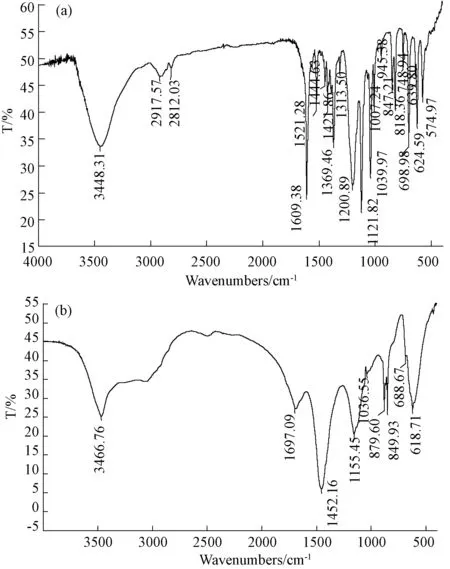
图8 MO(a)和降解产物(b)的IR光谱图Fig.8 IR spectrum of MO and its degradation product
[1] 左传梅. Fe(II)活化过硫酸盐高级氧化技术处理染料废水研究[D].重庆大学硕士学位论文,李宏,重庆,重庆大学, 2012.
[2] 王展. Fe(III)/过硫酸盐体系降解有机污染物及其机理研究 [D].上海大学硕士学位论文,陆永生,上海,上海大学, 2015.
[3] 孙威,刘春婷,李娜.金属离子在过硫酸盐降解甲基橙染料废水中活化作用的比较分析[J]. 辽宁化工, 2014, 43(11): 1373~1375.
[4] 王宇轩,王应军,方明珠.活性炭负载CuO 催化过硫酸盐去除活性艳红X-3B 染料[J]. 环境工程学报, 2016, 10 (1): 230~237.
[5] 张一兵, 饶太巧.水热法合成TiO2/Fe3+光催化剂及其氧化降解亚甲基蓝[J].材料科学与工程学报, 2014, 32 (3): 344~348.
[6] 刘金生,刘少友,赵钟兴,等.铁、镉复合掺杂氧化锌纳米粉体的制备及其光降解性能[J].材料科学与工程学报, 2013, 31(5): 752~758.
[7] 董海军,陈爱平,等.氮镍共掺杂TiO2纳米管的制备及其光催化性能[J].材料科学与工程学报, 2013, 31 (3):341~347.
[9] 孙宏,张泽,宋坤. 纳米层状二氧化锰去除水中罗丹明B的效能研究[J]. 印染助剂, 2016, 33(3): 38~40.
DegradationofMethylOrangebyNanoCo(II)-Mn(II)-MnO2
/K2S2O8/NaHCO3
SUNHong1,ZHANGZe2,WANGYufeng1
(1.CollegeofChemistryandChemicalEngineering,QiqiharUniversity,Qiqihar161006,China;2.QiqiharEnvironmentMonitoringCenter,Qiqihar161005,China)
To remove dyes in the alkaline solution, Co(II) and Mn(II) was loaded on the nanometer manganese dioxide (Co(II)-Mn(II)-MnO2) to catalyse potassium persulfate to oxidize dyes. The catalyst was characterized by scanning electron microscopy (SEM) and x-ray photoelectron spectroscopy (XPS). The influence factors of Methyl orange (MO) oxidation had been investigated including the initial pH, the reaction temperature, the dosage of catalyst, the molar ratio of MO and persulfate and the concentration of sodium bicarbonate. Intermediate structure was also analyzed in the investigation. The experimental results showed that under the optimum condition 82.61% of MO (40mg/L) was completely removed. MO degradation reaction kinetics was a first order reaction. Co(II)-Mn(II)-MnO2is suitable for treatment of MO in the neutral and alkaline solution.
Co(II)-Mn(II)-MnO2; nanometer Catalysis; load; potassium persulfate; MO
2016-08-15;
2016-10-18
黑龙江省教育厅资助项目(2012TD012)
孙 宏(1964-),教授,主要从事环境污染物防治。E-mail: sun1964214@163.com。
1673-2812(2017)06-0911-04
TQ620.9
A
10.14136/j.cnki.issn1673-2812.2017.06.011

