磷添加条件下摩西球囊霉与禾草内生真菌对多年生黑麦草生长的影响
郭艳娥,王晓瑜,高萍,段廷玉
(草地农业生态系统国家重点实验室,农业部草牧业创新重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020)
磷添加条件下摩西球囊霉与禾草内生真菌对多年生黑麦草生长的影响
郭艳娥,王晓瑜,高萍,段廷玉*
(草地农业生态系统国家重点实验室,农业部草牧业创新重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020)
本试验探究了不添加磷(P0)和添加50 mg/kg(P50)条件下,丛枝菌根(arbuscular mycorrhizae, AM)真菌摩西球囊霉(Glomusmosseae)和禾草内生真菌对多年生黑麦草生长、养分吸收和磷酸酶活性的影响。多年生黑麦草分别由含有禾草内生真菌(E+)和不含禾草内生真菌(E-)种子建植获得。结果表明:1)AM真菌与禾草内生真菌可显著影响多年生黑麦草的生物量(P<0.05),二者共同作用(AME+)时生物量最低。P0处理,以AM真菌E-植株生物量最高。P50条件下,对照(NME-)最高;2)P添加平均提高AM真菌的侵染率11.40%,P0和P50条件下E+植株较E-植株的菌根侵染率分别低18.65%和11.77%;3)AM真菌未显著影响P吸收(P<0.05)。禾草内生真菌增加了植株N含量,而AM真菌侵染降低了E+植株N含量;4)P添加显著提高了磷酸酶活性(P<0.05),不同处理以AME+的磷酸酶活性最高。两种共生微生物在不同P条件下,单独作用均有利于植物生长,共同作用时因对光合产物存在竞争,并未协同促进植物生长和养分吸收。
AM真菌;禾草内生真菌;磷添加;多年生黑麦草
多年生黑麦草(Loliumperenne)作为优良牧草和草坪草,具有养分利用率高,适口性好,再生能力强,建坪速度快,覆盖能力以及抗病虫害能力强等特性[1],在世界各温带地区都有分布[2]。禾草内生真菌(Epichlo⊇)是指在禾草体内完成全部或大部分生活周期,而禾草不显示明显病害症状的一大类真菌[3]。禾草内生真菌对宿主生长的介导效应与P的有效性密切相关[4]。缺P时,接种内生真菌能促进宿主植物生长[5-6]。与非感染禾草内生真菌(E-)植株相比,内生真菌感染(E+)的高羊茅(Festucaelata)根系直径减小,根毛长度增加,进而扩大了根系吸收面积[6]。此外,E+高羊茅还通过根部分泌酚类化合物对P胁迫作出反应[5]。目前,国际上销售的多年生黑麦草种子多含有禾草内生真菌。
丛枝菌根(arbuscular mycorrhizae, AM)真菌广泛存在于草地农业生态系统中,可与80%以上陆生植物根系建立共生关系,是土壤微生物的重要组成部分[7]。AM真菌促进植物生长的效应与菌根侵染改善植物的养分状况(尤其是P)密切相关[8-10],菌索及根外菌丝的生长,可比根系更远地扩展到土壤中,从而增加宿主植物吸取养分的范围[11-12]。AM真菌可与根际土壤和根皮层细胞形成密集的菌丝网,扩大植物根系吸收面积,缩短养分运输距离[11],分泌磷酸酶、有机酸和质子,改变根系周围土壤理化性质,解离难溶性磷酸盐[13],并通过磷转运蛋白完成磷从AM真菌到植物细胞的跨膜运输[14]。由于AM真菌的宿主具有广谱性,如单一宿主植物体内的菌丝在向周边生长过程中遇到另一植物的根系,可再度侵染,在两个植株间形成菌丝桥[15],利用菌丝桥对磷进行传递是可行的,而且形成的菌丝桥越多,宿主植物获得的养分越多[16],这种作用在含P不足的土壤环境中更为显著[17-19]。
我国土壤普遍缺P,改善P的吸收对促进植物生长和维持生态系统生产力具有重要意义[20]。在自然界和农业生态系统中,禾草能够分别与内生真菌和AM真菌建立共生关系[21-22],且有大量关于宿主植物与单一共生菌相互关系的报道。但二者共同作用对植物生长影响的报道还甚少,磷添加条件下两种共生微生物互作对宿主影响的研究更是鲜有报道。前人多是基于内生真菌和AM真菌关系的研究,所得结论也并不一致[23-25],当禾草内生真菌存在时,AM真菌是否还能促进养分吸收,尚不明确。本研究以多年生黑麦草为供试对象,旨在探究磷添加条件下AM真菌与禾草内生真菌对生长、养分吸收和磷酸酶活性的影响,以期为高效利用共生微生物,促进牧草生长提供理论支持。
1 材料与方法
1.1 试验材料
1.1.1供试植物 多年生黑麦草种子AR1带有内生真菌(E+)、Nil不带内生真菌(E-),由新西兰国家草地研究所(AgResearch)、新西兰皇家科学院院士John Caradus教授提供。
1.1.2AM真菌 摩西球囊霉(Glomusmosseae,G.m)购买于北京市农林科学院植物营养与资源研究所,“丛枝菌根真菌种质资源库BGC”编号为NM04A,以三叶草扩繁所得的孢子、菌根根段、根外菌丝及培养基质作为接种物。
1.1.3供试土壤 土壤理化性质:pH 7.6;全P 19.62 mg/g;全N 18.35 mg/g。将过3 mm筛的土壤,于121 ℃下高压蒸汽灭菌2 h,以消除基质中其他微生物的干扰,风干备用。
1.2 试验方法
1.2.1试验设计 盆栽试验于2016年4-6月在兰州大学草地农业科技学院智能温室中进行,共设2个P水平,不添加P(P0)和添加50 mg/kg(P50)。试验将20 g AM真菌接种物/盆平铺在800 g灭菌的土壤上面,然后再覆盖200 g土,对照(NM)则加等量灭菌接种物和接种物滤液,以保证微生物区系一致。挑选大小一致且籽粒饱满的种子,用10% H2O2对其表面消毒10 min,然后用无菌水冲洗干净,于25 ℃恒温培养箱催芽。48 h后,选取长势基本一致,大小相近的带菌(E+)和不带菌(E-)黑麦草植株分别移栽至直径18 cm、高19 cm的花盆中,每盆移栽5株,出苗1周后,定苗至3株。定苗后,加入所需量的0.1 mol/L KH2PO4溶液,建立P添加处理,P0则加入等量蒸馏水,共设8个处理,每个处理8个重复。生长8周后收获并测定植物生长及生理生化指标。
1.2.2指标测定 生物量采用烘干法测定;AM真菌侵染率的测定采用染色镜检法[26];土壤速效P含量采用钼锑抗比色法测定[27];全N、全P含量:用球磨仪研磨植物干样,并过2 mm筛,称取0.25 g左右研磨好的植物样,加入3.3 g催化剂(K2SO4和CuSO4研磨后10∶1混合)和10 mL浓H2SO4,420 ℃消煮2 h,冷却后定容至100 mL,采用流动注射仪(FIAstar 5000 Analyzer, FOSS, Sweden)测定;叶片与根系磷酸酶活性的测定参照Sadasivam等的方法[28];用改进的方法测定土壤磷酸酶活性[29]。
1.3 数据统计与分析
采用JMP IN 4对各指标进行交互效应以及方差分析,结果用GraphPad Prism 5.01作图。
2 结果与分析
2.1 生物量
P添加对地上生物量无显著影响(P>0.05)(表1)。低P条件下,以接种AM真菌的E-植株(AME-)生物量最高,其较NME-、NME+和AME+分别提高13.51%、19.09% 和32.41%。P50条件下,以不含两种共生微生物处理(NME-)的黑麦草地上生物量最高,但其与AME-和NME+间的差异不显著(P>0.05)(表1,图1)。由此可知,P与AM真菌互作时存在交互效应,P添加降低了AM真菌对宿主地上部分生长的贡献。此外,AM真菌与禾草内生真菌分别对宿主地上、地下生物量产生显著或极显著影响,二者共同作用(AME+)的地上、地下生物量皆为最低,AM真菌侵染抑制了E+植株的地上生长(P<0.05)(表1,图1)。
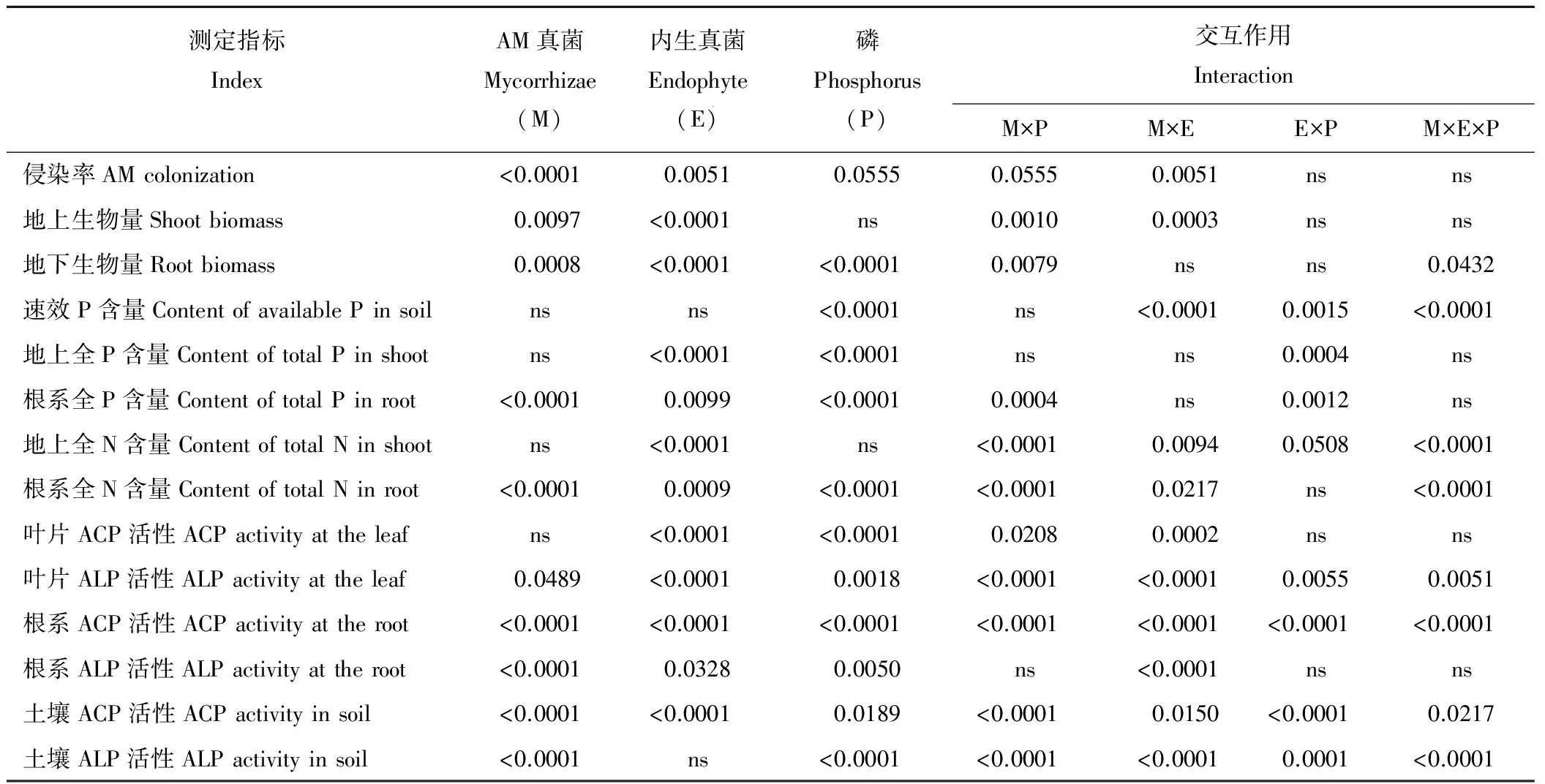
表1 AM真菌、禾草内生真菌与P添加对多年生黑麦草各指标的方差分析(P值)Table 1 Variance analyses of E- and E+perennial ryegrass inoculated with or without AM fungi under phosphorus addition (P value)
ns:P>0.05. ACP: Acid phosphatase; ALP: Alkaline phosphatase.

图1 AM真菌、禾草内生真菌与P添加对生物量的影响Fig.1 Biomass of E- and E+ perennial ryegrass inoculated with or without AM fungi under phosphorus addition 不同小写字母表示不同处理间差异显著(P<0.05)。下同。Different lowercase letters on the bars show significant differences among treatments (P<0.05). The same below.
P添加促进了植物根系生长,同时增加了AM真菌对宿主地下部分生长的贡献(P<0.05)(表1,图1)。AM真菌、P以及禾草内生真菌三者存在交互效应,P50条件下AME+的地下生物量比NME-、NME+和AME-分别低27.70%、18.69%和18.69%,低P条件AM真菌与禾草内生真菌各处理间的差异均不显著(P>0.05)(表1,图1)。
2.2 AM真菌侵染率
未接种AM真菌的植株均未发现菌根结构。AM真菌分别与P和禾草内生真菌存在交互作用,P添加显著提高了AM真菌的侵染率,禾草内生真菌抑制了AM真菌的侵染(P<0.05)(表1,图2)。接种AM真菌的E-、E+植株菌根侵染率差异显著。P0和P50条件下,E+植株的侵染率比E-植株低18.65%和11.77%(P<0.05)(图2)。
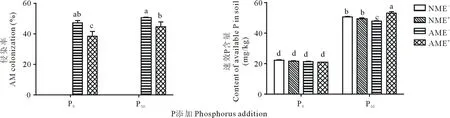
图2 AM真菌、禾草内生真菌与P添加对侵染率和速效P含量的影响Fig.2 AM colonization and available P content of E- and E+ perennial ryegrass inoculated with or without AM fungi under phosphorus addition
2.3 植物P、N含量
P添加对黑麦草速效P、地上全P以及根系全P含量皆产生极显著影响(P<0.05)(表1)。AM真菌与禾草内生真菌均对速效P含量无显著影响,但二者共同作用以及与P三者共同作用时存在交互效应。P0条件下,AM真菌降低了E+植株的速效P含量。P50条件下,AME+处理的速效P含量最高(P<0.05)(表1,图2)。
AM真菌对植物地上全P含量无显著影响(P<0.05)(表1)。禾草内生真菌对地上全P含量具有极显著影响,且与P存在交互效应,P添加显著增加了E+植株的地上全P含量,NMP50较NMP0高40.45%,AMP50较AMP0高55.29%(P<0.05)(表1,图3)。
与地上全P含量不同,AM真菌对根系全P含量产生极显著影响(P<0.05)(表1)。接种AM真菌增加了根系全P含量,且其与P有交互作用,P添加显著增加了AM所侵染宿主的根系全P含量(P<0.05)(表1,图3)。感染禾草内生真菌E+植株的根系全P含量显著高于E-植株(P<0.05)(图3)。与地上全P含量类似,P添加同样增加了E+植株的根系全P含量(图3)。
P对地上全N含量无显著影响,对根系全N含量产生极显著影响(P<0.05)(表1)。P添加降低了AM侵染植株的全N含量,二者互作时存在交互效应(表1,图4)。AM真菌对E+植株的地上、根系全N含量皆有显著影响,P0条件AM真菌显著降低E+植株的全N含量(P<0.05)(表1,图4)。P50条件AM真菌侵染却不同程度增加了E+植株的全N含量,其分别比NME-、NME+和AME-处理的地上全N含量高19.81%、19.65%和25.14%,AME+的根系全N含量亦为最高,但与NME+间的差异不显著(P<0.05)(表1,图4)。禾草内生真菌对地上、根系全N含量均产生显著影响,P0条件NME+处理的全N含量最高,分别较NME-、AME-和AME+的地上全N含量高8.57%、12.66% 和10.00%,较根系全N含量高18.64%、30.05% 和44.77%(P<0.05)(表1,图4)。

图3 AM真菌、禾草内生真菌与P添加对全P含量的影响Fig.3 Content of total P of E- and E+ perennial ryegrass inoculated with or without AM fungi under phosphorus addition
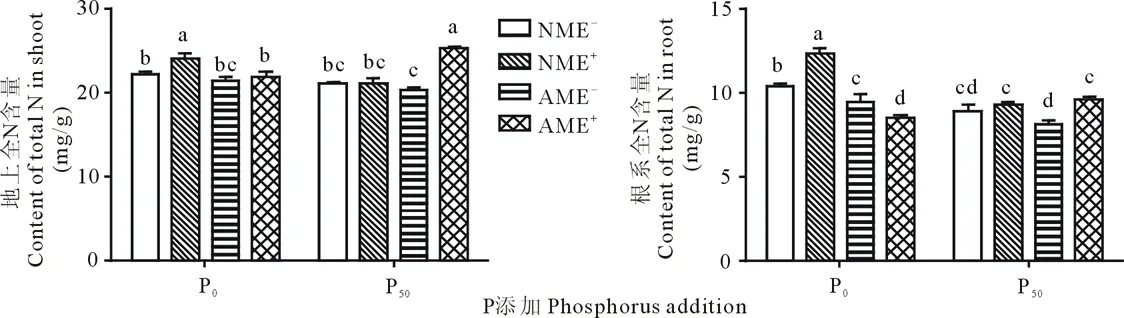
图4 AM真菌、禾草内生真菌与P添加对全N含量的影响Fig.4 Content of total N of E- and E+ perennial ryegrass inoculated with or without AM fungi under phosphorus addition
2.4 磷酸酶活性
P添加对叶片、根系以及土壤酸性磷酸酶(acid phosphatase, ACP)和碱性磷酸酶(alkaline phosphatase, ALP)活性皆产生显著或极显著影响(P<0.05)(表1)。P50的叶片、根系ACP和ALP活性均不同程度高于P0处理,土壤磷酸酶活性反之(图5)。AM侵染与P存在交互效应,P添加条件下,AM侵染植株的叶片ALP、土壤ACP活性均不同程度高于低P处理,根系ACP、土壤ALP活性低于低P处理(表1,图5)。禾草内生真菌对磷酸酶活性也有显著或极显著影响(P<0.05)(表1)。P添加对E+植株磷酸酶活性的影响不一致,P50条件下叶片ALP、根系ACP以及土壤ACP活性低于P0。P添加却增加了E+植株叶片ACP、根系及土壤ALP活性(图5)。AM真菌与禾草内生真菌互作时有交互效应,大多以二者共同作用的磷酸酶活性最高。不同P条件下二者的互作结果存在差异,根系ACP活性,P50条件下表现为最高;土壤ACP和ALP活性,低P条件AME+处理的最高,但与其他各处理间的差异均不显著(表1,图5)。
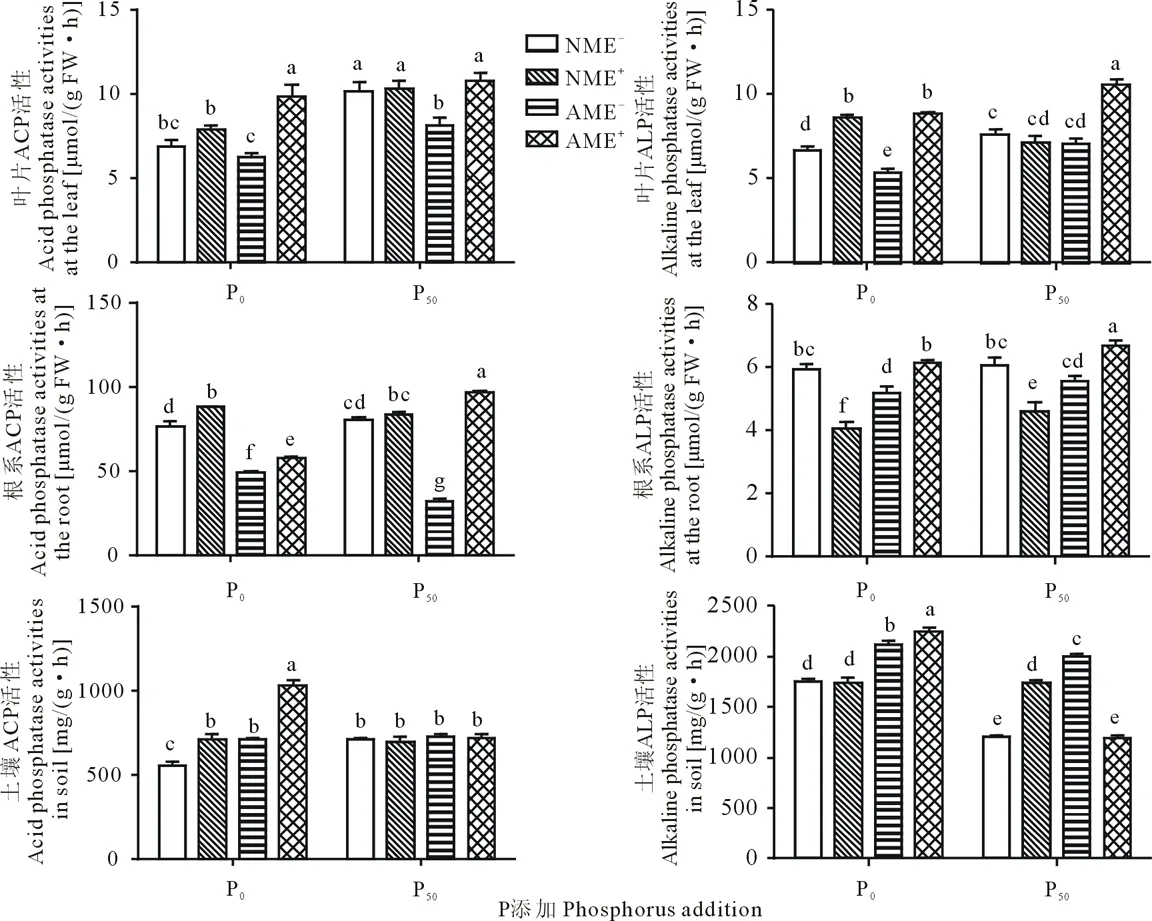
图5 AM真菌、禾草内生真菌与P添加对磷酸酶活性的影响Fig.5 Phosphatase activities of E- and E+ perennial ryegrass inoculated with or without AM fungi under phosphorus addition
3 讨论与结论
AM真菌可促进宿主植物生长,增加其对营养元素,尤其是P的吸收,这种作用在供P不足土壤环境中尤为显著[17-19]。禾草内生真菌通过增加分蘖数、生物量以及提高宿主植物抗逆性对植物的生长起一定介导作用[30-32],该效应亦与P的有效性密切相关[4],缺P土壤中,感染内生真菌的E+植株比E-植株吸收更多的N、P等元素[33]。本研究接种AM真菌与禾草内生真菌均对多年生黑麦草的生物量产生显著影响。P0条件下,接种AM真菌的地上生物量高于禾草内生真菌,这是由于AM真菌存在于宿主植物的根部,其根外菌丝可以直接吸收土壤中的N和P[17,34],而禾草内生真菌通常位于宿主植物的地上部分,其通过改变根部形态和生理性状等途径来间接获取养分[35]。因此,在该养分条件下AM真菌对多年生黑麦草生物量的贡献较禾草内生真菌更大。P50水平下,地上和地下生物量均以NME-处理最高,AME+最低,接菌处理并未显著提高宿主生物量,这与冯海艳等[36]的研究结果一致。在土壤有效养分供应充足的情况下,宿主植物与AM真菌之间的关系可能由互利共生转变为偏利共生,即AM真菌从宿主植物获取光合产物,但其帮助宿主植物吸收的养分对于植物的生长并未产生积极影响,甚至会导致宿主植物的生物量降低[37]。
P0条件下,不同处理对土壤速效P含量无显著影响,这可能与土壤基质的养分供应状况密切相关,当其满足宿主植物生长所需时,接种AM真菌与禾草内生真菌对养分的介导效应势必会减弱。P50条件下,AME-处理的速效P含量最低,AME+处理最高。菌根化植物对土壤中P元素的摄取包括直接吸收途径(direct uptaking process, DUP)和菌根吸收途径(mycorrhizal uptaking process, MUP)两条,且MUP途径对P吸收的贡献更大[17],非菌根植物只有DPU途径,因此菌根化植物能够吸收更多的P,相应土壤中残留的速效P含量最低。由于禾草内生真菌对AM真菌的抑制作用,被宿主吸收利用的养分降低,土壤速效P的含量达到最高。此外P50水平下AME+处理的P含量最高,这与对N含量影响的结果保持一致。
不同P添加条件下的全N含量都以E+植株(NME+处理)比接种AM真菌(AME-)效果显著。这是因为原始土壤P含量较高抑制了AM真菌的生长和代谢活性,致使AM真菌吸P量减少,造成菌根效应降低,同时减弱了AM真菌吸收 N 的能力[36]。P0条件NME+处理的全N含量最高,这与Malinowski等[33]的结果相似,表明存在于禾草茎叶中的内生真菌可以加强矿质元素的吸收。P50条件AME+处理最高,表明N、P积累存在协同效应,这与叶少萍等[38]在对不同P水平下AMF对狗牙根(Cynodondactylon)生长与再生影响的研究结果一致。
Ezawa等[39]用细胞化学的方法证明AM真菌菌丝释放的ACP和ALP对菌丝体内多聚磷酸盐的降解和运输起着重要作用。Chang等[40]的研究进一步证实菌根化植物的磷酸酶活性高于非菌根植物。本试验中AME-处理的磷酸酶活性最低,与前人的研究结果[41-44]并不一致。此外,供P条件对磷酸酶活性也产生显著影响,同一P添加条件下AME+处理的磷酸酶活性最高,NME+次之,这与养分的结果基本一致,原因可能是养分对磷酸酶活性进行直接调节,AM真菌等通过改善养分状况对其产生间接作用。
土壤pH是影响AM真菌孢子萌芽和菌丝生长的一个重要因子[45]。通常,AM真菌适应于中性和微酸性土壤环境[46]。本试验所添加的0.1 mol/L KH2PO4溶液pH为4.5左右,供试基质pH 7.6,KH2PO4溶液对该基质具有一定的缓冲性。不同供P条件所造成的pH差异对AM真菌侵染率亦产生显著影响,P50高于P0,这与AM真菌的适应性结果相一致。P添加处理的地上、地下生物量以及速效P、地上、根系全P含量皆高于P0,其原因可能是较低pH对植物的直接调节作用,抑或是通过影响AM真菌活性来间接改善宿主生存环境,促进对养分的吸收,并增加其生物量。此外,较低pH的地上与根系ACP和ALP活性高于P0,这与Joner等[47]的结果一致,酸性条件下的磷酸酶活性大于碱性条件。
AM真菌与禾草内生真菌共同作用对植物生长影响的报道尚不多见,所得结论也并不一致。例如感染内生真菌的高羊茅[48]、多年生[49]和一年生黑麦草(Lolium)[50]根系的菌根侵染率降低,禾草内生真菌的存在不同程度抑制了AM真菌的侵染,同样AM真菌降低了禾草内生真菌的菌丝密度和寄主植物叶片中的生物碱含量,二者相互竞争,互相制约[21,49-50]。然而,Novas等[51]对天然禾草雀麦(Bromussetifolius)的研究发现,禾草内生真菌可以增加AM真菌的侵染率,而且在一定浓度内,禾草内生真菌浸提液作用下可以增加AM真菌的菌丝长度。Larimer等[52]对披碱草(Elymushystrix)的研究发现,内生真菌对AM真菌侵染率的影响因AM真菌种类的不同而不同,接种近明球囊霉(Glomusclaroideum)的E-植株的侵染率高于E+。相反,接种摩西球囊霉的E+植株的侵染率显著高于E-。Vignale等[53]和Zhou等[24]的报道进一步指出,AM真菌与禾草内生真菌的互作可能与供试基质的养分状况、内生真菌菌株类型以及AM真菌类型等诸因素相关。
本研究不同P条件下,接种AM真菌与禾草内生真菌都对菌根侵染率产生显著影响。低P条件,AME+的侵染率比AME-降低18.65%,P50水平下降低11.77%,禾草内生真菌抑制了AM真菌的侵染。此外,P50的侵染率显著高于P0。有关禾草内生真菌抑制AM真菌侵染的作用机制尚不明确,目前认为有如下3种可能:1)宿主植物在资源分配上存在权衡[21],AM真菌和禾草内生真菌均须从宿主植物获得光合产物[54-55],但禾草内生真菌存在于地上部分,具有空间优势,可能优先获得光合产物,因而留给AM真菌的光合产物减少,从而抑制AM真菌的侵染[21];2)禾草内生真菌增加植物对P的吸收和贮存[32],改变宿主对营养元素的需求,降低AM真菌的有益作用[56],从而间接影响AM真菌对植物的侵染;3)禾草内生真菌产生的化感物质抑制了AM真菌侵染[48]。接种AM真菌与禾草内生真菌(AME+)处理的生物量最低,这与侵染率的结果相关联。
综上所述,不同P条件下,AM真菌与禾草内生真菌单独作用均促进了植物生长,共同作用时,因对光合产物存在竞争,禾草内生真菌抑制了AM真菌侵染,二者并未协同促进植物生长和养分吸收。
References:
[1] Altpeter F. Perennial ryegrass (LoliumperenneL.). Methods in Molecular Biology, 2006, 114: 75-105.
[2] Ma B Y. Research advances in stress physiological adaptation of perennial ryegrass. Journal of Biology, 2010, 27(2): 58-61.
马博英. 多年生黑麦草的逆境生理研究进展. 生物学杂志, 2010, 27(2): 58-61.
[3] Arnold A E, Maynard Z, Gilbert G S,etal. Are tropical fungal endophytes hyperdiverse. Ecology Letters, 2000, 3(4): 267-274.
[4] Li X, Ren A, Han R,etal. Endophyte-mediated effects on the growth and physiology ofAchnatherumsibiricumare conditional on both N and P availability. Plos One, 2012, 7(11): e48010.
[5] Malinowski D P, Alloush G A, Belesky D P. Evidence for chemical changes on the root surface of tall fescue in response to infection with the fungal endophyteNeotyphodiumcoenophialum. Plant and Soil, 1998, 205(1): 1-12.
[6] Malinowski D P, Brauer D K, Belesky D P. The endophyteNeotyphodiumcoenophialumaffects root morhology of tall fescue grown under phosphorus deficiency. Journal of Agronomy & Crop Science, 1999, 183(1): 53-60.
[7] Shi W Q, Xia Y S, Liu X L. The important role of arbuscular mycorrhizal in carbon sequestration in grassland ecosystems. Ecology & Environment, 2008, 17(2): 846-850.
石伟琦, 夏运生, 刘晓蕾. 丛枝菌根在草原生态系统碳固持中的重要作用. 生态环境学报, 2008, 17(2): 846-850.
[8] Hecke M M V, Treonis A M, Kaufman J R. How does the fungal endophyteNeotyphodiumcoenophialumaffect tall fescue (Festucaarundinacea) rhizodeposition and soil microorganisms. Plant and Soil, 2005, 275(1): 101-109.
[9] Casas C, Omacini M, Montecchia M S. Soil microbial community responses to the fungal endophyteNeotyphodiumin Italian ryegrass. Plant and Soil, 2011, 340(1): 347-355.
[10] Iqbal J, Siegrist J A, Nelson J A,etal. Fungal endophyte infection increases carbon sequestration potential of southeastern USA tall fescue stands. Soil Biology & Biochemistry, 2012, 44(1): 347-355.
[11] Li X L, George E, Marschner H. Extension of the phosphorus depletion zone in VA-mycorrhizal white clover in a calcareous soil. Plant and Soil, 1991, 136(1): 41-48.
[12] Marschner H, Dell B. Nutrient uptake in mycorrhizal symbiosis. Plant and Soil, 1994, 159(1): 89-102.
[13] Hinsinger P. Bioavailability of soil inorganic P in the rhizosphere as affected by root-induced chemical changes: a review. Plant and Soil, 2001, 237(2): 173-195.
[14] Balestrini R, Gomez-Ariza J L, Bonfante P. Laser microdissection reveals that transcripts for five plant and one fungal phosphate transporter genes are contemporaneously present in arbusculated cells. Molecular Plant-Microbe Interactions, 2007, 20(9): 1055-1062.
[15] Vestberg M, Tuomi J. A test of mutual aid in common mycorrhizal networks: established vegetation negates benefit in seedlings. Ecology, 2003, 84(4): 898-906.
[16] Ai W D, Zhang J L, Li L,etal. Phosphorus transfer via mycorrhizal hyphal links from red clover to rye grass. Chinese Journal of Applied Ecology, 1999, 10(5): 615-618.
艾为党, 张俊伶, 李隆, 等. 三叶草体内磷通过菌丝桥向黑麦草的传递研究. 应用生态学报, 1999, 10(5): 615-618.
[17] Smith S E, Smith F A, Jakobsen I. Mycorrhizal fungi can dominate phosphate supply to plants irrespective of growth responses. Plant Physiology, 2003, 133(1): 16-20.
[18] Smith S E, Read D J. Mycorrhizal Symbiosis. Longdon: Academic Press, 2008.
[19] Hodge A, Helgason T, Fitter A H. Nutritional ecology of arbuscular mycorrhizal fungi. Fungal Ecology, 2010, 3(4): 267-273.
[20] Van der Heijden M G A, Klironomos J N, Ursic M,etal. Mycorrhizal fungal diversity determines plant biodiversity, ecosystem variability and productivity. Nature, 1998, 396: 69.
[21] Mack K M L, Rudgers J A. Balancing multiple mutualists: asymmetric interactions among plants, arbuscular mycorrhizal fungi, and fungal endophytes. Oikos, 2008, 117(2): 310-320.
[22] Binet M N, Sage L, Malan C,etal. Effects of mowing on fungal endophytes and arbuscular mycorrhizal fungi in subalpine grasslands. Fungal Ecology, 2013, 6(4): 248-255.
[23] Larimer A L, Bever J D, Clay K. The interactive effects of plant microbial symbionts: a review and meta-analysis. Symbiosis, 2010, 51(2): 139-148.
[24] Zhou Y, Li X, Qin J,etal. Effects of simultaneous infections of endophytic fungi and arbuscular mycorrhizal fungi on the growth of their shared host grassAchnatherumsibiricumunder varying N and P supply. Fungal Ecology, 2016, 20: 56-65.
[25] García-Parisi P A, Omacini M. Arbuscular mycorrhizal fungi can shift plant-soil feedback of grass-endophyte symbiosis from negative to positive. Plant and Soil, 2017, DOI: 10.1007/s11104-017-3216-y.
[26] Koske R E, Gemma J N. A modified procedure for staining roots to detect VA mycorrhizas. Mycological Research, 1989, 92(4): 486-488.
[27] Pittman J J, Zhang H, Schroder J L,etal. Differences of phosphorus in mehlich 3 extracts determined by colorimetric and spectroscopic methods. Communications in Soil Science and Plant Analysis, 2005, 36(11/12): 1641-1659.
[28] Sadasivam S, Manickam A. Biochemical Methods. India: New Age International Publishers, 1996.
[29] Song Y C, Li X L, Feng G. Effect of phosphatase activity on soil organic phosphorus loss in the environment of clover growth. Acta Ecologica Sinica, 2001, 21(7): 1130-1135.
宋勇春, 李晓林, 冯固. 菌根真菌磷酸酶活性对红三叶草生境中土壤有机磷亏缺的影响. 生态学报, 2001, 21(7): 1130-1135.
[30] Clay K, Schardl C. Evolutionary origins and ecological consequences of endophyte symbiosis with grasses. The American Naturalist, 2002, 160(S4): S99-S127.
[31] Ren A Z, Gao Y B. Growth characteristics of endophyte-infected and endophyte-freeLoliumperenneL. seedlings under osmotic stress conditions. Acta Ecologica Sinica, 2003, 23(11): 2307-2317.
任安芝, 高玉葆. 渗透胁迫下内生真菌感染对黑麦草幼苗生长的影响. 生态学报, 2003, 23(11): 2307-2317.
[32] Rahman M H, Saiga S. Endophytic fungi (Neotyphodiumcoenophialum) affect the growth and mineral uptake, transport and efficiency ratios in tall fescue (Festucaarundinacea). Plant and Soil, 2005, 272(1): 163-171.
[33] Malinowski D P, Alloush G A, Belesky D P. Leaf endophyteNeotyphodiumcoenophialummodifies mineral uptake in tall fescue. Plant and Soil, 2000, 227(1/2): 115-126.
[34] Hodge A, Fitter A H. Substantial nitrogen acquisition by arbuscular mycorrhizal fungi from organic material has implications for N cycling. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(31): 13754-13759.
[35] Malinowski D P, Belesky D P. Adaptations of endophyte-infected cool-season grasses to environmental stresses: mechanisms of drought and mineral stress tolerance. Crop Science, 2000, 40(4): 923-940.
[36] Feng H Y, Feng G, Wang J G,etal. Regulation of P status in host plant on alkaline phosphatase (ALP) activity in intraradical hyphae and development of extraradical hythae of AM fungi. Mycosystema, 2003, 22(4): 589-598.
冯海艳, 冯固, 王敬国, 等. 植物磷营养状况对丛枝菌根真菌生长及代谢活性的调控. 菌物学报, 2003, 22(4): 589-598.
[37] Fang A G. Effects of Neotyphodium Endophyte and AM Fungi on Growth of Hordeum Brevisubulatum Under Salt and Phosphorus Stress Conditions. Lanzhou: Lanzhou University, 2013.
方爱国. 盐与磷胁迫条件下内生真菌和菌根菌对野大麦生长的影响. 兰州: 兰州大学, 2013.
[38] Ye S P, Zeng X H, Xin G R,etal. Effects of arbuscular mycorrhizal fungi (AMF) on growth and regrowth of bermudagrass under different P supply levels. Acta Prataculturae Sinica, 2013, 22(1): 46-52.
叶少萍, 曾秀华, 辛国荣, 等. 不同磷水平下丛枝菌根真菌(AMF)对狗牙根生长与再生的影响. 草业学报, 2013, 22(1): 46-52.
[39] Ezawa T, Saito M, Yoshida T. Comparison of phosphatase localization in the intraradical hyphae of arbuscular mycorrhizal fungi,Glomusspp. andGigasporaspp. Plant and Soil, 1995, 176(1): 57-63.
[40] Chang C N, Chou L C. Growth responses, enzyme activities, and component changes as influenced byRhizoctoniaorchidmycorrhiza onAnoectochilusformosanusHayata. Botanical Studies, 2007, 48(4): 445-451.
[41] Geneva M, Zehirov G, Djonova E,etal. The effect of inoculation of pea plants with mycorrhizal fungi andRhizobiumon nitrogen and phosphorus assimilation. Plant Soil & Environment, 2006, 52(10): 435-440.
[42] Amaya-Carpio L, Davies F T, Fox T,etal. Arbuscular mycorrhizal fungi and organic fertilizer influence photosynthesis, root phosphatase activity, nutrition, and growth ofIpomoeacarneassp.fistulosa. Photosynthetica, 2009, 47(1): 1-10.
[43] Ratti N, Verma H N, Gautam S P. Effect ofGlomusspecies on physiology and biochemistry ofCatharanthusroseus. Indian Journal of Microbiology, 2010, 50(3): 355-360.
[44] Doley K, Jite P K. Response of groundnut (‘JL-24’) cultivar to mycorrhiza inoculation and phosphorous application. Notulae Scientia Biologicae, 2012, 4(3): 118-125.
[45] Fortin J A, Bécard G, Declerck S,etal. Arbuscular mycorrhiza on root-organ cultures. Canadian Journal of Botany, 2002, 80(1): 1-20.
[46] Ouzounidou G, Skiada V, Papadopoulou K K,etal. Effects of soil pH and arbuscular mycorrhiza (AM) inoculation on growth and chemical composition of chia (SalviahispanicaL.) leaves. Brazilian Journal of Botany, 2015, 38(3): 487-495.
[47] Joner E J, Johansen A. Phosphatase activity of external hyphae of two arbuscular mycorrhizal fungi. Mycological Research, 2000, 104(1): 81-86.
[48] Chuchou M, Guo B, An Z Q,etal. Suppression of mycorrhizal fungi in fescue by theAcremoniumcoenophialumendophyte. Soil Biology & Biochemistry, 1992, 24(7): 633-637.
[49] Müller J. Artificial infection by endophytes affects growth and mycorrhizal colonisation ofLoliumperenne. Functional Plant Biology, 2003, 30(4): 419-424.
[50] Omacini M, Eggers T, Bonkowski M,etal. Leaf endophytes affect mycorrhizal status and growth of co-infected and neighbouring plants. Functional Ecology, 2006, 20(2): 226-232.
[51] Novas M V, Cabral D, Godeas A M. Interaction between grass endophytes and mycorrhizas inBromussetifoliusfrom Patagonia, Argentina. Symbiosis, 2005, 40(1): 23-30.
[52] Larimer A L, Bever J D, Clay K. Consequences of simultaneous interactions of fungal endophytes and arbuscular mycorrhizal fungi with a shared host grass. Oikos, 2012, 121(12): 2090-2096.
[53] Vignale M V, Iannone L J, Pinget A D,etal. Effect of epichloid endophytes and soil fertilization on arbuscular mycorrhizal colonization of a wild grass. Plant and Soil, 2016, 405(1/2): 279-287.
[54] Brundrett M C. Tansley review No. 134: Coevolution of roots and mycorrhizas of land plants. New Phytologist, 2002, 154(2): 275-304.
[55] Thrower L B, Lewis D H. Uptake of sugars byEpichloetyphina(Pers. Ex Fr.) Tul. in culture and from its host,AgrostisstoloniferaL. New Phytologist, 1973, 72(3): 501-508.
[56] Blanke V, Renker C, Wagner M,etal. Nitrogen supply affects arbuscular mycorrhizal colonization ofArtemisiavulgarisin a phosphate-polluted field site. New Phytologist, 2005, 166(3): 981-992.
EffectsofGlomusmosseaeandgrassendophytesonthegrowthofLoliumperenneunderphosphorusaddition
GUO Yan-E, WANG Xiao-Yu, GAO Ping, DUAN Ting-Yu*
StateKeyLaboratoryofGrasslandAgro-ecosystems,KeyLaboratoryofGrasslandLivestockIndustryInnovation,MinistryofAgriculture,CollegeofPastoralAgricultureScienceandTechnology,LanzhouUniversity,Lanzhou730020,China
This study aimed to determine the effects of arbuscular mycorrhizae fungiGlomusmosseaeand grass endophytes on the growth, nutrient absorption and phosphatase activities ofLoliumperennewithout phosphorus addition (P0) and with 50 mg/kg phosphorus addition (P50). Seeds of perennial ryegrass infected with grass endophyte (E+) and without grass endophyte (E-) were used to establish plants with and without the endophytes. The results showed that: 1) AM fungi and grass endophytes had significant effects on the host biomass (P<0.05); plants infected by both AM fungi and grass endophytes (AME+) had the lowest biomass. Plants infected by onlyGlomusmosseaehad the highest biomass under P0, while plants free of the two symbiosis fungi reached their highest biomass under P50. 2) Phosphorus addition increased mycorrhizal colonization of perennial ryegrass by 11.40%, while infection with grass endophytes inhibited plant mycorrhizal colonization by 18.65% and 11.77% under P0and P50respectively. 3)G.mosseaehad no significant effect on the absorption of P (P<0.05). Grass endophytes increased the content of total N, while AM colonization decreased the total N of plants with grass endophytes. 4) Phosphorus addition significantly increased phosphatase activities (P<0.05). Plants infected by AM fungi and grass endophytes had the highest phosphatase activities across the treatments. Each of the two symbiosis fungi improved plant growth when taken alone; however, they showed competition on photosynthate and did not enhance plant growth and nutrition absorption when applied together.
arbuscular mycorrhizal fungi; grass endophyte; phosphorus addition;Loliumperenne
10.11686/cyxb2017071http//cyxb.lzu.edu.cn
郭艳娥, 王晓瑜, 高萍, 段廷玉. 磷添加条件下摩西球囊霉与禾草内生真菌对多年生黑麦草生长的影响. 草业学报, 2017, 26(12): 160-169.
GUO Yan-E, WANG Xiao-Yu, GAO Ping, DUAN Ting-Yu. Effects ofGlomusmosseaeand grass endophytes on the growth ofLoliumperenneunder phosphorus addition. Acta Prataculturae Sinica, 2017, 26(12): 160-169.
2017-03-01;改回日期:2017-04-17
国家绿肥产业技术体系(CARS-22),中央高校基本科研业务费(2022016zr0003)和教育部创新团队发展计划项目(IRT_17R50)资助。
郭艳娥(1991-),女,甘肃会宁人,在读硕士。E-mail:guoye15@lzu.edu.cn*通信作者Corresponding author. E-mail:duanty@lzu.edu.cn

