马铃薯病毒诱导应答基因抑制消减杂交文库构建及分析
李忠旺,陈玉梁,欧巧明,叶春雷,裴怀弟,刘新星,王红梅,罗俊杰
(甘肃省农业科学院生物技术研究所,甘肃 兰州 730070)
马铃薯病毒诱导应答基因抑制消减杂交文库构建及分析
李忠旺,陈玉梁,欧巧明,叶春雷,裴怀弟,刘新星,王红梅,罗俊杰*
(甘肃省农业科学院生物技术研究所,甘肃 兰州 730070)
马铃薯病毒积累引起的种薯退化是马铃薯生产中造成产量和品质下降的重要原因之一。本研究以马铃薯病毒病携带植株叶片cDNA为试验组(Tester)、脱毒种苗叶片cDNA为驱动组(Driver),采用抑制消减杂交(suppression subtractive hybridization, SSH)技术构建了马铃薯病毒诱导应答基因的cDNA文库;为验证文库构建效果,从文库中随机挑取了98个阳性克隆经PCR验证后测序,获得了45条高质量的有效非重复序列;经与GenBank进行同源比对后发现,其中14条非重复序列属于马铃薯病毒基因序列,22条与已知基因序列同源性较高,9条无同源参考基因;选取文库中出现频率较高的2个ESTs(expressed sequence tag,表达序列标签)用qRT-PCR技术分析发现,其表达量受马铃薯病毒侵染的诱导。结果表明,该SSH文库构建较为成功,为进一步筛选与马铃薯病毒致病、防御相关的应答基因,解析马铃薯与病毒互作的分子机理,利用生物技术手段培育抗病毒马铃薯奠定了基础。
马铃薯;病毒;应答基因;抑制消减杂交
马铃薯(Solanumtuberosum)为茄科茄属多年生草本块茎植物,是世界上仅次于小麦(Triticumaestivum)、水稻(Oryzasativa)和玉米(Zeamays)的第四大粮食作物[1],因其块茎部分含有丰富的碳水化合物、蛋白质和各种维生素,是重要的粮菜饲兼用作物及工业原料。中国是世界最大的马铃薯生产国,总产量和人均消费量均处于世界前列且稳步增长,但单位面积产量却远远落后于荷兰等马铃薯生产发达的国家,影响单产的因素很多,其中病毒等病害积累引起的种薯退化是重要的原因之一[2-4]。已报道的在田间条件下能侵染马铃薯的病毒有近30余种[4-5],它们引起马铃薯植株花叶、褪绿、卷叶、矮缩以及坏死等症状,严重时导致植株生长发育异常,块茎产量下降,特别是复合侵染时可使产量损失80%以上,有些还会严重影响块茎品质和商品性[6-7]。
由于马铃薯病毒病的特殊性,目前尚无有效的化学方法防治马铃薯病毒病,利用茎尖分生组织培育健康无毒的马铃薯已成为预防马铃薯病毒病最为有效的方法之一。但茎尖脱毒组织培养技术本身具有成本高、对操作人员技术要求高、是否完全脱毒监测困难、脱毒种薯在栽培过程中易于再次感染的局限性[8],加上受经济条件、认知等原因的影响很难全面应用与生产。因此,培育抗病毒马铃薯品种可能是从根本上缓解这一问题的可行办法。但由于栽培种马铃薯一般是四倍体无性繁殖材料,育种中存在基因分离复杂、花粉不育和现有栽培种基因库狭窄等缺陷,极大地限制了可以利用的基因资源[9]。以转基因、分子标记辅助育种为代表的现代生物育种技术是有效弥补不足的可行方法,可以加速实现马铃薯抗病毒特性的改良目的,但需要对病毒入侵后马铃薯的应答反应相关主要功能基因及其作用机理有较为清晰的认识。
抑制消减杂交(suppression subtractive hybridization,SSH) 技术是1996年由Diatchenko等[10]以mRNA差异显示技术为基础建立起来的一种利用抑制性PCR和差减杂交技术为基础筛选差异表达基因的方法,由于该方法具有高效和假阳性率低的特点,目前已广泛应用于植物抗病、抗逆、发育等差异表达基因筛选研究中[11-15],但在马铃薯病毒病相关研究中的应用尚未见报道。
本研究以马铃薯病毒病携带植株叶片cDNA为试验组(Tester)、脱毒种苗叶片cDNA为驱动组(Driver),构建了马铃薯病毒诱导应答基因抑制消减杂交cDNA文库,筛选与马铃薯病毒病致病、防御相关的应答基因并研究其转录模式,以期在整体水平上了解马铃薯与病毒互作的分子机理、克隆抗病基因奠定基础。
1 材料与方法
1.1 试验材料与试剂
本实验于2014年7月-2016年4月进行,以甘肃省农业科学院马铃薯研究所育成品种“陇薯8号”(对花叶病毒病和卷叶病毒病具有很好的田间抗性)叶片为受试材料,实验组感病植株是从田间选取,驱动组脱毒种苗取材于马铃薯脱毒种苗繁育专用温室,均随机选取5株后混合取样。
供试Clontech SMARTerTM PCR cDNA synthesis Kit、Clontech SMARTerTM PCR cDNA synthesis Kit、SYBR Premix ExTaq购自大连TAKARA 公司,RNA提取试剂TRIzol购自上海Invitrogen公司,测序、引物合成及克隆载体pUCm-T、DH5α感受态细胞、质粒提取试剂盒、非酶DNA清除剂、PCR产物回收、纯化试剂盒购自上海生工生物工程有限公司。
1.2 RNA 的提取、纯化及SSH文库构建
取约100 mg 马铃薯叶片于液氮中研磨后参照Invitrogen公司TRIzol试剂说明书抽提总RNA,在氯仿抽提前加一步酚∶氯仿(24∶1)纯化步骤,最后RNA溶液用上海生工非酶DNA清除剂纯化,进一步提高了RNA的质量。
所获得的RNA合成双链cDNA后,分别感病植株cDNA 为实验组,以脱毒种苗cDNA 为驱动组,按照PCR-SelectTM cDNA Subtraction Kit(Clontech,Cat. No. 637401)试剂盒说明书进行RsaⅠ酶切消化、接头连接、杂交、PCR 扩增等操作,每步操作均设置3个平行实验;采用StTublin基因引物PCR 检测杂交效率,分别在18、20、22、24、26、28、30、32 个循环取PCR 产物进行凝胶电泳检测。利用DNA 回收试剂盒回收第2次PCR 差减产物连接到pUCm-T克隆载体,转化大肠杆菌感受态细胞DH5α。
1.3 差减文库的鉴定及ESTs 测序分析
随机挑选转化平板的白斑用pUCm-T载体M13引物(表1)PCR验证为阳性克隆后送交生工生物工程(上海)股份有限公司测序。将测序结果用VectorScreen分离出载体序列,再对EST序列进行比对后获得非冗余序列,再用tblastx(Search translated nucleotide database using a translated nucleotide query)进行同源性搜索分析基因功能。
1.4 候选基因Real-time PCR 验证
应用Invitrogen公司TRIzol试剂提取对照组和处理组的叶片总RNA,应用Clontech SMARTerTM PCR cDNA synthesis Kit试剂盒反转录合成cDNA,进行qRT-PCR分析,参考试剂盒说明书建成20 μL反应体系,反应条件为95 ℃预变性2 min,95 ℃变性20 s,58 ℃退火30 s,72 ℃延伸30 s,共40个循环,延伸阶段收集信号,从58 ℃到95 ℃,采集熔解曲线荧光信号。选取其中2个差异表达基因,利用Primer Premier 6.0 软件分别设计差异表达ESTs正、反向引物,以马铃薯持家基因StTublin为内参,做3次重复计算基因的相对表达量(表1)。
2 结果与分析

图1 马铃薯块茎RNA电泳Fig.1 Total RNA tested by agarose gel M:DNA marker;1~3:驱动组总RNA Driver total RNA;4~6:试验组总RNA Tester total RNA.
2.1 RNA的分离与质量检测
图1是用Invitrogen公司Trizol 试剂盒提取马铃薯叶片总RNA,总RNA经1%琼脂糖凝胶电泳检测,其28S和18S RNA带型清晰可见,且比例适当,表明总RNA质量好、纯度高,满足文库构建的要求。以该RNA作模板,以OligodT18 为引物进行反转录获得第一链cDNA,再进一步合成双链cDNA用于后续实验。
2.2 双链cDNA 酶切效果检测
为了验证长片段双链cDNA 是否被充分消化成小片段,用1%琼脂糖凝胶电泳检测酶切前后的双链cDNA,酶切前双链cDNA 分布在100~2000 bp(图2:Lane 1,3),经高频四碱基内切酶RsaⅠ酶切后,双链cDNA 分布范围明显下移(图2:Lane 2,4),说明RsaⅠ已将较长的双链cDNA 消化成带有粘性平末端的小片段,达到了实验预期,保证了实验操作的准确性。
2.3 接头连接及连接效率检测

图2 双链cDNA酶切效果验证Fig.2 ds-cDNA enzyme digestion efficiency M:DNA marker;1,3:未经过Rsa I酶切的驱动组双链cDNA、试验组双链cDNA Driver ds-cDNA and Tester ds-cDNA;2,4:经过Rsa I酶切的驱动组双链cDNA、试验组双链cDNA Driver ds-cDNA and Tester ds-cDNA after Rsa I digestion.
图3 接头连接效果PCR验证Fig.3 Detection of ligation efficiency of adaptor M:DNA marker;1,2:与接头1的连接产物 Ligased with adaptor 1;3~6:与接头2R的连接产物 Ligased with adaptor 2R;1,3,5:PCR Primer 1和StTublin 3′引物组合PCR产物 Product of Primer 1 and StTublin 3′primer;2,4,6:StTublin引物PCR产物 Product of StTublin primer.

图4 巢式PCR产物检测Fig.4 Nested PCR products tested by agarose gel
ds-cDNA与接头连接效率的高低是决定抑制性消减杂交成败非常关键的一步。将经酶切验证可用的实验组双链cDNA分成两份, 分别连接接头Adaptor 1和Adaptor 2R以便于后续的消减杂交。连接产物分别用试剂盒提供引物Primer 1和马铃薯持家基因StTublin反向引物组合以及马铃薯持家基因StTublin正反向引物组合(扩增片段内不含RsaI酶切位点)进行PCR扩增检测。结果显示(图3),持家基因的3′反向引物与接头的外侧引物Primer 1组合的扩增片段(连接接头的PCR产物)大于StTublin正反向引物组合的扩增片段,与预期结果一致。
2.4 巢式PCR产物检测
消减杂交后富集的差异表达基因片段再经过两次PCR扩增,第1次仅末端具有不同接头的双链cDNA呈指数扩增,在第2次巢式PCR将进一步降低背景和富集差异表达序列。实验结果显示,第2轮巢式PCR在扩增到15个循环时已经有较多的扩增产物出现,大小分布在100 bp到500 bp之间(图4),可以保证后续实验的顺利进行。
2.5 消减效率的PCR分析
用马铃薯内标基因StTublin引物进行PCR验证消减效率,结果显示在消减杂交产物中均不能扩增出目标产物,而非消减杂交对照组在22个循环就有目标条带出现(图5),说明本实验消减杂交成功,消减效率较高。
2.6 阳性克隆的获得与筛选
2次PCR产物纯化后连接到克隆载体pUCm-T后转化大肠杆菌感受态细胞DH5α,转化后涂布在含有X-gal和IPTG的Amp抗性LB平板上生长16 h,将其于4 ℃放置24 h后,挑选白斑于液体LB培养基培养10 h。以菌液为模板PCR鉴定阳性克隆结果显示,在随机挑选的28个克隆中,阳性克隆为27个,片段大小分布在200 bp到600 bp之间(图6),阳性重组率大于95%,满足随机挑选克隆测序要求,从而成功建立了马铃薯淀粉合成积累相关抑制消减杂交文库。
2.7 差异表达ESTs测序与分析
根据所获得的PCR产物大小随机挑选了98个阳性克隆经PCR验证后送交上海生工测序后,将测序结果用VectorScreen分离出载体序列,再对EST序列进行比对后获得45条非冗余序列,再用tblastx(Search translated nucleotide database using a translated nucleotide query)进行同源性分析基因功能。结果显示(表2),45 条非冗余序列中有9条序列尚无同源序列,14条序列属于马铃薯病毒基因片段,此外还有与植物抗病毒相关LRR类转录因子、衰老相关基因等,说明本文库质量较高,差异表达基因与马铃薯病毒致病及防御过程密切相关。

图5 消减效率的PCR检测Fig.5 Reduction efficiency by PCR analysis M:DNA marker;H:H2O;1:消减组cDNA Subtracted cDNA;2:未消减cDNA Unsubtracted cDNA;18C~32C:循环数Cycles number.

图6 阳性克隆PCR筛选电泳Fig.6 PCR products of positive clones which were selected randomly M:DNA marker;H:H2O;1~14: PCR扩增的插入片段The PCR products of the inserts.

表2 非冗余序列Blast注释结果Table 2 Non redundant sequence Blast annotation results
2.8 差异表达基因Real-time PCR验证
选取文库中出现频率较高、片段较长而易于设计引物的2个ESTs:一个是与植物抗病毒相关LRR类蛋白基因(EST1),一个是Blast比对无同源序列的EST(EST2)。用qRT-PCR技术,检测上述ESTs代表的基因在马铃薯病毒侵染前后的表达情况。结果发现,这两个ESTs在脱毒种苗中表达量很低或者几乎没有表达,但是在感染病毒的植株中表达水平急剧升高(图7),两个ESTs在病毒侵染前后的相对表达量差异均达到了极显著水平(PEST1=0.000219<0.01,PEST2=0.00038<0.01), 这初步说明上述两个ESTs所代表的基因参与了马铃薯对病毒侵染胁迫的应答反应。
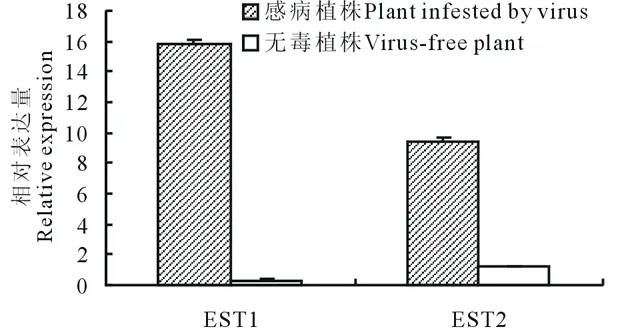
图7 差异表达ESTs的qRT-PCR验证Fig.7 Validation for the differential expression ESTs by qRT-PCR EST1:LRR类转录因子LRR type transcription factor;EST2:未知功能基因Functional unknown gene.
3 讨论
3.1 SSH文库的构建
基因的差异表达是调控生命活动的核心,通过比较同一植物组织在不同的病理条件下的基因表达差异是揭示植物病害致病机理及植物对病害防御机理的重要手段,抑制消减杂交技术的应用加快了基因差异表达分析的速度[16]。目前为止,抑制消减杂交技术已广泛应用于植物抗逆、抗病及生长发育相关领域[11-15],但在马铃薯病毒病入侵及抗病机理方面还没有相关研究报道。本研究以马铃薯病毒病携带植株的RNA为试验组(Tester)、脱毒种苗RNA为驱动组(Driver),构建了马铃薯病毒诱导应答基因抑制消减杂交cDNA文库,筛选出病毒入侵前后的差异表达基因,为进一步深入研究马铃薯病毒入侵机制,克隆马铃薯抗病毒基因并利用基因工程手段创制抗病毒马铃薯新种质奠定了基础。
但是抑制消减杂交技术也存在着一些不足,如:对实验材料的需求量较多,不适于来源困难的样品;得到的cDNA是限制酶消化后的小片段,进一步研究还需要扩增全长序列;要求对比实验组之间的差异性较低等。此外,实验本身的技术环节也存在不足,如酶切不完全、cDNA与接头的链接效率不高等,都会降低消减效率,致使消减结果存在一定的假阳性。在本文库的构建过程中,在每一个关键环节都进行了相应的验证,保证了实验结果的可靠性,差异表达ESTs测序结果显示文库内含有较多的病毒基因片段,选取的两个差异表达ESTs在病毒浸染后的相对表达量均显著提高,说明该消减文库构建比较成功,文库内包含的ESTs应该都是实验组所特有的基因片段。
3.2 马铃薯抗病毒基因的筛选
由于马铃薯在生产中造成产量下降的一个主要原因就是种薯感染病毒后导致的,再加上脱毒种薯的生产成本较高,因此,科学家一直在致力于抗病毒马铃薯新品种的培育[17]。而由于转基因技术的独特优势,科学家们也利用了多种转基因策略创制抗病毒马铃薯新种质,尤其是在马铃薯中表达病毒外壳蛋白基因和利用病毒反义RNA技术创制抗病毒种质方面开展了较多的研究[18-23],然而大多收效甚微或只能对一种病毒具有较好的效果,应用价值不高。因此,缺乏有效的抗病毒基因是利用基因工程技术培育马铃薯抗病毒品种多面临的最大困难。
R基因能够赋予植物对病毒、细菌、真菌等多种病原物的抗性,这种主动抗性依赖于寄主的R基因产物与病毒编码的无毒因子(Avr)之间的特异性识别,是目前为止所知道的能够赋予植物抗病性最好的基因[24]。目前克隆鉴定出来的植物抗病毒R基因中,绝大多数都是属于NBS-LRR蛋白,这类蛋白因为都有保守的核酸结合位点(nucleotide binding site,NBS)和亮氨酸重复结构域(leucine-rich repeats,LRR)而得名[25-26]。NBS-LRR类基因是在植物中发现的成员最多、多样性最丰富的基因家族之一,很多植物的基因组中含有很多个NBS-LRR蛋白家族成员,有报道指出二倍体栽培种马铃薯基因组中含有738个部分和完整的NBS-LRR序列[27]。目前从马铃薯中已克隆两个抗PVX基因Rx1和Rx2,它们均编码CC-NBS-LRR类型蛋白,特异性识别PVX的外壳蛋白(coat protein,CP),两者核酸序列也高度同源,转基因烟草和马铃薯也表现出了对PVX的极端抗性[28-30]。
本研究所构建的马铃薯病毒诱导应答基因SSH文库中就包含有一个具有亮氨酸重复结构域的LRR类蛋白基因,经Real-time PCR分析结果表明,该基因在不感染病毒的马铃薯植株中不表达,感染病毒植株中高表达。因此,该基因很可能是一个新的马铃薯抗病毒R基因,值得进一步深入研究。
References:
[1] Hawkes J. The Potato: Evolution, Biodiversity and Genetic Resources. London: Belhaven Press, 1990.
[2] Jansky S, Jin L, Xie K,etal. Potato production and breeding in China. Potato Research, 2009, 52(1): 57-65.
[3] Wang Q, Zhang W. An economic analysis of potato demand in China. American Journal of Potato Research, 2010, 87(3): 245-252.
[4] Wang B, Ma Y, Zhang Z,etal. Potato viruses in China. Crop Protection, 2011, 30(9): 1117-1123.
[5] Gebhardt C, Valkonen J P T. Organizatioin of genes controlling disease resistance in the potato genome. Annual Review of Phytopathology, 2001, 39(1): 79-102.
[6] Nie B H, Xie C H, Nie X Z. Progress in research on the resistance mechanism against viruses in potatoes. Acta Horticulturae Sinica, 2012, 39(9): 1703-1714.
聂碧华, 谢从华, 聂先舟. 马铃薯抗病毒机制研究进展. 园艺学报, 2012, 39(9): 1703-1714.
[7] Solomon-Blackburn R M, Barker H. Breeding virus resistant potatoes (Solanumtuberosum): A review of traditional and molecular approaches. Heredity, 2001, 86(1): 17-35.
[8] Wang X M, Jin L P, Yin J. Advances in research on potato virus breeding. Chinese Potato Journal, 2005, 19(5): 285-289.
王晓明, 金黎平, 尹江. 马铃薯抗病毒病育种研究进展. 中国马铃薯, 2005, 19(5): 285-289.
[9] Jia X X, Qi E F, Ma S,etal. Analysis of drought tolerance and herbicide resistance in transgenic potato plants over-expressing DREB1A/Bar. Acta Prataculturae Sinica, 2015, 24(11): 58-64.
贾小霞, 齐恩芳, 马胜, 等. 转DREB1A/Bar双价基因马铃薯的耐旱性及除草剂抗性分析.草业学报, 2015, 24(11): 58-64.
[10] Diatchenko L, Lau Y F, Campbell A P,etal. Suppression subtractive hybridization: a method for generating differentially regulated or tissue-specific cDNA probes and libraries. Proceedings of the National Academy of Sciences, 1996, 93(12): 6025-6030.
[11] Qiao S Y, Liu X Y, Wang Y H,etal. Constructing and analyzing SSH library for the early response genes in wheat brock afterBlumeriagraminisf.sp.tritici stress. Bulletin of Botanical Research, 2015, 35(1): 60-67.
乔石瑶, 刘晓颖, 王艳红,等. 栽培小麦Brock白粉菌诱导早期应答基因SSH 文库构建及分析. 植物研究, 2015, 35(1): 60-67.
[12] Li Z Y, Jia L X, Dong L,etal. Construction and preliminary analysis of the SSH library from the foxtail millet rust resistant variety of Shilixiang. Acta Agriculturae Boreali-Sinica, 2014, 29(6): 126-130.
李志勇, 贾丽霞, 董立, 等. 谷子十里香抗锈抑制消减杂交文库构建及初步分析. 华北农学报, 2014, 29(6): 126-130.
[13] Han M P, Wang Y H, Gao Y G,etal. Construction of differently expressed cDNA library of alfalfa by using suppression subtractive hybridization under the high temperature. Acta Prataculturae Sinica, 2011, 20(5): 126-132.
韩明鹏, 王彦华, 高永革, 等. 高温胁迫下紫花苜蓿抑制消减文库的构建. 草业学报, 2011, 20(5): 126-132.
[14] Wang T Z, Zhao M G, Zhang W H. Construction and analyses of two suppression subtractive hybridization libraries of Medicago falcate and Medicago truncatula under drought stress. Acta Prataculturae Sinica, 2012, 21(6): 175-181.
王天佐, 赵敏桂, 张文浩. 干旱胁迫下黄花苜蓿与蒺藜苜蓿两个抑制性差减杂交文库的构建及分析. 草业学报, 2012, 21(6): 175-181.
[15] Min Z, Geng W G, Fang Y L,etal. Screening and identification of differentially expressed endodormant genes from latent buds and prompt buds by suppression subtractive hybridization. Scientia Agricultura Sinica, 2014, 47(5): 1029-1040.
闵卓, 耿万刚, 房玉林, 等. 应用抑制消减杂交技术筛选葡萄冬芽和夏芽生理休眠相关基因. 中国农业科学, 2014, 47(5): 1029-1040.
[16] Diatchenko L, Lukyanov S, Lau Y F C,etal. Suppression subtractive hybridization: a versatile method for identifying differentially expressed genes. Methods in Enzymology, 1999, 303: 349-380.
[17] Chen Y L, Shi Y, Wang F Y. Utilization of new cultivars in China potato breeding//Chen Y L. Potato Research and Industry Development in China. Harbin: Harbin Engineering University Press, 2003, 70-76.
陈伊里, 石瑛, 王凤义. 新型栽培种在中国马铃薯育种中的利用//陈伊里. 中国马铃薯研究与产业开发. 哈尔滨: 哈尔滨工程大学出版社, 2003: 70-76.
[18] Song Y R, Ma Q H, Hou L L,etal. Transgenic potato with PVY coat protein gen and it’s small-scale field test. Acta Botanica Sinica, 1996, 38(9): 711-718.
宋艳茹, 马庆虎, 侯林林, 等. 转PVY外壳蛋白基因马铃薯及其田间实验. 植物学报, 1996, 38(9): 711-718.
[19] Cui X J, Peng X X, Shen Y F,etal. Cloning and sequencing of PLRV coat protein gene and construction of vectors for transgenic potato resistant to coinfection of PVY, PVX and PLRV. Chinese Journal of Biotechnology, 1994, 10(2): 185-189.
崔晓江, 彭学贤, 沈禹飞, 等. 马铃薯单双三价抗病毒基因表达载体的构建. 生物工程学报, 1994, 10(2): 185-189.
[20] Xiang Y, Yang L Y, Peng X X,etal. High virus-resistance of transgenic tobacco plants mediated by expression of modified Nib gene of potato virus Y. Chinese Journal of Biotechnology, 1996, 12(3): 258-265.
项瑜, 扬兰英, 彭学贤, 等. 改造的马铃薯Y 病毒复制酶基因介导高度抗病性. 生物工程学报, 1996, 12(3): 258-265.
[21] Dong J L, Hasi A, Zhang H L. The cDNA cloning and nucleotide sequence analysis of potato leafroll virus intergenic region. Virologica Sinica, 1996, 11(2): 144-148.
董江丽, 哈斯阿古拉, 张鹤龄. 马铃薯卷叶病毒基因间隔区的克隆及序列分析. 中国病毒学, 1996, 11(2): 144-148.
[22] Lamb J W, Hay R T. Ribozymes that cleave potato leafroll virus RNA within the coat protein and polymerase gene. Journal of General Virology, 1990, 71: 2257-2264.
[23] Yang X C, Zhu F, Liu Y L. The study on ribozyme gene of potato spindle tuber viroid//Chen Y L. Chinese Potato Academic Proceedings. Harbin: Heilongjiang science and Technology Press, 1996: 262-263.
杨希才, 朱峰, 刘玉乐. 抗马铃薯纺锤块茎类病毒的转核酶基因研究//陈伊里. 中国马铃薯学术研讨文集. 哈尔滨: 黑龙江科学技术出版社, 1996: 262-263.
[24] Martin G B, Bogdanove A J, Sessa G. Understanding the functions of plant disease resistance proteins. Annual Review of Plant Biology, 2003, 54: 23-61.
[25] Jones J D G, Dangl J L. The plant immune system. Nature, 2006, 444: 323-329.
[26] Moffett P. Mechanisms of recognition in dominant R gene mediated resistance. Advances in Virus Research, 2009, 75: 1-33.
[27] Bakker E, Borm T, Prins P,etal. A genome-wide genetic map of NB-LRR disease resistance loci in potato. Theoretical and Applied Genetics, 2011, 123(3): 493-508.
[28] Bendahmane A, Querci M, Kanyuka K,etal. Agrobacterium transient expression system as a tool for the isolation of disease resistance genes: Application to the Rx2 locus in potato. The Plant Joural, 2000, 21(1): 73-81.
[29] Grube R C, Radwanski E R, Jahn M. Comparative genetics of disease resistance within the Solanaceae. Genetics, 2000, 155(2): 873-887.
[30] Kang B C, Yeam I, Jahn M M. Genetics of plant virus resistance. Annual Review of Phytopathology, 2005, 43(1): 581-621.
Constructionandanalysisofasuppressionsubtractivehybridizationlibraryforthepotatovirusinducedresponsegene
LI Zhong-Wang, CHEN Yu-Liang, OU Qiao-Ming, YE Chun-Lei, PEI Huai-Di, LIU Xin-Xing,WANG Hong-Mei, LUO Jun-Jie*
BiotechnologyInstitute,GansuAcademyofAgriculturalSciences,Lanzhou730070,China
Potato virus accumulation is one of the important reasons for the decline of yield and quality in potato production. In order to screen and clone the potato virus induced response gene, we constructed a suppression subtractive hybridization (SSH) library using cDNAs from potato virus disease carrying plant leaf as the tester, and those cDNAs from a virus-free seedling leaf as the driver. To verify the effect of library, 98 randomly selected positive clones were identified by PCR from the library and sequenced, and 45 high quality non repeat sequences were obtained. By blast analysis in GenBank, we found that 14 of them were sequences belonging to the potato virus gene, 22 of them had high homology with known genes, and 9 of them had no homologous reference gene. Two frequently found ESTs in the library were analyzed using quantitative real time PCR, and their expression was induced by potato virus. The results therefore showed that the SSH library was constructed successfully. This work has thus laid a foundation for further screening for potato virus related pathogenicity, and induction of corresponding defense response genes. This may lead to analysis of the molecular mechanisms of interaction between the potato plant and the virus, and use of biotechnology to cultivate virus resistant potato varieties.
potato; virus; response gene; suppression subtractive hybridization
10.11686/cyxb2017063http//cyxb.lzu.edu.cn
李忠旺, 陈玉梁, 欧巧明, 叶春雷, 裴怀弟, 刘新星, 王红梅, 罗俊杰. 马铃薯病毒诱导应答基因抑制消减杂交文库构建及分析. 草业学报, 2017, 26(12): 152-159.
LI Zhong-Wang, CHEN Yu-Liang, OU Qiao-Ming, YE Chun-Lei, PEI Huai-Di, LIU Xin-Xing, WANG Hong-Mei, LUO Jun-Jie. Construction and analysis of a suppression subtractive hybridization library for the potato virus induced response gene. Acta Prataculturae Sinica, 2017, 26(12): 152-159.
2017-02-20;改回日期:2017-04-19
甘肃省农科院青年创新基金(2013GAAS29),甘肃省农业科学院创新团队(2015GAAS02),甘肃省农业科学院农业科技创新重大项目(2016GAAS59-02)和国家自然科学
基金项目(31460388)资助。
李忠旺(1980-),男,甘肃山丹人,助理研究员。E-mail: lizhongwang33@163.com*通信作者Corresponding author. E-mail:hnsljjie@163.com

