RABEp1基因与精神分裂症患者药物治疗所致体质量变化的关联分析
张婷,张旭,汪昕,郝苏怡,姚应水,沈冲
·论著·
RABEp1基因与精神分裂症患者药物治疗所致体质量变化的关联分析
张婷,张旭,汪昕,郝苏怡,姚应水,沈冲
目的探讨RABEp1基因多态性与精神分裂症(schizophrenia,SZ)患者抗精神病药治疗所致体质量变化的关联。方法调查并随访1 701例首发SZ患者使用抗精神病药治疗2~7周后的体质量变化。使用TaqMan基因分型技术检测RABEp1基因rs1058398和rs1065482位点多态性,COX比例风险模型分析RABEp1基因变异与SZ患者药物治疗所致体质量增加之间的关系。结果使用阿立哌唑治疗的SZ患者中,rs1058398位点AG+GG基因携带者相比AA基因携带者体质量增加的风险显著升高;调整年龄、性别后,风险比(HR)为1.842(95%CI:1.066~3.184,p=0.029);使用氯氮平患者中,rs1058398位点GG基因携带者相比AA+AG基因携带者体质量增加的风险显著降低,调整后HR为0.135(95%CI:0.018~0.992,p=0.049);使用奥氮平患者中,rs1058398位点相加模型与体质量增加相关联,调整后HR为1.740(95%CI:1.031~2.936,p=0.038)。此外,使用奥氮平患者中,rs1058398位点GG基因携带者相比AA+AG基因携带者体质量增加的风险显著升高,HR为3.534(95%CI:1.406~8.883,p=0.007)。使用阿立哌唑患者中,rs1065482位点CT+TT基因携带者相比CC基因携带者体质量增加的风险显著升高,HR为1.786(95%CI:1.034~3.083,p=0.037)。结论RABEp1基因rs1058398和rs1065482位点与抗精神病药所致体质量增加的发生风险显著关联;RABEp1基因多态性与阿立哌唑、奥氮平、氯氮平所致体质量增加有关。
精神分裂症; RABEp1基因; 抗精神病药; 体质量
精神分裂症(SZ)患者发生超重和肥胖的概率高于正常健康人群,抗精神病药治疗是导致体质量增加的重要原因之一[1]。抗精神病药可破坏人体能量平衡,导致代谢紊乱,致使患者体质量增加或肥胖。SZ患者的超重或肥胖可增加罹患糖尿病和心血管疾病的风险。抗精神病药与SZ患者体质量增加及代谢紊乱的关系值得关注与研究[2]。
药物遗传学认为,抗精神病药所致体质量变化存在内源性差异,即个体间在遗传易感性方面存在差异。药物反应的个体差异主要受遗传因素的影响。全基因组关联研究(genome-wide association study,GWAS)是发现复杂疾病易感基因的重要途径之一。SZ是一种复杂的多基因遗传性疾病,其遗传度为80%[3]。目前,GWAS研究已发现超过100个与SZ相关的遗传基因位点,其中,部分GWAS研究发现的遗传基因位点在不同种族、不同地区人群中得到重复验证[4]。Liu等[5]研究发现,RABEp1基因rs1058398和 rs1065482是miRNA结合位点,rs1058398和rs1065482位点的多态性可能与SZ的发病存在关联。RABEp1又称rabaptin-5,是参与胞内囊泡循环的重要效应分子和连接分子,它在细胞内吞、囊泡的形态调节和囊泡转运效率方面起调控作用,而内吞通路是聚合多种蛋白质参与各种神经障碍性疾病的一个关键点,包括阿尔茨海默症[6]。RABEp1基因参与疾病过程的具体机制还有待深入地研究。本研究通过临床随访研究,对SZ患者药物治疗后体质量的变化进行临床观察,并探讨抗精神病药所致体质量变化与RABEp1基因多态性的关系,为临床合理选用抗精神病药、减少体质量增加的发生提供理论依据。
1 对象和方法
1.1 对象
为2010年1月至2013年7月在江苏省淮安市第三人民医院首诊住院的精神分裂症患者。纳入标准:符合《疾病和有关健康问题的国际统计分类》第10版(ICD-10)精神分裂症诊断标准;住院前未接受抗精神病药治疗。排除标准:脑器质性和躯体疾病所致精神障碍、精神活性物质所致精神障碍。病前无肥胖、糖尿病、高血压及内分泌疾病史,无相关遗传病史。
对住院7 d以上的1 900例精神分裂症患者的体质量变化进行随访观察,纳入观察期在2~7周内的调查对象1 771例。进一步排除观察期2周后体质量变化记录异常(体质量变化超过20%)者70例,最终纳入分析对象1 701例。本研究获得所有患者及家属知情同意。
1.2 方法
1.2.1 研究流程 采用前瞻性随访研究,收集符合入组条件的研究对象一般人口学资料,包括年龄、性别、临床诊断、用药情况等。对首次入院的患者进行基线体质量的测量,在接受抗精神病药治疗2周后进行随访测量。测量前调查员经过统一、认真地培训,严格遵循操作指南完成。测量时保持环境安静、宽敞、地面水平;体质量计调零;被测者脱去鞋、帽子及外套,取出口袋携带的物品;平静直立于体质量计盘中央;待体质量秤读数稳定后,调查员记录读数,测量期间被测者身体保持直立状态。重复测量2次,精确度为0.5 kg,并随机抽取5%的个体进行重复测量,要求符合率达到100%。
1.2.2 治疗后体质量变化分组 随访期间根据患者药物治疗前后体质量变化差值的2.5%为切点,将体质量变化分为3组:体质量正常组(正常组,体质量变化±2.5%);体质量降低组(降低组,体质量降低2.6%~20%);体质量增加组(增加组,体质量增加2.6%~20%)。
1.2.3 SNp位点的选择 本研究在查阅国内外相关研究文献的基础上,结合生物信息学分析功能预测网站 (http://www.snpinfo.niehs.nih.gov/cgi-bin/snpinfo/snpfunc.cgi; http://www.microma.org/microma/home.do),在GWAS研究基础上,进一步筛选重复验证可能与SZ相关联的遗传位点进行研究,最终选择RABEp1基因rs1058398和rs1065482位点。
1.2.4 DNA的提取 采集SZ患者清晨空腹静脉血5 ml,EDTA抗凝。在24 h内对血样本进行4 000转离心10 min,分离血浆于1.5 ml Ep管。剩余血样本留存放置于-20 ℃冻存。DNA提取采用酚氯仿法。
1.2.5 基因分型 TaqMan探针法针对染色体上的不同SNp位点分别设计聚合酶链式反应(pCR)引物和TaqMan探针,进行实时荧光pCR扩增。pCR扩增在ABI 9700 pCR仪上完成,结果在ABI 7900荧光定量pCR仪上读取,实验结果通过分析软件SDS 2.3获得。
1.2.6 统计学方法 采用Epidata 3.0双轨录入数据。采用SpSS 15.0软件包进行统计分析。服从正态分布的连续性变量采用均数±标准差,非正态分布的连续性变量采用中位数(四分位数间距)表示。分类资料用构成比表示,采用χ2检验比较;正态分布资料组间比较分析采用方差分析或t检验,非正态分布组间比较采用非参数K-S检验。
COX比例风险模型分析不同基因型与抗精神病药所致体质量变化的风险比(Hazard ratio,HR)。进一步对抗精神病药以及单一联合用药进行分层分析,评价不同亚组中基因位点和SZ患者药物治疗后体质量变化之间的关系。双侧检验以p<0.05为差异有统计学意义。
2 结果
2.1 分组及基本情况变化比较
1 701例患者中男822例,女879例;平均年龄34.33岁;体质量变化分组:正常组948例,降低组175例,增加组578例;平均住院时间中位数为14 d;正常组、降低组与增加组的平均年龄分别为35.03岁、34.56岁和33.13岁;各组比较,增加组年龄低于正常组(t=3.063,p=0.002);单一用药或联合用药及不同种类的药物治疗的患者体质量变化差异无统计学意义(p>0.05)。见表1。
2.2 RABEp1基因变异与体质量变化的关联分析
COX回归分析显示,在调整年龄、性别后,RABEp1基因的rs1058398和rs1065482位点变异与体质量正常、体质量降低以及体质量增加的发生风险均无统计学关联(p>0.05)。见表2。
表1 各组基本情况比较(例数

表2 RABEp1基因多态性与体质量变化发生风险的关联分析
注:WT(野生型),HT(杂合型),MT(突变型);a:调整年龄和性别
2.3 RABEp1基因变异与体质量变化发生风险的分层分析
本研究根据抗精神病药治疗、单一、联合用药分组变量对研究对象分层,并调整协变量(年龄和性别)。结果显示,使用阿立哌唑治疗患者中,rs1058398位点AG+GG基因携带者相比AA基因携带者体质量增加的风险显著升高[HR为1.842(95%CI:1.066~3.184,p=0.029)];使用氯氮平治疗患者中,rs1058398位点GG基因携带者相比AA+AG基因携带者体质量增加的风险显著降低[HR为0.135(95%CI:0.018~0.992,p=0.049)];在使用奥氮平治疗患者中,rs1058398位点相加模型与体质量增加相关联[HR为1.740(95%CI:1.031~2.936,p=0.038)]。 此外,rs1058398位点GG基因携带者相比AA+AG基因携带者在使用奥氮平治疗患者中体质量增加的风险升高[HR为3.534(95%CI:1.406~8.883,p=0.007)]。rs1065482位点CT+TT基因携带者相比CC基因携带者在使用阿立哌唑治疗患者中体质量增加的风险升高[HR为1.786(95%CI:1.034~3.083,p=0.037)]。在利培酮、喹硫平以及奋乃静治疗患者中,未发现rs1058398和rs1065482不同基因分型(相加模型、显性模型和隐性模型)与体质量增加或降低的发生风险存在统计学关联(p>0.05)。见表3。
在单一用药组以及联合用药分组中,均未见rs1058398和rs1065482不同基因分型(相加模型、显性模型和隐性模型)与体质量增加或降低的发生风险存在统计学关联(p均>0.05)。见表4。

表3 不同抗精神病药分层分析rs1058398及rs1065482位点与体质量变化的发生风险
注:WT(野生型),HT(杂合型),MT(突变型);a:调整年龄和性别;*p<0.05,**p<0.01
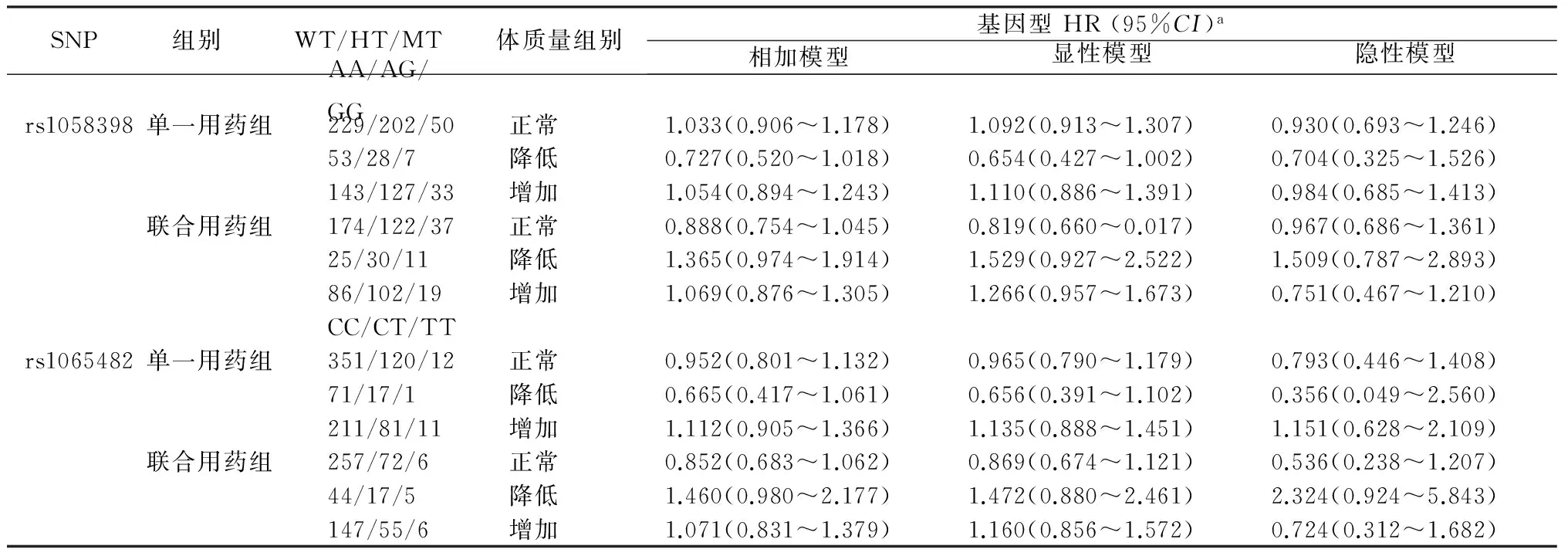
表4 药物分层分析两位点与体质量变化的发生风险
注:WT(野生型),HT(杂合型),MT(突变型);a:调整年龄和性别
3 讨论
抗精神病药可有效改善SZ患者症状,然而药物使用会出现体质量增加或肥胖等不良反应。本研究以首发SZ患者为对象,经过2~7周的抗精神病药治疗后,55.7%的患者体质量变化正常,34.0%的患者体质量增高,10.3%的患者体质量降低,体质量增高的比率高于体质量降低的比率。
不同个体接受同样的抗精神病药治疗后体质量的变化情况不同,遗传因素是个体差异非常重要的一个组成部分。越来越多的基因被发现与抗精神病药引起的体质量增加有关[7]。抗精神病药治疗所致体质量增加是基于其可作用于体质量调控通路靶蛋白的假说,该假说认为外周瘦素通路和中枢单胺类如多巴胺、组织胺(H)、5-羟色胺(5-HT)神经递质通路(包括这类递质及其代谢产物、递质前体及转运体、有关代谢酶活性等多个环节)等的基因变异可能是SZ患者体质量变化的基础[4]。
RABEp1,又称为Rabaptin-5或Neurocrescin,属于蛋白编码基因,位于染色体17p13.2,RABEp1蛋白主要分布在胞浆、细胞膜和内体上[8],作为Rab的功能蛋白,可通过连接γ-adaptin、RAB4A及RAB5A蛋白,促进膜融合而介导囊泡转运、早期内体融合及膜内吞作用[9]。当机体细胞受体外内环境因素刺激,调控Rabaptin-5表达水平的机制失去平衡,则可导致疾病的发生与发展。GWAS研究[5]报道,RABEp1基因rs1058398和rs1065482位点的多态性可能与SZ有关联。提示其可能影响脑组织的功能,尤其是下丘脑,下丘脑在影响食欲和食物摄入中扮演潜在角色,从而推测RABEp1基因可能参与体质量增加发生的机制。因此,进一步研究RABEp1基因与抗精神病药所导致的体质量变化有重要的意义。
本研究发现,RABEp1基因多态性与阿立哌唑、氯氮平以及奥氮平所致SZ患者体质量增加的发生风险存在关联。阿立哌唑、氯氮平以及奥氮平均属于非典型抗精神病药,能够有效稳定人体的多巴胺D2受体和5-HT受体系统,其主要通过激发这两个系统的活性,对SZ患者有较好的治疗效果[10]。D2受体是抗精神病药的重要作用靶点,研究[11]显示D2受体与基因功能位点联锁不平衡,D2受体通过提高其在纹状体内的表达水平以及食物摄入和能量代谢调控的增加,从而增加肥胖的易感性。5-HT受体中,5-HT2C受体基因是目前认为与SZ患者体质量相关的高危险因素[12]。
抗精神病药治疗所导致的体质量增加及代谢障碍等不良反应,是影响患者药物治疗依从性和生活质量的重要因素,是精神病治疗亟待解决的重要问题之一。本研究根据药物治疗前后患者体质量变化进行分组,体质量分组反映的是个体自身前后对比以及体质量变化的幅度和倾向,研究结果较客观。但本研究也存在不足,没有进行药物剂量上的比较,随访观察时间短,不足之处有待于进一步探讨。
综上所述,本研究随访观察了SZ患者入院后药物治疗2~7周后RABEp1基因变异与药物治疗所致体质量增加的关联,为探索药源性体质量增加的发生机制提供了一定的依据。
[1] Bak M,Fransen A,Janssen J,et al.Almost all antipsychotics result in weight gain:A meta-analysis[J].plos One,2014,9(4):94112.
[2] Torrent C,Amann B,Sánchezmoreno J,et al.Weight gain in bipolar disorder:pharmacological treatment as a contributing factor[J].Acta psychiatrica Scandinavica,2008,118(1):4-18.
[3] Inoue K,Lupski JR.Genetics and genomics of behavioral and psychiatric disorders[J].Curr Opin Genet Dev,2003,13(3):303-309.
[4] Fagiolini A,Chengappa KN.Weight gain and metabolic issues of medicines used for bipolar disorder[J].Current psychiatry Reports,2007,9(6):521-528.
[5] Liu C,Zhang F,Li T,et al.MirSNp,a database of polymorphisms altering miRNA target sites,identifies miRNA-related SNps in GWAS SNps and eQTLs[J].BMC Genomics,2012,13(1):661.
[6] Surendran S,Tyring SK,Matalon R.Expression of calpastatin,minopontin,NIpSNAp1,rabaptin-5 and neuronatin in the phenylketonuria (pKU) mouse brain:possible role on cognitive defect seen in pKU[J].Neurochemistry International,2005,46(8):595.
[7] Adkins DE,Aberg K,Mcclay JL,et al.Genomewide pharmacogenomic study of metabolic side effects to antipsychotic drugs[J].Molecular psychiatry,2010,16(3):321-332.
[8] Zerial M,Mcbride H.Rab proteins as membrane organizers[J].Nature Reviews Molecular Cell Biology,2001,2(2):107.
[9] Valsdottir R,Hashimoto H,Ashman K,et al.Identification of rabaptin-5,rabex-5,and GM130 as putative effectors of rab33b,a regulator of retrograde traffic between the Golgi apparatus and ER[J].Febs Letters,2001,508(2):201-209.
[10] Jr Kp,Mcelroy SL.Aripiprazole:a partial dopamine D2receptor agonist antipsychotic[J].Expert Opinion Investigational Drugs,2003,12(4):655-662.
[11] Hong CJ,Liou YJ,Bai YM,et al.Dopamine receptor D2gene is associated with weight gain in schizophrenic patients under long-term atypical antipsychotic treatment[J].pharmacogenetics Genomics,2010,20(20):359-366.
[12] Sicard MN,Zai CC,Tiwari AK,et al.polymorphisms of the HTR2C gene and antipsychotic-induced weight gain:an update and meta-analysis[J].pharmacogenomics,2017,11(11):1561-1571.
AssociationanalysesbetweenRABEp1polymorphismandweightchangeamongpatientswithantipsychoticdrugstreatment
ZHANGTing,ZHANGXu,WANGXin,HAOSu-yi,YAOYing-shui,SHENChong.
SchoolofpublicHealth,WannanMedicalCollege,Wuhu241001,China
ObjectiveTo explore the association between RABEp1 gene polymorphism and body weight changes among schizophrenic (SZ) patients with antipsychotic drugs treatment.MethodTo investigate and follow-up of 1701 first-episode patients with SZ who developed weight changes for 2 to 7 weeks after antipsychotic treatment.rs1058398 and rs1065482 of RABEp1 gene polymorphism was detected by TaqMan genotyping technology.COX proportional hazard model was used to analyze the hazard ratio of RABEp1 gene about weight change induced by antipsychotic treatment.ResultsAfter adjustment for age and gender,patients with aripiprazole treatment and carrying AG or GG genotypes of rs1058398 had an increased risk of weight gain,and adjusted HR was 1.842(95%CI:1.066-3.184,p=0.029);patients with clozapine treatment and carrying GG genotype of rs1058398 had a decreased risk of weight gain,and adjusted HR was 0.135(95%CI:0.018-0.992,p=0.049);patients with olanzapine treatment,carrying the additive model of rs1058398 was significantly associated with the risk of weight gain,and adjusted HR was 1.740 (95%CI:1.031-2.936,p=0.038).In addition,patients carrying GG genotype of rs1058398 had an increased risk of weight gain,HR was 3.534 (95%CI:1.406-8.883,p=0.007).patients treated with aripiprazole and carrying CT or TT genotypes of rs1065482 had an increased risk of weight gain,and HR was 1.786 (95%CI:1.034-3.083,p=0.037).Conclusionrs1058398 and rs1065482 of RABEp1 are associated with the risk of weight gain among SZ patients due to antipsychotic treatment.Significant association of RABEp1 polymorphism with weight gain is observed in SZ patients with aripiprazole,clozapine and olanzapine treatment.
schizophrenia; RABEp1 gene; antipsychotic drugs; weight gain
R749.3
A
1005-3220(2017)06-0377-05
江苏省淮安市科技局社会发展项目(HAS2011023);安徽省教育厅高校省级自然科学研究项目资助课题(KJ2012A272)
241001 安徽芜湖,皖南医学院公共卫生学院(张婷,姚应水);南京医科大学公共卫生学院(张婷,沈冲);江苏省淮安市第三人民医院(张旭,汪昕,郝苏怡)
沈冲,E-Mail:sc100@126.com
2017-03-29
2017-07-30)

