CRISPLD2蛋白对内毒素-诱导急性呼吸窘迫综合征小鼠炎性因子表达的影响
刘雪峰,李文放,林兆奋
·基础医学·
·论著·
CRISPLD2蛋白对内毒素-诱导急性呼吸窘迫综合征小鼠炎性因子表达的影响
刘雪峰,李文放,林兆奋
目的探讨CRISPLD2蛋白对内毒素-诱导急性呼吸窘迫综合征(LPS-ARDS)小鼠体内炎性因子表达的影响。方法采用数字表法将40只雄性昆明小鼠随机分5组:对照组(A组),气道内滴入0.1 mg内毒素(LPS);rCRISPLD2蛋白1组(B组)、rCRISPLD2蛋白2组(C组),小鼠尾静脉分别注射1.0、0.4 mg rCRISPLD2蛋白,6 h后气道内滴入0.1mg LPS;rCRISPLD2蛋白3组(D组)、rCRISPLD2蛋白4组(E组),予小鼠气道内滴入0.1mg LPS,6 h后予小鼠尾静脉分别注射1.0、0.4 mg rCRISPLD2蛋白。每组小鼠在LPS气道滴入后第12 h收集支气管肺泡灌洗液(BALF),离心后计数沉淀中性粒细胞,测量上清液及血标本中的肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)及IL-6。结果B、C组BALF中的中性粒细胞计数(0.31±0.07、0.76±0.08)ng/L、TNF-α(8.88±17.37、134.63±24.44)ng/L、IL-1β(48.63±15.61、99.75±12.30)ng/L、IL-6(80.75±21.03、140.12±29.29)ng/L均明显低于A、D、E组(1.64±0.10、1.73±0.13、1.65±0.08),差异有统计学意义(P<0.05);B组以上检测值均明显低于C组,差异有统计学意义(P<0.05)。结论CRISPLD2蛋白可下调LPS所诱导的炎症因子表达水平,并且呈现一定的剂量依赖关系。
CRISPLD2蛋白;内毒素;急性呼吸窘迫综合征;炎症因子
急性呼吸窘迫综合征(ARDS)是由多种肺内外因素所诱发的以顽固性低氧血症为主要临床表现的一组临床综合征[1],肺泡上皮细胞以及肺毛细血管内皮细胞的弥漫性损伤是其病理特征。ARDS起病急骤、进展快,临床死亡率高,至今仍无特效治疗。目前认为失控的炎症反应是其发生/发展的根本原因。
CRISPLD2蛋白是一个高度保守的半胱氨酸富集的血浓度较高的分泌型蛋白,人类和小鼠的肺脏、小肠以及各种免疫细胞都可以表达CRISPLD2蛋白[2-3]。现有研究发现提升小鼠血清CRISPLD2蛋白浓度,可对内毒素(LPS)诱导的ARDS小鼠起到保护作用,减轻模型小鼠死亡率[4]。本研究拟通过观察CRISPLD2蛋白对LPS诱导的ARDS小鼠肺部炎症因子的影响,进一步探讨CRISPLD2蛋白对LPS-ARDS小鼠的保护作用。
1 材料与方法
1.1 实验动物
健康雄性昆明小鼠40只,体质量(20±2)g,购自第二军医大学实验动物中心,实验前给予3 d适应实验环境。
1.2 主要实验试剂
LPS购自Sigma公司。CRISPLD2蛋白的稳定表达株(CHO-A5)购自上海南方基因公司(中国),通过培养扩增蛋白表达株,对上清液进行离心提纯获得CRISPLD2蛋白。其余试剂购自上海晶抗生物制品有限公司。
1.3 分组及实施
1.3.1 分组 采用随机数字表法将40只雄性昆明小鼠随机分为以下5组(n=8):对照组(A组),气道内滴入0.1 mg LPS;rCRISPLD2蛋白1组(B组)、rCRISPLD2蛋白2组(C组),小鼠尾静脉分别注射1.0、0.4 mg rCRISPLD2蛋白,6 h后气道内滴入0.1 mg LPS;rCRISPLD2蛋白3组(D组)、rCRISPLD2蛋白4组(E组),予小鼠气道内滴入0.1 mg LPS,6 h后予小鼠尾静脉分别注射1.0、0.4 mg rCRISPLD2蛋白。
1.3.2 标本留取及指标测定 各组小鼠在气道滴入LPS后第12小时以1%戊巴比妥钠麻醉,断尾留取血;收集支气管肺泡灌洗液(BALF)。取0.5 ml BALF检测中性粒细胞计数;剩余BALF以1 500 r/min(r=8 cm)离心10 min,抽取上清液;通过ELISA法检测BALF上清液及血清中的肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)及IL-6。
1.4 统计学处理
检测数据采用均数±标准差(x±s)表示,采用SPSS 18.0统计软件进行分析。2组之间的比较采用t检验;多组之间采用方差分析。P<0.05表示差异具有统计学意义。
2 结果
2.1 CRISPLD2蛋白对BALF中性粒细胞计数的影响
各组实验小鼠LPS气道滴入第12小时测量留取肺泡灌洗液,与A、D、E组相比,B、C组BALF中的中性粒细胞计数明显降低,差异有统计学意义(P<0.05);且B组中性粒细胞较C组低,差异有统计学意义(P<0.05)。A、D、E组间差异无明显统计学意义(P>0.05)。见表1。

表1 各组小鼠BALF中所含中性粒细胞(x±s)
注:与A、D、E组比较aP<0.05;与C组比较bP<0.05。BALF:支气管肺泡灌洗液。A组:小鼠气道滴入0.1 mg内毒素,B、C组:小鼠尾静脉分别注射1.0、0.4 mg rCRISPLD2蛋白,6 h后气道内滴入0.1 mg内毒素,D、E组:小鼠气道内滴入0.1 mg内毒素,6 h后予小鼠尾静脉分别注射1.0、0.4 mg rCRISPLD2蛋白
2.2 CRISPLD2蛋白对BALF中TNF-α、IL-1β及IL-6表达量的影响
小鼠BALF检测结果表明,与A、D、E组相比,B、C组的TNF-α、IL-1β及IL-6表达量降低,差异有统计学意义(P<0.05);且与C组相比,B组3项检测值更低,差异有统计学意义(P<0.05);而A、D、E组间差异无统计学意义(P>0.05)。见表2。
2.3 CRISPLD2蛋白对血清中TNF-α、IL-1β及IL-6表达量的影响
小鼠血清检测结果表明,与A、D、E组相比,B、C组的TNF-α、IL-1β及IL-6表达量降低,差异有统计学意义(P<0.05);且B组检测值均低于C组,差异有统计学意义(P<0.05);而A、D、E组间差异无统计学意义(P>0.05)。见表3。
3 讨论
ARDS是临床上常见的一种危重症,其本质是全身炎症反应综合征在肺部的体现。巨噬细胞、中
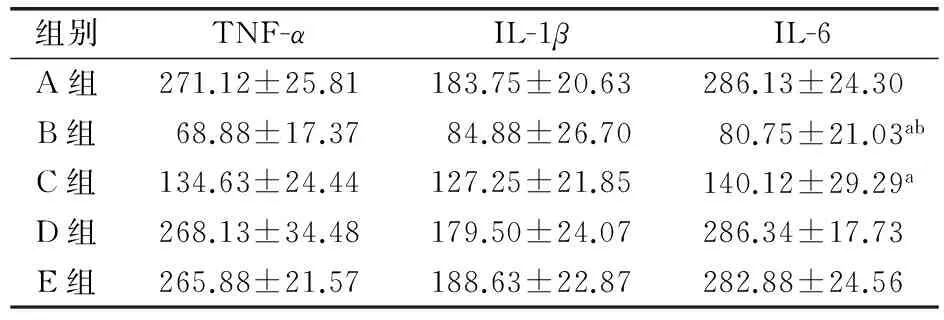
表2 各组小鼠BALF中TNF-α、IL-1β及IL-6的表达量(ng/L,x±s,每组n=8)
注:与A、D、E组比较aP<0.05;与C组比较bP<0.05。BALF:支气管肺泡灌洗液,TNF-α:肿瘤坏死因子-α,IL-1β:白细胞介素-1β。A组:小鼠气道滴入0.1 mg内毒素,B、C组:小鼠尾静脉分别注射1.0、0.4 mg rCRISPLD2蛋白,6 h后气道内滴入0.1 mg内毒素,D、E组:小鼠气道内滴入0.1 mg内毒素,6 h后予小鼠尾静脉分别注射1.0、0.4 mg rCRISPLD2蛋白

表3 各组小鼠BALF中TNF-α、IL-1β及IL-6的表达量(ng/L,x±s,每组n=8)
注:与A、D、E组比较aP<0.05;与C组比较bP<0.05。BALF:支气管肺泡灌洗液,TNF-α:肿瘤坏死因子-α,IL-1β:白细胞介素-1β。A组:小鼠气道滴入0.1 mg内毒素,B、C组:小鼠尾静脉分别注射1.0、0.4 mg rCRISPLD2蛋白,6 h后气道内滴入0.1 mg内毒素,D、E组:小鼠气道内滴入0.1 mg内毒素,6 h后予小鼠尾静脉分别注射1.0、0.4 mg rCRISPLD2蛋白
性粒细胞等炎性细胞的肺组织浸润聚集以及促炎因子的大量释放是导致肺毛细血管内皮细胞损伤、血管通透性增加以及肺泡表面活性物质减少的主要及关键因素[5]。LPS通过激活TLR4受体通路引起TNF-α、IL-1β及IL-6等促炎因子释放[6-7];TNF-α等因子可刺激其他炎症因子的进一步释放,从而形成瀑布效应导致机体炎症反应失衡,又可诱发中性粒等免疫细胞在肺间质组织的浸润,加重炎症反应和组织破坏[8]。
本实验在LPS气道滴入诱导ARDS小鼠模型基础[9]上,通过调整rCRISPLD2蛋白注射剂量及时间点来研究此蛋白对小鼠血清及BALF中TNF-α、IL-1β及IL-6等促炎因子的影响。实验发现在LPS造模前给予rCRISPLD2可降低BALF及血清中的TNF-α、IL-1β及IL-6的表达,减少BALF中的中性粒细胞聚集水平,并且rCRISPLD2蛋白的使用剂量与炎症因子及中性粒细胞的检测值呈负相关;同时发现LPS造模6 h后再给予小鼠rCRISPLD2蛋白未见到明显的抗炎作用,各种检测值与对照组相比无改善。笔者前期研究发现,预先提升小鼠血CRISPLD2蛋白浓度可以起到保护LPS-ARDS小鼠,降低5 d死亡率的作用[4],与本次实验数据相一致,并提示rCRISPLD2蛋白减轻LPS诱导的ARDS与抑制TNF-α等炎症因子的表达相关。
综上所述,预先予rCRISPLD2蛋白处理,可降低LPS所诱导的炎症因子表达水平,改善模型小鼠预后,并且有一定的量效关系;而LPS充分诱导小鼠肺部炎症反应后再给予rCRISPLD2蛋白则无此作用。说明CRISPLD2蛋白可阻断LPS,激活TLR4受体途径,从而起到对LPS-ARDS小鼠的保护作用。
[1] Tuinman PR, Dixon B, Levi M, et al.Nebulized anticoagulants for acute lung injury-a systematic review of preclinical and clinical investigations[J].Crit Care,2012,16(2):R70-R70. DOI:10.1186/cc11325.
[2] Chiquet BT, Lidral AC,Stal S, et al. CRISPLD2: a novel NSCLP candidate gene[J]. Hum Mol Genet. 2007, 16(18): 2241-2248.DOI:10.1093/hmg/ddm176.
[3] Warren HS, Suffredini AF, Robert SM. Risks and benefits of activated protein c treatment for severe sepsis[J]. N Engl J Med.2002,347(13):1027-1030.DOI:10.1056/NEJMsb020574.
[4] 刘雪峰,瞿金龙,李文放,等.CRISPLD2蛋白对内毒素急性呼吸窘迫综合征小鼠的保护作用[J].海军医学杂志. 2017,38(1): 21-23.DOI:10.3969/j.issn.1009-0754.2017.01.008.
[5] Moloney ED, Griffiths MJ.Protective ventilation of patients with acute respiratory distress syndrome[J].Crit Care,2004,92(2):261-270.DOI: 10.1186/cc2849.
[6] Beutler B.TLR4 as the mammalian endotoxin sensor[J].Curr Top Microbiol Immunol,2002,270:109-120.DOI:10.1111/j.1472-765X.2004.01588.x.
[7] Banerjee A, Moore EE, Mclaughlin NJ, et al.Hyperosmolarity attenuates TNF-α-mediated proinflammatory activation of human pulmonary microvascular endothelial cells[J].Shock,2013,39(4):366-372.DOI: 10.1097/SHK.0b013e3182894016.
[8] Aisiku IP, Yamal J, Doshi P, et al.Plasma cytokines IL-6,IL-8,and IL-10 are associated with the development of acute respiratory distress syndrome in patients with severe traumatic brain injury[J].Crit Care,2016,20:288.DOI:10.1186/s13054-016-1470-7.
[9] 陶一帆,田方敏,郭向阳,等.不同剂量脂多糖在不同作用时间下诱导小鼠急性肺损伤的效果评价[J].中国中西医结合急救杂志,2015,22(2):142-146.DOI:10.3969/j.issn.1008-9691.2015.02.008.
Effect of CRISPLD2 on the expression of inflammatory cytokine in LPS-induced ARDS mice
LiuXuefeng,LiWenfang,LinZhaofen
(DepartmentofCriticalCareMedicine,ChangzhengHospital,Shanghai200003,China)
ObjectiveTo investigate the effect of CRISPLD2 protein on the expression of inflammatory cytokine in LPS-induced acute respiratory distress syndromes (ARDSs) mice.MethodsForty male Kunming mice were randomly divided into 5 groups; the control group (group A), which was given 0.1mg LPS via the intratracheal instillation; the rCRISPLD2 group 1 (group B) and the rCRISPLD2 group 2 (group C), which were respectively treated with 1mg and 0.4mg rCRISPLD2 by tail vein, and after 6 hours rCRISPLD2 was injected intratracheally; the rCRISPLD2 group 3 (group D) and the rCRISPLD2 group 4 (group E), which were first given 0.1mg LPS intratracheally and then were injected with 1mg and 0.4mg rCRISPLD2 by tail vein. At hour 12 after intratracheal injection of LPS in the mice of all the groups, bronchoalveolar lavage fluid (BALF) was collected. After centrifugation, the number of neutrophils was counted, and the levels of TNF-α, IL-1βand IL-6 were detected in supernatant fluid and blood samples.ResultsThe number of neutrophils(0.31±0.07、0.76±0.08), TNF-α(8.88±17.37、134.63±24.44), IL-1β(48.63±15.61, 99.75±12.30)and IL-6 (80.75±21.03,140.12±29.29)in serum and BALF in groups B and C were all significantly lower than those of group A, D and E, and statistical significance could be noted, when comparisons were made between these groups (P<0.05). The detected data of group B were obviously lower than those of group C, also with statistical significance (P<0.05).ConclusionrCRISPLD2 could down-regulate the expression levels of LPS-induced inflammatory factors, and dosage dependence could be noted to a certain extent.
rCRISPLD2; Lipopolysaecharide; Acute respiratory distress syndrome; Inflammatory cytokine
R576
A
10.3969/j.issn.1009-0754.2017.06.010
200003 上海,上海长征医院急救科
林兆奋,电子信箱:linzfczjj@163.com
2016-07-08)
(本文编辑:张阵阵)

