Ca2+参与H2O2促进盐碱混合胁迫下燕麦种子的萌发和成苗
刘建新 刘秀丽 王金成 贾海燕
(1.甘肃省高校陇东生物资源保护与利用省级重点实验室,庆阳 745000; 2.陇东学院生命科学与技术学院,庆阳 745000)
Ca2+参与H2O2促进盐碱混合胁迫下燕麦种子的萌发和成苗
刘建新1,2刘秀丽1,2王金成1,2贾海燕1,2
(1.甘肃省高校陇东生物资源保护与利用省级重点实验室,庆阳 745000;2.陇东学院生命科学与技术学院,庆阳 745000)
盐碱胁迫是制约作物高产优质的重要因素,Ca2+和H2O2作为信号分子参与作物逆境响应调节。为了解Ca2+是否参与H2O2对盐碱胁迫下植物种子萌发和成苗的调控,以燕麦(Avenanude)为试验材料,采用隶属函数分析方法,研究了胞外游离Ca2+螯合剂EGTA、质膜Ca2+通道阻断剂LaCl3和液泡膜Ca2+释放抑制剂钌红(RR)与H2O2共处理对盐碱混合(NaCl∶Na2SO4∶NaHCO3∶Na2CO3=12∶8∶9∶1)胁迫下种子萌发和成苗的影响。结果表明,25~200 mmol·L-1盐碱混合胁迫显著抑制燕麦的种子萌发和成苗,抑制程度随浓度提高而增强;0.001~2 mmol·L-1H2O2能够促进燕麦种子的萌发和成苗,且0.5 mmol·L-1H2O2可以显著缓解75 mmol·L-1盐碱混合胁迫对燕麦种子萌发和成苗的抑制作用;而EGTA、LaCl3和RR均能消减H2O2对盐碱混合胁迫下燕麦种子萌发和成苗的促进作用。表明Ca2+参与H2O2促进盐碱混合胁迫下燕麦种子萌发和成苗的信号转导过程。
钙离子;过氧化氢;盐碱混合胁迫;燕麦;种子萌发和成苗
土壤盐碱化是作物生长发育主要的制约因素之一,提高作物盐碱耐性是高效利用盐碱地最为经济的有效途径[1]。过氧化氢(hydrogen peroxide,H2O2)是植物细胞内一种重要的信号分子,参与调节植物的抗逆反应[2]。研究表明,H2O2作为根源信号介导盐胁迫诱导的蚕豆(ViciafabaL.)气孔关闭[3],外源H2O2预处理能够提高植物的耐盐性[4]。种子的萌发和成苗是植物物种繁衍和生存的前提。种子萌发起始于吸胀,结束于胚根突破周围结构,但成苗是种子萌发后的事件,不属于萌发的内容[5]。H2O2能够促进茄子(Solanummelongena)种子的萌发[6],缓解盐胁迫对板蓝根(Isatisindigotica)幼苗生长的抑制[7]。然而,H2O2促进植物种子萌发和缓解盐胁迫抑制成苗过程中的信号转导机制仍尚不十分清楚。
钙离子(Ca2+)是植物必需的矿质元素,也是偶联胞外信号与胞内生理生化反应的第二信使,参与植物生长发育与各种逆境响应调节[8]。研究证明,盐胁迫下细胞质膜Ca2+/H+逆向转运蛋白大量表达[9],引起胞质Ca2+浓度改变[10],并通过钙调蛋白的级联传导,调控细胞分裂和伸长[11]。H2O2作为信号分子激活拟南芥(Arabidopsisthaliana)保卫细胞质膜Ca2+通道[12],可逆抑制山黧豆(Lathyrusquinquenervius)幼苗根的向地性[13]。然而,Ca2+是否参与H2O2对盐碱混合胁迫下植物种子萌发和成苗过程的调控,目前尚未见报道。本试验以耐盐碱的小杂粮作物燕麦为材料,模拟燕麦种植地土壤盐、碱的组成,探讨H2O2对种子萌发和成苗的影响及Ca2+在其中的作用,旨在为揭示H2O2调控植物盐碱胁迫响应机制提供依据。
1 材料与方法
1.1 供试材料与盐碱混合溶液配制
燕麦(Avenanuda)品种为‘定莜6号’,种子由甘肃省定西市旱作农业科研推广中心提供。NaCl、Na2SO4、NaHCO3、Na2CO3、H2O2均为国产分析纯;质膜Ca2+通道阻断剂LaCl3、胞外Ca2+螯合剂乙二醇双(2-氨基乙基醚)四乙酸(EGTA)和液泡膜Ca2+释放抑制剂钌红(ruthenium red,RR)均为Sigma公司产品。
首先分别配制0.4mol·L-1NaCl、0.2mol·L-1Na2SO4、0.3mol·L-1NaHCO3和0.02mol·L-1Na2CO3溶液,然后根据甘肃省燕麦种植地盐分组成,将中性盐NaCl、Na2SO4和碱性盐NaHCO3、Na2CO3按12∶8∶9∶1摩尔质量比配制成浓度分别为0、25、50、75、100、125、150、175、200mmol·L-1的盐碱混合溶液。
1.2 种子萌发试验
精选饱满、均一的燕麦种子以3%次氯酸钠表面消毒15min,漂洗干净后备用。将100粒种子均匀摆置在铺有双层滤纸的直径12cm培养皿中,分别加入蒸馏水、盐碱混合溶液、H2O2、EGTA、LaCl3和RR溶液4mL进行单独处理或共处理,在培养箱中20℃培养,观察种子的萌发和成苗情况,每天观察时补充2mL相应溶液,参考唐静等[14]的实验及预备实验筛选所用EGTA=5mmol·L-1,LaCl3=2mmol·L-1,RR=0.2mmol·L-1。实验设3次重复。在种子置床12h后进行观察记载,以胚根突破种皮2mm为萌发标准记录发芽数,除H2O2对种子萌发的影响每4h观察1次外,其余实验均每隔12h记录1次发芽数,直至对照组发芽数不变为止后统计发芽率,用直尺测量萌发种子的胚根和胚芽长度,称量100粒种子萌发苗的鲜重后置105℃杀青30min,70℃烘干至恒重,称干重。计算萌发前3d的萌发势、萌发指数和活力指数。
萌发率(%)=种子萌发数/供试种子数×100
(1)
萌发势(%)=萌发前3d种子萌发数/供试种子数×100
(2)
萌发指数(GI)=∑Gt/Dt
(3)
式中:Gt为第t天的种子发芽数;Dt为相应发芽天数。
活力指数(VI)=GI×S
(4)
式中:S为胚根和胚芽总干重。
1.3 数据统计分析
为反映不同处理下燕麦种子萌发和成苗的差异,避免用单一指标评价带来的片面性,采用隶属函数法来进行综合评价,分别计算萌发率、萌发势、萌发指数、活力指数、鲜重、干重、胚根长和胚芽长的隶属函数值,以隶属函数值的平均值±标准差反映燕麦种子的萌发和成苗状况,采用SPSS20.0软件对平均值进行单因素方差分析,Duncan法多重比较差异显著性(P<0.05)。隶属函数值:
U(Xi)=(Xi-Xmin)/(Xmax-Xmin)i=1,2,3,…,n
式中:Xi为指标测定值;Xmin和Xmax为不同处理下某一指标测定值的最小值和最大值。
2 结果与分析
2.1 盐碱混合胁迫对燕麦种子萌发和成苗的影响
由图1可见,随着盐碱混合处理浓度增大,燕麦种子萌发率、萌发势、萌发指数、活力指数、鲜重、干重、胚根长和胚芽长的平均隶属函数值呈明显下降趋势,与对照相比,25~200mmol·L-1盐碱混合胁迫处理的平均隶属函数值下降了7.5%~98.4%,其中75mmol·L-1处理的平均隶属函数值降低50%左右,为54.3%。因此,以下实验以75mmol·L-1作为盐碱混合胁迫的处理浓度。

图1 盐碱混合胁迫对燕麦种子萌发和成苗的影响 不同小写字母表示处理间差异显著(P<0.05)Fig.1 Effect of salt-alkaline mixed stress on the seed germination and seedling formation of oat Different letters means significant difference at P<0.05

图2 不同浓度H2O2对燕麦种子萌发和成苗的影响Fig.2 Effect of different concentrations of H2O2 on the seed germination and seedling formation of oat
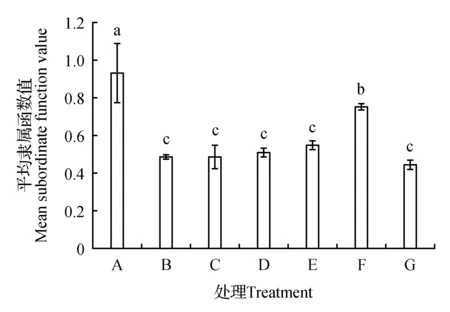
图3 H2O2对盐碱混合胁迫下燕麦种子萌发和成苗的影响 A.对照;B. 75 mmol·L-1盐碱混合胁迫;C. 75 mmol·L-1盐碱混合胁迫+0.001 mmol·L-1 H2O2;D. 75 mmol·L-1盐碱混合胁迫+0.01 mmol·L-1 H2O2;E. 75 mmol·L-1盐碱混合胁迫+0.1 mmol·L-1 H2O2;F. 75 mmol·L-1盐碱混合胁迫+0.5 mmol·L-1 H2O2;G. 75 mmol·L-1盐碱混合胁迫+1 mmol·L-1 H2O2Fig.3 Effect of H2O2 on seed germination and seedling formation of oat under salt-alkaline mixed stressA.Control;B. 75 mmol·L-1 salt-alkaline mixed stress;C. 75 mmol·L-1 salt-alkaline mixed stress+0.001 mmol·L-1 H2O2;D. 75 mmol·L-1 salt-alkaline mixed stress+0.01 mmol·L-1 H2O2;E. 75 mmol·L-1 salt-alkaline mixed stress+0.1 mmol·L-1 H2O2;F. 75 mmol·L-1 salt-alkaline mixed stress+0.5 mmol·L-1 H2O2;G. 75 mmol·L-1 salt-alkaline mixed stress+1 mmol·L-1 H2O2
2.2 H2O2对燕麦种子萌发和成苗的影响
从图2可知,在0.001~4 mmol·L-1H2O2处理浓度范围内,燕麦种子萌发和成苗的平均隶属函数值随H2O2浓度提高呈先升后降变化。与对照相比,0.001~2 mmol·L-1H2O2均不同程度促进了种子的萌发和成苗,其中0.1 mmol·L-1处理的效果最好,2 mmol·L-1处理的平均隶属函数值与1 mmol·L-1处理的差异不显著,4 mmol·L-1处理下的平均隶属函数值与对照无显著差异。说明一定范围浓度的H2O2可以促进燕麦种子的萌发和成苗。因此,选择0.001、0.01、0.1、0.5和1 mmol·L-1H2O2与75 mmol·L-1盐碱混合胁迫进行交叉处理,观察H2O2对盐碱混合胁迫下燕麦种子萌发和成苗的影响。
2.3 H2O2对盐碱混合胁迫下燕麦种子萌发和成苗的影响
分别用蒸馏水、75 mmol·L-1盐碱混合溶液、75 mmol·L-1盐碱混合溶液与0.001~1 mmol·L-1H2O2共处理下燕麦种子萌发和成苗的结果(图3)显示,75 mmol·L-1盐碱混合溶液和0.5 mmol·L-1H2O2共处理(F处理)下燕麦种子萌发和成苗的平均隶属函数值显著高于单独75 mmol·L-1盐碱混合处理(B处理),而其它浓度H2O2共处理(C、D、E、G)的平均隶属函数值与单独盐碱混合处理(B处理)无显著差异。表明0.5 mmol·L-1H2O2能够缓解盐碱混合胁迫对燕麦种子萌发和成苗的抑制。

图4 EGTA对H2O2缓解盐碱混合胁迫抑制燕麦种子萌发和成苗的影响 A.对照;B. 75 mmol·L-1盐碱混合胁迫;C. 0.5 mmol·L-1 H2O2;D. 75 mmol·L-1盐碱混合胁迫+0.5 mmol·L-1 H2O2;E. 5 mmol·L-1 EGTA;F. 75 mmol·L-1盐碱混合胁迫+5 mmol·L-1 EGTA;G. 5 mmol·L-1 EGTA+0.5 mmol·L-1 H2O2;H. 75 mmol·L-1盐碱混合胁迫+0.5 mmol·L-1 H2O2+5 mmol·L-1 EGTAFig.4 Effect of EGTA on mitigative effect of H2O2 to seed germination and seedling formation inhibition of oat induced by salt-alkaline mixed stress A.Control;B. 75 mmol·L-1 salt-alkaline mixed stress;C. 0.5 mmol·L-1 H2O2;D. 75 mmol·L-1 salt-alkaline mixed stress+0.5 mmol·L-1 H2O2;E. 5 mmol·L-1 EGTA;F. 75 mmol·L-1 salt-alkaline mixed stress+5 mmol·L-1 EGTA;G. 5 mmol·L-1 EGTA+0.5 mmol·L-1 H2O2;H. 75 mmol·L-1 salt-alkaline mixed stress+0.5 mmol·L-1 H2O2+5 mmol·L-1 EGTA
2.4 EGTA对H2O2缓解盐碱混合胁迫抑制燕麦种子萌发和成苗的影响
EGTA是胞外Ca2+的螯合剂。由图4可知,(1)EGTA处理(E处理)显著抑制燕麦种子的萌发和成苗,使平均隶属函数值比对照下降了59.0%,而外源H2O2能够有效降低EGTA的抑制作用(G处理与E处理相比);(2)盐碱混合胁迫下Ca2+被EGTA螯合后燕麦种子的萌发和成苗受到极大抑制(F处理与B处理相比),同样,外源H2O2能明显降低EGTA的抑制作用(H处理与F处理相比);(3)外源H2O2对盐碱混合胁迫抑制燕麦种子萌发和成苗的缓解作用(D处理与B处理相比),经EGTA处理后明显受到阻遏(H处理与D处理相比)。以上说明胞外Ca2+螯合剂能够降低H2O2对盐碱混合胁迫下燕麦种子萌发和成苗抑制的缓解作用。
2.5 LaCl3对H2O2缓解盐碱胁迫抑制燕麦种子萌发和成苗的影响
LaCl3是质膜Ca2+通道的阻断剂,能够阻断胞外Ca2+向胞内的流动。从图5可见,LaCl3处理明显抑制盐碱混合胁迫下燕麦种子的萌发和成苗(G处理与C处理比较);LaCl3和H2O2共处理显著削弱了H2O2对盐碱混合胁迫下燕麦种子萌发和成苗的促进作用(E处理与C处理比较)(H处理与E处理比较)。说明H2O2促进盐碱混合胁迫燕麦种子萌发和成苗过程有经质膜通道内流Ca2+的参与。
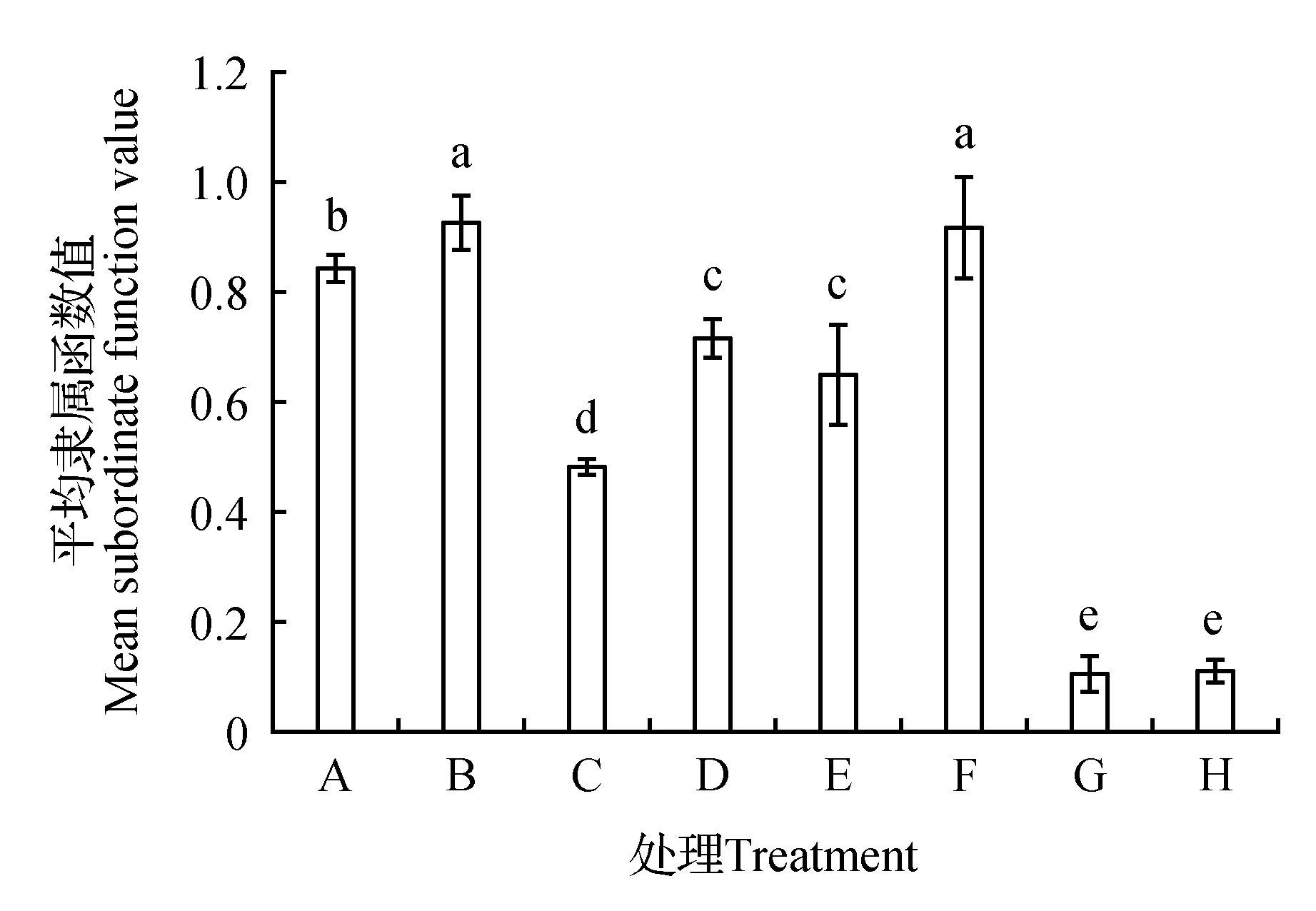
图5 氯化镧对H2O2缓解盐碱混合胁迫抑制燕麦种子萌发和成苗的影响 A.对照;B. 0.5 mmol·L-1 H2O2;C. 75 mmol·L-1盐碱混合胁迫;D. 2 mmol·L-1 LaCl3;E. 75 mmol·L-1盐碱混合胁迫+0.5 mmol·L-1 H2O2;F. 0.5 mmol·L-1 H2O2+2 mmol·L-1 LaCl3; G. 75 mmol·L-1盐碱混合胁迫+2 mmol·L-1 LaCl3;H. 75 mmol·L-1盐碱混合胁迫+2 mmol·L-1 LaCl3+0.5 mmol·L-1 H2O2Fig.5 Effect of LaCl3 on mitigative effect of H2O2 to oat seed germination and seedling formation inhibition induced by salt-alkaline mixed stress A.Control;B. 0.5 mmol·L-1 H2O2;C. 75 mmol·L-1 salt-alkaline mixed stress;D. 2 mmol·L-1 LaCl3;E. 75 mmol·L-1 salt-alkaline mixed stress+0.5 mmol·L-1 H2O2;F. 0.5 mmol·L-1 H2O2+2 mmol·L-1 LaCl3; G. 75 mmol·L-1 salt-alkaline mixed stress+2 mmol·L-1 LaCl3;H. 75 mmol·L-1 salt-alkaline mixed stress+2 mmol·L-1 LaCl3+0.5 mmol·L-1 H2O2
2.6 RR对H2O2缓解盐碱混合胁迫抑制燕麦种子萌发和成苗的影响
钌红(RR)是液泡膜Ca2+释放的抑制剂,能够抑制Ca2+由液泡向胞质的转移。从图6可见:(1)RR抑制H2O2对燕麦种子萌发和成苗的促进作用(处理D与处理C比较);(2)RR极大加重了盐碱混合胁迫对燕麦种子萌发和成苗的抑制(处理F与处理C比较);(3)RR有效逆转了H2O2对盐碱混合胁迫下燕麦种子萌发和成苗的促进作用(处理H与处理G比较)。说明可能有液泡释放的Ca2+参与H2O2促进燕麦种子的萌发和成苗过程。

图6 钌红对H2O2缓解盐碱混合胁迫抑制燕麦种子萌发和成苗的影响 A.对照;B. 0.2 mmol·L-1 RR;C. 0.5 mmol·L-1 H2O2;D. 0.2 mmol·L-1 RR+0.5 mmol·L-1 H2O2;E. 75 mmol·L-1盐碱混合胁迫;F. 75 mmol·L-1盐碱混合胁迫+0.2 mmol·L-1 RR;G. 75 mmol·L-1盐碱混合胁迫+0.5 mmol·L-1 H2O2;H. 75 mmol·L-1盐碱混合胁迫+0.5 mmol·L-1 H2O2+0.2 mmol·L-1 RRFig.6 Effect of ruthenium red(RR) on mitigative effect of H2O2 to oat seed germination and seedling formation inhibition induced by salt-alkaline mixed stress A. Control;B. 0.2 mmol·L-1 RR; C. 0.5 mmol·L-1 H2O2;D. 0.2 mmol·L-1 RR+0.5 mmol·L-1 H2O2;E. 75 mmol·L-1 salt-alkaline mixed stress;F. 75 mmol·L-1 salt-alkaline mixed stress+0.2 mmol·L-1 RR;G. 75 mmol·L-1 salt-alkaline mixed stress+0.5 mmol·L-1 H2O2;H. 75 mmol·L-1 salt-alkaline mixed stress+0.5 mmol·L-1 H2O2+0.2 mmol·L-1 RR
3 讨论
为了研究方便,通常将Na2SO4和NaCl等中性盐胁迫称为盐胁迫,而将Na2CO3和NaHCO3等碱性盐胁迫称为碱胁迫。研究证明,盐碱复合胁迫并不是盐胁迫和碱胁迫的简单叠加,两种胁迫间存在协同效应[15]。绝大多数盐渍化土壤实际上也含有多种盐离子,根据土壤盐分组成研究作物对盐碱混合胁迫的响应更能真实反映其适应机理[1],但以往的研究多以单一NaCl胁迫[4,7,9,14]或碱胁迫[15]为主。种子萌发和成苗是植物生活史中最脆弱的环节,土壤盐分组成的差异对其影响甚大。现有的对植物种子萌发和成苗影响的研究多以少数几个萌发指标单独反映[14],存在一定程度的局限性。隶属函数分析提供了一种多指标综合评价的方法,从而提高了评价的准确性[16]。甘肃中部是全国燕麦的主产区之一,燕麦种植地较高的土壤含盐量和春季返盐是正值播种期燕麦壮苗形成的重要限制因素。本研究模拟种植地土壤盐碱组成,根据影响种子萌发及成苗的多项指标,采用隶属函数综合分析的方法,探讨了盐碱混合胁迫对‘定莜6号’燕麦新品种种子萌发和成苗的影响。结果表明,随着盐碱混合胁迫浓度的增大,燕麦种子萌发和成苗受到显著抑制(图1),这与前人以单一盐胁迫[11]或碱胁迫[16]的结果一致。
H2O2是细胞应答各种胁迫反应的信号分子,参与植物盐胁迫响应的调控[4]。1~50 mmol·L-1H2O2能够显著提高镉胁迫下黄瓜(Cucumissativus)种子的发芽指数和活力指数,缓解镉对黄瓜幼苗生长的抑制[17]。NaCl和Na2CO3胁迫显著抑制四翅滨藜(Atriplexcanescens)种子的萌发,且Na2CO3胁迫的抑制作用大于NaCl胁迫[18]。本研究表明,0.001~2 mmol·L-1H2O2能够提高燕麦种子的萌发和成苗(图2),且0.5 mmol·L-1H2O2显著促进75 mmol·L-1盐碱混合胁迫下燕麦种子的萌发和成苗(图3)。这与前人[7]H2O2能够缓解盐胁迫抑制板蓝根种子萌发和幼苗生长的结果一致。说明外源H2O2能够减缓盐碱胁迫对植物种子萌发和成苗的抑制。其原因可能与H2O2能够介导质膜Na+/H+逆向转运蛋白基因(Salt Overly Sensitive 1,SOS1)表达,从而调控K+、Na+和Ca2+平衡,降低氧化伤害有关[19]。
Ca2+在植物生长发育过程及逆境适应中发挥着多种信号功能[20],通过激活过氧化氢酶活性能够维持细胞内H2O2的平衡[21]。当植物遭受盐胁迫时胞外Ca2+内流会导致胞质Ca2+水平升高,从而参与H2O2介导的胞质K+/Na+的平衡,提高植物对盐胁迫的适应能力[22]。王康君等[23]研究指出,外源H2O2缓解盐胁迫对小麦种子萌发和幼苗生长的抑制与其提高种子α-淀粉酶活性及胚根Ca2+含量,降低膜脂过氧化水平有关。本研究结果表明,外源H2O2能够促进盐碱混合胁迫下燕麦种子的萌发和成苗,Ca2+螯合剂EGTA、质膜Ca2+通道阻断剂LaCl3、液泡膜Ca2+释放抑制剂RR与H2O2共处理后均可消减H2O2对盐碱混合胁迫下燕麦种子萌发和成苗的缓解作用(图4~6)。说明胞外Ca2+水平、胞外Ca2+的内流和液泡中Ca2+的释放均与H2O2调控的盐碱混合胁迫下燕麦种子的萌发和成苗密切相关,Ca2+参与了H2O2促进盐碱混合胁迫下燕麦种子萌发和成苗的信号转导过程。H2O2促进盐碱混合胁迫下燕麦种子萌发和成苗的原因可能是外源H2O2作为信号激活了细胞质膜Ca2+的通道[12],从而提高胞质Ca2+水平,通过Ca2+信使系统调控K+、Na+平衡[19],提高抗氧化防御系统[21]所致。然而,盐碱胁迫下植物种子萌发和成苗过程中H2O2信号产生和作用机制以及与Ca2+之间的相互关系十分复杂,H2O2和Ca2+信号级联系统如何通过基因表达调控来响应盐碱胁迫等许多未知还有待进一步揭示。
4 结论
盐碱混合胁迫抑制燕麦种子的萌发和成苗,H2O2能够缓解盐碱混合胁迫对燕麦种子萌发和成苗的抑制,胞外流入和液泡释放的Ca2+参与了H2O2促进盐碱混合胁迫下燕麦种子萌发和成苗的过程。
1.Liu B S,Kang C L,Wang X,et al.Tolerance mechanisms ofLeymuschinensisto salt-alkaline stress[J].Acta Agriculturae Scandinavica,Section B-Soil & Plant Science,2015,65(8):723-734.
2.Wang Y,Li J L,Wang J Z,et al.Exogenous H2O2improves the chilling tolerance of manilagrass and mascarenegrass by activating the antioxidative system[J].Plant Growth Regulation,2010,61(2):195-204.
3.安国勇,李保珠,武桂丽,等.H2O2作为根源信号介导盐胁迫诱导的蚕豆气孔关闭反应[J].植物生理学报,2012,48(3):265-271.
An G Y,Li B Z,Wu G L,et al.H2O2could act as root source signal to mediate stomatal closure induced by salt stress ofViciafabaL.[J].Plant Physiology Journal,2012,48(3):265-271.
4.De Azevedo Neto A D,Prisco J T,Enéas-filho J,et al.Hydrogen peroxide pre-treatment induces salt-stress acclimation in maize plants[J].Journal of Plant Physiology,2005,162(10):1114-1122.
5.Bewley J D,Bradford K J,Hilhorst H W M,et al.Seeds:physiology of development,germination and dormancy:3rd ed[M].New York:Springer,2013.
6.Meng S C,Cui Y L,Xing B T,et al.Seed germination of eggplant(SolanummelongenaL.) Luba 2 treated with hydrogen peroxide[J].Agricultural Science & Technology,2014,15(7):1117-1119.
7.李源.外源NO与H2O2对盐胁迫下板蓝根幼苗生长及其氧化应激反应的影响[D].兰州:甘肃农业大学,2009:26-32.
Li Y.Effect of exogenous nitric oxide and hydrogen peroxide to woad seedling growth and oxidative stress reaction under salt stress[D].Lanzhou:Gansu Agricultural University,2009:26-32.
8.Dodd A N,Kudla J,Sanders D.The language of calcium signaling[J].Annual Review of Plant Biology,2010,61(1):593-620.
9.Tuteja N,Mahajan S.Calcium signaling network in plants:an overview[J].Plant Signaling & Behavior,2007,2(2):79-85.
10.Kader M A,Lindberg S.Cytosolic calcium and pH signaling in plants under salinity stress[J].Plant Signaling & Behavior,2010,5(3):233-238.
11.Rozi A,Jia Y.A theoretical study of effects of cytosolic Ca2+oscillations on activation of glycogen phosphorylase[J].Biophysical Chemistry,2003,106(3):193-202.
12.Pei Z M,Murata Y,Benning G,et al.Calcium channels activated by hydrogen peroxide mediate abscisic acid signalling in guard cells[J].Nature,2000,406(6797):731-734.
13.Jiang J L,Su M,Wang L Y,et al.Exogenous hydrogen peroxide reversibly inhibits root gravitropism and induces horizontal curvature of primary root during grass pea germination[J].Plant Physiology and Biochemistry,2012,53:84-93.
14.唐静,韩宇,陈康,等.钙离子参与一氧化氮促进盐胁迫下的玉米种子萌发[J].植物生理学通讯,2007,43(3):421-424.
Tang J,Han Y,Chen K,et al.Ca2+involved in seed germination of maize(ZeamaysL.) induced by nitric oxide under salt stress[J].Plant Physiology Communications,2007,43(3):421-424.
15.Shi D C,Sheng Y M.Effect of various salt-alkaline mixed stress conditions on sunflower seedlings and analysis of their stress factors[J].Environmental and Experimental Botany,2005,54(1):8-21.
16.李丰先,周宇飞,王艺陶,等.高粱品种萌发期耐碱性筛选与综合鉴定[J].中国农业科学,2013,46(9):1762-1771.
Li F X,Zhou Y F,Wang Y T,et al.Screening and identification of sorghum cultivars for alkali tolerance during germination[J].Scientia Agricultura Sinica,2013,46(9):1762-1771.
17.王素平.H2O2对镉胁迫下黄瓜种子萌发及生长的影响[J].种子,2012,31(3):98-100.
Wang S P.Effects of H2O2on seed germination and growth of cucumber under cadmium stress[J].Seed,2012,31(3):98-100.
18.王娟娟,张文辉.NaCl和Na2CO3胁迫对四翅滨藜种子萌发及保护酶活性的影响[J].林业科学,2011,47(2):154-160.
Wang J J,Zhang W H.Effects of activities of protective enzymes and seed germination in Atriplex canescens under NaCl and Na2CO3stress[J].Scientia Silvae Sinicae,2011,47(2):154-160.
19.Yadav N S,Shukla P S,Jha A,et al.TheSbSOS1 gene from the extreme halophyteSalicorniabrachiataenhances Na+loading in xylem and confers salt tolerance in transgenic tobacco[J].BMC Plant Biology,2012,12(1):188.
20.Batistiĉ O,Kudla J.Analysis of calcium signaling pathways in plants[J].Biochimica et Biophysica Acta(BBA) -General Subjects,2011,1820(8):1283-1293.
21.Yang T,Poovaiah B W.Hydrogen peroxide homeostasis:activation of plant catalase by calcium/calmodulin[J].Proceedings of the National Academy of Sciences of the United States of America,2002,99(6):4097-4102.
22.Sun J,Wang M J,Ding M Q,et al.H2O2and cytosolic Ca2+signals triggered by the PM H+-coupled transport system mediate K+/Na+homeostasis in NaCl-stressedPopuluseuphraticacells[J].Plant,Cell & Environment,2010,33(6):943-958.
23.王康君,王龙,顾正中,等.盐胁迫对小麦种子萌发与幼苗生长的影响及外源物质调控效应[J].江苏农业科学,2016,44(1):111-115.
Wang K J,Wang L,Gu Z Z,et al.Effects of salt stress on seed germination and seedling growth of wheat and regulation effect of exogenous substances[J].Jiangsu Agricultural Sciences,2016,44(1):111-115.
The project was financially supported by the science and technology plan project of Qingyang city in Gansu province(KZ2014-19)
introduction:LIU Jian-Xin(1964—),male,professor,mainly engaged in plant stress physiology.
date:2017-03-03
EffectofCa2+onSeedGerminationandSeedlingFormationofOatInducedbyH2O2underSaline-AlkaliComplexStress
LIU Jian-Xin1,2LIU Xiu-Li1,2WANG Jin-Cheng1,2JIA Hai-Yan1,2
(1.Provincial Key Laboratory for Protection and Utilization of Longdong Bio-resources in Gansu Province,Qingyang745000;2.College of Life Science and Technology,Longdong University,Qingyang745000)
Salinity-alkalinity stress is an important factor of restricting crop high-yield and good quality, Ca2+and H2O2as signal molecules involved in crop response to stress. In order to understand whether Ca2+is involved in the regulation of H2O2on the seed germination and seedling formation in plant under saline-alkali stress, using subordinate function analysis method, we studied the effects of extracellular dissociation Ca2+chelant EGTA, plasma membrane Ca2+channel blockers LaCl3, tonoplast Ca2+release inhibitor ruthenium red(RR) and H2O2on seed germination and seedling formation under saline-alkali complex stress(NaCl∶Na2SO4∶NaHCO3∶Na2CO3=12∶8∶9∶1) with oat(Avenanude). The results showed that25-200mmol·L-1saline-alkali complex stress significantly inhibited seed germination and seedling formation of oat, and its inhibition was more obvious as the concentration was increased. While0.001-2mmol·L-1H2O2could promote the seed germination and seedling formation of oat, and0.5mmol·L-1H2O2significantly relieve the inhibition of75mmol·L-1saline-alkali complex stress to seed germination and seedling formation of oat. After EGAT treatment, combining with LaCl3and RR, the effect of H2O2was decreased. Therefore, Ca2+was involved in the signal transduction of seed germination and seedling formation of oat induced by H2O2under saline-alkali mixed stress.
Ca2+;H2O2;saline-alkali mixed stress;oat;seed germination and seedling formation
甘肃省庆阳市科技计划项目(KZ2014-19)资助
刘建新(1964—),男,教授,主要从事植物逆境生理方面的研究。
2017-03-03
Q945
A
10.7525/j.issn.1673-5102.2017.06.008

