蒙药蓝刺头对骨折愈合过程中BMP-2及VEGF表达影响△
巴音额古乐 金鸿宾
(1.内蒙古国际蒙医医院,内蒙古 呼和浩特 010065;2.天津医院,天津 300211)
实验研究
蒙药蓝刺头对骨折愈合过程中BMP-2及VEGF表达影响△
巴音额古乐1金鸿宾2
(1.内蒙古国际蒙医医院,内蒙古 呼和浩特 010065;2.天津医院,天津 300211)
目的:观察蒙药蓝刺头对骨折愈合过程中BMP-2、VEGF表达的影响,初步探讨蒙药蓝刺头对骨折愈合影响及其作用机制。方法选用健康成年日本大耳白兔75只,制作双侧桡骨中段骨折模型。实验随机分为模型组,阳性对照骨碎补组(0.3g. kg-1),蒙药蓝刺头高、中、低剂量组(3g. kg-1、1.5 g. kg-1、0.3g. kg-1),药物掺入饲料,于造模后第1天连续给药8wk。分别于骨折后第 2、4、8wk时处死,并取材进行免疫组化染色,通过组织学及免疫组化法检测骨折部位BMP-2 、VEGF的阳性表达,进行阳性细胞平均光密度( MOD) 值分析。结果测定各组骨外膜BMP-2 表达阳性的 MOD 值,各组间比较显示:干预 2wk时蒙药高剂量组与模型组比较具有统计学意义(P<0.05);4 wk时蒙药高剂量组与模型组、蒙药中剂量组、骨碎补组比较具有统计学意义(P<0.05),且蒙药中剂量组、骨碎补组与模型组比较也具有统计学意义(P<0.05);8 wk时各组间比较无统计学意义(P>0.05) 。测定各组骨内膜处 BMP-2 表达阳性的 MOD 值, 各组间比较显示: 2 wk时蒙药高、中剂量组与蒙药低剂量组、模型组比较具有统计学意义(P<0.05),且蒙药高剂量组与蒙药中剂量组、骨碎补组比较也有统计学意义(P<0.05);第 4 wk时蒙药高剂量组与模型组比较具有统计学意义(P<0.05);第 8 wk时蒙药高、中剂量组及骨碎补组与模型组比较具有统计学意义(P<0.05)。测定各组骨外膜处 VEGF表达阳性的 MOD 值, 各组间比较显示: 2 、4wk时蒙药高剂量组与模型组、蒙药低剂量组比较具有统计学意义 (P<0.05);8 wk时各组间比较无统计学意义(P>0.05)。测定各组骨内膜 VEGF 表达阳性的MOD 值,各组间比较显示:在第 2 、 4 wk时蒙药高、中剂量组及骨碎补组与模型组、蒙药低剂量组比较均有统计学意义(P<0.05);8wk时各组间比较无统计学意义(P>0.05)。结论蒙药蓝刺头对骨折愈合具有一定的促进作用,能够提高BMP-2、VEGF的表达,其机制可能是促进成骨细胞活性及提高骨生长因子BMP-2 和 VEGF的表达有关。
蒙药蓝刺头;骨折愈合;BMP-2;VEGF;成骨细胞
蒙医在治疗前臂骨折、骨不愈合、骨折较轻而筋伤较宽等情况时,惯用内服蓝刺头水煎剂,均有很好的治疗效果。当前,蓝刺头化学组分研究主要集中在脂溶性成分,包括生物碱、黄酮类、三萜及噻吩类化合物等[1]。刘岩等[2]通过动物实验研究蒙药蓝刺头对骨代谢性疾病作用影响结果表明,蒙药蓝刺头具有类雌激素样的促进骨形成和抑制骨吸收作用。然而,蒙药蓝刺头对骨折愈合过程中骨生长因子的影响作用机制方面的研究尚未见有报道。本实验拟制作兔桡骨骨折模型,观察蒙药蓝刺头干预骨折愈合过程中对骨形态发生蛋白-2(BMP-2)、血管内皮生长因子(VEGF)的表达影响,探讨蒙药蓝刺头对骨折愈合影响及其部分作用机制,为临床提供理论与实验依据。
1 实验材料
1.1 实验动物:健康日本大耳白兔共75只,体重 2.0kg~2.5 kg,12wk龄,其中雌性38只,雄性37只,由天津市骨科研究所动物实验室提供,动物模型建立、饲养和取材均在天津市骨科研究所动物实验进行。
1.2 药品和试剂:蓝刺头(花序),河北保定安国药材市场购买;骨碎补,天津中医药大学第一附属医院药房购买;盐酸赛拉嗪注射液(速眠新Ⅱ号),吉林省敦化市圣达动物药品有限公司;兔IgG免疫组化试剂盒,武汉博士德生物工程有限公司;显色试剂盒(DAB),武汉博士德有限公司; VEGF免疫组化试剂盒,武汉博士德有限公司;BMP-2免疫组化试剂盒,北京博奥森生物技术有限公司;防脱载玻片,江苏世泰实验器材有限公司;苏木素、伊红,天津市永大化学试剂开发中心。
1.3 仪器:南韩牙科台式钻N3/E102N3,佛山市多易美医疗器材有限公司;高速万能粉碎机YJ-1000A,济南亿健医疗设备有限公司;超低温冰箱DW-86L486,青岛海尔特种电器有限公司;切片机RM2255 ,德国 LEICA 公司;自动双重纯水蒸馏器SZ-93,上海徐新生化仪器厂;制冰机AF200-PSC50R,日本 SANYO 公司;多功能显微镜AX-80,日本 Olympus 公司;恒温干燥箱(电热)202,山东省潍坊医疗器械厂。
2 实验方法
2.1 蒙药蓝刺头制备:蒙药蓝刺头原材料由内蒙古国际蒙医医院国家蒙药制剂中提供,原材料为蓝刺头花序,共10kg。将其原材料在内蒙古医科大学蒙医药学院蒙药炮制中心用小型万能粉碎机打磨成粉末状(过80目),并封装成袋,作为实验药品备用。
2.2 骨折模型建立:模型建立参照文献[3],将动物分笼适应性饲养2wk,手术当日将每只兔称重后可用速眠新Ⅱ号(盐酸塞拉嗪注射液)肌肉注射麻醉(肌注部位:臀肌处,肌注剂量:0.15mL·kg-1体重),待麻醉后双上肢常规脱毛,实施无菌手术,于双侧桡骨中1/3处纵行切开皮肤及皮下组织,暴露双侧桡骨中1/3部位,用口腔专用磨钻造成3mm完全横断骨折,不作任何固定,生理盐水冲洗切口,逐层缝合切口。术后分笼饲养,常规饲料及饮水。术后连续3d肌肉注射硫酸庆大霉素预防感染, 4万U/次, 1次/d,每日观察动物活动及创口愈合情况。
2.3 动物分组和给药:将75 只日本大耳白兔,随机数字表法分为5组:模型组,蒙药高、中、低剂量组和阳性对照骨碎补组,每组 15只。每组再随机分成3个小组,分别为2wk组、4 wk组、8 wk组,每组 5只,编号,分笼饲养。各组兔术后均常规饲养,给药剂量按《人兔体表面积折算的等效剂量比值表》计算,术后d1开始给予饲料混合喂养不同剂量的蒙药蓝刺头粉剂(高、中、低剂量组,依次为3g﹒kg-1、1.5g﹒kg-1、0.3g﹒kg-1,其低剂量组为临床等效剂量,高、中、低剂量比例为10:5:1)1次/d,骨碎补组以临床等效剂量0.3g﹒kg-1灌胃,1次/d,模型组灌胃等量蒸馏水1次/d。
2.4 标本留取: 分别于术后 2、4、8 wk,每个实验组(5组)随机抽取5只大耳朵白兔,并进行耳缘性空气处死。在无菌条件下取出双侧尺桡骨,沿骨折断端为中心,缺损区边缘7.5 mm处截骨(长约15~16mm),放入中性甲醛内固定 7d。取右侧桡骨标本为研究对象,若骨折位置移位明显或出现骨折处感染等情况时选择取对侧桡骨标本为主。将标本放入10%的EDTA脱钙液中脱钙30d(脱钙期间7d换1次脱钙液),待骨组织较松软时即为达到脱钙标准。
2.5 标本切片制作:脱钙标本矢状位剖开后进行脱水、透明、浸蜡、包埋(同HE染色标本的脱水、透明、浸蜡、包埋过程)等程序,用切片机制成4μm厚蜡片,将各组标本蜡片展于载玻片上并相应切片标码后放入烤箱内,在42℃条件下烤片48h后取出。
2.6 BMP-2、VEGF表达检测:使用北京博奥森生物技术有限公司的BMP-2试剂盒和武汉博士德有限公司的VEGF试剂盒,按照试剂盒说明书要求,进行标本的BMP-2和VEGF表达检测,观察骨折愈合不同时间点骨外膜、骨内膜BMP-2与VEGF的表达情况。
2.7 染色结果分析:通过染色后可见细胞浆变为棕色或棕黄色为BMP-2、VEGF表达阳性,未显棕色或棕黄色为BMP-2、VEGF表达阴性,阴性对照片所有组织均未显色。
2.8 免疫组化染色图像分析:应用显微图像采集系统对免疫组化切片进行图像采集,以骨折中心部位及wk围组织处各取2个高倍镜视野,采用Image-Pro plus 6.0图像分析软件对骨BMP-2与VEGF表达阳性细胞进行平均光密度( MOD) 测定。
2.9 统计学方法:数据统一采用(±S)表示,采重复测量资料的方差分析(Repeated ANOVA)。数据满足方差齐性的,组内两两比较采用S-N-K法。不满足方差齐性的采用调整水准的Dunnett3法。设定检验水准α=0.05,取双侧曲线下面积,P<0.05有统计学差异。
3 实验结果
3.1 骨折愈合不同时间点BMP-2表达结果:各组骨痂组织中均可见软骨细胞、成纤维细胞、骨原细胞和骨小梁中的骨细胞胞浆中有阳性表达,各组间的不同时间点的表达阳性的细胞类别大致一样,但表达的强弱却不一样,早期以骨原细胞、骨小梁中的骨细胞及骨痂外wk的幼稚软骨细胞表达为主,后期以骨母细胞表达为主,各期蒙药高、中剂量组与骨碎补组胞浆着色深度显著于蒙药低剂量组和模型组。测定各组骨外膜 BMP-2表达的 MOD 值,各组间比较显示:干预骨折2wk时蒙药高剂量组与模型组比较具有统计学意义(P<0.05);4wk时蒙药高剂量组与蒙药低剂量组比较有显著性差异(P<0.01),且与模型组、蒙药中剂量组、骨碎补组比较具有统计学意义(P<0.05),蒙药中剂量组、骨碎补组与蒙药低剂量组比较具有统计学意义(P<0.05);8wk时各组间比较无统计学意义(P>0.05)。测定各组内骨膜 BMP-2表达的 MOD 值,各组间比较显示: 2wk时蒙药高中剂量组、骨碎补组与模型组、蒙药低剂量组比较具有统计学意义(P<0.05),且蒙药高剂量组与蒙药高剂量组、骨碎补组比较也有统计学意义(P<0.05);4wk时蒙药高剂量组与模型组比较具有统计学意义(P<0.05);8wk时蒙药高中剂量组、骨碎补组与模型组、蒙药低剂量组比较具有统计学意义(P<0.05)。
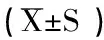
表1 各组各期骨外膜BMP-2表达的MOD值
注:与模型组比较 *P<0.05,与蒙药低剂量组比较 #P<0.01;与蒙药中剂量组比较,☆P<0.05;与骨碎补组比较,◇P<0.05.

表2 各组各期骨内膜BMP-2表达的MOD值
注:与模型组比较 *P<0.05,与蒙药低剂量组比较 #P<0.01;与蒙药中剂量组比较,☆P<0.05;与骨碎补组比较,◇P<0.05.
3.2 骨折愈合不同时间点VEGF表达结果:各组骨痂组织中成纤维细胞、软骨细胞、骨母细胞均可见有阳性表达,各组间的不同时间点的表达阳性的细胞类别大致一样,但表达的强弱却不一样。测定各组骨外膜处VEGF表达的 MOD 值,各组间比较显示:2wk时蒙药高剂量组、骨碎补组与模型组、蒙药低剂量组比较有统计学意义(P<0.05);4wk时蒙药高剂量组与模型组、蒙药低剂量组比较具有统计学意义(P<0.05);8wk时各组间比较无统计学意义(P>0.05)。测定各组骨内膜处VEGF表达的 MOD 值,各组间比较显示:在第2wk、4wk时蒙药高中剂量组、骨碎补组与模型组、蒙药低剂量组比较均有统计学意义(P<0.05);8wk时各组间比较无统计学意义(P>0.05)。
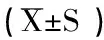
表3 各组各期骨外膜VEGF表达的MOD值
注:与模型组比较 *P<0.05,与蒙药低剂量组比较 #P<0.01;与蒙药中剂量组比较,☆P<0.05;与骨碎补组比较,◇P<0.05.
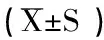
表4 各组各期骨内膜VEGF表达的MOD值
注:与模型组比较 *P<0.05,与蒙药低剂量组比较 #P<0.01;与蒙药中剂量组比较,☆P<0.05;与骨碎补组比较,◇P<0.05.
4 讨论
蒙药蓝刺头为常用接骨蒙药之一,具有固骨折,接骨愈伤,清热止痛的功效[4]。其味苦,性凉、稀、轻、柔、钝。系菊科植物蓝刺头(Echinops lotifolis Tausch)的干燥复头状花序,多年本草[5]。始载于《智慧之剑》中, 属于蒙医自采自用药之一,近代蒙医药学文献《认药白晶鉴》中均以阿扎格-刺日敖恩作为乌日格苏图-呼和(蓝刺头)收载[6]。研究发现[7],蓝刺头全草含黄酮类化合物,花序含量最高。
当骨组织未受到组织形态改变时BMP-2处于静止态势,一旦发生骨折,由于骨组织环境的改变,会立即激活BMP-2的活性,使BMP-2的活性增强,数量迅速增加,并诱导大量的新骨形成而促进骨组织修复。因此,BMP-2是一类具有潜在的活性糖蛋白,其对软骨内骨化还是膜内成骨形成都有一定的促进作用[8],是通过诱导间充质干细胞分裂、增殖,转化为成骨细胞或软骨细胞后而进行成骨,骨髓间充质干细胞在骨折局部被激活的BMP-2的诱导下有方向性迁徒,经过一系列的分裂、增殖和分化等过程,转化为软骨细胞或成骨细胞,进一步形成软骨和骨组织[9]。通过本次实验研究发现,BMP-2在骨折修复阶段,每个组骨痂wk围的成纤维细胞及骨痂内的软骨细胞、骨母细胞、骨小梁中的骨细胞胞浆中均有阳性表达,不同时间点各组间阳性表达的细胞种类大体一样,但表达强度有所差别,伴随骨折修复中的组织学改变,早期主要在骨母细胞、骨细胞(骨小梁内的)和幼稚软骨细胞(骨痂外围处的)中表达阳性,中后期主要在成骨细胞中表达阳性,各个时间段的蒙药高中剂量组、骨碎补组的细胞胞浆显色度显著深于模型组、蒙药低剂量组。研究表明[10],骨形态发生蛋白-2在骨和骨膜中成骨能力最强,而骨膜是产生新生骨的主要部位,具有向成骨细胞分化的功能[11,12],故检测了骨折处的骨外模和骨内模BMP-2表达的MOD值。实验结果显示,蒙药组和中药组具有促进骨痂、骨外膜、骨内膜BMP-2的表达作用,以骨折早中期(第2、4wk)为显著,其中蒙药高剂量组对促进骨外膜、骨内膜成骨细胞表达作用最强,蒙药中剂量组、骨碎补组、蒙药低剂量组均高于模型组,并且蒙药高剂量组对后期(第8wk)骨内膜的BMP-2的表达也比其它组显著,说明蒙药蓝刺头高剂量组对后期提高膜内成骨能力也较显著。本次实验证实了蒙药蓝刺头接骨愈伤作用,可能一定程度上早期提高了成骨能力及BMP-2的表达,加快了骨痂形成及改建,促进骨折愈合。骨折愈合过程中有多种细胞因子、生长因子及其细胞外基质在内的协同作用下促使骨折断端愈合,但骨折断端早期微血管形成是骨折愈合过程中的最主要的前提,VEGF作为血管生成强效生长因子之一,在骨折愈合过程中起着极为重要作用,其主要通过旁分泌或自分泌而与相应受体相结合,并诱导体内新生血管的生成,增加血管通透性,促使骨折端供氧,加速新陈代谢,提供有效的营养成分,为骨折断端修复创造了有利的条件,并促使骨折愈合。通过本次实验研究发现,VEGF在骨折愈合过程中,各组骨痂组织中成纤维细胞、软骨细胞、骨母细胞均可见有阳性表达,早期以软骨细胞、纤维细胞、骨母细胞阳性表达为主,中后期以骨母细胞、骨细胞及部分髓腔内脂肪细胞阳性表达为主。骨折断端早期微血管形成是骨折愈合的最主要的前提,骨膜含丰富的微血管,并有成骨细胞和未分化的间充质干细胞等参与膜内成骨和软骨内成骨过程[13]。本次实验结果表明,只有蒙药高剂量组在骨折愈合早中期(第2、4wk)具有促进骨外膜、骨内膜VEGF的表达作用,并表达作用为最强。说明蒙药蓝刺头促进VEGF的表达强度存在一定的量-效关系。本次实验初步证实了蒙药蓝刺头早期也能促进VEGF的表达,可能在一定程度上早期提高VEGF的表达,诱导体内新生血管的生成而促进骨折愈合。
总之,蒙药蓝刺头对骨折愈合具有一定的促进作用,其机制可能是促进成骨细胞合成及提高骨生长子 BMP-2 和 VEGF的表达有关。但是,蒙药蓝刺头对骨折愈合影响相关作用机制的物质基础、细胞通路方面研究还有待于进一步深入研究。
[1]王宏伟,杨婷,董玉.蓝刺头的研究进展[J].疾病监测与控制,2011,12:734-735.
[2]刘岩,鞠亚波,常虹.蒙药蓝刺头对去卵巢模鼠骨钙素影响的实验研究[J].内蒙古医科大学学报,2014,S1:7-11.
[3] 廖保强,邓墨渊,傅亚,等. 力生长因子对兔桡骨骨折愈合的作用[J]. 中国组织工程研究与临床康复,2010,02:245-248.
[4] 国家药典委员会.中华人民共和国卫生部药品标准·蒙药分册[S].1998.
[5] 内蒙古卫生厅.内蒙古蒙药材标准[S].1987.
[6] 若喜道尔吉.蒙古医学经典丛书-药物学[M].内蒙古人民出版社,1999.
[7] 袁少飞.蒙药材蓝刺头质量标准的建立及化学成分研究[D].内蒙古医学院,2010.
[8] Sampath TK, Coughlin JE, Whetstone RM, et al. Bovine osteogenic protein is composed of dirners of OP-1 and BMP-2A, two members of the transforming growth factor beta super-family[J]. Biol Chem, 1990, 265: 13198.
[9] Wozney J, Seeherman H. Protein-based tissue engineering in bone and cartilage repair [J]. Curr Opin Bioteehnol, 2004, 15(5): 392-398.
[10]Urist MR,Kovaee S,Yate KA.Regeneration of anenehondroma under the influence of an implant of human bone morphogenetic protein[J].J Hand Surg(Am),1986, 11:417-419.
[11] Samee M, Kasugai S, Kondo H, et al. Bone morphogenetic protein-2 (BMP-2) and vascular endothelial growth factor (VEGF) transfection to human periosteal cells enhances osteoblast differentiation and bone formation[J]. Pharmacol Sci,2008, 108(1): 18-31.
[12] Yu YY, Lieu S, Lu C, et al. Bone morphogenetic protein 2 stimulates endochondral ossification by regulating periosteal cell fate during bone repair[J]. Bone, 2010, 47(1): 65-73.
[13] 张国营,方加虎,李翔,等.wk期性流体静压对骨膜细胞血管内皮生长因子表达的影响及其机制[J]. 江苏医药,2015,09:999-1001.
内蒙古自然科学基金( 2015MS08131)
R291.2
A
1006-6810(2017)06-0053-04
2017年1月9日收稿

