负压引流技术对瘢痕切除复合植皮术患者创面细胞增殖活性及血管生成的影响
冯 剑,刘代宏
(空军军医大学唐都医院烧伤整形科 陕西 西安 710038)
负压引流技术对瘢痕切除复合植皮术患者创面细胞增殖活性及血管生成的影响
冯 剑,刘代宏
(空军军医大学唐都医院烧伤整形科 陕西 西安 710038)
目的:观察负压引流技术在瘢痕切除复合植皮术患者中的应用,探讨其对创面细胞增殖活性及血管生成的影响。方法:选取86例行瘢痕切除复合植皮术患者,随机分为观察组和对照组,每组43例。观察组采取瘢痕切除复合植皮术+VSD,对照组采取瘢痕切除复合植皮术+加压固定。比较两组患者术后植皮存活率、二次手术率、术后换药次数、住院时间、创面完全愈合时间、术后1周和2周的创面疼痛评分(采用视觉模拟评估量表)、术后6个月的瘢痕评分(用温哥华瘢痕量表评估)、治疗前1d及术后3d、7d的创周组织的血小板衍生因子(PDGF)、转化生长因子-β(TGF-β)、血管内皮生长因子(VEDF)表达水平。结果:两组患者二次手术率比较,差异无统计学意义(P>0.05);观察组患者植皮存活率为(95.36±3.24)%,高于对照组(89.14±5.22)%,差异有统计学意义(P<0.05);观察组术后换药次数(2.58±0.95)次,低于对照组(4.41±1.23)次(P<0.05);观察组患者住院时间、创面完全愈合时间均少于对照组,术后1周、2周的创面疼痛评分及术后6个月瘢痕评分均低于对照组(P<0.05);两组患者术后3d、7d的PDGF、TGF-β水平均较术前升高,VEDF较术前下降(P<0.05);观察组患者术后7d的PDGF、TGF-β水平均高于对照组,术后3d、7d的VEDF水平均低于对照组(P<0.05)。结论:瘢痕切除复合植皮术患者采取VSD可提高植皮存活率,减少换药次数,降低二次手术率,促进创面细胞增殖及血管生成,有利于创面愈合。
瘢痕切除;植皮术;负压引流技术;细胞增殖活性;血管生成
瘢痕增生为烧伤创面愈合后的常见并发症,易导致血液循环减慢、生长能力差、愈合困难。目前临床多采取瘢痕切除复合植皮术进行治疗,但研究显示[1],单纯植皮易引发感染,且对创面细胞增殖活性及血管生成并无明显改善作用。持续封闭负压引流技术(vacuum sealing drainage,VSD)可减轻炎性水肿、抑制感染,在促进创面愈合中已得到广泛应用。国外有研究指出[2],VSD还具有提高创面细胞增殖活性、促进血管生成的作用,但国内相关研究还较为缺乏。本研究以86例行瘢痕切除复合植皮术患者为研究对象,观察负压引流技术对瘢痕切除复合植皮术患者创面细胞增殖活性及血管生成的影响,现报道如下。
1 资料和方法
1.1 一般资料:选取本院2015年4月-2017年6月收治的行瘢痕切除复合植皮术患者86例,按随机数表法分为观察组和对照组,每组43例。观察组:男26例,女17例;年龄21~51岁,平均(36.87±5.48)岁;瘢痕切除面积56~540cm2,平均(268.54±22.69)cm2;瘢痕分布:上肢12例,下肢10例,躯干18例,颈部3例。对照组:男28例,女15例;年龄23~55岁,平均(38.09±7.23)岁;瘢痕切除面积63~504cm2,平均(275.64±25.74)cm2;瘢痕分布:上肢13例,下肢11例,躯干15例,颈部4例。两组患者基线资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入标准:①所有患者严重皮肤缺损,均行瘢痕切除复合植皮术;②年龄18岁以上者;③术后至少随访6个月者;④研究获医院伦理委员会批准,患者自愿签署知情同意书。
1.3 排除标准:①合并严重心、肺、肝、肾器官异常者;②过敏体质者。
1.4 手术方法
1.4.1 观察组:采取瘢痕切除复合植皮术+VSD。瘢痕切除复合植皮术:术中切除瘢痕组织,用生理盐水冲洗创面2~3次,结合创面大小与形状常规覆盖脱细胞异体真皮并用细丝线固定,移植自体刃厚皮,将其连同覆盖其上的油纱用皮肤缝合器固定。VSD:结合患者创面大小与形状覆盖VSD海绵紧贴于整个创面,用半透性粘贴薄膜将整个创面密闭至外周,连接吸引器并确认无漏气,用贴膜加固至负压形成,持续负压引流1周,负压为-60~-40 kPa,三叉接头管内壁用肝素进行冲洗,1次/d,确保引流通畅。1周后将VSD海绵撤除,创面换药。
1.4.2 对照组:采取瘢痕切除复合植皮术+加压固定。同观察组切除瘢痕后分别移植脱细胞异体真皮+自体表皮,打包固定,加压包扎,于l周后将敷料拆除,创面换药。
1.5 观察指标
1.5.1 手术疗效:①植皮成活率:用电脑设计边长2mm的正方形方格,打印在投影胶片纸上,剪至创面大小块备用,在胶片纸上画出成活区域,植皮成活标准:皮片颜色红润,与创基紧密贴附,未见皮下积液。术后1周评估两组患者植皮存活率。植皮存活率=皮片存活面积/植皮总面积×100%;②二次手术率:比较两组患者二次手术率,二次手术指创面植皮区域部分或全部皮片坏死,经换药治疗后无效,需二次补充植皮修复;③术后换药次数:术后植皮区换药至术区拆线痊愈的次数。
1.5.2 术后恢复:①住院时间:术后第1天至出院的平均时间;②创面完全愈合时间:去除创面所有覆盖物后至创面完全上皮化的时间;③术后疼痛:采用视觉模拟评估量表(VAS)[3]评估两组患者术后创面疼痛情况,0分为无痛,10分为剧痛难忍。评估时间为术后1周和2周;④瘢痕评分:术后6个月参照温哥华瘢痕量表[4]进行评估,量表共包括色泽、厚度、柔软度、血管分布4个维度。色泽:植皮区颜色与其他部分皮肤接近,0分;色泽较浅,1分;混合色泽,2分;色泽较深,3分。厚度:正常,0分;超过正常厚度0~1mm,1分;超过1~2mm,2分;超过正常厚度2~4mm,3分;超过4mm,4分。柔软度:正常,0分;较小阻力下皮肤可变形,1分;压力下可变形,2分;无法变形,移动呈块状,3分;瘢痕伸展时会退缩,4分;瘢痕出现扭曲,5分;血管分布:正常肤色,与身体其他部位接近,0分;肤色偏粉红,1分;偏红,2分;呈紫色,3分。总分15分,评分越低瘢痕外观恢复情况越好。
1.5.3 创面细胞增殖活性及血管生成:分别于治疗前1d及术后3d、7d,对创周组织取材,测定血小板衍生因子(PDGF)、转化生长因子-β(TGF-β)、血管内皮生长因子(VEDF)表达水平,应用Western blot及Kodak Digital Science ID软件系统测定。
1.6 统计学分析:所有数据应用SPSS19.0软件统计分析。计量资料采用(±s)表示,行t检验,多时点比较采取重复测量的方差分析;计数资料用率(%)表示,采用χ2检验,理论频数<5时采取连续校正卡方。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者术后疗效比较:由表1可知,两组患者二次手术率比较,差异无统计学意义(P>0.05);观察组患者植皮成活率高于对照组,且术后换药次数低于对照组,差异有统计学意义(P<0.05)。
表1 两组患者术后疗效比较 (±s)
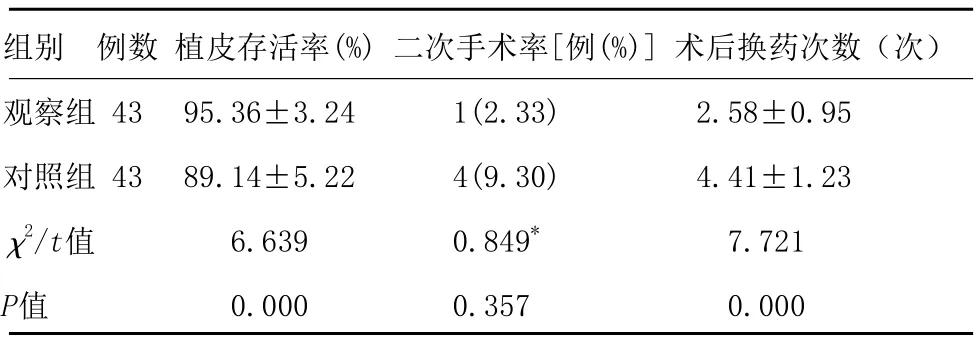
表1 两组患者术后疗效比较 (±s)
注:*表示连续矫正卡方检验
组别 例数 植皮存活率(%) 二次手术率[例(%)] 术后换药次数(次)观察组 43 95.36±3.24 1(2.33) 2.58±0.95对照组 43 89.14±5.22 4(9.30) 4.41±1.23 χ2/t值 6.639 0.849* 7.721 P值 0.000 0.357 0.000
2.2 两组患者术后恢复情况比较:由表2可知,观察组患者住院时间、创面完全愈合时间均少于对照组,术后创面疼痛评分及瘢痕评分均低于对照组,差异有统计学意义(P<0.05)。
2.3 两组患者创面细胞增殖活性及血管生成情况比较:由表3可知,两组患者术前1d的PDGF、TGF-β、VEDF表达水平比较,差异均无统计学意义(P>0.05);两组患者术后3d、7d的PDGF、TGF-β均较术前升高,VEDF较术前下降,差异有统计学意义(P<0.05)。观察组术后7d的PDGF、TGF-β高于对照组,术后3d、7d的VEDF水平均低于对照组,差异有统计学意义(P<0.05)。
3 讨论
VSD最早由德国学者Fleischmann提出[5],随后在皮肤软组织缺损治疗中得到广泛应用。本研究两组患者均采用瘢痕切除复合植皮术,观察组联合VSD,对照组术后加压固定,结果显示,在植皮成活率、术后换药次数、创面愈合方面,观察组均显著优于对照组。VSD具有调节创面细胞因子,促进细胞增殖,促进肉芽组织生成与血管形成的作用。专家认为[6],复合植皮中,刃厚皮片的成活与异体真皮网眼处创面基底的血供有直接联系。负压作用可使皮片紧贴创面,刃厚皮片与异体真皮网眼处的创面基底之间的贴合程度可因此获得改善,避免皮片移动,为皮片成活创造基础,故观察组皮片存活率显著高于对照组。而加压固定下皮片表皮与创面基底的接触面积会有所减小,稍有积液即可导致皮片失活[7]。此外,VSD可有效清除渗液和坏死组织,消除组织肿胀,避免坏死组织积聚[8],保持创面清洁,为创面愈合提供基础,故观察组创面完全愈合时间与住院时间均短于对照组,换药次数明显减少,减轻了医护人员工作量,减轻患者负担。随着创面愈合的加快,患者创面疼痛消退速度也更快,故观察组术后1周、2周的疼痛VAS评分均低于对照组,术后6个月的瘢痕评分较对照组也更低,另外,VSD在臀部、颈部等部位的应用不仅皮片存活率高,还可免除大量厚敷料包扎带来的不便,利于患者术后早期开展适度活动。
表2 两组患者术后恢复情况比较 (±s)
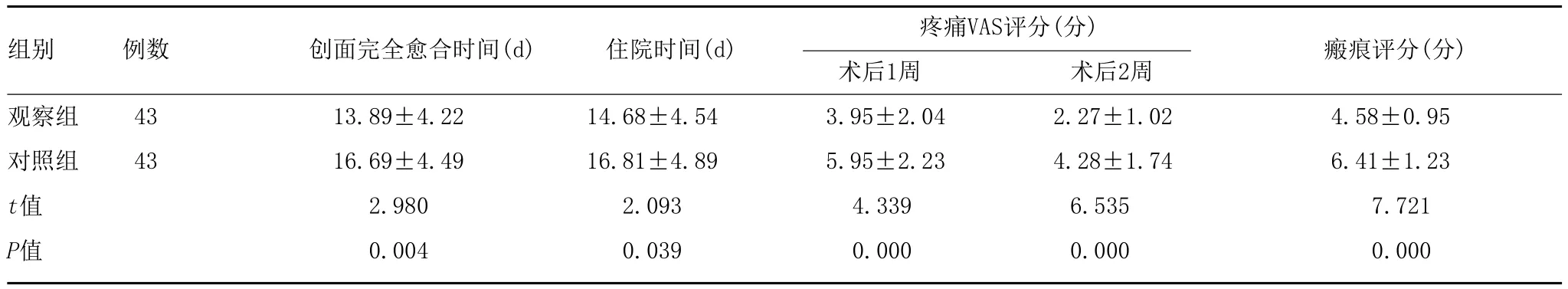
表2 两组患者术后恢复情况比较 (±s)
组别 例数 创面完全愈合时间(d) 住院时间(d) 疼痛VAS评分(分) 瘢痕评分(分)术后1周 术后2周观察组 43 13.89±4.22 14.68±4.54 3.95±2.04 2.27±1.02 4.58±0.95对照组 43 16.69±4.49 16.81±4.89 5.95±2.23 4.28±1.74 6.41±1.23 t值 2.980 2.093 4.339 6.535 7.721 P值 0.004 0.039 0.000 0.000 0.000
表3 两组患者治疗前后创面细胞增殖活性及血管生成情况比较 (±s)
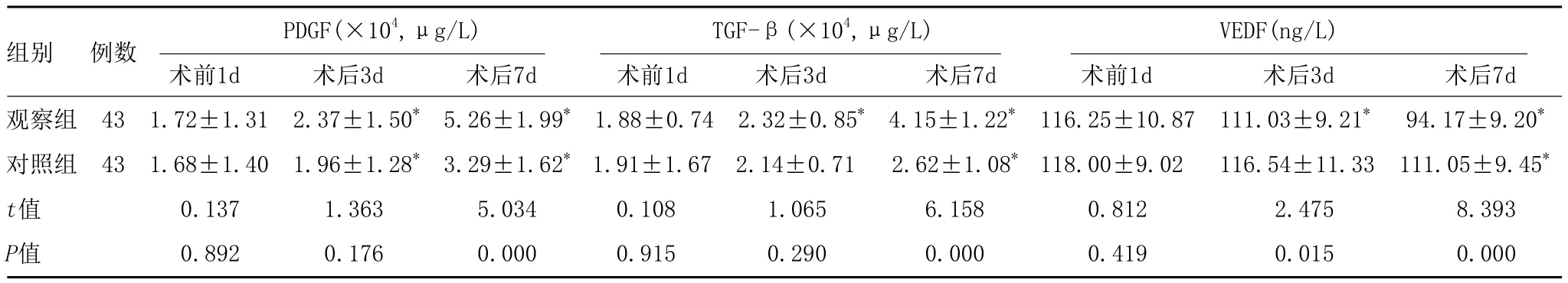
表3 两组患者治疗前后创面细胞增殖活性及血管生成情况比较 (±s)
注:*表示与术前1d比较,P<0.05
组别 例数 PDGF(×104,μg/L) TGF-β(×104,μg/L) VEDF(ng/L)术前1d 术后3d 术后7d 术前1d 术后3d 术后7d 术前1d 术后3d 术后7d观察组 43 1.72±1.31 2.37±1.50* 5.26±1.99* 1.88±0.74 2.32±0.85* 4.15±1.22* 116.25±10.87 111.03±9.21* 94.17±9.20*对照组 43 1.68±1.40 1.96±1.28* 3.29±1.62* 1.91±1.67 2.14±0.71 2.62±1.08* 118.00±9.02 116.54±11.33 111.05±9.45*t值 0.137 1.363 5.034 0.108 1.065 6.158 0.812 2.475 8.393 P值 0.892 0.176 0.000 0.915 0.290 0.000 0.419 0.015 0.000
有研究认为[9-10],PDGF受体的表达可刺激创面细胞增殖,提高细胞增殖活性,引起细胞形状活动性改变,在胚胎发育及创伤愈合中均起到重要作用。PDGF为肽类调节因子,可促进间质细胞分裂,创面及周围细胞组织分泌的PDGF有利于提高创面细胞增殖活性,使创面细胞不断更新,进而调控创伤修复,促进创面愈合。TGF-β是一种双链多肽,人体所有细胞均可产生TGF-β。TGF-β可趋化单核细胞、成纤维细胞,还具有促进细胞外基质沉积的作用[11],有助于加快血管形成。本研究中两组患者术后3d、7d的PDGF、TGF-β均较术前升高,且观察组术后7d的PDGF、TGF-β高于对照组,表明VSD的应用在提高创面细胞增殖活性及促进血管生成方面均发挥积极作用。
VEGF为血管生成促进因子,可影响血管通透性,诱导毛细血管生成。有研究显示[12],VEGF可作用于血管内皮细胞上络氨酸激酶受体而诱导血管内皮细胞增殖,使血管通透性增大。创面及周围组织水肿时VEGF的表达会使组织细胞间距离增大,组织间物质交换受到影响,阻碍创面微循环,创面愈合所需营养物质的供应受阻[13]。本研究中,两组术后的VEDF较术前均呈下降趋势,观察组术后3d、7d的VEGF水平均低于对照组,提示VSD治疗可通过消退水肿,降低血管通透性,使创面微循环得到改善,从而为创面愈合过程提供营养物质供应。VSD可利用负压机械压力促进创周组织的压力减小,减轻微血管后负荷,血流速度提高,不仅创周组织微血管通透性从而下降,同时较大的血流速度还有利于带走创周局部堆积的组胺、前列腺素等炎症因子[14-15],为创面细胞的增殖创造条件。值得注意的是,VSD处理前需充分止血,原因在于负压并无法完全压迫止血,且对出血灶有加剧出血作用,故术后24h应严密观察引流液颜色及量。术后需保持引流管通畅,引流管堵塞或密闭不良可导致负压丧失。三叉接口为引流管堵塞最常见部位,多见于引流物较多的前3d[16],应定期冲洗,预防引流管堵塞。
综上,VSD在瘢痕切除复合植皮术患者中的应用可提高皮片存活率并促进创面愈合,减少换药次数,降低二次手术率,同时还可提高创面细胞增殖活性、促进血管生成,值得推广应用。
[1]耿艳侠,卢思英,刘岩,等.封闭负压引流技术联合游离皮片植皮在糖尿病足感染创面的应用研究[J].重庆医学,2016,45(9):1260-1262.
[2]张燕.负压封闭引流技术在创面愈合应用中的护理措施[J].中国美容医学,2015,24(24):57-59.
[3]徐子寒,张振信,王本峰,等.延期植皮术联合牵引术在重度关节瘢痕挛缩畸形中的应用[J].中华整形外科杂志,2014,30(6):424-427.
[4]刘丹,张雪峰,冯国友,等.扩创植皮联合封闭负压引流技术在大面积烧伤患者感染难愈创面治疗的效果[J].中华医院感染学杂志,2017,27(9):2088-2091.
[5]李军,朱靓,徐明达,等.封闭负压固定技术在特殊部位植皮中的应用[J].中国美容医学,2013,22(14):1472-1475.
[6]周廷玉,喻爱喜.负压引流结合腓肠神经营养血管皮瓣修复足踝部慢性感染创面58例治疗体会[J].中国综合临床,2016,32(8):720-722.
[7]李健,林茂辉,孟英堂,等.封闭式负压引流技术在植皮术中的应用[J].中国美容医学,2014,23(21):1763-1765.
[8]徐海栋,赵建宁,卢俊浩,等.基于生物材料创面敷料封闭负压引流在创伤性骨髓炎治疗中的应用[J].中国组织工程研究,2012,16(12):2189-2192.
[9]朱磊,李国庆,王来斌,等.持续封闭负压引流在骨科创伤中的临床疗效观察[J].实用骨科杂志,2010,16(7):534-535.
[10]曾光伟,李玉梅,何俊俊,等.鼓式取皮机的切取技巧在瘢痕松解植皮中应用[J].中国美容医学,2013,22(15):1582-1584.
[11]廖莉,赵小瑜,沈国良,等.人工真皮联合负压封闭引流治疗增生性瘢痕的疗效观察[J].浙江临床医学,2016,18(11):2054-2055.
[12]Torigoe T,Sato S,Kanazawa H.Percutaneous transluminal pulmonary valvuloplasty in a child with tricuspid atresia,ventricular septal defect,and severe pulmonary valve stenosis:usefulness of the femoral artery approach[J].Catheter Cardiovasc Interv,2014,83(5):774-777.
[13]Silva Lda F,Silva JP,Turquetto AL,et al.Horizontal right axillary minithoracotomy: aesthetic and effective option for atrial and ventricular septal defect repair in infants and toddlers[J].Rev Bras Cir Cardiovasc,2014,29(2):123-130.
[14]Jung SH,Gon Je H,Choo SJ,et al.Right or left anterolateral minithoracotomy for repair of congenital ventricular septal defects in adult patients[J].Interact Cardiovasc Thorac Surg,2010,10(1):22-26.
[15]肖万安,田峰,田立杰,等.负压引流技术联合游离植皮治疗复杂创面大面积皮肤缺损[J].中国现代医学杂志,2013,23(36):77-80.
[16]Fu YC.Transcatheter device closure of muscular ventricular septal defect[J]. Pediatr Neonatol,2011,52(1):3-4.
Effects of Vacuum Sealing Drainage on Cell Proliferation and Angiogenesis in Patients with Scar Resection Combined with Skin Grafting
FENG Jian,LIU Dai-Hong
(Department of Burn and Plastic Surgery,Tangdu Hospital of the Air Force Military Medical University,Xi´an 710038,Shaanxi,China)
Objective To observe the effect of negative pressure drainage on cell proliferation and angiogenesis in patients with scar resection combined with skin grafting.Methods A total of forty-eight patients with scar-resection and composite skin graft were randomly divided into observation group and control group randomly,43 cases in each group. The observation group was treated with scar resection and composite skin graft + VSD. The control group was treated with scar resection and composite skin grafting. The skin survival rate,secondary surgery rate,postoperative dressing times,hospitalization time,wound healing time,wound pain (assessed by visual analogue scale) at 1 week and 2 weeks after treatment,scar score(assessed with the Vancouver Scarlet Scale) at 6 months after treatment,the expression of platelet-derived factor (PDGF),transforming growth factor-β (TGF-β),vascular endothelial growth factor (VEDF) at 1 d before treatment and 3 d after and 7 d after treatment were compared between two groups.Results There was no signi fi cant difference in the secondary operation rate between the two groups (P>0.05). The skin survival rate of observation group was (95.36±3.24)%,which was higher than(89.14±5.22)% in the control group(P<0.05). The postoperative dressing times was (2.58±0.95) times,which was lower than(4.41±1.23) times in control group (P<0.05). The hospitalization time,wound healing time of observation group were shorter than the control group(P<0.05). The wound pain score in observation group at 1 week and 2 weeks after treatment and the scar score at 6 months after treatment were lower than the control group (P<0.05). The levels of PDGF and TGF-β in both groups 3d and 7d after treatment were higher than those 1d before treatment,and VEDF was decreased (P<0.05). The levels of PDGF and TGF-β in the observation group were higher than those in the control group at 7d after operation,and VEDF was lower than that in the control group at 3d and 7d after operation (P<0.05).Conclusion The application of VSD in patients with scar resection and composite skin grafting can improve the survival rate of skin,reduce the number of dressing,reduce the secondary operation rate,promote cell proliferation and angiogenesis,and promote wound healing.
scar resection; skin grafting; vacuum sealing drainage; cell proliferative activity; angiogenesis
R619+.6
A
1008-6455(2017)11-0034-04
刘代宏,空军军医大学唐都医院烧伤整形科,主治医师;E-mail:daihongemall@163.com
2017-09-28
2017-11-01
编辑/朱婉蓉

