子宫内膜异位症盆腔粘连大鼠模型的建立与评价
李田田,孙伟伟,赵瑞华*
(1.中国中医科学院广安门医院,北京 100053; 2.北京市回民医院,北京 100054)
子宫内膜异位症盆腔粘连大鼠模型的建立与评价
李田田1,2,孙伟伟1,赵瑞华1*
(1.中国中医科学院广安门医院,北京 100053; 2.北京市回民医院,北京 100054)
研究报告
目的探索子宫内膜异位症盆腔粘连大鼠模型的建立方法及评价指标。方法采用自体移植法将子宫内膜移植于大鼠肠系膜间,术后1、3、5、7、14、21、28 d分别随机抽取8只大鼠开腹观察病灶生长情况,采用美国生殖学会粘连分级(AFS)分级、Haber粘连评分两种方法同时对盆腔粘连程度进行评分;同时采取各组病灶及周围粘连腹膜组织行HE染色;术后5、7、14、21、28 d组分别采取病灶周围粘连组织,对其组织型纤溶酶原激活剂(tPA)含量进行动态检测。结果两种粘连评分方法均显示造模后5 d已形成典型的盆腔粘连;与空白对照组及假手术相比,造模5 d后各模型组大鼠盆腔粘连腹膜组织中tPA含量极度降低(P< 0.01),造模28 d后tPA含量有上升趋势,但仍显著低于空白对照组及假手术组(P< 0.01)。结论采用自体移植法将子宫内膜移植于肠系膜间建立EMs盆腔粘连模型,造模术后5 d即为成熟模型,tPA与EMs盆腔粘连的发生具有相关性。
子宫内膜异位症;盆腔粘连;大鼠;组织型纤溶酶原激活剂
子宫内膜异位症(endometriosis,EMs)是指子宫内膜组织生长于子宫腔以外的部位,主要发生在育龄期妇女,近年来发病率呈逐年上升趋势。盆腔粘连是内异症的重要特征,有研究表明,80%以上的患者在初次手术时即发现有盆腔粘连[1],且术后再粘连发生率高。EMs相关痛经、不孕、慢性盆腔痛及其复发等均与盆腔粘连有关。另外,盆腔粘连越严重,术程越长、术中出血也愈多[2]。因此,许多学者将内异症相关盆腔粘连治疗提上议程[3]。受伦理限制,EMs盆腔粘连动物模型的建立是阐明机制、观察疗效的重要研究方法,但目前并无公认的EMs盆腔粘连动物模型,其建立与评价方法仍有待研究。研究表明,上调内异症患者腹膜纤溶系统中组织型纤溶酶原激活剂(tissue-type plasminogen activator, tPA)表达可减轻腹膜粘连的程度[1],这提示tPA与EMs盆腔粘连有极大关系。本实验从EMs盆腔粘连产生发展过程出发,确定模型成立时间,并对造模后不同时间点大鼠盆腔粘连组织中tPA含量经行测定,初步探讨其与EMs盆腔粘连发生的关系。
1 材料和方法
1.1 实验动物
清洁级性成熟未孕雌性SD大鼠116只,8周龄,体重220±20 g,由北京维通利华实验动物技术有限公司提供[SCXK(京)2006-0009]。饲养于中国中医科学院广安门医院SPF级动物实验室[SYXK(京)2012-0001],灯光(12 L:12 D),室温 22℃。饲养动物所需的笼具及饮水瓶均由专业饲养人员高压灭菌后提供。
1.2 主要试剂与仪器
常规手术器械包2套,超净工作台等。
水合氯醛(批号:20140304,国药集团化学试剂有限公司,中国);苯甲酸雌二醇(批号:B131204,规格4 mg: 2 mL,宁波市三生药业有限公司,中国);青霉素钠(国药准字:H13020657,规格:80万单位/支,华北制药股份有限公司,中国)。
大鼠酶联免疫吸附测定(Elisa)试剂盒,由武汉华美生物工程有限公司提供;倒置显微镜:IX~70,日本Olympus公司产品;离心机:CT15 RE型,日本Hitachi公司产品;酶标仪:Stat Fax 2100, Awareness公司产品。
1.3 实验方法
1.3.1 药物配制方法
10%水合氯醛:用100 mL无菌蒸馏水溶化10 g水合氯醛晶体;苯甲酸雌二醇:2 mL苯甲酸雌二醇与植物油18 mL混合均匀,配成1:10的苯甲酸雌二醇溶液。
1.3.2 造模方法
术前准备:术前2 d肌注4 mg/2 mL的苯甲酸雌二醇0.1 mg/(kg·d),使其处于同一动情周期,造模前禁食12 h。
分组:造模前将72只雌性SD大鼠按照体重随机分为空白组8只(B组)、假手术组8只(S组)、模型组(56只)。
模型制作:参考Haber造模方法[4],模型组大鼠禁食12 h后,采用自体移植法在无菌条件下进行造模。大鼠称重,10%水合氯醛(0.38 mL/100 g)腹腔麻醉,置于超净台,腹部备皮,在尿道口上约1 cm处靠左侧做平行于正中线长约1.5 cm的纵切口进腹,进腹后在膀胱背侧找到子宫,游离左侧子宫,近端离左子宫角 1 cm 处结扎,远端离卵巢 2 cm 处结扎,并结扎两端间的子宫系膜血管,切除约 1.0 cm 长子宫段,立即放入盛有无菌生理盐水的培养皿中,用眼科剪沿系膜部剪开管状子宫,切割成3 mm × 3 mm大小的碎片,共4片,注意区分肌层与内膜面,内膜面朝向肠系膜,用5-0线缝合于右侧肠系膜血管丰富处,检查腹腔无出血后,腹腔留置青霉素钠0.25 mL,5-0线缝合腹壁,2-0线缝合皮肤进行逐层关腹。分笼喂养,待其自然苏醒。术后连续3 d肌注青霉素钠0.25 mL,每天1次,以预防术后感染,术后第二天开始肌注苯甲酸雌二醇0.1 mg/kg·d,以促进异位灶的生长。
假手术组制作:术前准备、麻醉、子宫的切除方法同模型组,紧贴肠系膜缝4针5/0尼龙线。
1.3.3 观察指标及测定方法
模型组分别于造模术后第1天(M1组)、3天(M2组)、5天(M3组)、7天(M4组)、14天(M5组)、21天(M6组)、28天(M7组)随机抽取8只大鼠,其中第28天同时将假手术组开腹,开腹后观察盆腔粘连情况及异位灶生长情况。
1.3.4 盆腔粘连评分
每只大鼠均采用两种粘连评分方法:①美国生殖医学会粘连分级(AFS)分级方法[5]:粘连范围:0分:无,1分:≤25%,2分:≤50%,3分:≤75%,4分:≤100%;粘连类型:0分:无,1分:膜状、透明、无血管,2分:不透明或半透明,无血管,3分:不透明,有毛细血管,4分:不透明,有更大的血管;粘连韧性:0分:无,1分:自动分离,2分:需要牵拉才能分离,3分:需要锐性分离;分别从粘连范围、粘连类型及粘连强度三个方面进行评价,总粘连评分为三者总和。②Haber粘连评分方法[4]:0分:无粘连,无粘连带;1~2分:轻微粘连,有少许粘连带,几乎难以辨认;3~4分:轻中度粘连,移植物周围可见一些粘连带,不需要分解;5分:中度粘连,移植物周围有一些粘连带,相对容易分解;6~7分:中重度粘连,粘连带较多,大部分围绕移植物,在肠管间也可见粘连带,难以分解;8~9分:重度粘连,肠管间有很多粘连带,粘连分解困难;10分:严重粘连,大量的粘连带使肠管、肠系膜、腹膜严重粘连,在不损伤脏器的情况下无法分解粘连。以上两种粘连评分方法均有相同的两位实验人员独立进行,每种评分方法均取两位实验人员所评分数的平均值作为最终粘连评分。
1.3.5 粘连组织tPA活性检测
造模术后第5天、第7天、14天、第21天、第28天组均采取粘连处腹膜组织,假手术组及空白组采取正常腹膜组织,进行组织匀浆、离心、蛋白定量, ELISA方法检测tPA含量。
1.4 统计学方法
2 结果
2.1 肉眼观察
造模术后第1天:异位灶肿胀,紧贴肠系膜,未见有透亮异位囊泡生成,异位灶周围肠管相互接触,稍松动即可分离,松动过程中可见有极薄的透明弹性组织断裂,分离过程中无出血。(图1-A)
造模术后第3天:可见直径3 mm左右大小的异位灶,内含透亮液体,异位灶周围及肠管间有轻度粘连,稍提拉即可分离,分离过程中可见有较薄的透明组织断裂,分离过程中无出血。(图1-B)
造模术后第5天:囊泡直径增大至4~8 mm左右,内含清亮液体,表面覆盖有新生血管;盆腔广泛粘连,多见于异位灶附近肠管与肠管、肠管与肠系膜、异位灶与侧盆壁或远部脏器粘连,粘连部位脂肪组织轻度增生,呈半透明活不透明状,粘连韧性增强,有小的新生血管生成,易钝性分离,分离后可见有少量出血,可压迫止血。(图1-C)
造模术后第7天:病灶处可见移植物体积增大至5~10 mm左右,呈透明囊泡状,内含清亮液体,表面覆盖有新生血管及脂肪组织;盆腔广泛粘连,粘连部位脂肪组织增生增厚,不透明,有小的新生血管生成,钝性分离后,分离面广泛渗血,压迫止血时间长,易伤及正常组织。(图1-D)
造模术后第14天:移植物体积增大,呈透明囊泡状,内有液体积聚,表面覆盖有丰富的新生血管及脂肪组织;盆腔粘连致密,脂肪组织进一步增生增厚,钝性分离易撕破肠管,造成大鼠死亡。(图1-E)
造模术后第21天、28天:移植物体积缩小,呈半透明囊泡状,内有稍浑浊液体积聚,常包埋在粘连组织内;盆腔广泛粘连,更加致密,粘连部位新生血管丰富,需小心锐性分离,分离面出血量多,压迫止血困难,常伤及周围正常组织,造成大鼠死亡。(图1-F、G)
假手术后28天:缝合线周围基本无粘连,脂肪组织稍增厚,正常解剖结构未破坏,无需分离。
2.2 美国生殖医学会粘连分级(AFS)评分
结果显示,造模术后1~5 d内各组大鼠盆腔粘连范围、粘连类型、粘连韧性评分均不断提高,各组间评分比较,差异有显著性(P< 0.05);造模术后5~7 d粘连范围基本固定,约75%的病灶周围均形成粘连,新生毛细血管已形成,粘连类型基本固定,粘连韧性增强变慢,造模术后第5天与第7天组在粘连范围、粘连类型及粘连韧评分方面差异无显著性(P> 0.05)。造模术后第14天、21天、28天组在粘连范围、粘连类型及粘连韧性评分方面差异无显著性(P> 0.05)。(见表1)

注:A:M1组;B:M2组;C:M3组;D:M4组;E:M5组;F:M6组;G:M7组;H:S组;I:B组。图1 造模术后不同时间大鼠盆腔粘连情况比较Note.A: M1 group. B: M2 group. C: M3 group. D: M4 group. E: M5 group. F: M6 group. G: M7 group. H: S group. I: B group.Fig.1 Pelvic adhesions of the model rats at different stages表1 造模术后不同时期EMs大鼠盆腔粘连AFS评分比较Tab.1 Comparison of AFS scores of pelvic adhesions in the EM rats at different stages
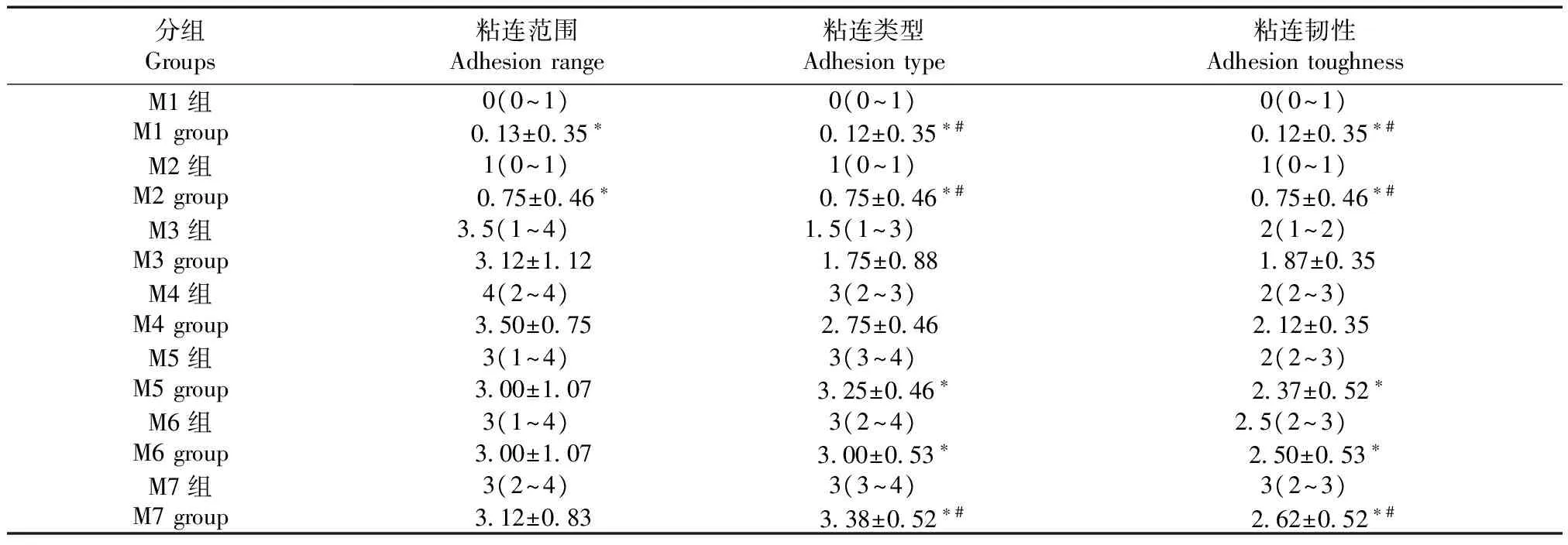
分组Groups粘连范围Adhesionrange粘连类型Adhesiontype粘连韧性AdhesiontoughnessM1组M1group0(0~1)0(0~1)0(0~1) 013±035∗ 012±035∗# 012±035∗#M2组M2group1(0~1)1(0~1)1(0~1) 075±046∗ 075±046∗# 075±046∗#M3组M3group35(1~4) 15(1~3) 2(1~2)312±112175±088 187±035M4组M4group4(2~4)3(2~3)2(2~3)350±075275±046212±035M5组M5group3(1~4)3(3~4)2(2~3)300±107 325±046∗ 237±052∗M6组M6group3(1~4)3(2~4)25(2~3) 300±107 300±053∗ 250±053∗M7组M7group3(2~4)3(3~4)3(2~3)312±083 338±052∗# 262±052∗#
注:A(B~C):A表示AFS评分中最小值B与最大值C之间的中位数;与造模术后第5天相比,*P<0.05;与造模术后第7天相比,#P< 0.05。
Note.A represents the median of the minimum B and the maximum C in AFS scores. Compared with the group of five days after modeling,*P< 0.05. Compared with the group of one week after modeling,#P< 0.05.
2.3 Haber粘连评分
结果显示,造模术后第1~5天内粘连发生率不断增长,造模术后第5天粘连发生率即可达到峰值100%,粘连评分为6.15±1.28,已达到中重度粘连,顿性分离相对困难,且造模术后5 d粘连组织中新生毛细血管生成,其后将形成不可逆粘连。(见表2、图2)

表2 造模术后不同时期EMs大鼠盆腔粘连Haber评分比较Tab.2 Comparison of Haber scores of pelvic adhesions in the EM rats at different stages
注:与造模术后第5天相比,*P< 0.05;与造模术后第7天相比,#P< 0.05。
Note.Compared with the group of five days after modeling,*P< 0.05. Compared with the group of one week after modeling,#P< 0.05.

注:与造模术后第5天相比,* P< 0.05;与造模术后第7天相比,#P< 0.05。图2 造模术后不同时期EMs大鼠盆腔粘连Haber评分比较Note.Compared with the group of five days after modeling,* P< 0.05. Compared with the group of one week after modeling,#P< 0.05.Fig.2 Comparison of Haber scores of pelvic adhesions in the EMs rats at different stages
2.4 造模术后不同时期病灶周围组织HE染色
结果显示,造模术后第1天:纤维脂肪组织表层多量纤维素附着,形成红染的粘附带,较多炎细胞和吞噬细胞浸润,血管扩张充血不明显,线头和内膜周围多量炎细胞浸润,伴有纤维组织增生(图3-A)。
造模术后第3天:纤维脂肪组织表层可见纤维蛋白渗出,部分表面衬覆红染粘附带,呈纤维修复性改变,表面可见间皮细胞增生,细胞呈立方或低柱状,伴有大量炎细胞浸润(图3-B)。
造模术后第5天:纤维脂肪组织内多量炎细胞浸润,可见大量新生小血管,大量炎性肉芽生长,伴有血栓形成(图3-C)。
造模术后7~28 d:纤维增生,浆膜面纤维组织增生主要以胶原纤维及平滑肌样细胞为主,粘连逐渐致密。可见炎细胞浸润,新生血管逐渐增多形成血管网(图3-D)。
假手术后28 d:未见明显纤维组织增生,偶可见炎性细胞浸润,未见明显血管增生(图3-E)。
正常对照:无纤维组织增生,未见明显炎性细胞浸润,无增生血管(图3-F)。
2.5 tPA含量检测
与正常组或假手术比较,各个时期模型组tPA含量均大幅度降低,差异有显著性(P< 0.01)。造模术后5 d tPA含量低水平表达维持到造模术后21 d,各组间差异无显著性(P> 0.05),造模术后28 d tPA含量有回升趋势,与模组型比较,差异有显著性(P< 0.01),但仍显著低于空白对照组及假手术组,差异有显著性(P< 0.01)。(见表3、图4)。
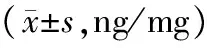
表3 造模术后各组大鼠盆腔tPA含量比较Tab.3 Comparison of the relative expression of tPA in EMs rat peritoneum at different stages
注:与假手术、空白组相比,*P< 0.01;不同时期模型组与造模术后28 d组相比较,#P< 0.01。
Note.Compared with the sham operation group and blank group,*P< 0.01. Models of different periods compared with the group at 28 days after modeling,#P< 0.01.
3 讨论
3.1 动物的选择
相关研究指出,灵长类动物月经周期与人类接近,是建立EMs模型的最佳动物,但因动物稀有、价格昂贵,且自发性EMs的比例低(4.8%)[6],这很大程度上限制了其在实际科研中的应用。裸鼠是一种免疫缺陷型小鼠,是建立内异症模型的理想动物,但因免疫缺陷,它在体现自身免疫学改变方面存在不足[7]。小鼠体积较小,脏器柔弱,开腹及分离粘操作困难,且更易伤及脏器造成死亡。大鼠作为实验动物,具有性成熟早、动情周期短、个体较大、生命力强、实验重复性好、价格适宜等优点,是复制EMs盆腔粘连模型的最佳选择。
3.2 盆腔粘连的时间选择
在异位灶的刺激下,两块接触的腹膜被覆纤维蛋白胶原而形成粘连条带,随着时间的推移,粘连范围逐渐扩大,粘连组织逐渐增厚,韧性不断增强,直至在不损伤正常脏器的情况下无法分离。本实验研究发现,造模术后粘连程度不断增强,术后5~7 d后粘连范围基本固定,14~28 d粘连类型及致密程度处于平稳期,这与Uguralp相关研究中“粘连形成于术后5~7 d”相吻合[8]。
3.3 盆腔粘连的评价
EMs盆腔粘连的发病机制尚不明确。郎景和团队在EM发病机制中提出“在位内膜决定论”,认为EM相关盆腔粘连是腹膜对逆流入腹腔经血刺激的一种保护性机制的过度反应[9]。异物、组织缺氧、感染、机械损伤等均可导致腹膜的损害,引起一系列多系统、多细胞及多因子参与复杂的网络反应,其中,纤维蛋白的沉淀和降解是腹膜粘连中重要的因素[10]。纤溶系统的作用是降解损伤腹膜修复过程中所形成的纤维,其中血管内皮细胞、腹膜间皮细胞、巨噬细胞等产生的tPA将纤溶酶原转变成纤溶酶,后者主要的功能就是降解纤维素。浆膜腔tPA主要来源于腹膜间皮细胞,其纤溶活性决定了浆膜腔局部纤维蛋白的沉积和清除[8]。若tPA含量降低,纤溶活性受到抑制,纤维胶原组织无法降解,最终形成粘连[11],因此tPA在粘连形成过程中起重要的抑制作用。通过本实验研究发现,造模5 d后,不同时间点模型大鼠粘连组织中tPA含量均显著降低,造模术后5~21 d粘连组织中tPA活性持续丧失,纤维蛋白酶缺少,沉积的纤维蛋白不能及时溶解而机化,最终成为永久性纤维粘连。

注:A:M1组;B:M2组;C:M3组;D:M4-M7组;E:S组;F:B组。图3 造模术后不同时期EMs大鼠病灶周围组织比较(HE×200)Note.A: M1 group. B: M2 group. C: M3 group. D: M4-M7 group. E: S group. F: B group.Fig.3 Peritoneal adhesions of the model rats at different stages. HE staining
本实验采用自体移植法将子宫内膜移植于肠系膜间建立EMs盆腔粘连模型,从盆腔粘连评分及含量检测等方面进行比较,发现本实验造模成功率高达100%,造模后5~21 d纤溶活性一直处在抑制状态;造模术后5 d模型作为成熟模型,造模术后5~7 d是预防粘连的关键时期;提高tPA表达水平可作为防治EMs盆腔粘连的方法之一。
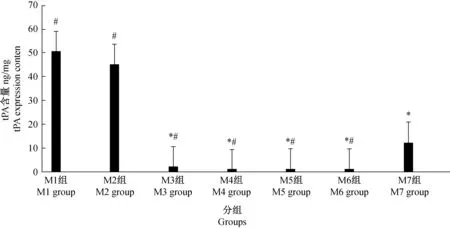
注:与假手术、空白组相比,* P< 0.01;不同时期模型组与造模术后28 d组相比较,#P< 0.01。图4 造模术后各组大鼠盆腔tPA含量比较Note.Compared with the sham operation group and blank group,* P< 0.01. Model groups of different periods compared with the group at four weeks after modeling,#P< 0.01.Fig.4 Comparison of the relative expression of tPA in EM rat peritoneum at different stages
[1] 李孟慧, 冷金花, 李成龙, 等. GnRH-α对EMs腹膜纤溶相关因子tPA/PAI表达影响的研究[J]. 现代妇产科进展, 2012, 21:20-23.
[2] 陈萍. 子宫内膜异位周围组织粘连程度与患者的临床特点、手术情况及术后复发的相关性分析 [J]. 中国妇幼保健,2014,29(5): 253-254.
[3] 刘媛媛,赵任峰. EMs盆腔粘连和疼痛的相关性研究 [J]. 广西医学,2013,35(5): 588-590.
[4] Haber E, Danenberg HD, Koroukhov N, et al. Peritoneal macrophage depletion by liposomal bisphosphonate attenuates endometriosis in the rat model [J]. Hum Reprod,2009,24(2): 398-407.
[5] The Surgical Membrane Study Group. Prophylaxis of pelvic sidewall adhesions with Gore-Tex surgical membrane: a multicenter clinical investigation [J]. Fertil Steril, 1992, 57(4): 921-923.
[6] Dehoux JP,Defrere S,Squifflet J. Is the baboon model appropriate for endometriosis studies? [J]. Fertil Steril, 2011, 96(3): 728-733.
[7] 冯雪,黄薇.子宫内膜异位症动物模型研究进展 [J]. 中国比较医学杂志,2014, 24(12): 67-70.
[8] Uguralp S, Akin M, Karabulut AB, et al. Reduction of peritoneal adhesions by sustained and local administration of epidermal growth factor [J]. Pediatr Surg Int, 2008, 24(2): 191-197.
[9] 李孟慧. 腹膜间皮细胞及转化生长因子在EMs粘连中作用研究 [D]. 北京,北京协和医学院,2012.
[10] Esposito AJ, Heydrick SJ, Cassidy MR, et al. Substance P is an early mediator of peritoneal fibrinolytic pathway genes and promotes intra-abdominal adhesion formation [J]. J Surg Res, 2013, 181(1): 25-31.
[11] Shimomura M, Hinoi T, Ikeda S, et al. Preservation of peritoneal fibrinolysis owing to decreased transcription of plasminogen activator inhibitor-1 in peritoneal mesothelial cells suppresses postoperative adhesion formation in laparoscopic surgery [J]. Surgery, 2013, 153(3): 344-356.
Establishmentandevaluationofaratmodelofendometriosiswithpelvicadhesions
LI Tian-tian1,2, SUN Wei-wei1, ZHAO Rui-hua1*
(1.Guang’anmen Hospital, China Academy of Chinese Medical Sciences, Beijing 100053, China; 2.The Beijing Muslem People’ s Hospital, Beijing 100054)
ObjectiveTo establish and evaluate a rat model of endometriosis with pelvic adhesions.MethodsTo establish a rat model of endometriosis and pelvic adhesions by autologous transplantation of endometrial tissue to the mesenterium. After modeled, eight rats were randomly selected for examination at 1, 3, 5, 7, 14, 21 and 28 days after operation. The American Society for Reproductive Medicine Classification of Endometriosis and Haber Adhesion Score were used to evaluate the pelvic adhesions. At the same time, the lesions and surrounding peritoneal adhesions were taken for pathological examination using HE staining. The tissue-type plasminogen activator (tPA) content was detected at 5, 7, 14, 21 and 28 days after operation.ResultsThe two adhesion scoring methods showed that typical pelvic adhesions were formed 5 days after modeling. Compared with the blank control group and the sham operation group, the tPA content in the pelvic adhesions of the model group was significantly decreased after 5 days (P< 0.01), and increased at 28 days after model establishment, but still significantly lower than that of the blank control group and sham operation group (P< 0.01).ConclusionsThe autologous transplantation method is successfully used to establish a rat model of pelvic adhesions of endometriosis in the mesenterium. The model is matured at 5 days after surgery. The tPA is correlated with the formation of pelvic adhesions of endometriosis.
Endomeitriosis; Pelvic adhesions; Rat; Tissue-type plasminogen activator, tPA
国家自然科学基金资助项目(81373678)。
李田田(1989-),女,住院医师,硕士研究生,研究方向:中医妇科。E-mail: 836859326@qq.com
赵瑞华(1959-),女,主任医师,博士,研究方向:中医妇科。E-mail: Rhz801@sohu.com
A
1671-7856(2017) 12-0008-08
10.3969.j.issn.1671-7856. 2017.12.002

