大、小鼠支气管肺泡灌洗术的研究进展
龙 隆,赵显莉,谭 红*,张爱华,杨鸿波,何锦林
(1.贵州医科大学公共卫生学院,贵阳 550025; 2.贵州省分析测试研究院,贵阳 550002)
大、小鼠支气管肺泡灌洗术的研究进展
龙 隆1,2,赵显莉2,谭 红2*,张爱华1,杨鸿波2,何锦林2
(1.贵州医科大学公共卫生学院,贵阳 550025; 2.贵州省分析测试研究院,贵阳 550002)
研究报告
支气管肺泡灌洗术是研究呼吸系统及其病变的一种重要的动物实验技术,它可以获得呼吸道及肺部深处多种生化因子、炎症介质和免疫细胞等,为动物实验研究提供重要的评价指标和参考依据,是探讨呼吸系统性疾病的一种有效可靠的方法。目前应用于人的支气管肺泡灌洗术已经逐步标准化并在临床广泛开展,但没有一套针对实验动物大小鼠的支气管肺泡灌洗操作的标准。支气管肺泡灌洗液的检测结果受诸多因素共同影响, 如灌洗液、灌注压力、灌洗量和回收量以及灌洗液在肺部停留时间等, 成功而高效获取灌洗标本是研究和评价呼吸系统性疾病的关键所在。本文总结了目前国内外研究人员常用的灌洗操作方法,为今后进一步开展相关的实验研究提供参考。
支气管肺泡灌洗术;动物实验;呼吸系统
支气管肺泡灌洗术 (bronchoalveolar lavage, BAL)是研究人和动物呼吸系统性疾病的一种十分重要的实验技术,该技术方法在临床试验和动物实验研究中都得到了广泛应用与研究[1-3],但在实验动物相关研究中并未得到应有的重视。如今有关大小鼠的实验与日俱增,在实验研究中的地位越发重要,而环境空气污染愈发严重,对人健康危害极大[4],了解动物呼吸系统的病变,并将其研究成果应用于我们人类显得格外重要,尤其是在吸入毒性试验中,同时支气管肺泡灌洗液 (bronchoalveolar lavage fluid, BALF) 也广泛用于研究吸入纳米颗粒物、大气颗粒物以及工人们在某些特定的职业场所吸入空气中的悬浮颗粒物后所引起的肺损伤,例如实验动物染毒后BALF中的肺泡巨噬细胞、中性粒细胞的数量、磷脂和总蛋白的浓度的显著性改变,是肺部炎症损伤程度的重要生物标志物[5],BALF的检测结果显得十分关键[6-8]。但目前国内外学者对于实验动物大小鼠支气管肺泡的灌洗并没有形成一种准确、可靠而规范的一套操作方法,研究人员的肺泡灌洗方法千差万别,导致相关实验研究之间缺乏可比性,BALF的检测结果受到诸多因素影响,不同的灌洗操作方法对BALF意义重大,对灌洗液的回收率和灌洗液中细胞及细胞因子活性的影响都不容忽视,这一点细小的差异可能会对整个实验研究结果产生深远的影响,如灌洗液被污染混入血液、抽吸压力大小、灌洗量和灌洗液的种类等。因此,建立一种可靠、准确、成功率高的标准灌洗方法尤为重要,本文总结了国内外学者的支气管肺泡灌洗方法,为今后进一步开展相关实验研究提供参考和依据。
1 麻醉
动物手术前的麻醉不仅是为了减轻动物的痛苦,满足动物福利的要求,也是为了保证动物手术顺利进行的前提,目前国外大多数实验研究采用的麻醉方式都是通过腹腔注射(intraperitoneal injection, IP) 戊巴比妥钠,戊巴比妥钠已经成为了国外学者首选的麻醉药,在比较发达的国家和地区,则倾向采用更为安全、效率更高的吸入异氟烷麻醉,异氟烷被动物吸入体内后几乎不参与体内代谢,对实验结果干扰较小。国内使用的吸入麻醉药还包括乙醚,但乙醚会对动物的呼吸道造成强烈的刺激。吸入麻醉相比传统的麻醉方式具有以下明显的优点:麻醉作用快、动物苏醒迅速、麻醉深度易于控制以及实验动物的病死率低,然而吸入麻醉成本较高,术前准备及麻醉操作相对复杂,国内应用并不多见。而国内实验人员选择的麻醉药除了戊巴比妥钠外也有用水合氯醛,尽管戊巴比妥钠和水合氯醛等麻醉剂使用较为方便,麻醉过程平衡且稳定,维持时间长,但也存在明显的缺点:动物苏醒时间较长,更重要的是麻醉药对呼吸系统和循环系统存在明显的抑制作用[9-10],给开展部分实验带来较大的干扰。因此麻醉药和麻醉剂量要依据自己实验的要求和目的来选择,不同品系的大小鼠对不同种类麻醉药的敏感性也不同,这就需要我们根据自己实践的结果并结合参考文献来选择适合的麻醉方式。现阶段常用的大小鼠腹腔注射戊巴比妥钠麻醉剂量为30~50 mg/kg,浓度1%~3%,水合氯醛麻醉剂量为300~400 mg/kg,浓度10%,乌拉坦由于具有较强的致癌作用应用较少。当下同时研究授试物与麻醉药对机体联合及交互作用的研究并不多见,部分药物的动力学及药效学尚不完全清楚,这也许会给实验结果带来困扰,是授试物造成的结局亦或是麻醉药影响了特定生化指标的改变还需要更进一步的探讨。
2 灌洗液
选择合适的灌洗液是目前BAL中争议最大的环节,也是整个灌洗过程中最混乱的一部分,国内外实验人员在选择灌洗液种类、温度以及灌洗量上都存在较大差异。常用的灌洗液包括生理盐水(pH 6.2~7.4)、磷酸盐缓冲液(PBS,pH 7.4)以及D-Hanks液(pH 7.9)。史菲等[11]通过导管吸取37℃预热的生理盐水缓慢注入大鼠左侧肺内,并来回抽吸10次,每只大鼠的单次肺泡灌洗量为2.5 mL。曹君等[12]选用无菌PBS对小鼠进行单侧肺泡灌洗,单次灌洗量为0.5 mL。国内学者大多选用生理盐水和磷酸盐缓冲液[3,12]进行灌洗,但很少有学者约定灌洗液的温度和pH值,值得一提的是,国外实验人员偏爱pH 7.4含有钙镁离子并且预热的PBS,他们认为其更有利于灌洗液中细胞因子的活性[13-15]。灌洗液的种类、pH值以及温度高低的差异可能对呼吸道的刺激作用不同,对收集的灌洗液中细胞因子活性的影响也不一样,给灌洗液后续检测分析结果带来一定干扰,国内的相关研究几乎处于一片空白。能否进行成功的灌洗,收集到准确而可靠的结果,标准化BAL的操作,选择合适的灌洗液显得尤为重要,很多试验中并没有对该问题引起重视,在实验方法中简略描述,今后相关实验研究需要注重BALF的收集方法且具体化,并增加必要的讨论。
3 灌洗部位
大小鼠的肺叶分部与我们人存在明显差异,左肺为单叶,右肺由上、中、下及副叶组成,因此根据实验目的决定是全肺灌洗或单肺灌洗,如果要求灌洗标本更多,则选取灌洗全肺或右肺,如果对组织病理学要求更高,则选择左肺进行灌洗,国内外实验人员对于选取实验动物灌洗部位也有着明显的差别,国内实验人员通常灌洗左肺[1,11],为了避免气管插管进入复杂的右肺肺叶,也有学者灌洗全肺[13],虽然全肺灌洗可以获得更多的灌洗标本,但也在一定程度上限制了动物的有效利用,同时增加实验动物数量,违反了实验动物的减量化(reducing)、再利用(reusing)和再循环(recycling)原则,反之,国外学者更偏向于结扎左主支气管灌洗右肺[14-16],Shin等[14]用3 mL预热的含有Ca2+、Mg2+离子的磷酸盐缓冲液对右肺进行了14次灌洗。Kim等[15]同样使用了含有Ca2+、Mg2+离子的磷酸盐缓冲液对右肺进行了4次灌洗,他们的操作方法基本一致。国外学者认为BAL是一项十分重要的操作技术,BALF中各种细胞因子、免疫因子以及细胞涂片等的检测结果至关重要,大小鼠右肺组织明显多于左肺,因而灌洗右肺能够获得更多的标本,可供参考的数据更多更准确,也遵循了动物福利,这也是他们绝大部分实验选择灌洗右肺的根本原因。
4 灌洗方式
灌洗方式是指离体操作或在体操做,在体灌洗只需通过手术暴露实验动物整个肺组织及气管并行插管后对其进行灌洗,相比之下,离体灌洗就稍显复杂,还需要将肺部及气管完整的取出后再进行灌洗,两种方式都存在明显的利弊,虽然在体灌洗对BALF中的细胞因子活性影响较小,但灌洗液回收率比较低,尽管离体灌洗时灌洗液回收量比较大,然而对细胞活性影响比较大,同时离体灌洗还需要对肺部进行手术分离,稍有不慎就可能刺穿肺叶,影响灌洗,导致整个实验失败,使得灌洗操作变得更加复杂,费时费力,值得注意的是在对小鼠进行操作时应格外小心,如果没有剥离干净,在行气管插管时,血管可能被手术器械挑破,导致血液流出不仅会干扰插管的视野,还会导致BALF污染,影响BALF生化因子和细胞成分的分析。当前并没有实验研究明确揭示在体灌洗与离体灌洗的差异,对细胞活性有着怎样的影响,国内外研究人员也并未对其进行深入探讨,这应当是今后相关实验研究的一个重点。
5 灌洗液的处理
收集到BALF之后,为了分离灌洗液中的多种成分,将对其离心,使相关细胞因子留在上清液中用于相关细胞因子的检测,而细胞等成分则沉淀下来通过重悬,给沉淀细胞一个合适的环境,并使其形态保持完整性后行染色涂片、细胞计数以及显微镜镜检。国内外实验研究人员对于离心速度、离心时间、离心温度和细胞重悬所用的液体都没有一个统一的标准,这也使得相关实验数据的结果缺乏可比性。国外实验人员BAL汇总如表1所示。
6 灌洗过程的注意事项及讨论
6.1 气管插管的选取
由于大小鼠实验动物的气管管径不同,行BAL时所使用的导管也略有不同,小鼠气管直径1.5 mm左右,大鼠气管2~2.5 mm左右,灌洗套管太粗不容易插进去,还会损伤气管,致使起到穿孔,灌洗管太细又容易导致液体外溢,使回收率降低,因此选用适合的导管十分关键。史菲等[11]采用外径为1.8 mm的静脉导管作为气管插管。酆孟洁等[28]使用24 G静脉留置套管针收集小鼠BALF,在灌洗液中观察到大量嗜酸性粒细胞,成功收集到了哮喘小鼠模型BALF。曹君等[12]采用22G静脉留置针套管行气管插管收集BALF,与酆孟洁等使用的气管插管方法基本一致。
6.2 抽吸力度和速度
灌洗操作过程中的抽吸速度、抽吸力度和抽洗次数同样也是收集BALF的关键,极容易被人忽视,在灌洗过程中,抽吸速度过快、力度过大,不仅灌洗不彻底,影响实验结果,还会导致管腔压力剧增,灌洗液溢出,甚至细胞变形破裂,包浆丢失,灌注压力过大会使灌洗液从肺组织表面渗出,抽吸力度过大易导致气管和静脉导管变形,反而不容易吸出液体。反复抽吸的次数过多,虽然收集到的标本中的细胞会相应增多,但灌洗量却会随之减少,导致回收率降低,此外抽吸次数过多还可能导致细胞受挤压变形而破裂严重干扰实验结果,国外研究人员大多抽吸2~4次。
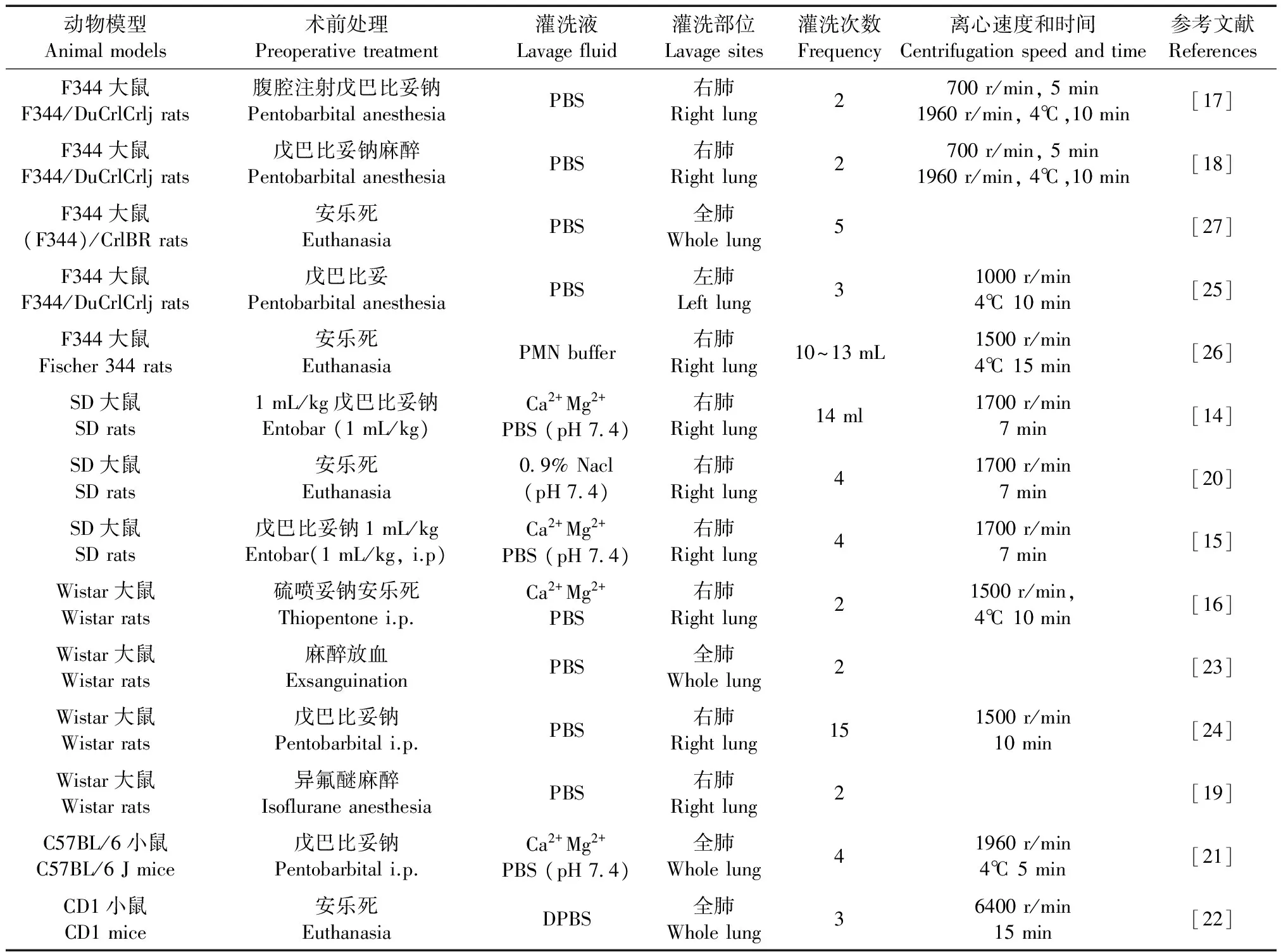
表1 支气管肺泡灌洗术汇总表Tab.1 Summary of bronchoalveolar lavage techniques
6.3 灌洗量和停留时间
众所周知大鼠肺组织容量大于小鼠,因此大鼠和小鼠的肺泡灌洗量也有所区别,灌洗液量过大将导致肺内压力急剧升高,严重时可导致灌洗液由肺组织包膜渗入胸腔中,过小则会导致回收不全,影响实验结果。常用的大鼠肺泡单次灌洗量为3~5 mL,小鼠为0.2~1 mL,除此之外,灌洗液在肺组织内停留时间的长短对实验结果的影响也不容忽视,停留时间过短也会导致灌洗液回收不彻底,目前,绝大多数实验都将15~30 s作为灌洗液在肺组织内最合适的停留时间。
6.4 回收率
值得提出的是,我们不难发现肺泡灌洗操作过程一点的不同,BALF的回收率千差万别,同时BALF回收率也饱受争议,在实际操作过程中想要每一个灌洗标本都得到一个较高的回收率并不容易,尤其是第一个灌洗标本的回收量是最少的,再者如果只行单侧肺泡灌洗, 回收率将进一步降低,回收率是否应当纳入标准肺泡灌洗还需更进一步的探讨。
鉴于BAL对今后开展呼吸系统相关研究的意义重大[29-33],必然会对研究实验动物呼吸道、肺部疾病做出更大贡献,同时也应该看到灌洗液的种类、灌洗方式以及灌洗操作等均会对BALF的检测结果产生干扰,在研究不同疾病时,BAL的操作可能不尽相同,因此有必要对其深入探讨,相关研究有待进一步深化。
[1] 宋一平,崔德健,茅培英,等. 慢性阻塞性肺疾病大鼠模型气道重塑及生长因子的研究 [J].中华结核和呼吸杂志, 2001, 24(5): 283-287.
[2] Kelly EA, Rodriguez RR, Busse WW, et al. The effect of segmental bronchoprovocation with allergen on airway lymphocyte function [J]. Am J Respir Crit Care Med, 1997, 156(5): 1421-1428.
[3] 湛孝东,姜玉新,李良怿,等. 不同浓度卵蛋白变应原对小鼠哮喘模型建立的影响 [J]. 中国实验动物学报, 2012, 20(4): 16-20.
[4] 黄鹂鸣,王格慧,王荟,等. 南京市空气中颗粒物PM10、PM2.5污染水平 [J]. 中国环境科学, 2002, 22(4): 334-337.
[5] Henderson RF. Use of bronchoalveolar lavage to detect respiratory tract toxicity of inhaled material [J]. Exp Toxicol Pathol, 2005, 57(1): 155-159.
[6] Warheit DB, Laurence BR, Reed KL, et al. Comparative pulmonary toxicity assessment of single-wall carbon nanotubes in rats [J]. Toxicol Sci, 2004, 77(1): 117-125.
[7] Lam CW, JamesJ T, Mccluskey R, et al. A review of carbon nanotube toxicity and assessment of potential occupational and environmental health risks [J]. Crit Rev Toxicol, 2006, 36(3): 189-217.
[8] Bermudez E, Mangum JB, Asgharian B, et al. Long-term pulmonary responses of three laboratory rodent species to subchronic inhalation of pigmentary titanium dioxide particles [J]. Toxicol Sci, 2002, 70(1): 86-97.
[9] 周昆,屈彩芹. 动物实验常用麻醉剂的比较与选择 [J]. 实验动物科学, 2008, 25(2): 41-43.
[10] 李志勇, 孙建宁, 张硕峰. 水合氯醛和戊巴比妥钠对SD大鼠麻醉效果的比较 [J]. 四川动物, 2008, 27(2): 299-302.
[11] 史菲,邱晨. 大鼠支气管肺泡灌洗术标准化操作的探讨 [J]. 中国现代医学杂志, 2002, 12(24): 67-69.
[12] 曹君, 陈平, 杨悦, 等. 烟雾暴露所致肺气肿小鼠模型的建立与评价 [J]. 中国实验动物学报, 2010, 18(4): 278-282.
[13] 应杏秋, 曾群力, 祝慧娟, 等. 纳米SiO2与标准SiO2致大鼠急性肺损伤的作用 [J]. 中华劳动卫生职业病杂志, 2006, 24(2): 116-117.
[14] Shin JH, Han SG, Kim JK, et al. 5 day repeated inhalation and 28 day post exposure study of graphene [J]. Nanotoxicology, 2015, 9(8): 1023-1031.
[15] Kim JK, Shin JH, Lee JS, et al. 28-day inhalation toxicity of graphene nanoplatelets in Sprague-Dawley rats [J]. Nanotoxicology, 2016, 10(7): 891-901.
[16] Francis AP, Ganapathy S, Palla VR, et al. One time nose-only inhalation of MWCNTs exploring the mechanism of toxicity by intermittent sacrifice in Wistar rats [J]. Toxicol Rep, 2015, 2(3): 111-120.
[17] Umeda Y, Kasai T, Saito M, et al. Two-week toxicity of multi-walled carbon nanotubes by whole-body inhalation exposure in rats [J]. J Toxicol Pathol, 2013, 26(2): 131-140.
[18] Kasai T, Umeda Y, Ohnishi M, et al. Thirteen week study of toxicity of fiber like multi walled carbon nanotubes with whole body inhalation exposure in rats [J]. Nanotoxicology, 2015, 9(4): 413-422.
[19] Ma-Hock L, Strauss V, Treumann S, et al. Comparative inhalation toxicity of multi-wall carbon nanotubes, graphene, graphite nanoplatelets and low surface carbon black [J]. Part Fibre Toxicol, 2013, 10(1): 23-42.
[20] Han SG, Kim JK, Shin JH, et al. Pulmonary responses of Sprague-Dawley rats in single inhalation exposure to graphene oxide nanomaterials [J]. Biomed Res Int, 2015. 2015 Article ID 376756.
[21] Mercer RR, Scabilloni JF, Hubbs AF, et al. Distribution and fibrotic response following inhalation exposure to multi-walled carbon nanotubes [J]. Part Fibre Toxicol, 2013, 10(1): 33-47.
[22] Blum JL, Rosenblum LK, Grunig G, et al. Short-term inhalation of cadmium oxide nanoparticles alters pulmonary dynamics associated with lung injury, inflammation, and repair in a mouse model [J]. Inhal Toxicol, 2014, 26(1): 48-58.
[23] Landsiedel R, Ma-Hock L, Hofmann T, et al. Application of short-term inhalation studies to assess the inhalation toxicity of nanomaterials [J]. Part Fibre Toxicol, 2014, 11(1): 16-42.
[24] Kadoya C, Lee BW, Ogami A,et al. Analysis of pulmonary surfactant in rat lungs after inhalation of nanomaterials: fullerenes, nickel oxide and multi-walled carbon nanotubes [J]. Nanotoxicology, 2016, 10(2): 194-203.
[25] Aiso S, Yamazaki K, Umeda Y, et al. Pulmonary toxicity of intratracheally instilled multiwall carbon nanotubes in male Fischer 344 rats [J]. Ind Health, 2010, 48(6): 783-795.
[26] Morimoto Y, Izumi H, Yoshiura Y, et al. Pulmonary toxicity of well-dispersed cerium oxide nanoparticles following intratracheal instillation and inhalation [J]. J Nanopart Res, 2015, 17(11): 442-458.
[27] Bermudez E, Mangum JB, Wong BA, et al. Pulmonary responses of mice, rats, and hamsters to subchronic inhalation of ultrafine titanium dioxide particles [J]. Toxicol Sci, 2004, 77(2): 347-357.
[28] 酆孟洁, 邱晨, 刘雯雯. 支气管肺泡灌洗术在哮喘小鼠模型中的应用 [J]. 国际检验医学杂志, 2012, 33(19): 2305-2306.
[29] Chanez P, Vignola AM, O’Shaugnessy T, et al. Corticosteroid reversibility in COPD is related to features of asthma [J]. Am J Respir Crit Care Med, 1997, 155(5): 1529-1534.
[30] Vasakova M, Sterclova M, Kolesar L, et al. Cytokine gene polymorphisms and BALF cytokine levels in interstitial lung diseases [J]. Respir Med, 2009, 103(5):773-779.
[31] Drent M, van Nierop MA, Gerritsen FA, et al. A computer program using BALF-analysis results as a diagnostic tool in interstitial lung diseases [J]. Am J Respir Crit Care Med, 1996, 153(2): 736-741.
[32] van Rijt LS, Kuipers H, Vos N, et al. A rapid flow cytometric method for determining the cellular composition of bronchoalveolar lavage fluid cells in mouse models of asthma [J]. J Immunol Methods, 2004, 288(1-2): 111-121.
[33] 毕玉田, 王彦, 吴奎, 等. 屋尘螨致敏/激发小鼠气道变态反应性炎症模型的构建 [J]. 中国实验动物学报, 2007, 15(5): 338-341.
Researchprogressofbronchoalveolarlavageinratsandmice
LONG Long1,2, ZHAO Xian-li2, TAN Hong2*, ZHANG Ai-hua1, YANG Hong-bo2, HE Jin-lin2
(1.School of Public Health of Guizhou Medical University, Guiyang 550025, China; 2.Guizhou Academy of Testing and Analysis, Guiyang 550002)
Bronchoalveolar lavage is an important animal experimental technique in the study of respiratory system and its pathological changes. It can acquire a variety of biochemical factors, inflammatory mediators and immune cells from the respiratory tract and lungs, and provides an important evaluation index and reference for animal experiment. Bronchoalveolar lavage is an effective and reliable method for the diagnosis of respiratory diseases. It has been gradually standardized and widely used in clinical practice at present, however, there is no set of standard for bronchoalveolar lavage in rats and mice. The results of bronchoalveolar lavage fluid are affected by many factors, such as the lavage fluid, suction pressure, the amount of lavage and recovery, and the retention time of lavage fluid in the lungs. Successful and efficient acquisition of lavage specimens is the key to the study and evaluation of respiratory diseases. This paper summarizes the current lavage methods commonly used by domestic and foreign researchers, and provides a reference for further research in the this field.
Bronchoalveolar Lavage; Animal experiment; Respiratory system
贵州省科技计划(黔科合外G字[2015]7001号);中央引导地方科技科技发展专项(黔科中引地[2016]4001号);环境化学与生态毒理学国家重点实验室开放基金(KF2016-21);遗传资源与进化国家重点实验室开放课题(GREKF17-15)。
龙隆(1991-)男,硕士研究生,专业:公共卫生-环境医学与卫生监督。E-mail: 497192979@qq.com
谭红(1959-)女,研究员,研究方向:食品安全、环境监测、新化学物质毒理测试研究。E-mail: tan-hong@tom.com
R-33
A
1671-7856(2017) 12-0115-05
10.3969.j.issn.1671-7856. 2017.12.020
2017-04-19

