下丘脑室旁核NMDAR介导大鼠促炎因子增强高血压 交感活动的作用
逯 鹏,潘 虹,马春蕾,3,施 真*
(1.滨州医学院烟台附属医院,山东 烟台 264100; 2.滨州医学院生理学教研室,山东 烟台 264003; 3.山东省脑中风重点实验室,山东 烟台 264003)
下丘脑室旁核NMDAR介导大鼠促炎因子增强高血压 交感活动的作用
逯 鹏1,潘 虹2,马春蕾2,3,施 真2*
(1.滨州医学院烟台附属医院,山东 烟台 264100; 2.滨州医学院生理学教研室,山东 烟台 264003; 3.山东省脑中风重点实验室,山东 烟台 264003)
研究报告
目的研究自发性高血压大鼠(spontaneously hypertensive rat, SHR)下丘脑室旁核促炎性细胞因子是否促进交感神经活动过度增强,以及N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor, NMDAR)是否介导其上述作用。方法本研究采用成年SHR以及正常血压的Wistar-Kyoto(WKY)大鼠。应用蛋白质免疫印迹分析技术(Western blot)和酶联免疫吸附测定法(ELISA)分别测定下丘脑室旁核(paraventricular nucleus, PVN)肿瘤坏死因子(TNF)和白细胞介素(IL)-1β受体IL-1RI蛋白表达以及TNF-α和IL-1β水平。并应用脑立体定位进行PVN微量药物注射。肾交感神经活动(renal sympathetic nerve activity, RSNA)的测定采用Powerlab系统记录肾交感神经干电活动,并进行积分处理,比较给药前后的RSNA变化。颈动脉插管经压力传感器与PowerLab系统连接记录和分析平均动脉血压(mean arterial pressure, MAP)。结果与WKY大鼠相比,SHR PVN中TNF-α及IL-1β水平,以及TNF-α受体p55TNFR、p75TNFR和IL-1β受体IL-1RI蛋白表达均显著升高(P< 0.05)。PVN微量注射Etanercept 或IL-1ra阻断TNF-α和IL-1β效应在SHR组更显著的降低交感神经活动水平(P< 0.05)。PVN微量注射NMDAR拮抗剂DL-2-amino-5-phosphonovaleric acid(APV)或MK-801(Dizocilpine)在SHR和WKY组大鼠均降低RSNA和MAP(P< 0.05),并且在SHR组该效应更显著(P< 0.05);另外,APV或MK-801预处理阻断PVN中NMDA受体均显著减弱PVN微量注射TNF-α或IL-1β增强SHR和WKY组大鼠 RSNA和升高MAP的效应(P< 0.05),与WKY组大鼠相比,该效应在SHR组更显著(P< 0.05)。结论SHR PVN促炎性细胞因子TNF-α、IL-1β及其受体均表达增加,PVN中NMDA受体介导SHR大鼠PVN 中TNF-α、IL-1β促进交感活动增强和血压升高的效应。
自发性高血压;NMDA受体;交感神经活动;促炎性细胞因子
交感神经过度激活是高血压病的重要特征之一[1, 2],在其病程发展和器官损害中起重要作用,但其机制仍不清楚。下丘脑室旁核(paraventricular nucleus,PVN)是心血管活动整合的重要中枢结构之一,在交感神经活动调控中发挥关键作用[3,4]。与炎症有关的细胞因子即炎性细胞因子,又可分为促炎性细胞因子(PICs),如肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β等和抗炎性细胞因子(AICs),如IL-4、IL-10 等。有研究发现,疾病状态下中枢升高的PICs促进交感神经活动的增强[5,6]。但PVN中PICs通过何种机制调控交感活动促进高血压仍不清楚。近来研究表明PVN中离子型谷氨酸受体调控交感传出活动[7, 8]。PVN的谷氨酸能紧张性在自发性高血压大鼠异常升高,这是通过突触前谷氨酸递质释放增加和突触后N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor, NMDAR)活动增强导致的[9]。本研究旨在观察SHR PVN中TNF、IL-1β受体IL-1RI蛋白表达以及TNF-α、IL-1β水平变化,药物阻断二者对SHR交感神经活动和血压的影响,以及TNF-α、IL-1β的上述效应是否通过NMDAR介导。
1 材料和方法
1.1 实验动物
实验采用16周龄雄性自发性高血压大鼠(spontaneously hypertensive rat, SHR)和16周龄雄性正常血压的Wistar-Kyoto(WKY)大鼠。体重260~280 g,清洁级,在滨州医学院实验动物中心进行实验[SYXK(鲁) 2013-0020]。实验动物购自上海斯莱克实验动物有限责任公司[SCXK(沪)2012-0002]。饲养期间给予啮齿类动物标准颗粒饲料(由实验动物中心提供)及自由饮水,12 h循环灯光,恒定湿度,室温(23±2)℃。本实验所有操作均符合中华人民共和国《实验动物管理条例》。
1.2 实验试剂
Etanercept、IL-1ra、DL-2amino-5-phosphonovaleric acid(APV)、MK-801(Dizocilpine)购自Sigma公司;TNF-α、IL-1β购自Peprotech公司;TNF-α、IL-1β测定所需ELISA试剂盒购自R&D公司;Western blot所需抗体购自Santa Cruz公司;蛋白定量试剂盒购自南京建成生物工程研究所;TNF-α和IL-1β测定所需ELISA试剂盒购自R&D公司。
1.3 实验方法
1.3.1 PVN中 TNF-α、IL-1β和p55TNFR、p75TNFR、IL-1RI蛋白水平测定
WKY和 SHR组各6只苯巴比妥钠(40 mg/kg)麻醉后断头取脑,液氮速冻后保存于-70℃低温冰箱中。用冰冻切片机(Leica CM 1900-1-1,Germany)在PVN冠状面水平做连续切片,用内径1.0 mm打孔针头分别取出PVN和同一冠状面皮层部位相同大小组织块,组织放置于0.1 mL RIPA lysis 缓冲液中匀浆并提取总蛋白。利用酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA),按大鼠ELISA 试剂盒(R&D Systems; Oxfordshire, UK)说明书中所述操作步骤分别检测PVN TNF-α、IL-1β水平。Western blotting法测定PVN中的p55TNFR、p75TNFR、IL-1RI受体蛋白。
1.3.2 记录动脉血压
用充有肝素生理盐水溶液的PE-50聚乙烯管插入右侧颈总动脉,经压力传感器与四通桥式放大器(QUAD Bridge,AD Instruments,Australia)相连,经PowerLab数据分析处理系统(8SP型, AD Instruments, Australia)记录动脉血压,并对血压信号进行处理,同步记录动脉血压和MAP。
1.3.3 记录RSNA和基础交感神经水平测定
经腰部纵行切口沿腹膜后路径暴露左侧肾脏、肾动脉和肾神经,于接近腹主动脉处的肾动脉和肾静脉附近仔细游离出肾交感神经,并浸入温石蜡油中,安放银丝电极引导RSNA,经交流/直流差分放大器(Model 3000,A-M System Inc.,USA)放大后(低端截止频率设置在60 Hz,高端截止频率设置在2 kHz),用PowerLab数据分析处理系统(8SP型, AD Instruments, Australia)记录RSNA,并对RSNA进行积分处理,同步记录原始RSNA和RSNA积分值。实验结束时切断肾神经中枢端以消除肾交感神经传出活动,记录噪音水平,RSNA积分值减去噪音积分值即为实际RSNA积分值。比较各种干预引起的RSNA变化的百分比值[10]。
静脉注射六烃季铵(30 mg/kg)引起短暂而强烈的降低血压效应,动脉血压降至60 mmHg以下低于压力感受器的阈值时,反射性的引起RSNA增强到最大值(RSNAmax),同时伴有动脉血压回升。记录注射六烃季铵之前的RSNA(RSNA before)以及注射六烃季铵后RSNAmax,计算基础RSNA。基础RSNA=(RSNA before/ RSNAmax)×100%[11]。同时,比较各组之间六烃季铵对MAP和RSNA的影响,其中降压持续时间为降压效应开始至MAP恢复到最大降压水平20%的时间。
1.3.4 PVN立体定位和微量注射
将大鼠头部固定于立体定位仪上,暴露前囟,根据Paxinos和Watson的大鼠立体定位图谱,行双侧PVN插管(AP:-1.8 mm,RL:0.4 mm,H:7.9 mm),插管外径0.6 mm, 内径0.3 mm。双侧PVN微量注射药液体积均为50 nL,于1 min内注射完毕。WKY和 SHR组各24只,分别随机分为两亚组每组12只。其中一亚组PVN微量注射Etanercept(n=6)或IL-1ra(n=6)预处理观察对静脉应用六烃季铵测定的基础交感水平的影响;另外一亚组PVN微量注射NMDAR拮抗剂APV(n=6)、MK-801(n=6)预处理观察对PVN 微量注射TNF-α、IL-1β引起的RSNA增强和MAP升高的影响。实验结束时双侧PVN分别注射50 nL的0.25%伊文思蓝溶液,过量麻醉处死大鼠,取脑,将其放入10%的福尔马林溶液中固定一周后,脑组织切片鉴定注射位点。注射位点不在PVN范围内的实验数据不予统计处理。
1.4 统计学方法
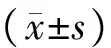
2 结果
2.1 PVN中 TNF-α、IL-1β和p55TNFR、p75TNFR、IL-1RI蛋白水平
与WKY组大鼠相比,SHR组大鼠PVN中TNF-α、IL-1β(图1)和p55TNFR、p75TNFR、IL-1RI蛋白水平(图2)均显著升高(P< 0.05)。
2.2 PVN 中PICs对SHR过度增强的交感神经活动的作用
各组大鼠静脉注射六烃季铵降低MAP并增强RSNA。WKY和SHR两组的组间降压幅度无显著差异的情况下(图3 A),SHR组降压持续时间延长, 而Etanercept或IL-1ra预处理的SHR组降压持续时间显著缩短(P< 0.05)(图3B)。如图3C所示,SHR组大鼠RSNA增强程度显著减弱,Etanercept或IL-1ra预处理显著阻止SHR的上述变化(P< 0.05)。以注射SNP后的最大RSNA变化百分比表示基础RSNA,与WKY组大鼠相比,SHR组基础RSNA显著增强(P< 0.05);而Etanercept或IL-1ra预处理显著阻止SHR的上述变化(P< 0.05)(图3D)。图3E,F代表性的原始记录图,记录曲线自上而下依次为动脉血压(ABP)、平均动脉压(MAP)、肾交感神经活动(RSNA)和积分处理的RSNA。

注:与WKY组相比,* P< 0.05。图1 PVN中TNF-α、IL-1β水平(n=6)Note.Compared with the WKY group,* P< 0.05.Fig.1 TNF-α and IL-1β levels in the paraventricular nucleus

注:与WKY组相比,* P< 0.05。图2 PVN 中p55TNFR、p75TNFR、IL-1RI蛋白水平(n=6)Note.Compared with the WKY group,* P< 0.05.Fig.2 p55TNFR, p75TNFR and IL-1RI protein levels in the paraventricular nucleus
2.3 PVN中NMDAR对TNF-α、IL-1β增强RSNA和升高MAP作用的影响
WKY和SHR组PVN微量注射TNF-α、IL-1β均显著增强RSNA(图4)和升高MAP(图5),SHR组的变化更显著(P< 0.05);PVN微量注射APV或MK-801阻断NMDAR在WKY和SHR均降低RSNA(图4)和MAP(图5),SHR组变化更显著(P< 0.05);另外,APV或MK-801预处理均减弱TNF-α或IL-1β增强WKY和SHR交感神经活动(图4)和升高血压(图5)的效应,在SHR组改效应更显著(P< 0.05)。

注:与WKY-Saline组相比,* P< 0.05;与WKY-Etanercept组相比,†P< 0.05;与WKY-IL-1ra组相比,P< 0.05。图3 抑制PVN中TNF-α、IL-1β对基础RSNA水平的影响(n=6)Note.Compared with WKY group,* P < 0.05. Compared with WKY-Etanercept group,†P<0.05. Compared with WKY-IL-1ra group,P < 0.05.Fig.3 Effects of inhibition of TNF-α or IL-1β in PVN on the basal RSNA levels
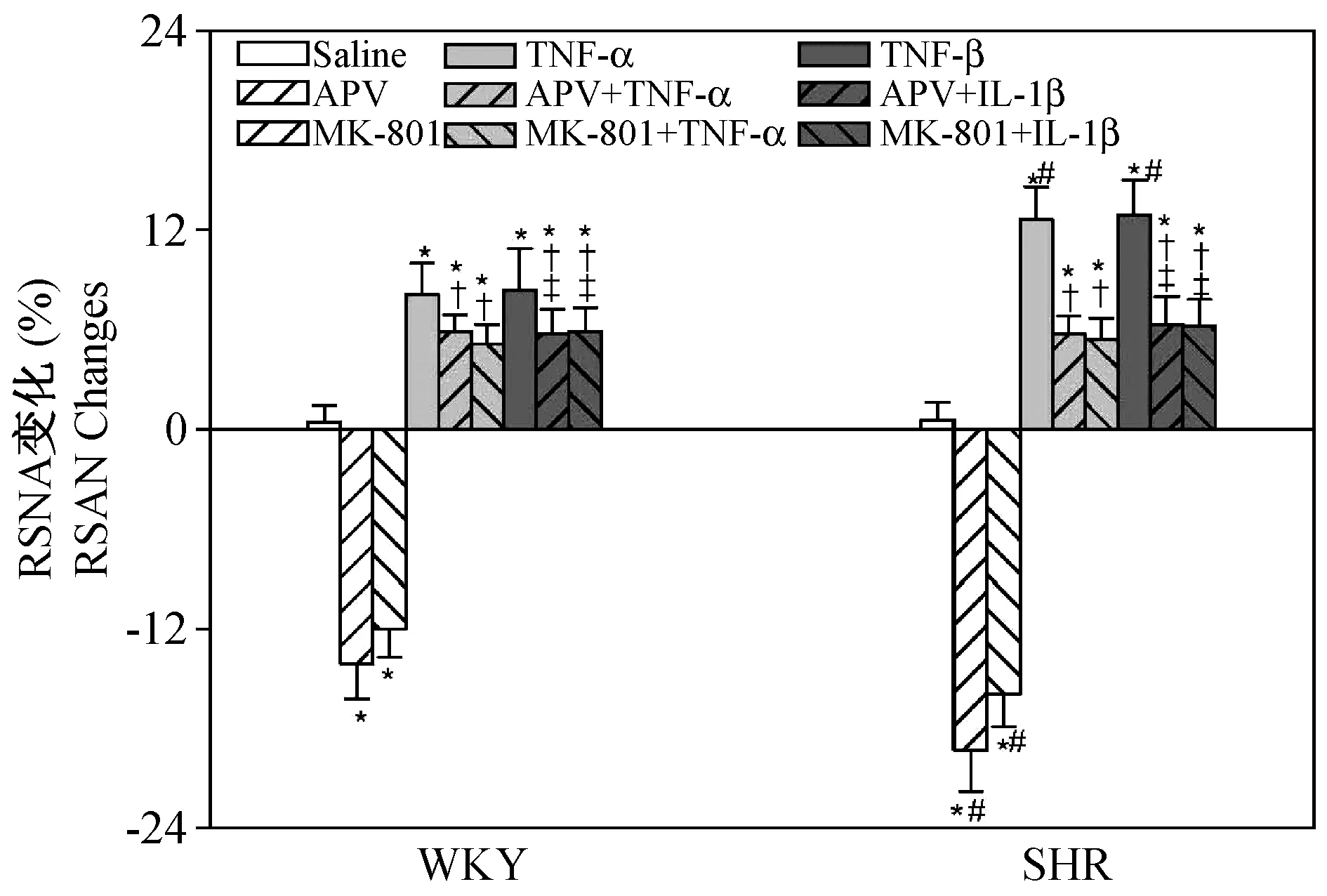
注:与Saline相比,* P< 0.05;与TNF-α相比,†P< 0.05;与IL-1β相比,P< 0.05。与WKY相同处理组相比,#P< 0.05。图4 PVN中NMDAR介导TNF-α、IL-1β 增强RSNA效应(n=6)Note.Compared with saline,* P< 0.05. Compared with TNF-α, †P< 0.05. Compared with IL-1β,P< 0.05. Compared with the same treatment group of WKY rats,#P< 0.05.Fig.4 PVN NMDA receptor mediated the effects of TNF-α and IL-1β on increasing RSNA

注:与Saline相比,* P< 0.05;与TNF-α相比,†P< 0.05;与IL-1β相比,P< 0.05。与WKY相同处理组相比,#P< 0.05。图5 PVN中NMDAR介导TNF-α、 IL-1β升高MAP效应(n=6)Note.Compared with saline,* P< 0.05. Compared with TNF-α,†P< 0.05. Compared with IL-1β,P< 0.05. Compared with the same treatment group of WKY rats,#P< 0.05.Fig.5 PVN NMDA receptor mediated the effects of TNF-α and IL-1β on increasing MAP
3 讨论
本研究发现SHR PVN 中PICs,包括TNF-α和IL-1β及其受体p55TNFR、p75TNFR、IL-1RI蛋白表达均显著升高。PVN 微量注射Etanercept或IL-1ra药物阻断TNF-α或IL-1β作用均能显著降低SHR的基础交感神经活动,且SHR PVN 应用NMDAR阻断剂APV或MK-801预处理均显著削弱PVN 微量注射TNF-α或IL-1β引起的RSNA增强和MAP升高效应。这些结果表明SHR PVN中促炎性细胞因子作用增强在过度增强的交感神经活动中起重要作用,并且PVN中NMDAR介导其增强交感神经活动和升高血压的效应。
国内外最新研究进展表明,交感神经系统活动过度激活在高血压发生发展和并发症形成中起了极其重要作用[1,2]。各种高血压的动物模型也均有显著的交感神经系统激活特征,包括自发性高血压大鼠(SHR)[9]、盐敏感性高血压大鼠[12]、等。本研究在SHR静脉注射神经节阻滞剂六烃季铵引起短暂而强烈的降低血压效应,动脉血压降至60 mmHg以下低于压力感受器的阈值时,会反射性的引起RSNA增强到最大值(RSNAmax),同时伴有动脉血压回升。SHR基础交感神经活动已经处于过度增强水平,因此可反射性调节的范围变小,因此SHR组观察到RSNA增强幅度较WKY组明显减小,记录注射SNP之前的RSNA(RSNA before)以及注射SNP后RSNAmax,则基础RSNA=(RSNA before/ RSNAmax)×100%[11],在SHR组显著较WKY组升高,且SHR组的动脉血压回升所需时间也明显延长。虽然已知交感神经活动主要受中枢神经系统调控,但高血压时交感神经活动增强的中枢机制尚不明确,是当前迫切需要解决的关键问题。
炎性机制在高血压和心血管疾病的发生、发展及转归中也扮演着极其重要的角色[13]。以往研究主要集中在外周炎性细胞因子在高血压等心血管疾病中的作用,而最近越来越多证据表明炎性细胞因子在中枢神经系统(CNS)也能够合成和分泌,且发挥重要作用[6,14,15]。外周血源性炎性细胞因子分子量较大,不易被动扩散透过血脑屏障进入CNS发挥作用。有研究发现,冠状动脉结扎诱导急性心肌梗死大鼠几分钟内即出现下丘脑TNF-α、IL-1β水平显著升高,并且该升高是独立于心肌组织和血浆PICs升高的,是源自神经信号机制[14]。
下丘脑室旁核(PVN)是心血管活动整合的重要中枢结构之一[3,4]。我们既往研究表明PVN中血管紧张素II[16]、活性氧[17]等多种神经递质或信号分子介导或调控高血压大鼠增强的心交感传入反射和交感传出活动,表明PVN是调控高血压交感神经活动亢进的关键核团,在高血压发生、发展中起重要作用。本研究检测SHR 中枢核团PVN 中的TNF-α和IL-1β水平,以及其发挥作用的主要受体p55TNFR、p75TNFR、IL-1RI,结果发现这些促炎性因素均显著增强。这与我们已往在SHR PVN中微量注射TNF-α或IL-1β能显著增强RSNA和升高MAP的研究结果相呼应[18]。并且本研究在SHR PVN微量注射Etanercept或IL-1ra预处理阻断TNF-α或IL-1β效应后,发现SHR静脉应用六烃季铵引起血压回升时间延长以及RSNA变化减少的效应均得到显著改善,这表明抑制PVN 中PICs能显著减弱SHR增强的交感神经活动。
然而,高血压中枢显著增加的PICs在高血压发病机制中的作用研究尚不明确。谷氨酸作为一种主要的兴奋性神经递质在中枢神经系统(包括PVN)发挥调控交感神经活动的作用[9]。PVN存在大量的谷氨酸免疫活性突触和NMDAR[19,20]。大鼠PVN中微量注射谷氨酸或NMDA均引起显著的交感神经活动增强和血浆去甲肾上腺素水平升高[7,8]。本研究两组大鼠PVN微量注射两种NMDAR拮抗剂APV和MK-801 RSNA 和MAP均显著降低。并且PVN应用APV或MK-801预处理亦显著削弱PVN 微量注射TNF-α或IL-1β引起的RSNA增强和MAP 升高效应。以上研究表明PVN中NMDAR在PICs促进高血压交感神经活动增强中起重要作用。
对于高血压的研究大多集中外周心脏和血管的病理改变在高血压病发生、发展中的作用方面[21,22],但仍存在诸多问题,其发病机制至今不是十分清楚。本研究从神经调控角度研究高血压发病机制,初步观察到中枢炎症机制参与交感神经过度增强促进高血压发生、发展。SHR PVN中的PICs,包括TNF-α、IL-1β及其受体均表达增加并促进SHR基础交感神经活动的增强;PVN中NMDAR介导SHR PVN 中TNF-α、IL-1β促进交感活动增强和血压升高的效应。
[1] Di RD, Musiari G, Grova M, et al. The “neurocentric” approach to essential hypertension: how reliable is the paradigm of hyperkinetic hypertension? A focus on the sympathetic nervous system dysregulation in essential hypertensive patients with elevated resting heart rate [J]. Curr Pharm Des, 2017. doi: 10.2174/1381612823666170911102711.
[2] Hogarth AJ, Mackintosh AF, Mary DA. The sympathetic drive after acute myocardial infarction in hypertensive patients [J]. Am J Hypertens, 2006, 19(10): 1070-1076.
[3] Badoer E. Hypothalamic paraventricular nucleus and cardiovascular regulation [J]. Clin Exp Pharmacol Physiol, 2001, 28(1-2): 95-99.
[5] Guggilam A, Patel KP, Haque M, et al. Cytokine blockade attenuates sympathoexcitation in heart failure: cross-talk between nNOS, AT-1R and cytokines in the hypothalamic paraventricular nucleus [J]. Eur J Heart Fail, 2008, 10(7): 625-634.
[6] Francis J, Zhang ZH, Weiss RM, et al. Neural regulation of the proinflammatory cytokine response to acute myocardial infarction [J]. Am J Physiol Heart Circ Physiol, 2004, 287(2): H791-H797.
[7] Kannan H, Hayashida Y, Yamashita H. Increase in sympathetic outflow by paraventricular nucleus stimulation in awake rats [J]. Am J Physiol, 1989, 256(6 Pt 2): R1325-R1330.
[8] Katafuchi T, Oomura Y, Kurosawa M. Effects of chemical stimulation of paraventricular nucleus on adrenal and renal nerve activity in rats [J]. Neurosci Lett, 1988, 86(2):195-200.
[9] Li DP, Pan HL. Glutamatergic inputs in the hypothalamic paraventricular nucleus maintain sympathetic vasomotor tone in hypertension [J]. Hypertension, 2007, 49(4): 916-925.
[10] Han Y, Zhang Y, Wang HJ, et al. Reactive oxygen species in paraventricular nucleus modulates cardiac sympathetic afferent reflex in rats [J]. Brain Res. 2005, 1058: 82-90.
[11] Liu JL, Irvine S, Reid IA, et al. Chronic exercise reduces sympathetic nerve activity in rabbits with pacing-induced heart failure: A role for angiotensin II [J]. Circulation. 2000, 102: 1854-1862.
[12] Fujita M, Ando K, Nagae A, et al. Sympathoexcitation by oxidative stress in the brain mediates arterial pressure elevation in salt-sensitive hypertension [J]. Hypertension, 2007, 50(2): 360-367.
[13] 毛红亚,刘云鹏, 王子皓, 等. 血小板通过炎症反应在盐敏感性高血压中的作用机制研究 [J]. 中国比较医学杂志, 2017, 27(5): 23-30.
[14] Buchanan JB, Johnson RW. Regulation of food intake by inflammatory cytokines in the brain [J]. Neuroendocrinology, 2007, 86(3): 183-190.
[15] Kang YM, Zhang ZH, Xue B, et al. Brain pro-inflammatory cytokines contribute to sympathetic drive in heart failure [J]. Faseb J, 2007, 21(6): A1266.
[16] Zhu GQ, Xu Y, Zhou LM, et al. Enhanced cardiac sympathetic afferent reflex involved in sympathetic overactivity in renovascular hypertensive rats [J]. Exp Physiol, 2009, 94(7): 785-794.
[17] Han Y, Fan ZD, Yuan N, et al. Superoxide anions in paraventricular nucleus mediate the enhanced cardiac sympathetic afferent reflex and sympathetic activity in renovascular hypertensive rats [J]. J Appl Physiol, 2011, 110(3): 646-652.
[18] Shi Z, Jiang SJ, Wang GH, et al. Pro-inflammatory cytokines in paraventricular nucleus mediate the cardiac sympathetic afferent reflex in hypertension [J]. Auton Neurosci, 2014, 186: 54-61.
[19] Khan AM, Stanley BG, Bozzetti L, et al. N-methyl-D-aspartate receptor subunit NR2B is widely expressed throughout the rat diencephalon: an immunohistochemical study [J]. J Comp Neurol, 2000, 428(3): 428-449.
[20] Herman JP, Eyigor O, Ziegler DR, et al. Expression of ionotropic glutamate receptor subunit mRNAs in the hypothalamic paraventricular nucleus of the rat [J]. J Comp Neurol, 2000, 422(3): 352-362.
[21] 郑婧. 自发性高血压大鼠心肌组织microRNA-97a与TGF-β1蛋白表达的改变及意义 [J]. 中国比较医学杂志, 2016, 26(11): 72-76.
[22] 侯永兰, 李石林, 刘玲玲. MicroRNA-137与Ang II在自发性高血压大鼠心脏重构中的作用 [J]. 中国比较医学杂志, 2016, 26(7): 52-56.
NMDARinparaventricularnucleusmediatesenhancedsympatheticactivitiescausedbypro-inflammatorycytokinesinspontaneouslyhypertensiverats
LU Peng1, PAN Hong2, MA Chun-lei2,3, SHI Zhen2*
(1.Yantai Affiliated Hospital of Binzhou Medical University, Yantai 264100, China; 2.Department of Physiology, Binzhou Medical University, Yantai 64003; 3.Shandong Province Key Laboratory of Stroke, Yantai 264003)
ObjectiveTo investigate whether pro-inflammatory cytokines (PICs) in the paraventricular nucleus (PVN) regulate the enhanced sympathetic activities in spontaneously hypertensive rats (SHR), and whether N-methyl-D-aspartate receptor (NMDAR) in PVN mediate the effects of PICs on sympathetic activities.MethodsSHR and normotensive wistar-Kyoto(WKY)rats were used in this experiment. TNF receptor and IL-1β receptor (IL-1RI) protein levels were measured by Western blot. PICs, including TNF-α and IL-1β levels were measured by ELISA. Rats were placed in a stereotaxic instrument to complete the microinjection of drugs. The coordinates for the PVN were determined according to the Paxinos and Watson rat atlas. The raw RSNA and integrated RSNA were simultaneously recorded on a PowerLab data acquisition system. The right carotid artery was cannulated for recording of mean arterial pressure (MAP).ResultsTNF-α receptor p55TNFR, p75TNFR and IL-1β receptor IL-1RI protein expression and TNF-α and IL-1β levels in PVN were all increased in SHR compared with WKY rats (P< 0.05). Bilateral microinjection of etanercept or IL-1ra into PVN to block the effects of TNF-α or IL-1β decreased the sympathetic activities in SHR rats significantly (P< 0.05). Bilateral microinjection of NMDAR blockers, both DL-2amino-5-phosphonovaleri acid (APV) and MK-801 (Dizocilpine) into PVN decreased the RSNA and MAP in both SHR and WKY rats. APV or MK 801 caused greater decreases in RSNA and MAP in SHR than WKY rats. In addition, pretreatment with APV or MK 801 attenuated the increased RSNA and MAP caused by microinjection of TNF-α or IL-1β into PVN to a lower level in SHR than in WKY rats (P< 0.05).ConclusionsTNF and IL-1β receptor protein as well as TNF-α and IL-1β cytokines levels in PVN are all increased in SHR rats. NMDAR in PVN mediates enhanced sympathetic activities and elevated blood pressure caused by TNF-α and IL-1β in SHR.
Spontaneously hypertensive rats; NMDA receptor; Sympathetic activities; Pro-inflammatory cytokines;Paraventricular nucleus
山东省医药卫生科技发展计划项目(2016WS0051);山东省自然科学基金(BS2015YY036)。
逯鹏(1981-),男,硕士,研究方向:心血管活动的神经调控。E-mail: bylupeng@163.com
施真(1981-),女,博士,副教授,硕士研究生导师,研究方向:心血管活动的神经调控。E-mail: zhen_shizhen@163.com
R-33
A
1671-7856(2017) 12-0021-07
10.3969.j.issn.1671-7856. 2017.12.004
2017-09-18

