超抗原葡萄球菌肠毒素B诱导IgA 肾病小鼠模型的建立
史丽强,万 强,吴燕升,刘伟伟,高建东
(上海中医药大学附属曙光医院肾病科,上海中医药大学中医肾病研究所,肝肾疾病病证教育部重点实验室, 上海市中医临床重点实验室,上海 201203)
超抗原葡萄球菌肠毒素B诱导IgA 肾病小鼠模型的建立
史丽强,万 强,吴燕升,刘伟伟,高建东
(上海中医药大学附属曙光医院肾病科,上海中医药大学中医肾病研究所,肝肾疾病病证教育部重点实验室, 上海市中医临床重点实验室,上海 201203)
研究报告
目的建立IgA肾病小鼠模型,并观察模型的生化及病理指标特点。方法12只BALB/c小鼠随机分为正常组(6只)和模型组(6只),模型组单次尾静脉注射葡萄球菌肠毒素B(SEB) 0.8 mg/kg,第二周开始,连续注射三周,第四周结束后检测小鼠24 h尿蛋白定量,尿微量白蛋白,肾功能BUN、Scr、UA;蛋白指标TP、ALB;肝功能ALT、AST、ALP;血脂TC、TG、LDL的情况,肾脏免疫荧光IgA的沉积,肾脏病理HE、PAS、PASM、Masson染色以及透射电镜的观察肾脏超微结构,以及肝脏与小肠HE染色、免疫荧光IgA的沉积变化。结果与正常组比较,模型组小鼠24 h尿蛋白定量与尿微量白蛋白均升高(P< 0.01);模型组小鼠肾功能指标CREA,UA均高于正常组(P< 0.05),BUN差异无显著性;模型组小鼠蛋白指标TP、ALB差异无显著性;模型组小鼠肝功能指标AST水平高于正常组(P< 0.05),ALT、ALP差异无显著性;模型组小鼠血脂TG水平低于正常组(P< 0.05),LDL水平高于正常组(P< 0.01),TC差异无显著性。肾脏免疫荧光检查可见模型组小鼠肾小球系膜区呈颗粒状、团块状的IgA沉积;模型组小鼠肾脏病理轻中度损伤,系膜区免疫复合物增多;模型组小鼠肝脏HE染色可见少量炎性细胞浸润伴有部分肝细胞坏死,小肠绒毛缺损,肠绒毛变短变细、间距明显增宽,有部分分上皮脱落,中央央乳糜管扩张显著,淋巴细胞增多,明显可见炎性细胞浸润。结论使用超抗原SEB尾静脉注射小鼠可以成功复制IgA肾病动物模型。
IgA肾病;动物模型;SEB;小鼠
IgA肾病 (IgA nephropathy, IgAN) 是目前全球最常见的原发性肾小球疾病之一。是导致终末期肾功能衰竭的一个很重要的原因。在国内,IgA肾病占原发性肾小球疾病的35%~55%,IgA肾病多呈慢性进行性发展,进入终末期肾病的患者,每10年大约有5%~25%[1]。因此采用合适的动物模型来研究其发病机制与疾病的特点是很有必要的。本文主要介绍复制葡萄球菌肠毒素B诱导的IgA肾病动物小鼠模型,该模型最早为刘志红[2]院士在1989年报道,主要采用大鼠进行制作。目前尚未看到有报道采用此方法在小鼠身上复制的报道,因此本研究在BALB/c小鼠上复制此种动物模型。
1 材料和方法
1.1 实验动物
SPF级别BALB/c雄性小鼠12只,体重16~18 g,6周龄,由上海西普尔-必凯实验动物有限公司提供[SCXK(沪):2013-0016],饲养在上海中医药大学科技实验中心/医学实验动物中心[SYXK(沪):2014-0008],自由饮食进水,动物伦理登记编号:SZY201607002。
1.2 主要试剂与仪器
葡萄球菌肠毒素B (staphylococcal enterotoxin B,SEB)(北京军事医学科学院);Goat anti-Mouse IgA Secondary Antibody [FITC](Novus Biologicals,货号:NB7503);2%戊巴比妥钠(德国Merck,批号:20140820);一次性使用无菌注射针(上海康得莱集团,0.3×13RWLB);小鼠固定器(北京冀诺泰科技发展有限公司,货号:JNT-CXQ);切片石蜡(国药集团化学试剂有限公司,货号:69019361);二甲苯(江苏彤晟化学试剂有限公司,货号:1330-20-7);无水乙醇(江苏彤晟化学试剂有限公司,货号:64-17-5);苏木素-伊红染液(赛维尔生物科技有限公司货号:G1005);PAS染色试剂盒(赛维尔生物科技有限公司货号:G1008);六铵银染液试剂盒(赛维尔生物科技有限公司货号:G1059);Masson染色试剂盒(赛维尔生物科技有限公司货号:G1006);粘附载玻片(江苏世泰实验器材有限公司,货号:188105);甘油明胶封片剂(赛维尔生物科技有限公司货号:G1402);甲醛溶液(国药集团化学试剂有限公司,货号:10010018)。
自动组织脱水机(浙江省金华市科迪仪器设备有限公司,KD-TS3A);生物组织冷冻包埋机(浙江省金华市科迪仪器设备有限公司,KD-BM);摊片机(浙江省金华市科迪仪器设备有限公司,KD-P);烘片机(浙江省金华市科迪仪器设备有限公司,KD-H);低温冷冻切片机(德国Leica,CM3050S);荧光光学显微镜(尼康,Nikon Eclips E80i);全自动生化分析仪美国(Beckman Coulter, Inc, AV5800)。
1.3 实验方法
1.3.1 造模方法
动物适应性喂养一周后按体重分为两组,A为正常组,B为模型组。模型组第二周开始注射SEB,SEB使用无菌PBS稀释,剂量为0.8 mg/kg,每只小鼠尾静脉注射0.2 mL,每周一次,连续三周;第四周结束后留取尿液;小鼠处死前禁食12 h, 2%戊巴比妥钠50 mg/kg腹腔注射麻醉小鼠后摘眼球处死取血清做肾功能、、蛋白、血脂的检测;取小鼠肾脏、肝脏及小肠做免疫荧光和病理染色检测。
1.3.2 肾脏透射电镜标本的留取
取材全程在冰块上低温进行,左肾下部分用锋利剪刀剪下一小块组织,迅速放到滴有预冷固定液的硬纸片或蜡片上,在固定液中用刀片弃去剪过的切面,把组织切成薄片,再改切成体积约1×1×1 mm 5小块(用牙签将5~6小块组织转移至含有2~3 mL预冷固定液的干净青霉素小瓶内,瓶上应贴上标签,用铅笔书写),实验结束后标本立即送上海中医药大学电镜室检测。
1.3.3 小鼠生化指标的检测
小鼠血尿指标的检测由上海中医药大学附属曙光医院检验科使用全自动生化仪检测。
1.3.4 石蜡切片的制作
取材:新鲜组织放置于10倍体积的4%多聚甲醛内一天左右。在通风橱内将组织从固定液取出用刀片将小鼠肾脏组织修平整,将修好的组织放置于包埋框内,用铅笔做好标记。
脱水:将包埋框整齐的放进自动脱水机的吊篮里,核对程序的顺序与时间,点击编好的程序,梯度酒精进行脱水。(75%酒精4 h,85%酒精2 h,90%酒精2 h,95%酒精1 h,无水乙醇I 30 min,无水乙醇II 30 min,醇苯5~10 min,二甲苯I 5~10 min,二甲苯II 5~10 min,蜡I 1 h,蜡II 1 h,蜡III 1 h。)
包埋:将脱好水的组织放置于于生物组织包埋机内进行包埋。
切片:将修整好的蜡块置于轮转切片机上切片,切片厚度为3 μm。 用毛笔刷将切片漂浮于摊片机37℃ 温水中将组织展平,用防脱载玻片将组织捞起,并平放于KD-H烤片机上烤片2 h左右。待切片蜡烤化后,常温保存备用。
1.3.5 病理染色
肾脏病理做HE、PAS、PASM、Masson染色,肝脏与小肠HE染色步骤均按照赛维尔生物科技有限公司染色试剂说明书制作。
1.3.6 冰冻切片免疫荧光直接法染色
冰冻切片固定:冰冻切片从冰箱拿出来复温半个小时,使用预冷的丙酮固定10 min,用pH 7.4的PBS轻柔的洗涤3次,每次5 min。
加荧光标记的一抗:在切片上滴加稀释好的荧光一抗,切片平放于加水的湿盒内4℃避光孵育过夜。
封片:玻片使用pH 7.4的PBS轻柔的洗涤3次,每次5 min。切片稍甩干然后迅速用预热好的明胶抗荧光淬灭封片剂避光封片。
镜检拍照:切片在黑暗房间内使用尼康倒置荧光显微镜观察并拍取合适像素的照片放置于专门的文件夹内做好标记。(FITC绿光激发波长465~495 nm,发射波长515~555 nm)
1.4 统计学方法
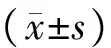
2 结果
2.1 一般情况
实验结束时,模型组小鼠造模后小鼠精神萎靡不振,倦卧聚集于一起,毛色晦暗,饮食减少;正常小鼠活泼易动,毛色纯白有光泽,饮食如常。
2.2 生化指标
与正常组比较,模型组小鼠24小时蛋白定量升高(P< 0.01),尿白蛋白高于正常组(P< 0.01)(见表1);与正常组比较,模型组小鼠Scr,UA均高于正常组(P< 0.05),BUN无统计学差异(见表2);与正常组比较,模型组小鼠TP,ALB差异无显著性;与正常组比较,模型组小鼠AST水平高于正常组(P< 0.05),ALT、ALP差异无显著性;与正常组比较,模型组小鼠TG低于正常组(P< 0.05),与正常组比较,模型组小鼠LDL高于正常组(P< 0.01),与正常组比较TC差异无显著性。
2.3 小鼠肾脏病理
2.3.1 小鼠肾脏免疫荧光
通过免疫荧光直接法免疫荧光间接法检测小鼠肾组织冰冻切片IgA在肾小球的沉积,免疫荧光间接法检测小鼠肾组织石蜡切片IgA在肾小球的沉积,两种染色方法均看到模型组小鼠肾小球系膜区呈颗粒状、团块状IgA沉积,正常组未见IgA免疫复合物沉积。(见图1)
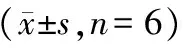
表1 小鼠尿蛋白的比较Tab.1 Comparison of the mouse urine proteins
注:与正常组比较,#P< 0.01。
Note.Compared with the control group,#P< 0.01.
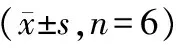
表2 小鼠肾功能的比较Tab.2 Comparison of the mouse renal function
注:与正常组比较,*P< 0.05。
Note.Compared with the control group,*P< 0.05.

表3 小鼠血清蛋白的比较Tab.3 Comparison of the mouse serum proteins
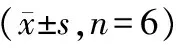
表4 小鼠肝功能的比较Tab.4 Comparison of the mouse liver functions
注:与正常组比较,*P< 0.05。
Note.Compared with the control group,*P< 0.05.

表5 小鼠血脂的比较Tab.5 Comparison of the mouse blood lipid
注:与正常组比较,*P< 0.05,#P< 0.01。
Note.Compared with the control group,*P< 0.05,#P< 0.01.

图1 小鼠肾脏免疫荧光Fig.1 Immunofluorescence in the mouse kidney tissues
2.3.2 小鼠肾脏病理染色
正常对照组小鼠肾脏形态结构未见异常,模型组小鼠肾组织可以看到肾小球毛细血管襻的扩张以及毛细血管腔有部分闭锁,系膜区系膜细胞及基质明显增生,Masson染色可见系膜区有嗜红物沉积说明系膜区免疫复合物增多,部分小管可以看到扩张,部分伴间质小管病变及小血管病变。(见图2)

图2 小鼠肾脏病理染色Fig.2 Pathological changes of the mouse kidney tissues with different staining.
2.3.3 肾脏超微结构
正常组肾脏结构未见异常,模型组可见到系膜区系膜细胞与基质轻度增生,系膜少量细颗粒状电子致密物的沉积,足突有间断融合,箭头所指为凋亡的系膜细胞。(见图3)

注:右图黑色箭头示为凋亡的系膜细胞。图3 肾脏透射电镜结果(×6000)Note.The black arrow on the right picture indicates an apoptotic mesangial cell.Fig.3 Ultrastructural changes of the kidney tissues
2.4 小鼠肝脏与小肠的病理及免疫荧光
光镜下正常对照组小鼠肝脏结构完整,肝内内细胞形态正常,未看到炎性细胞浸润;模型组小鼠肝脏HE染色可见少量炎性细胞浸润甚至肝细胞坏死,见轻度肝细胞脂肪变性,管区可见少量纤维增生,光镜下正常对照组大鼠小肠肠绒毛形态正常、未见缺损,上皮细胞排列整齐,见明显炎性细胞浸润,模型组小鼠小肠绒毛不完整,肠绒毛变短变细、间距明显增宽,有部分分上皮脱落,中央央乳糜管扩张显著,淋巴细胞增多,明显可见炎性细胞浸润。正常组肝脏与小肠免疫荧光可见微量IgA沉积,模型组小鼠肝脏免疫荧光可见大量颗粒状IgA沉积,主要沉积在汇管及血窦区,模型组小鼠小肠IgA沉积较正常组明显。(见图4)
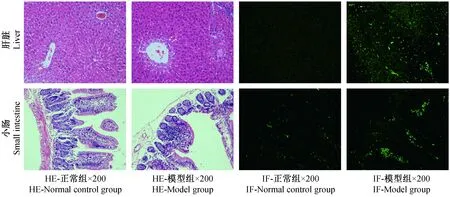
图4 肝脏与小肠病理及免疫荧光染色Fig.4 Pathological changes of the mouse liver and small intestine tissues. immunofluorescence staining.
3 讨论
目前诊断IgA肾病,只能通过肾活检来确诊[3],肾脏免疫荧光诊断为金标准,IgAN的特征是以IgA为主的免疫球蛋白分子在肾小球系膜区沉积。我们采用冰冻与石蜡切片两种方法做免疫荧光证实使用SEB诱导的造模可以在小鼠上成功复制IgA肾病模型,这种模型的特点是成功率高,周期短,模型较为稳定,不失为一种较为理想的IgA肾病模型,其发病机制可能是由于超抗原导致高水平细胞因子和IgG和IgA的多克隆活化引起[4],超级抗原(SAgs)是一类导致非特异性免疫的蛋白质;1989年, Choi等[5]首次提出超抗原的概念,并且提出丝裂原是通过大量激活具有相同的T细胞受体复合物(TCR)的β链V区结构域的T淋巴细胞来发挥作用。1989年,瑞典科学家White等[6]指出,SE与MHCⅡ类分子结合后,并不能激活所有的T细胞,只有那些受体上有Vβ成分的T细胞才能被激活,SE对T细胞的激活能力是普通抗原的2000~50 000倍,细菌、病毒、寄生虫等均可能产生这类特殊的蛋白质。
有研究发现超抗原性对内皮细胞的直接毒性作用,将会导致于内皮细胞愈合延迟[7]。SEB可以增加炎症细胞因子的产生,导致细胞和组织炎症细胞浸润、坏死,而肾脏本身作为排毒器官器官,所以毒素会导致肾功能损伤,可能也是导致IgA在肾脏沉积的原因之一。但这种损害对小鼠来说并不是致命性的,Krakauer[8]做了暴露于不同剂量葡萄球菌肠毒素B(SEB)或脂多糖(LPS)及其组合的小鼠的细胞因子反应和致死率发现,使用高剂量的SEB(100微克/小鼠),所有小鼠都存活。SEB单独诱导中等水平的IL-2和MCP-1;LPS(80微克/小鼠)造成48%的致死率并诱导高水平的IL-6和MCP-1。我们实验做的结果于文献报道一致,实验结束后小鼠未发现有死亡。
而SEB作为超级抗原,在尾静脉注射后会损伤小肠毛细血管内皮,破环肠道的屏障,我们在小肠的病理HE染色中也看到模型组小鼠肠绒毛形态的异常,肠绒毛变短变细、间距明显增宽,有部分分上皮脱落,中央央乳糜管扩张显著,淋巴细胞增多,明显可见炎性细胞浸润。在实验中我们发现肝脏小泡性(脂肪变性)形式主要见于小叶中央区,小泡性脂肪变性由线粒体功能受损导致,线粒体功能障碍通常由一种遗传性代谢错误或一种药物或毒素的作用所致,在这种情况下,脂肪酸β氧化减少导致三酰甘油(triacylglycerol)和游离脂肪酸的蓄积。肝脏内的所产生的抗体主要以IgA为主,肝内的树突状细胞表面MHC-Ⅱ类分子表达比枯否细胞的表达更强。其主要分布在小鼠与肝脏的门静脉周围,肝小叶实质内,近年来有研究表明肝脏实质细胞表达的具有活性的细胞表面分子,MHC-Ⅱ类HLA-DR 抗原、CD44抗原、CDW60抗原等会启动或调节多种免疫反应。肝实质细胞的免疫调节是在T细胞释放的细胞因子控制下完成的,因此当超抗原SEB进入体内后会激活肝脏表达MHC-Ⅱ类的细胞释放前炎症细胞因子如TNF-a、IL-1、IFN-γ等引起肝脏的损伤,有研究证实在门静脉区以辅助性T细胞为主,这也可以解释模型组肝脏病变主要集中在门静脉周围。
采用SEB尾静脉注射的造模方法成模时间短,成本低,重复性较好,不仅如此,它在发病机制上与人类IgA肾病粘膜免疫发病的途径类似,能够更好的对于IgA肾病的发病机制进行研究,不失为一种方便廉价的研究IgA肾病的动物模型。
[1] D’Amico G. Natural history of idiopathic IgA nephropathy: role of clinical and histological prognostic factors [J].Am J Kidney Dis, 2000, 36(2): 227-237.
[2] 刘志红, 黎磊石. 葡萄球菌肠毒素诱发的 IgA 肾病模型 [J]. 中华肾脏病杂志, 1989, 5(1): 6-10.
[3] Gharavi AG, Yan Y, Scolari F, et al. Nephropathy, the most common cause of glomerulonephritis, is linked to 6q22-23 [J]. Nat Genet, 2000, 26(3): 354-357.
[4] Koyama A, Kobayashi M, Yamaguchi N, et al. Glomerulonephritis associated with MRSA infection: a possible role of bacterial superantigen [J]. Kidney Int, 1995, 47(1): 207-216.
[5] Choi YW, Kotzin B, Herron L, et al. Interaction of Staphylococcus aureus toxin “superantigens” with human T cells [J]. Proc Natl Acad Sci U S A, 1989, 86(22): 8941-8945.
[6] White J, Herman A, Pullen AM, et al. The Vβ-specific superantigen staphylococcal enterotoxin B: stimulation of mature T cells and clonal deletion in neonatal mice [J]. Cell, 1989, 56(1): 27-35.
[7] Salgado-Pabón W, Breshears L, Spaulding AR, et al. Superantigens are critical for Staphylococcus aureus infective endocarditis, sepsis, and acute kidney injury [J]. MBio, 2013, 4(4): e00494-13.
[8] Krakauer T, Buckley MJ, Fisher D. Proinflammatory mediators of toxic shock and their correlation to lethality [J]. Mediators Inflamm, 2010, 2010: 517594.
EstablishmentofamousemodelofIgAnephropathyinducedbysuperantigenstaphylococcalenterotoxinB
SHI Li-qiang, WAN Qiang, WU Yan-sheng, LIU Wei-wei, GAO Jian-dong*
(Department of Nephrology, Shuguang Hospital, Shanghai University of Traditional Chinese Medicine; TCM Institute of Kidney Diseases, Shanghai University of Traditional Chinese Medicine; Key Laboratory of Liver and Kidney Diseases, Shanghai University of Traditional Chinese Medicine; Ministry of Education, Shanghai Key Laboratory of Traditional Chinese Clinical Medicine, Shanghai 201203, China)
ObjectiveTo establish a mouse model of IgA nephropathy and to observe its biochemical and pathological characteristics.MethodsTwelve BALB/c mice were randomly divided into the normal group and model group, with 6 mice in each group. Mice in the model group
an intravenous injection of 0.8 mg/kg superantigen staphylococcal enterotoxin B (SEB) into the tail vein once a week for three weeks. At the end of the 4th week, the mice were sacrificed, and the 24 h-urinary protein, urinary microalbumin, the renal function indicators BUN, Scr and UA were measured, levels of liver function indicators ALT, AST, ALP, and the blood lipid levels of TC, TG, and LDL were determined, the renal morphological changes were examined by pathology using HE, PAS, PASM and Masson staining, and by electron microscopy, the IgA deposition in the renal tissue was observed with immunofluorescence, and the liver and small intestine were observed by pathology using HE staining.ResultsCompared with the normal group, the mice of model group showed increased 24-hour urinary protein and urinary microalbumin (P<0.01), increased CREA and UA (P<0.05), but not significantly changed BUN, TP and ALB. The liver function indicator AST was significantly increased (P<0.05), but ALT and ALP were not significantly changed. The blood lipid TG was significantly decreased (P<0.05) and LDL increased (P<0.01), while the TC was not significantly changed. The kidney tissues had moderate histological changes, and immunofluorescence observation showed granular or massive IgA deposition in the renal glomerular mesangium. The liver tissue had some inflammatory cell infiltration and hepatocyte necrosis. The small intestine showed slender and shortened villi with widened inter-villous space and sloughed off epithelial cells, dilated central lacteal, and lymphocyte infiltration.ConclusionsA mouse model of IgA nephropathy can be successfully established by tail vein injection of superantigen staphylococcal entrotoxin B.
IgA nephropathy; Animal model; Staphylococcal enterotoxin B, SEB; Mice
上海市中医药事业发展三年行动计划项目(ZYSNXD-CC-YJXYY);上海市中医药事业发展三年行动计划项目(ZYSNXD-CC-MZY044)。
史丽强(1990-)男,硕士研究生,研究方向:肾脏疾病。E-mail: shiliqiang16@live.com
高建东(1967-)男,医学博士,主任医师,研究方向:中医药防治慢性肾脏病。E-mail: gaojiandong@hotmail.com
R-33
A
1671-7856(2017) 12-0102-07
10.3969.j.issn.1671-7856. 2017.12.018
2017-05-19

