细菌性腹水266例腹水菌种构成及其耐药性分析
周 清,朱 坚
细菌性腹水266例腹水菌种构成及其耐药性分析
周 清,朱 坚
细菌性腹水;抗菌药物;耐药性
细菌性腹水是腹腔感染的临床表现之一,主要发生在肝硬化腹水患者、腹部外科手术后及腹腔透析患者等。随着抗生素的过度使用,细菌的耐药机制日渐复杂[1],给临床抗感染药物的选择带来了一定的困难。笔者通过分析266株致病菌的种类及耐药情况,为临床抗生素使用提供参考依据。
1 对象与方法
1.1 对象 选取2012-05至2016-03在我院进行细菌性腹水治疗的266例为研究对象,男169例,女92例,年龄34~72岁,平均(53.26±5.12)岁。
1.2 方法 临床医师无菌条件下行腹腔穿刺术,抽取患者腹水10 ml至血培养瓶中,及时送检。将所有患者的腹水样本使用美国BD公司Phoenix 100型全自动微生物鉴定仪进行鉴定,药敏试验采用法国梅里埃生物公司药敏试剂,严格按照操作规程进行药敏分析。
1.3 结果
1.3.1 病原菌检测情况 266例中共检测出致病菌266株,病原菌中革兰阴性菌166株(62.4%),以大肠埃希菌(72株,占27.1%)和肺炎克雷伯菌(36株,占13.5%)为主。革兰阳性菌78株(29.3%),以凝固酶阴性葡萄球菌(26株,占9.8%)和肠球菌(26株,占9.8%)为主。真菌22株(8.3%)。菌种构成比与国内其他相关报导一致[2-4](表1)。
1.3.2 病原菌的耐药性分析 通过细菌的耐药性分析,革兰阴性杆菌对氨苄西林的耐药性最高,对哌拉西林/他唑巴坦、亚氨培南、阿米卡星的耐药率低,其中亚氨培南的敏感性最高,第3代头孢菌素的耐药率高于第4代头孢菌素(表2);革兰阳性菌对利奈唑胺、万古霉素高度敏感(耐药率为0),肠球菌耐药率比凝固酶阴性葡萄球菌高(表3)。
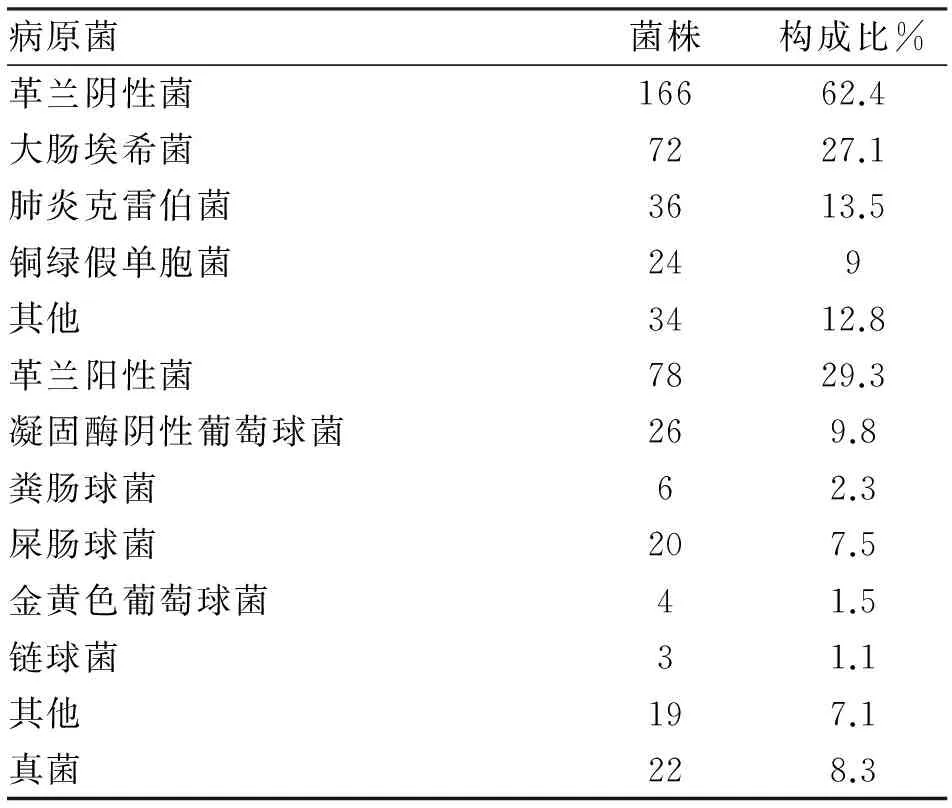
表1 2012-2016年住本院266例腹水培养病原菌分布及构成比
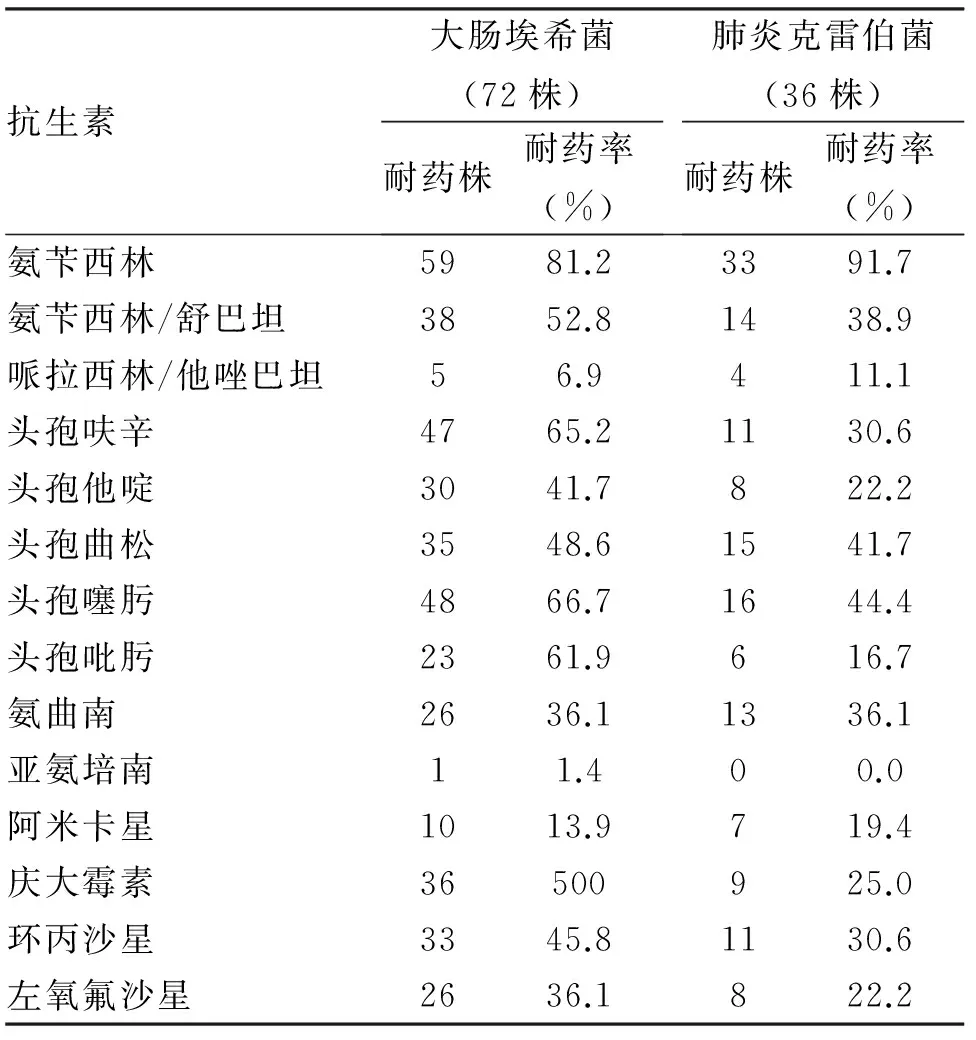
表2 2012-2016年住本院266例革兰阴性菌耐药率比较
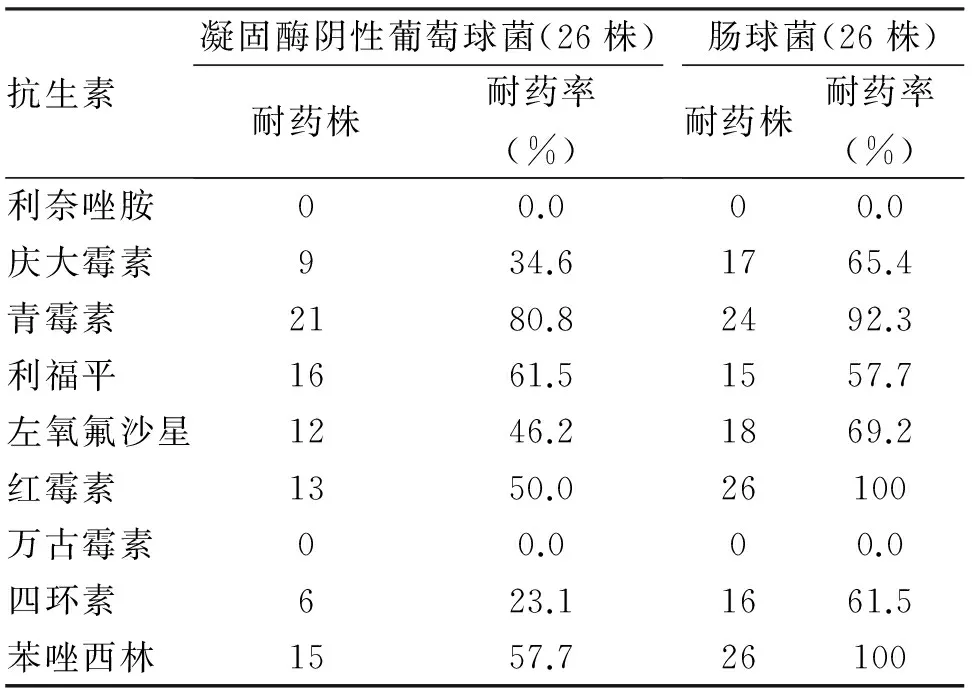
表3 2012-2016年住本院266例革兰阳性菌耐药性比较
3 讨 论
腹腔感染常发生于肝硬化腹水患者、外科手术后及腹膜透析患者,其病原菌的分布和对抗菌药物的敏感性对于临床医生治疗时抗菌药物的选择有重要价值。自发性细菌性腹水较多见于肝硬化失代偿期及肝衰竭患者,是终末期肝病患者重要的死亡原因之一。目前认为导致自发性细菌性腹水的原因是肝硬化患者肠壁淤血水肿,肠黏膜屏障作用削弱、肠道菌群紊乱、吞噬细胞与白细胞吞噬作用下降、腹腔积液中抗菌物质缺乏,肠内细菌过度繁殖等多种原因[5-6]。也有相关文献[7,8]报道,消化道出血及腹水蛋白是肝硬化腹水并发细菌性腹水的独立危险因素。
本研究结果显示,我院腹腔感染的致病菌以革兰阴性菌为主(62.4%),主要为大肠埃希菌(27.1%)和肺炎克雷伯菌(13.5%)。药敏结果显示,大肠埃希菌和肺炎克雷伯菌对哌拉西林/他唑巴坦、亚氨培南、阿米卡星的耐药率低,第3代头孢菌素的耐药率高于第4代头孢菌素,对氨苄西林高度耐药。革兰阴性菌对β-内酰胺类耐药的主要机制是产生超广谱β-内酰胺酶(ESBLs),它可以水解青霉素类抗生素,使该抗菌药物失去抗菌活性,是导致细菌耐药的主要原因[9],而对哌拉西林/他唑巴坦和氨曲南影响较小。如腹水培养出大肠埃希菌,首先要鉴定其是否ESBLs阳性,针对阳性病菌,建议使用添加酶抑制剂的抗生素或碳青霉烯类抗生素[10,11]。近年来,由于β内酰胺类抗生素的广泛使用,使产ESBLs菌日益增多,对抗生素的耐药性比不产ESBLs菌高,给临床治疗带来了一定的困难。
本研究中,革兰阳性菌占29.3%,以凝固酶阴性葡萄球菌和肠球菌为主。在耐药性分析中对利奈唑胺和万古霉素敏感,对其他抗菌药物均有较高的耐药率。肠球菌占全部病原菌的9.8%,已成为腹腔感染的重要病原菌,其耐药性高于凝固酶阴性葡萄球菌,与以往文献[12]相似。有研究报道,主要由van A介导肠球菌耐药[13],针对其多重耐药、耐药率高的特点应引起临床医生的重视,尽早明确患者感染的病原菌种类及耐药性,合理使用抗生素。
综上所述,对于腹腔感染的患者应及时进行腹水培养,尽早明确病原菌的感染种类以及耐药性,根据其分析结果合理应用抗生素。但细菌培养和药敏试验需要一定的时间,故临床医生应熟悉引起细菌性腹水的病原菌种类,在腹水培养结果明确之前可根据经验选用广谱抗生素兼顾革兰阴性菌和革兰阳性菌[14],待药敏结果出来后再换用敏感的抗生素,以防耐药菌的形成。此外,晚期肝硬化使得肝功能严重受损而导致腹水发生,尽管针对该病进行了相应的治疗,但是腹水的症状不会完全消失,有时甚至可能会成为顽固性腹水,这种情况下,必须要进行综合性治疗。早期诊断并积极治疗可明显降低自发性细菌性腹膜炎患者的病死率[15].
[1] 李朝霞.抗生素的过量使用与细菌耐药性关系分析[J].世界最新医学信息文摘(电子版),2014,14(13):147-148.
[2] 罗开忠,曹 伟,雷建华,等.慢性肝衰竭并自发性细菌性腹膜炎的腹水培养及病原菌耐药分析[J].实用预防医学,2015,22(1):97-99.
[3] 汤立冬,王 宇.肝硬化并自发性细菌性腹膜炎腹水标本的菌种构成及耐药性分析[J].中国误诊学杂志,2012,12(15):3944-3945.
[4] 林奇龙,陈琼娜,李春儿,等.肝硬化并自发性腹膜炎的菌谱及耐药性分析[J].检验医学,2014,29(3):301-302.
[5] 沈桂月,易建华.原发性细菌性腹膜炎的诊治与预防[J].临床内科杂志,2013,30(8):575-576.
[6] Trikudanathan G,Israel J.Association between proton pump inhibitors and spontaneous bacterial peritonitis in cirrhotic patients-a systematic review and metaanalysis[J].Int J Clin Pract,2011,65(6):674.
[7] 胡利萍,依巴万力·艾拜都拉,努力比亚·阿不都克尤木,等.肝硬化腹水并发自发性细菌性腹膜炎的临床特征及危险因素分析[J].实用临床医药杂志,2015,19(11):29-31.
[8] 张玉江,张仕岭,王巧林.慢性重型肝炎和肝硬化并发自发性细菌性腹膜炎的临床分析[J].中华肝脏病杂志,2003,11(7):441.
[9] 卜 昕,张文瑾,范振平,等,肝硬化并发自发性细菌性腹膜炎患者腹水感染161例的细菌种类及耐药分析[J].中华临床医师杂志,2012,6(13):177-180.
[10] 李莎莎,高学武,谭 林. 42例肝硬化腹水并自发性细菌性腹膜炎病原菌的耐药情况分析[J].蚌埠医学院学报,2013,38(1):45-47.
[11] 童学成,姚玲娣,徐天敏.肝硬化并自发性细菌性腹膜炎腹水病原菌及耐药性分析[J].海南医学,2014,25(4):593-595.
[12] 郭晶晶,王慧珠,贺文艳,等. 肝硬化合并自发性细菌性腹膜炎患者病原菌分布及耐药敏感性分析[J].Labeled Immunoassays﹠Clin Med,2015,22(9):830-834.
[13] Pourakbari B,Aghdam M K,Mahmoudi S.High frequency of vancomycin-resistant enterococcus faecalis in an Iranian referral children medical hospital[J].Maedica(Buchar),2012,7(3):201-204.
[14] 黄利华,张 英.自发性细菌性腹膜炎预防与治疗进展[J].实用肝脏病杂志,2014,17(4):348-351.
[15] 熊清芳,余琼华,戴列军,等.肝硬化自发性腹膜炎患者血浆、腹水ICAM-1和趋化因子检测及其意义[J].咸宁学院学报,2010,24(1):23-26.
R446.5
周 清,本科学历,技师。
314001,武警浙江总队嘉兴医院检验科
(2017-06-11收稿 2017-09-21修回)
(责任编辑 梁秋野)

