肠内、外联合营养支持改良方案对老年重症脑卒中患者肠道微生态的影响
·专科护理·
※内科护理
肠内、外联合营养支持改良方案对老年重症脑卒中患者肠道微生态的影响
周春霞
目的:探讨肠内、外联合营养支持改良方案对老年重症脑卒中患者肠道微生态的影响。方法:回顾性分析2015年5月~2017年5月我院老年病科ICU收治的年龄≥75岁、格拉斯哥昏迷评分(GCS)在3~8分的脑卒中患者100例,按照随机数字法等分为观察组和对照组,对照组根据患者的实际情况决策后选取单纯肠内营养还是单纯肠外营养支持,观察组采用改良肠内外联合营养支持。比较两组患者营养状况、免疫功能以及各种并发症的发生情况。结果:第21天后观察组患者外周血白蛋白、血红蛋白水平,免疫球蛋白IgA,IgG,IgM水平,T细胞亚群CD4,CD4/CD8比率显著高于对照组,差异有统计学意义(P<0.05);观察组患者各种感染及胃肠道并发症发生情况均低于对照组,差异有统计学意义(P<0.05)。结论:改良的肠内外联合营养支持对老年重症脑卒中患者的肠道微生态具有良好的调节作用,能够显著改善患者营养状态和免疫功能,降低并发症发生,值得临床推广。
肠内外营养;重症脑卒中;肠道微生态;营养状况;免疫功能
10.3969/j.issn.1672-9676.2017.23.009
重症脑卒中患者机体处于应激状态,此时体内的分解代谢增强,合成代谢减弱,加上脑卒中引起的意识不清、吞咽困难等症状使摄入严重不足造成负氮平衡,引起低蛋白血症、离子紊乱、免疫功能降低、感染等一系列并发症,威胁患者生命[1]。因此脑卒中后的营养和能量支持至关重要,尤其对于免疫力低下,肠道功能减弱的老年重症脑卒中患者。临床工作中发现,以往的肠内营养由于蛋白质和能量限制而不能充分满足人体所需,且部分患者由于肠道功能受损无法充分吸收[2]。肠外营养虽然满足了患者的营养需求,使肠黏膜细胞得到充分休息,降低了肠源性感染发生率,但由于液体量过高加重老年患者心脏负担也限制了临床应用[3]。近年来,营养学专家提出了改良的肠内外联合营养支持方案。本次研究即对几种营养方案进行分析比较,旨在探究肠内、外联合营养支持改良方案对老年重症脑卒中患者肠道微生态的影响。现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2015年5月~2017年5月我院老年病科ICU收治的重症脑卒中患者。所有患者均符合中华医学会《脑卒中》的诊断标准,年龄≥75岁,格拉斯哥昏迷评分(GCS)在3~8分,美国国立卫生研究院卒中量表(NIHSS)评分≥10分。排除标准:(1)蛛网膜下腔出血。(2)合并严重心、肝、肾功能不全。(3)合并恶性肿瘤、血液疾病以及内分泌风湿免疫疾病。(4)合并消化系统溃疡、结核及应激性出血者。(5)治疗期间由于不能耐受而改变营养支持方案者。(6)急性期死亡者。最终入选患者100例,按照随机数字法等分为观察组和对照组,对照组中男24例,女26例;平均年龄(83.2±8.3)岁;脑出血25例,前循环梗死11例,后循环梗死14例;平均GCS评分(5.2±1.1)分;平均NIHSS评分(15.5±3.9)分。观察组中男26例,女24例;平均年龄(81.3±8.1)岁;脑出血23例,前循环梗死15例,后循环梗死12例;平均GCS评分(5.5±1.3)分;平均NIHSS评分(15.1±3.7)分。两组患者性别、年龄、脑卒中类型、平均GCS和NIHSS评分比较差异无统计学意义(P>0.05),具有可比性。
1.2 营养支持方法 患者入院24 h内给予留置鼻饲管,48 h内行锁骨下静脉中心置管。按热量30~35 kcal/(kg·d)、氮0.15~0.20 g/(kg·d)的比例给予营养支持[4]。
1.2.1 观察组 经锁骨下静脉导管输注全3 L装肠外营养液,每天1440 ml,并补充相应微量元素电解质等。能量不足部分以肠内营养补充,糖尿病患者给予肠内营养乳剂(TPF-D),非糖尿病患者给予肠内营养混悬液(TPF),以25~30 ml/h速度持续鼻饲[5]。
1.2.2 对照组 根据患者的实际情况由本院营养科主任医师决策采用肠内营养或者肠外营养。肠内营养:肠内营养液选择同观察组,起始量为500 ml,以20~25 ml/h持续泵入,如无腹胀、腹泻、反流等不适于次日加至1000 ml,以50 ml/h持续泵入,第3天加之足量,1500 ml,以75 ml/h持续泵入,间断鼻饲注水,保证每日注水量不低于1000 ml[6]。肠外营养:经锁骨下静脉导管输注全3 L装肠外营养液,每天3000 ml,并补充相应微量元素和电解质。
1.3 观察指标 (1)营养状态。入院第1天和第21天分别检测外周血白蛋白(ALB)、血红蛋白(Hb)水平。(2)免疫功能。入院第1天和第21天分别检测外周血免疫球蛋白IgA,IgG,IgM,T细胞亚群CD4,CD8,CD4/CD8。(3)并发症。观察干预21 d后两组患者肺部、泌尿系、肠道感染发生率,以及腹泻、腹胀等胃肠道并发症发生率。
1.4 统计学处理 采用SPSS 21.0统计软件,计量资料比较采用重复测量设计的方差分析,计数资料比较采用两独立样本的χ2检验。检验水准α=0.05。
2 结 果
2.1 两组患者不同时间点营养状态比较(表1)
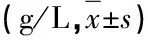
表1 两组患者入院第1天及第21天营养状态比较
注:两组患者入院第1天外周血ALB和Hb水平差异无统计学意义(P>0.05);第21天,两组患者ALB和Hb水平与第1天相比均有所升高,差异有统计学意义(P<0.05);第21天,观察组患者ALB和Hb水平最高,与对照组相比,差异均有统计学意义(P<0.05)
2.2 两组患者不同时间点免疫功能比较(表2)
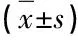
表2 两组患者入院第1天及第21天免疫功能比较
注:两组患者入院第1天外周血中免疫球蛋白和T细胞亚群水平差异无统计学意义(P>0.05);第21天,观察组患者外周血IgA,IgG,IgM,CD4,CD4/CD8水平较第1天明显升高,差异有统计学意义(P<0.05);第21天,观察组患者外周血IgA,IgG,IgM,CD4,CD4/CD8水平较对照组均明显升高,差异有统计学意义(P<0.05)
2.3 两组患者并发症发生情况比较(表3)

表3 两组患者并发症发生情况比较 例(%)
注:对照组患者中有40例发生并发症,其中各种感染28例,胃肠道并发症12例;观察组有23例发生并发症,其中各种感染13例,胃肠道并发症10例
3 讨 论
肠道微生态是肠道菌群与宿主相互作用共同生存的统一体,肠道内寄生着超过1000种数量达1014的菌群,健康状态下各菌群保持相对平衡,从而促进各种营养物质的吸收,抵御外界细菌和病毒的入侵,调节机体免疫功能[7]。当发生应激性疾病时肠道该平衡被打破,造成营养不良,低蛋白血症以及免疫功能紊乱等并发症[8]。这就是脑卒中患者比正常人更易发生营养相关性并发症的原因,此外重症脑卒中患者无法自主进食,营养摄入不足加剧了肠道微生态破坏[9]。肠道微生态紊乱不但影响神经系统功能恢复,还可引发感染、多器官衰竭等严重并发症而危及生命,因此倍受临床医师关注[10]。既往对于重症脑卒中后不能自主进食者主张早期行胃肠内营养支持,其优点是符合人体正常的生理解剖功能,保护肠道菌群和肠黏膜屏障功能,预防胆汁淤积;缺点是提供的营养物质及能量有限,持续鼻饲使肠道不能得到有效休息,易引起反流、腹胀、腹泻等并发症。而传统的普外科胃肠外营养通过完全的静脉途径将患者每日所需的营养物质输入体内,相比于肠内营养,肠外营养使肠道得到充分休息,可以保证长期不能进食者营养的供应,反流等胃肠道并发症显著降低。但由于其不符合正常解剖功能,破环了肠道菌群及屏障功能,还可加重心脏负担,引起胆汁淤积等并发症[11]。
我国营养学专家根据亚洲人群胃肠道解剖和生理特点制定了改良的胃肠内外联合营养方案。李国峰[8]学者对90例重症脑卒中患者进行研究,结果发现肠内外联合营养支持能改善其营养状况,控制并发症发生率,效果优于单纯肠内营养支持或单纯肠外营养支持。本次研究选取年龄≥75岁、GCS评分在3~8分的老年重症脑卒中患者,由于这类患者基础健康状况差,更易发生难以纠正的营养相关并发症。结果显示,第21天后采用了肠内营养联合肠外营养的患者无论是营养状态还是免疫功能情况均得到明显改善,且感染及胃肠道并发症发生率均低于单纯肠内营养和肠外营养使用(对照组)的患者,差异有统计学意义(P<0.05),从而说明改良的肠内外联合营养支持优点得到了扩大,而副作用部分抵消。
综上所述,肠内外联合营养支持改良方案对改善老年重症脑卒中患者肠道微生态效果明显,可以有效提高患者营养状态和免疫功能,降低感染及胃肠道相关并发症,值得临床推广。
[1] Carabotti M,Scirocco A,Maselli MA,et al. The gut-brain axis:interactions between enteric microbiota,central and enteric nervous systems[J].Ann Gastroenterol,2015,28(2):203-209.
[2] 曲春雨.早期肠内营养与肠外营养在重症脑卒中患者中的应用效果比较[J].中国医药科学,2015,5(11):214-216.
[3] 钱平安,王碧炯,査 芹.重症脑卒中患者早期肠内和肠外营养支持的对比分析[J].中外医疗,2014,8(11):1175-1177.
[4] Berer K,Krishnamoorthy G.Microbial view of central nervous system autoimmunity[J].Febs Letters,2014,588(22):4207-4213.
[5] 郭 蕾,潘利伟,范录平,等.肠内和肠外营养支持对于早期重症脑卒中的效果分析[J].中国慢性病预防与控制,2015,23(4):303-304.
[6] 杨海新,姜 雯,刘 红.个体化营养支持对急性重症脑卒中患者临床结局的影响[J].现代预防医学,2013,40(15):2804-2807.
[7] Yu J,An H,Su H,et al.Risk factors associated with Helicobacter pylori infection in army and navy recruits[J].Zhonghua Yi Xue Za Zhi,2015,95(2):138-141.
[8] 李国锋.肠内外联合营养支持对急性重症脑卒中患者临床疗效的影响[J].临床合理用药,2015,8(3):99-100.
[9] 刘凤鸣,谢逢春.肠内营养支持对急性重症脑卒中患者预后的影响分析[J].中国医药指南,2013,11(19):108-109.
[10] Okyshin K,Takahashi Y,Yamamichi N,et al.Helicobacter pylori infection is not associated with fatty liver disease including non-alcoholic fatty liver disease:a large-scale cross-sectional study in Japan[J].BMC Gastroenterol,2015(15):25.
[11] Rune I,Rolin B,Larsen C,et al.Modulating the gut microbiota improves glucose tolerance,lipoprotein profile and atherosclerotic plaque development in apoE-deficient mice[J].PLoS One,2016,22(11):e0146439.
Theeffectofcombinedenteralandparenteralnutritionsupportimprovementontheintestinalmicroecologyofelderlypatientswithseverestroke
ZHOUChun-xia
(The First Hospital Affiliated to Medical College of Zhejiang University,Hangzhou 310000)
Objective: To explore the effect of combined enteral and parenteral nutrition support improvement on the intestinal microecology of elderly patients with severe stroke. Methods: A retrospective analysis was made for a total of 100 stroke patients aged ≥75 and with 3-8 in Glasgow coma score (GCS) admitted to the ICU in the Department of Geriatrics of our hospital from May 2015 to May 2017. With random number method, the patients were divided into observation group and control group. According to the actual situation of patients in the control group, it was decided to adopt simple enteral nutrition or simple parenteral nutrition support. The modified combined enteral and parenteral nutritional support was adopted for the observation group. The nutritional status, immune function and the incidence of various complications were compared between the two groups. Results: After 21 days, it was observed that the level of serum albumin and hemoglobin, the level of immunoglobulin IgA, IgG and IgM and the ratio of T cell subgroup CD4 and CD4/CD8 in the observation group were significantly higher than those in the control group, and the differences was statistically significant(P<0.05). It was observed that the incidence of various infections and gastrointestinal complications in the observation group was lower than that in the control group, and the differences were statistically significant(P<0.05). Conclusion: The modified combined enteral and parenteral nutrition support has a good regulatory effect on the intestinal microecology of elderly patients with severe stroke, which can significantly improve the nutritional status and immune function of patients, reduce the incidence of complications, and is worthy of clinical promotion.
Enteral and parenteral nutritional; Severe stroke; Intestinal microecology; Nutritional status; Immune function
310000 杭州市 浙江大学医学院附属第一医院老年病科
周春霞:女,本科,主管护师,副护士长
2017-08-02)
(本文编辑 白晶晶)

