乳腺癌新辅助化疗患者上肢淋巴水肿的危险因素分析
张顺康,郑磊贞,陈 刚,孙丽云
1.上海交通大学医学院附属新华医院,上海 200092;
2.上海市黄浦区中心医院放疗科,上海 200002;
3.上海交通大学医学院附属新华医院肿瘤科,上海 200092;
4.上海市黄浦区中心医院放疗科,上海 200002
乳腺癌新辅助化疗患者上肢淋巴水肿的危险因素分析
张顺康1,2,郑磊贞3,陈 刚4,孙丽云4
1.上海交通大学医学院附属新华医院,上海 200092;
2.上海市黄浦区中心医院放疗科,上海 200002;
3.上海交通大学医学院附属新华医院肿瘤科,上海 200092;
4.上海市黄浦区中心医院放疗科,上海 200002
背景与目的:局部晚期乳腺癌新辅助化疗后联合其他局部治疗,如手术、放疗后患者的上肢淋巴水肿的相关危险因素尚未完全明确。该研究旨在回顾性分析新辅助化疗后患者上肢淋巴水肿的发生率及相关危险因素。方法:回顾分析2007年1月—2012年12月共103例乳腺癌新辅助化疗后行手术(包含腋淋巴结清扫)的患者。所有患者术后接受了全乳或胸壁以及锁上野放疗。淋巴水肿的诊断采用上肢周径测量法。结果:中位随访时间4.5年,41例患者发生上肢淋巴水肿。4.5年淋巴水肿的累积发生率为39.8%。分析结果显示:腋窝淋巴结切取个数大于15(HR=2.455;P=0.006)与完成足疗程新辅助化疗(HR=2.199;P=0.014)为发生淋巴水肿的独立危险因素。结论:该研究患者中有超过1/3的患者在治疗完成后的4~5年内发生患侧上肢的淋巴水肿。腋窝淋巴结切取个数大于15以及完成足疗程新辅助化疗的患者发生淋巴水肿的风险较高,因而对这部分患者需要更加密切的随访以便使淋巴水肿能够被早期发现和治疗。
乳腺癌;淋巴水肿;新辅助化疗;危险因素
患侧上肢淋巴水肿(lymphedema,LE)是乳腺癌治疗后常见的损伤表现之一。有荟萃分析指出超过20%的乳腺癌患者在治疗后发生患侧上肢或近端躯干部位的淋巴水肿[1]。因其常伴有明显的不适症状与外观异常,往往造成身心双重损害,显著降低了患者的生活质量[2-3]。
相关研究结果显示:腋窝淋巴结切取个数、辅助化疗、同侧腋窝顶部及锁骨上野放疗是发生淋巴水肿的危险因素[4-6]。乳腺肿瘤诱发的慢性炎性反应在淋巴水肿发生、发展过程中起到不可忽视的作用[7-8],而由手术、放化疗导致局部淋巴结构的一系列损伤性改变,使得与淋巴水肿形成相关的慢性炎性反应进一步加重[7]。
局部进展期乳腺癌患者术前行新辅助化疗已经成为标准的治疗方案[9]。新辅助化疗的优势包括可评估肿瘤对化疗药物的反应情况,明确最适合的个体化疗方案,并通过缩小肿瘤范围,减少手术损伤,从而增加了某些患者保乳手术的可能性。由于乳腺癌新辅助化疗患者通常需要腋窝淋巴结清扫手术与区域淋巴结的辅助放疗,其发生淋巴水肿的风险相对较高。目前乳腺癌新辅助化疗的使用情况有所增加,而关于新辅助化疗患者淋巴水肿风险的研究相对较少,包括这些患者的淋巴水肿发生率、危险因素、与放疗的关系等的有文献关报道较为有限。
本研究拟通过回顾性分析患者的随访结果,以临床客观检查的诊断方法,观察乳腺癌新辅助化疗患者淋巴水肿的发生情况,并对患者自身、肿瘤相关及治疗相关等因素与淋巴水肿发生的相关性进行分析,从而明确乳腺癌新辅助化疗患者发生淋巴水肿的危险因素。
1 资料和方法
1.1 患者资料
回顾性分析上海市黄浦区中心医院2007年1月—2012年12月收治的乳腺癌新辅助化疗患者(n=136)的临床资料,将其中同期或随后出现对侧乳腺癌的患者、因各种原因随访时间少于2年的患者、在手术及术后放化疗未完成前即出现患侧上肢水肿的患者筛除,共筛除33例患者。剩余103例患者入组分析。103例患者的中位年龄为52岁(37~63岁)。
1.2 治疗
1.2.1 新辅助化疗及辅助化疗情况
103例患者的新辅助化疗由3~8个周期的含蒽环类、紫杉类或蒽环类与紫杉类药物联合的化疗方案组成;其中35例(34.0%)完成6~8个周期的足疗程的新辅助化疗后手术且术后未行辅助化疗,68例(66.0%)先行3~7个周期的新辅助化疗(未完成足疗程的新辅助化疗)并在术后完成1~5个周期的辅助化疗。新辅助化疗通常选择患侧手臂静脉输注。辅助化疗的给药途径包括健侧手臂的浅静脉或经外周静脉植入的中心静脉导管(peripherally inserted central catheter,PICC)。
1.2.2 手术情况
手术时间通常在新辅助化疗3~4周后,除非有证据显示疾病在化疗期间有进展而适当缩短时间间隔。选择保乳手术患者(n=5)满足以下情况:初诊时无皮肤或胸壁受侵,无弥漫微小钙化灶和肿瘤多灶点情况,有足够的乳腺组织以行保乳手术,以及有全乳切除的绝对禁忌证。其他患者均行全乳切除术(n=98)。103例患者均予标准的腋窝第一组、第二组淋巴结清扫,其腋窝淋巴结切取的中位个数为16(8~34)。
1.2.3 术后放疗
103例患者均接受了同侧乳房/胸壁放疗+锁骨上野放疗。放疗开始时间在术后的3~4周(完成足疗程新辅助化疗的患者)或辅助化疗后的1~2周(未完成足疗程新辅助化疗的患者)。放疗定位采用CT模拟定位技术,并根据CT定位扫描图像在拓能(Topslane)三维治疗计划系统中进行靶区勾画,处方剂量要求覆盖勾画区域的95%以上;采用常规放疗模式。全乳及胸壁以切线照射野技术,使用6 MV X射线,处方剂量为50.0 Gy/25 次,共5周,每日剂量2.0 Gy。保乳术后的患者予相同体位下在瘤床部位以电子线推量10.0 Gy/5次,共1周,每日剂量2.0 Gy。锁骨上野(包括腋窝顶部及锁骨上区)予处方剂量50.0 Gy/25次,共5周,以6 MV X线与9 MeV电子线按3∶2剂量比例混合照射,每日剂量2.0 Gy。有74例进行了内乳野照射。所有患者完成既定的放疗计划。
1.2.4 内分泌治疗
共有67例患者(65.0%)接受了内分泌治疗,所用药物为三苯氧胺或芳香化酶抑制剂。
1.2.5 靶向治疗
2011年起,18例荧光原位杂交(fluorescence in situ hybridization,FISH)检测人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)过表达的患者中有15例接受了1年的曲妥珠单抗治疗。
1.3 淋巴水肿的诊断评估
淋巴水肿的诊断采用临床客观检查(手臂周径测量)的方法。测量部位:肩峰下15 cm处及尺骨鹰嘴下15 cm处。对于患侧上肢周径超过健侧上肢相同部位2 cm及以上者诊断为上肢淋巴水肿[10]。淋巴水肿的评估时间为放疗结束开始,放疗后第1年内每3个月进行1次随访评估,放疗后第2年开始改为每6个月1次。
1.4 统计学处理
淋巴水肿累积发生率以Kaplan-Meier生存曲线法进行计算,所有统计数据均从放疗结束以后开始测量获得。以卡方检验对淋巴水肿的危险因素进行单因素分析,包括:① 患者自身相关因素,如年龄、体质量指数;② 肿瘤相关因素,如ypT分期、ypN分期、yp分期;③ 治疗相关因素,如手术方式、腋窝淋巴结切取个数,以及辅助化疗情况。单因素分析中有意义的变量(P<0.05)进入多因素分析,并对不同危险因素组别之间进行进一步评估。所有数据使用SPSS 19.0统计软件进行分析,并使用GraphPad Prism 5.0软件制作Kaplan-Meier曲线图。所有统计数据检验均采用双向检测法,P<0.05为差异有统计学意义。
2 结 果
2.1 淋巴水肿发生率及时间过程
中位随访时间为放疗后4.5(2.0~7.5)年。共有41例患者(39.8%)随访中诊断为患侧上肢淋巴水肿。其中13例患者手臂水肿半年内自行消退,考虑为暂时性水肿;剩余28例患者连续半年随访中水肿情况持续,定义为永久性水肿。从放疗结束到上肢淋巴水肿最初出现的中位时间间隔是7.5(3.0~42.0)个月,其中2例(4.9%)患者水肿出现在放疗后3个月内,20例(48.8%)为放疗后6个月内,31例(75.6%)为放疗后1年内,37例(90.2%)为放疗后2年内,4例(9.8%)则是在放疗结束2年以后。
2.2 淋巴水肿的相关危险因素分析
发生淋巴水肿的患者自身、肿瘤相关、治疗相关因素的单因素分析结果见表1。结果显示,年龄(P=0.022)、ypN分期(P=0.034)、腋窝淋巴结切取数(P=0.014)以及新辅助化疗情况(P=0.031)与淋巴水肿发生存在相关性,且差异有统计学意义。体质量指数(P=0.504)、yp分期(P=0.090)、ypT分期(P=0.716)、手术方式(P=0.344)等4项因素不影响淋巴水肿的发生率。
在Cox回归多因素分析应用向后逐步选择进程法对单因素分析中4个与淋巴水肿发生有相关性的因素进行多因素分析后,结果显示:腋窝淋巴结切取个数大于15枚[相对危险率(hazard ratio,HR)=2.455;P=0.006]与完成足疗程新辅助化疗(HR=2.199;P=0.014)为发生淋巴水肿的独立危险因素(表2)。年龄大于52岁与ypN2~N3期对淋巴水肿发生率的影响差异无统计学意义(P>0.006)。
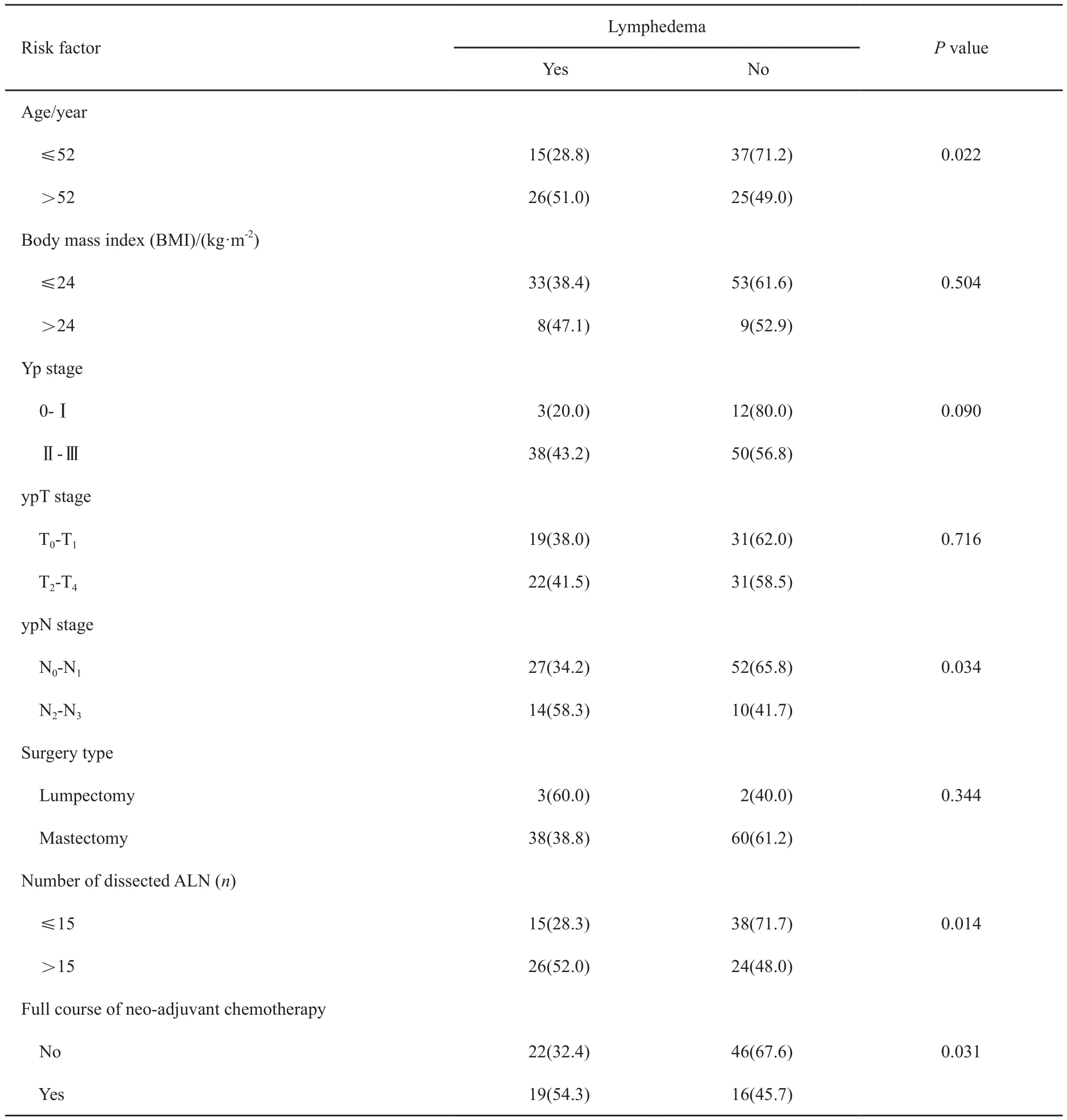
表 1 103例患者的临床因素分布情况及淋巴水肿危险因素的单因素分析Tab. 1 Clinical characteristics distribution of 103 patients and uni-analysis of lymphedema risk factors[n (%)]

表 2 乳腺癌新辅助化疗后患者淋巴水肿危险因素的多因素分析Tab. 2 Multi-analysis of lymphedema risk factors in breast cancer patients treated with neo-adjuvant chemotherapy
不同危险因素个数患者淋巴水肿发生率的比较:不同危险因素个数的患者淋巴水肿发生率结果见表3。与无危险因素的患者相比,有两个危险因素的患者4.5年淋巴水肿发生率显著升高(25.8% vs 70.6%,P=0.003)。两组患者的4.5年淋巴水肿累积发生曲线见图1。
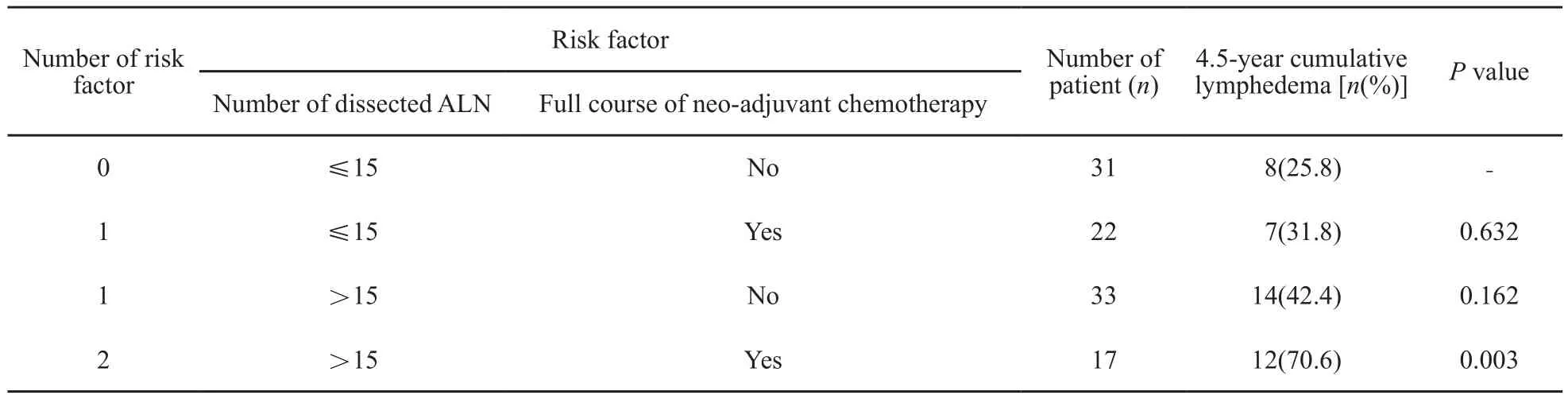
表 3 不同危险因素个数的4.5年淋巴水肿累积发生率Tab. 3 Cumulative incidence of lymphedema according to different number of risk factor
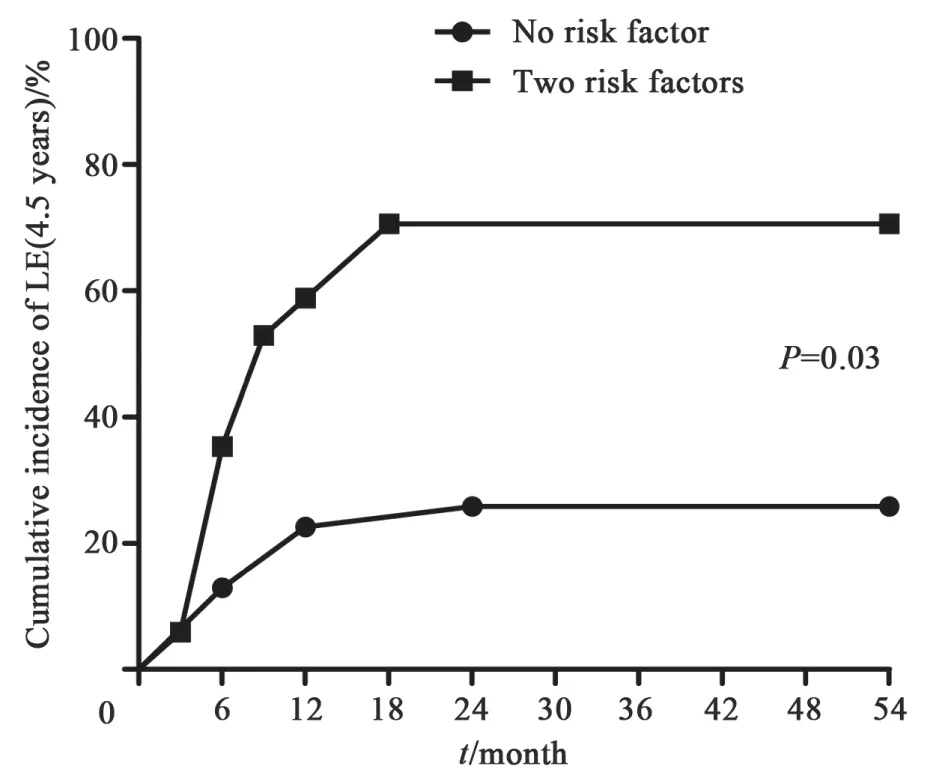
图 1 不同危险因素个数的淋巴水肿累积发生率曲线Fig. 1 Cumulative incidence curve of lymphedema according to different number of risk factor
3 讨 论
本研究通过对103例乳腺癌新辅助化疗患者的临床数据回顾分析,发现腋窝淋巴结切取个数大于15的患者与完成足疗程新辅助化疗的患者淋巴水肿发生率分别为52.0%与54.3%(HR=2.455和HR=2.199,P<0.05)。根据上述分析,笔者认为腋窝淋巴结切取个数大于15与完成足疗程新辅助化疗是患者发生上肢淋巴水肿的独立危险因素。Kim等[11]对313例乳腺癌新辅助化疗患者进行研究后发现,腋窝淋巴结切取个数小于等于10枚与大于10枚的患者5年淋巴水肿累积发生率分别为32%与47%(P=0.03),该作者的另一项对772例非新辅助化疗的乳腺癌患者的研究结果显示,腋窝淋巴结切取个数小于等于10枚与大于10枚的患者5年淋巴水肿累积发生率分别为6%与27%(P<0.001)[5]。Shah等[12]对1 497例行保乳手术的乳腺癌患者的长期随访研究后也得出相似结论,发生淋巴水肿与未发生淋巴水肿患者的腋窝淋巴结切除个数均值分别为16与14(P=0.04)。我们认为,尽管腋窝淋巴结清扫被认为与乳腺癌患者发生淋巴水肿显著相关[5,13-14],但也有程度轻重之分。切取的淋巴结个数在一定程度上能够反映手术清扫范围的大小,决定了腋窝淋巴组织损伤程度的轻重,从而影响了发生淋巴水肿的风险。而导致本研究中完成足疗程新辅助化疗的患者淋巴水肿发生率较高的原因,笔者认为与新辅助化疗往往选择从患侧手臂进行药物输注有关。患侧手臂化疗给药次数越多,药物对手臂脉管系统的刺激破坏越频繁,导致该部位的淋巴循环能力异常,进而增加了淋巴水肿的发生风险。Bevilacqua等[15]报道同侧手臂输注化疗药物的周期数是淋巴水肿发生的独立危险因素。Clark等[16]报道术后患侧手臂行非化疗药物静脉输注的患者淋巴水肿的风险增加2.44倍。因此,笔者认为从降低淋巴水肿的发生风险的角度,应该适当减少对新辅助化疗患者患侧手臂静脉给药的次数。
本研究中新辅助化疗后患者发生淋巴水肿的中位时间为放疗结束后7.5个月,其中1年内发生淋巴水肿的患者占所有淋巴水肿患者的75.6%,2年内的占90.2%。作者将其与一些相关研究结果进行了比较。刘风华等[17]对157例乳腺癌术后患者进行2年随访观察后发现,这些患者半年的淋巴水肿累积发生例数占2年内所有淋巴水肿发生例数的33.3%(13/39),1年内的则占到了74.4%(29/39)。Norman等[18]报道80%的患者淋巴水肿初发时间在术后2年内,89%的患者在3年内。由此可见,新辅助化疗患者淋巴水肿的发生时间较之其他患者并无明显区别。
也有报道结果显示,年龄增高是发生淋巴水肿的危险因素[15,18-19]。本研究的单因素分析结果显示,小于等于52岁组与大于52岁组的淋巴水肿发生率分别为28.8%和51.0%(P=0.022),但在多因素分析中差异无统计学意义(P=0.226)。该结果与郑建伟等[20]的研究结果一致。老年患者较高的淋巴水肿发生率可归咎于淋巴-静脉吻合结构的进行性减少,该结构是由于淋巴循环压力增高并造成淋巴循环与血液循环系统桥接,形成新的淋巴引流通路,可有效地增加淋巴系统的循环能力[15]。该说法可解释为何本研究中大于52岁组患者淋巴水肿发生率相对较高。
已有不少研究尝试通过控制治疗相关因素及患者自身相关因素以降低乳腺癌新辅助化疗患者的淋巴水肿风险。首先是对初诊临床腋窝淋巴结阳性的新辅助化疗患者以前哨淋巴结活检替代腋窝淋巴结清扫,并获得ACOSOG Z1071研究结果的支持[21]。其次,由于区域淋巴结放疗已被证实为淋巴水肿的独立危险因素,可使淋巴水肿的风险增加2.0~4.5倍[1,5,13-14],因此新辅助化疗后优化治疗方案避免区域淋巴结放疗亦可降低淋巴水肿的发生风险。Daveau等[22]与Le Scodan等[23]分别对保乳术后及全乳切除术后Ⅱ~Ⅲ期、ypN0的乳腺癌新辅助化疗患者进行临床观察,结果显示这部分患者即使不做术后区域淋巴结放疗也能够取得可以接受的临床结果。NSABP B-51/RTOG 1304研究已开始患者的前瞻性征集工作,以评估新辅助化疗后淋巴结阴性的患者不做放疗的可行性。
诚然,本研究也有一些不足之处,包括术前数据的缺失,诸如一些患者相关因素(基础疾病病史、手臂外伤史、感染病史、手臂有否过度使用的情况等),因此无法对其进行风险评测。然而,对于不同危险因素个数的患者淋巴水肿 风险的评估,可帮助临床医师对患者进行教育,并通过调整自身相关因素降低淋巴水肿的风险。
[1] DISIPIO T, RYE S, NEWMAN B, et al. Incidence of unilateral arm lymphoedema after breast cancer: a systematic review and meta-analysis[J]. Lancet Oncol, 2013, 14(6): 500-515.
[2] GARTNER R, JENSEN M B, NIELSEN J, et al. Prevalence of and factors associated with persistent pain following breast cancer surgery[J]. JAMA, 2009, 302(18): 1985-1992.
[3] HEINEY S P, MCWAYNE J, CUNNINGHAM J E, et al.Quality of life and lymphedema following breast cancer[J].Lymphology, 2007, 40(4): 177-184.
[4] ZHU Y Q, XIE Y H, LIU F H, et al. Systemic analysis on risk factors for breast cancer related lymphedema[J]. Asian Pac J Cancer Prev, 2014, 15(16): 6535-6541.
[5] KIM M, KIM S W, LEE S U, et al. A model to estimate the risk of breast cancer-related lymphedema: combinations of treatment-related factors of the number of dissected axillary nodes, adjuvant chemotherapy, and radiation therapy[J].Int J Radiat Oncol Biol Phys, 2013, 86(3): 498-503.
[6] MILLER C L, SPECHT M C, SKOLNY M N, et al. Risk of lymphedema after mastectomy: potential benefit of applying ACOSOG Z0011 protocol to mastectomy patients[J]. Breast Cancer Res Treat, 2014, 144(1): 71-77.
[7] SHAH C, WILKINSON J B, BASCHNAGEL A, et al. Factors associated with the development of breast cancer-related lymphedema after whole breast irradiation[J]. Int J Radiat Oncol Biol Phys, 2012, 83(4): 1095-1100.
[8] REDON C E, DICKEY J S, NAKAMURA A J, et al. Tumors induce complex DNA damage in distant proliferative tissues in vivo[J]. Proc Natl Acad Sci U S A, 2010, 107(42): 17992-17997.
[9] FISHER B, BROWN A, MAMOUNAS E, et al. Effect of preoperative chemotherapy on local-regional disease in women with operable breast cancer: findings from National Surgical Adjuvant Breast and Bowel Project B-18[J]. J Clin Oncol, 1997, 15(7): 2483-2493.
[10] DEUTSCH M, LAND S, BEGOVIC M, et al. The incidence of arm edema in women with breast cancer randomized on the National Surgical Adjuvant Breast and Bowel Project Study B-04 to radical mastectomy versus total mastectomy and radiotherapy versus total mastectomy alone[J]. Int J Radiat Oncol Biol Phys, 2008, 79(4): 1020-1024.
[11] KIM M, PARK I H, LEE K S, et al. Breast cancer-related lymphedema after neoadjuvant chemotherapy[J]. Cancer Res Treat, 2015, 47(3): 416-423.
[12] SHAH C, WILKINSON J B, BASCHNAGEL A, et al. Factors associated with the development of breast cancer-related lymphedema after whole-breast irradiation[J]. Int J Radiat Oncol Biol Phys, 2012, 83(4): 1095-1100.
[13] COEN J J, TAGHIAN A G, KACHNIC L A, et al. Risk of lymphedema after regional nodal irradiation with breast conservation therapy[J]. Int J Radiat Oncol Biol Phys,2003, 55(5): 1209-1215.
[14] SAKORAFAS G H, PEROS G, CATALIOTTI L, et al.Lymphedema following axillary lymph node dissection for breast cancer[J]. Surg Oncol, 2006, 15(3): 153-165.
[15] BEVILACQUA J L, KATTAN M W, CHANGHONG Y, et al.Nomograms for predicting the risk of arm lymphedema after axillary dissection in breast cancer[J]. Ann Surg Oncol,2012, 19(8): 2580-2589.
[16] CLARK B, SITZIA J, HARLOW W. Incidence and risk of arm oedema following treatment for breast cancer: a three-year follow-up study[J]. QJM, 2005, 98(5): 343-348.
[17] 刘风华, 胡 艳, 沈培佩, 等. 乳腺癌相关淋巴水肿发病情况及危险因素前瞻性队列研究[J].中华放射肿瘤学杂志, 2016, 25(6): 593-597.
[18] NORMAN S A, LOCALIO A R, POTASHNIK S L, et al.Lymphedema in breast cancer survivors: incidence, degree,time course, treatment, and symptoms[J]. J Clin Oncol,2009, 27(3): 390-397.
[19] SPECHT M C, MILLER C L, SKOLNY M N, et al. Residual lymph node disease after neoadjuvant chemotherapy predicts an increased risk of lymphedema in node-positive breast cancer patients[J]. Ann Surg Oncol, 2013, 20(9): 2835-2841.
[20] 郑建伟, 蔡淑艳, 宋慧敏, 等. 乳腺癌患者术后上肢淋巴水肿的危险因素分析[J]. 中华乳腺病杂志(电子版), 2015,9(6): 363-366.
[21] HAYES S C, JANDA M, CORNISH B, et al. Lymphedema after breast cancer: incidence, risk factors, and effect on upper body function[J]. J Clin Oncol, 2008, 26(21): 3536-3542.
[22] DAVEAU C, STEVENS D, BRAIN E, et al. Is regional lymph node irradiation necessary in stage Ⅱ to Ⅲ breast cancer patients with negative pathologic node status after neoadjuvant chemotherapy? [J]. Int J Radiat Oncol Biol Phys, 2010,78(2): 337-342.
[23] LE SCODAN R, SELZ J, STEVENS D, et al. Radiotherapy for stage Ⅱ and stage Ⅲ breast cancer patients with negative lymph nodes after preoperative chemotherapy and mastectomy[J]. Int J Radiat Oncol Biol Phys, 2012, 82(1): 1-7.
Anylasis of risk factors for arm lymphedema in breast cancer patients treated with neoadjuvant chemotherapy
ZHANG Shunkang1,2, ZHENG Leizhen3, CHEN Gang4, SUN Liyun4 (1. Xin Hua Hospital Affiliated to Shanghai Jiao Tong University School of Medicine, Shanghai 200092, China; 2. Department of Radiation Oncology, Huangpu District Central Hospital, Shanghai 200002, China; 3. Department of Oncology, Xin Hua Hospital, School of Medicine, Shanghai Jiao Tong University, Shanghai 200092, China;4. Department of Radiation Oncology, Huangpu District Central Hospital, Shanghai 200002, China)
ZHENG Leizhen E-mail: zhangleizhen2006@126.com
Background and purpose:The risk of arm lymphedema in locally advanced breast cancer patients treated with neoadjuvant chemotherapy and local treatment (e.g., surgical procedure and radiation therapy) has not been fully clarif i ed so far. This study was conducted to retrospectively investigate the incidence of lymphedema and associated risk factors in patients treated with neo-adjuvant chemotherapy.Methods:A total of 103 breast cancer patients who underwent neo-adjuvant chemotherapy followed by surgery with axillary lymph node (ALN) dissection from Jan. 2007 to Dec. 2012 were retrospectively analyzed. All patients
postoperative breast/chest wall and supraclavicular field radiation therapy. The determination of lymphedema was based on arm circumference measurement.Results:At a median follow-up time of 4.5 years, 41 patients developed lymphedema. The overall 4.5-year cumulative incidence of lymphedema was 39.8%. According to the analysis result, the number of dissected ALN>15[hazard ratio (HR)=2.455; P=0.006] and having full course of neo-adjuvant chemotherapy (HR=2.199; P=0.014)were independent risk factors for lymphedema. Conclusions: More than 1/3 of the patients in our setting developed lymphedema. Those who have the number of dissected ALN>15 and full course of neo-adjuvant chemotherapy are more likely to develop lymphedema. Thus, more frequent surveillance are necessary for them to detect and treat lymphedema at an early stage.
Breast cancer; Lymphedema; Neoadjuvant chemotherapy; Risk factor
10.19401/j.cnki.1007-3639.2017.10.009
R737.9
A
1007-3639(2017)10-0815-07
上海市黄浦区卫生计生系统科技项目B类(HWK201448)。
郑磊贞 E-mail:zhengleizhen2006@126.com
2017-04-02
2017-08-20)

