循环肿瘤标志物在前列腺癌研究中的新进展
李高翔,杨云杰 综述,戴 波 审校
复旦大学附属肿瘤医院泌尿外科,复旦大学上海医学院肿瘤学系,上海200032
循环肿瘤标志物在前列腺癌研究中的新进展
李高翔,杨云杰 综述,戴 波 审校
复旦大学附属肿瘤医院泌尿外科,复旦大学上海医学院肿瘤学系,上海200032
前列腺癌是最常见的恶性肿瘤之一,虽然前列腺特异性抗原(prostate-specific antigen,PSA)筛查、综合治疗的开展使其早期诊断、治疗疗效有较大改善,但若实现前列腺癌的个体化治疗仍亟需新的生物标志物。循环肿瘤标志物来源于肿瘤组织,与肿瘤转移及预后密切相关。该研究对循环肿瘤标志物的检测方法及其在前列腺癌研究中的新进展进行综述。
前列腺癌;循环肿瘤标志物;检测;个体化治疗
长期以来,前列腺癌一直是世界范围内最常见的恶性肿瘤之一[1]。而前列腺特异性抗原(prostate-specific antigen,PSA)在临床应用中其灵敏度和特异度仍有一定的局限性,所以早期准确诊断前列腺癌仍需更加精准的标志物来改善现状。同时,对于转移性前列腺癌(metastatic prostate cancer,mPCa)、去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC)等进行预后的判断、治疗疗效的实时定量监测仍是临床上需要改善的问题。作为前列腺癌个体化诊疗的一种新的手段,“液体活检”能够为早期诊断前列腺癌、提高mPCa的疗效提供更有效的临床证据。“液体活检”最初仅包括循环肿瘤细胞(circulating tumor cell,CTC)检测,现在也包括循环肿瘤DNA(circulating tumor DNA,ctDNA)、外泌体(exosome)、小分子RNA(mircoRNA)及长链非编码RNA(long non-coding RNA)等肿瘤标志物的检测。目前临床常用主要为CTC和ctDNA,其中,美国食品药品管理局(Food and Drug Administration,FDA)相继在2004—2008年间批准外周血CTC计数可用于转移性乳腺癌,结直肠癌和前列腺癌的预后评估和治疗反应情况的评估[2-4]。同时,ctDNA检测在国内也处于临床探索的热点。因此,该研究就循环肿瘤标志物现今在肿瘤个体化诊疗领域,特别是在前列腺癌个体化诊疗中的研究及进展做一回顾和总结。
1 CTC
1.1 CTC定义及生物学特征
Ashworth于1896年首次发现并提出CTC的概念[5]。1889年Paget提出了著名的“种子和土壤”假说(seed and soil hypothesis)[6],该假说中的“种子”即CTC,其在肿瘤的发生、发展中发挥着重要作用。此学说成功地阐释了癌症复发和转移的机制。肿瘤原发灶或转移灶中,具有转移倾向的一类肿瘤细胞,通过EMT等生物学行为,迁移入血称之为CTC。外周血中检测出CTC并不一定意味着患者已经存在远处转移,具有干细胞特征的播散的肿瘤细胞(disseminated tumor cells,DTC)聚集成团,并且形成微转移灶,同时该转移灶可以逃避免疫系统的识别,肿瘤的远处转移才可能发生[7]。
基于CTC的生物学特征,肿瘤个体化治疗领域CTC的检测可有效地应用于预后判断,指导个体化治疗,包括临床药物的筛选、耐药性的检测及肿瘤新药物的开发等,为动态实时监测患者的治疗效果提供最直接的证据。
1.2 CTC检测方法
由于CTC在外周血中的数量很少,每105~107个有核细胞中才有1个CTC,因此对CTC的检测技术要求更为准确、敏感。CTC的检测方法主要分为两部分:CTC富集技术和CTC检测技术。主要富集和检测方法的介绍及优缺点见表1[8-9]。
1.3 CTC的临床应用
1.3.1 辅助诊断
Schwarzenbach等[10]入组了69例前列腺癌患者,结果发现,71%的M0期患者及92%的M1期患者外周血CTC检出数为1~40个,且CTC的出现与肿瘤分期(P<0.03)及增高的Gleason评分(P<0.04)具有相关性,提示CTC检测可协同PSA指导前列腺癌患者预后分期分组。但是CTC与前列腺癌分期分级关联尚有争议,是否有助于辅助前列腺癌的早期诊断仍待大规模的临床研究。
1.3.2 预后判断
目前的研究显示,CTC数目和肿瘤的进展、接受药物治疗后的疗效密切相关。Bono等[4]入组了276例CRPC患者,利用CellSearch平台在治疗前后按月对患者外周血CTC进行持续动态监测,发现以7.5 mL外周血中CTC数为5个作为Cutoff值,治疗前的CTC基线水平对患者的中位总生存期(overall survial,OS)具有预测价值,这项研究直接促使FDA批准CellSearch System(CSS)用于前列腺癌患者外周血中CTC的检测。Goodman等[11]的研究对33例mHRPC患者内分泌治疗前及内分泌治疗2个月后进行CTC计数及血生化指标的检测,统计学结果显示,多因素分析中仅基线CTC计数为mHRPC患者进展至CRPC的独立预后因素。
大量研究已经证实CTC计数为前列腺癌患者的敏感预后因子。但是,对于CTC预测预后的最佳临界值仍有争议,CTC在低肿瘤负担的晚期前列腺癌患者中的预测价值有待进一步评估。
1.3.3 疗效评估
Okegawa等[12]对80例接受内分泌治疗的mPCa患者的CTC进行了研究,44例(55%)检出大于或等于5个(7.5 mL外周血),其内分泌治疗中位有效期为17个月;小于5个的患者的内分泌治疗中位有效期大于32个月。此外,CTC的检测已经被纳入研发新型靶向治疗药物的Ⅰ期和Ⅱ期临床试验中,其中一项关于阿比特龙治疗雄激素抵抗性前列腺癌的Ⅱ期试验[13]显示,60%~70%的患者初始CTC较高,经过阿比特龙治疗后,近50%的患者CTC降到较低水平。这些研究充分证明了CTC为内分泌治疗敏感性的预测因子,可作为反映抗肿瘤治疗疗效的指标,其在临床新型治疗方法的研发中具有重要作用,有助于制定最佳的治疗方案。
1.3.4 分子标志物检测
在前列腺癌疾病进展过程中,促进肿瘤发展的分子标志物可能会发生变化,为了实现有效的个体化治疗,根据肿瘤所表达分子特征选择治疗方案至关重要。
有研究报道,前列腺癌患者C T C中TMPRSS2-ERG基因融合、雄激素受体AR突变及AR-V7突变[14-15],往往提示前列腺癌更具侵袭性及对恩杂鲁胺和阿比特龙耐药。其他CTC水平分子特征分析的内容还包括PTEN缺失、扩增和MYC的扩增,CTC中Ki-67增殖很大程度上提示前列腺癌患者容易发生去势抵抗,AR蛋白的改变与临床对多西他赛的反应相关,还有对CTC细胞的微管束研究也发现其与多西他赛化疗的疗效相关[16]。此外,一项共入组了70例mCRPC患者的研究将CTC计数和分子标志物表达相结合,结果表明,对于接受了多西他赛加泼尼松一线化疗的患者,较多的CTC(7.5 mL外周血中CTC计数大于等于5)和CTC表面干细胞相关基因(ABCG2、PROM1和PSCA)的表达均是OS的独立预后因子(多因素分析中P=0.02和P=0.01)[17]。因此,检测CRPC患者外周血CTC中AR及其他相关基因的亚细胞水平可以预测患者对多西他赛、阿比特龙的反应,对治疗方案的选择和更换具有重要意义。
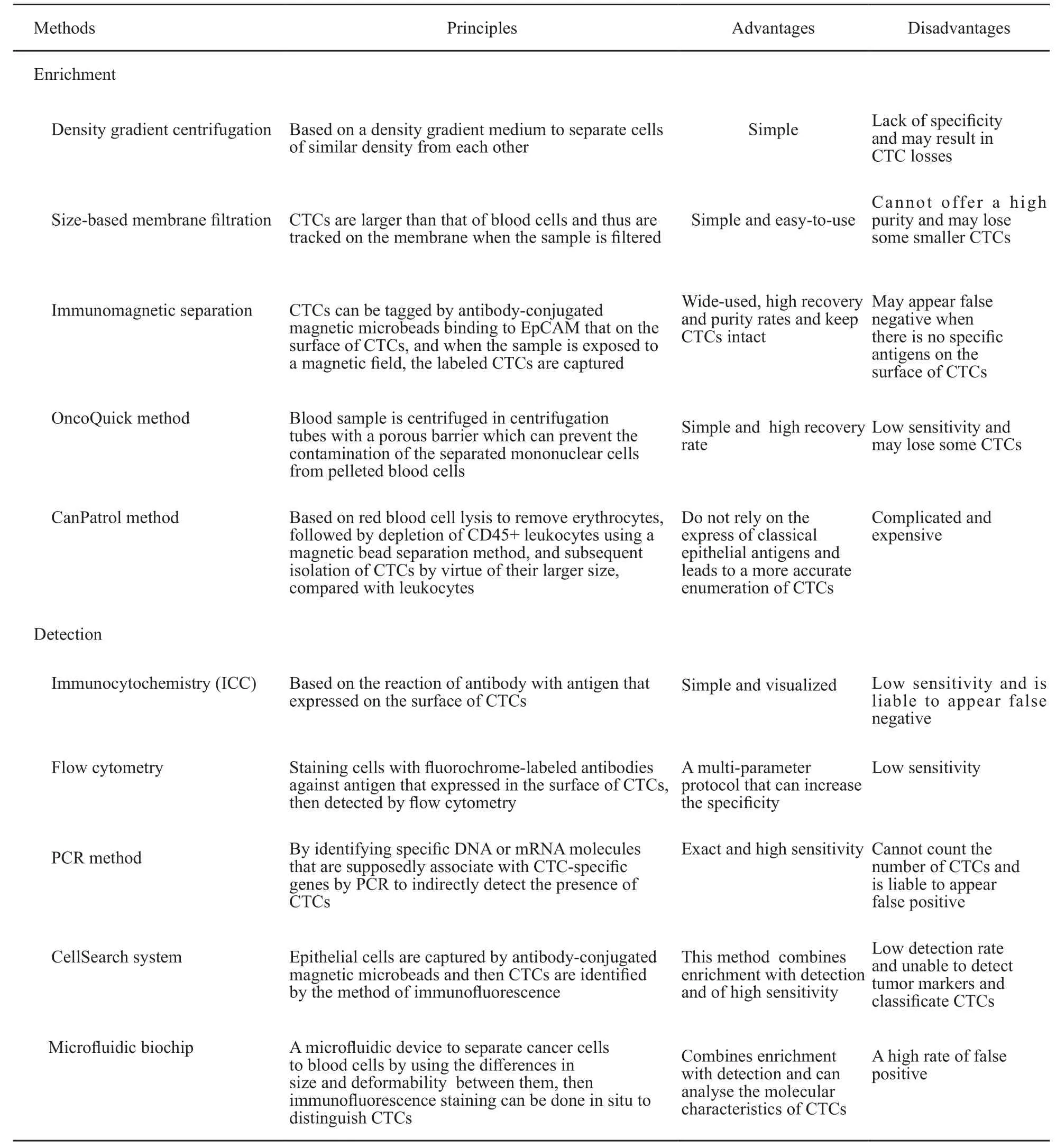
表 1 CTC的主要富集和检测方法汇总表Tab. 1 The main methods of enrichment and detection of CTC
2 血浆游离DNA(cell-free DNA,cfDNA)/ctDNA
2.1 定义及生物学特征
cfDNA也叫循环游离DNA(circulating-free DNA),是外周血中游离存在、不包含在完整细胞结构内的DNA。ctDNA是来源于肿瘤细胞的双链DNA片段,属于cfDNA的一种类型,主要来源于:① 坏死的肿瘤细胞;② 凋亡的肿瘤细胞;③ CTC;④ 肿瘤细胞分泌的外排体[18]。cfDNA主要存在于血液、滑膜液和脑脊液等液体中,含量极微,其携带一定的特征,包括突变、缺失、插入和甲基化等,通过对cfDNA中肿瘤特异度畸变(如肿瘤原癌基因和致癌基因突变、微卫星改变和DNA甲基化等)的识别[19],证实其与肿瘤细胞基因组信息相一致。因此定量或定性分析这些ctDNA可以间接反映肿瘤疾病的相关特征,对肿瘤的早期诊断、个体化治疗、病情监测及预后的评价都具有重要意义[20]。
2.2 ctDNA的检测
对ctDNA的检测可分为定量和定性两种:前者主要检测血清和血浆中ctDNA总量,后者则检测DNA中肿瘤特异度基因的改变。
对于定量检测,既往缺乏统一标准,此外定量检测不仅会受到检测背景中大量正常cfDNA的干扰,导致大量假阳性结果,也容易受到血液的凝固、储存温度及患者的基本情况等诸多因素的影响,并不适合作为肿瘤诊断和评估的有效指标[21];再加上操作技术的限制,导致定量检测一直未受重视。因此,一些定性分析方法受到关注。目前临床上主要开展的检测包括基因突变、甲基化异常、微卫星不稳定性和杂合性缺失等。
第三代PCR技术-数字化PCR(digital PCR)及二代测序技术(next-generation sequencing,NGS)的发展使ctDNA中肿瘤特异度的基因突变或拷贝数异常的检测成为可能[22]。这种高通量的方式具有非常高的敏感性,并能精确的捕捉到临床治疗过程中微量ctDNA的变化[23],具有非常好的应用前景,为实时无创监测患者治疗疗效提供了新的方向。
2.3 临床应用
在早期诊断方面,主要是根据恶性肿瘤患者ctDNA含量与正常人之间的差异来进行分析。早在2004年即有文献报道[24],对于PSA升高或直肠指检异常的患者,经前列腺穿刺活检证实,穿刺之前为良性前列腺增生患者(benign prostatic hyperplasia,BPH)其血浆DNA总量为936 GE/mL(中位值,单位为:genome equivalents/milliliterplasma),显著低于前列腺癌患者的1 734 GE/mL(中位值,P=0.01)和上皮内瘤变患者的1 780 GE/mL(中位值,P=0.04),证实了血浆DNA含量可以作为鉴别前列腺良恶性疾病的一个重要指标。Altimari等[25]在2008年的一项研究也显示,64例临床局限型前列腺癌患者的cfDNA水平[(15.4±0.9) ng/mL]显著高于45名健康男性[(5.5±3.5) ng/mL,P<0.001],并且血浆游离DNA水平还和前列腺癌分期相关,T3期明显高于T2期[(17.5±12.1) ng/mL vs (12.6±8.4) ng/mL;P<0.05]。目前有关cfDNA应用于前列腺癌诊断的研究数据尚少,但这些研究视野的拓展和新发现,为肿瘤的早发现、早诊断提供了新的思路和方法。
近年来,有关cfDNA水平或某一特定相关基因的水平与抗肿瘤(包括手术、放疗、新辅助化疗及姑息性化疗等)疗效预测方面的研究陆续出现。Kienel等[26]入组了59例前列腺癌患者,其中48例(81.4%)接受多西他赛化疗的CRPC患者基线cfDNA水平和PSA下降的幅度呈负相关,而在评价生存期方面,cfDNA大于等于55 ng/mL(5例)和小于55 ng/mL的无疾病生存期(progression-free sunival,PFS)分别为9.4和7.5个月,OS分别为17.0和31.5个月。Salvi等[22]共入组了53例CRPC患者,在服用阿比特龙之前抽取外周血,测定其AR及CYP17A1基因的拷贝数(CNVs),并根据正常对照组的测定结果将其分为有拷贝组和无拷贝组,结果表明,相较于无拷贝组,AR及CYP17A1基因有拷贝组的PFS明显缩短(2.8 vs 9.5个月,P<0.000 1;2.8 vs 9.2个月,P=0.001 4),在OS分析中也能观察到同样的结果,且多因素分析表明,AR基因有拷贝是PFS及OS的独立预测因子(P=0.000 4,P=0.002 6)。这些研究表明患者血浆中cfDNA的总量或某一基因的相对数量可以作为患者疗效预测的指标,这为实时无创地监测患者治疗之后的疗效提供了新的方向。
上述研究主要从cfDNA整体水平变化进行探讨,近年来随着分子生物学研究的深入,针对与疾病关系明确的DNA片段进行定性分析成为新的研究主体。Lallous等[27]通过对CRPC患者外周血ctDNA进行基因组分析,以AR BF3位点为靶点的恩杂鲁胺在CRPC患者中可有效阻碍其他24个AR突变的活性。此外在Azad等[28]的一项研究中,共入组62例因疾病进展停止服用阿比特龙(n=29)、恩杂鲁胺(n=19)或者其他药物(n=14)的转移性去势抵抗性前列腺癌(mCRPC)患者,其中有53%的恩杂鲁胺耐药的患者能够检测到AR表达增强,而AR基因8号外显子错义突变在11例(18%)患者中检测到,包括在1例恩杂鲁胺耐药患者中首次检测到的F876L突变和在7例阿比特龙耐药患者中首次检测到的H874Y和T877A突变;随后有39例患者服用了恩杂鲁胺,其服药前AR基因表达增加和(或)8号外显子突变和更低的PSA反应率(下降大于等于30%,P=0.013)及更短的影像学/临床PFS呈显著相关(P=0.01)。
目前肿瘤患者的临床处理正在从基于患者临床特征选择治疗方案的传统治疗模式,转变为基于患者肿瘤分子表达谱选择治疗方法的个体化治疗模式,这种全新的医疗模式以个人基因组信息为基础,为患者量身设计出最佳治疗方案,包括选择合适的药物及正确的剂量,预测药物的疗效等,对于CRPC患者而言,通过对cfDNA进行基因分析可为其选择更为个体化的治疗方案提供重要参考。
cfDNA可以直接从患者的外周血中获取,通过分析肿瘤患者和健康个体游离DNA的差异,为非侵入性肿瘤诊断及病情监测提供了一种新的可能性,有望发展成为一种新型的肿瘤学监测指标。作为一种灵敏、特异、无创的分子生物学检测手段,检测cfDNA可以便捷地对肿瘤做出早期诊断、进行疗效监测及对恶性肿瘤做出预后评价,这也是未来cfDNA用于临床的主要方面。但是,我们也应该看到,作为一个新兴的检测指标,各个中心对于ctDNA的大量患者对照研究结果还有较大的差异,尤其是尚未建立标准化的监测方法,是其应用于临床的一大瓶颈。因此,未来ctDNA检测方法的改进及大规模临床试验的开展是其应用于临床所需要的。
3 小结
对于CTC而言,其相关研究及研究方法已较成熟,通过在临床治疗前进行CTC检测,建立基数水平,在治疗过程中监测CTC数目的变化,可以更好地监测治疗效果、评估预后及制订个性化治疗方案;也可以对CTC分选后研究其分子生物学特性,尽可能多地寻找肿瘤分子标记,在提高CTC检测特异度的同时,可为肿瘤治疗提供更多的预后指标及新的治疗靶点。而循环肿瘤DNA研究虽起步较晚,但是其具有与肿瘤细胞直接相关的分子生物学特征的特性使得其在肿瘤的早期诊断及个体化治疗方面有着广阔的应用前景,尤其是近10年来数字PCR和NGS的发展,显著促进了其临床研究的步伐。
除了CTC、cfDNA/ctDNA之外,循环外泌体、小分子RNA和长链非编码RNA也在肿瘤的发生过程中起着重要的作用,作为“液体活检”的组成部分应用于临床方面有着良好的前景。但是作为新兴的检测手段,CTC和ctDNA仍有不少问题值得我们去探索,富集、检测技术的改进,辅助前列腺癌诊断、预后判断及疗效监测都需要进一步、大规模的临床数据证实,这也是循环肿瘤标志物未来真正应用于临床所需要面临的挑战。
[1] SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics,2015[J]. CA Cancer J Clin, 2015, 65(1): 5-29.
[2] CRISTOFANILLI M, BUDD G T, ELLIS M J, et al. Circulating tumor cells, disease progression, and survival in metastatic breast cancer[J]. N Engl J Med, 2004, 351(8): 781-791.
[3] COHEN S J, PUNT C J, IANNOTTI N, et al. Relationship of circulating tumor cells to tumor response, progressionfree survival, and overall survival in patients with metastatic colorectal cancer[J]. J Clin Oncol,2008, 26(19):3213-3221.
[4] DE BONO J S, SCHER H I, MONTGOMERY R B, et al.Circulating tumor cells predict survival benefit from treatment in metastatic castration-resistant prostate cancer[J]. Clin Cancer Res, 2008, 14(19): 6302-6309.
[5] ASHWORTH T R. A case of cancer in which cells similar to those in the tumors were seen in the blood after death[J].Aust Med J, 1869, 14(3): 146-149.
[6] PAGET S. The distribution of secondary growths in cancer of the breast1889[J]. Cancer Metastasis Rev, 1989, 8(2): 98-101.
[7] AGUIRRE-GHISO J A. Models, mechanisms and clinical evidence for cancer dormancy[J]. Nat Rev Cancer,2007,7(11): 834-846.
[8] 兰 峰, 刘永萍. 循环肿瘤细胞检测的临床进展[J]. 现代肿瘤医学, 2015(15): 2219-2222.
[9] HONG B, ZU Y. Detecting circulating tumor cells: current challenges and new trends[J]. Theranostics, 2013, 3(6):377-394.
[10] SCHWARZENBACH H, ALIX-PANABIERES C, MULLER I, et al. Cell-free tumor DNA in blood plasma as a marker for circulating tumor cells in prostate cancer[J]. Clin Cancer Res, 2009, 15(3): 1032-1038.
[11] GOODMAN O J, FINK L M, SYMANOWSKI J T, et al.Circulating tumor cells in patients with castration-resistant prostate cancer baseline values and correlation with prognostic factors[J]. Cancer Epidemiol Biomarkers Prev, 2009, 18(6):1904-1913.
[12] OKEGAWA T, NUTAHARA K, HIGASHIHARA E.Immunomagnetic quantification of circulating tumor cells as a prognostic factor of androgen deprivation responsiveness in patients with hormone naive metastatic prostate cancer[J].J Urol, 2008, 180(4): 1342-1347.
[13] REID A H, ATTARD G, DANILA D C, et al. Significant and sustained antitumor activity in post-docetaxel, castrationresistant prostate cancer with the CYP17 inhibitor abiraterone acetate[J]. J Clin Oncol, 2010, 28(9): 1489-1495.
[14] STEINESTEL J, LUEDEKE M, ARNDT A, et al. Detecting predictive androgen receptor modifications in circulating prostate cancer cells[J]. Oncotarget, 2015, 5. [Epub ahead of Print]
[15] ANTONARAKIS E S, LU C, WANG H, et al. AR-V7 and resistance to enzalutamide and abiraterone in prostate cancer[J]. N Engl J Med, 2014, 371(11): 1028-1038.
[16] KIRBY B J, JODARI M, LOFTUS M S, et al. Functional characterization of circulating tumor cells with a prostatecancer-specific microfluidic device[J]. PLoS One, 2012,7(4): e35976.
[17] CHANG K, KONG Y Y, DAI B, et al. Combination of circulating tumor cell enumeration and tumor marker detection in predicting prognosis and treatment effect in metastatic castration-resistant prostate cancer[J]. Oncotarget, 2015,6(39): 41825-41836.
[18] PERKINS G, YAP T A POPE L et al. Multi-purpose utility of circulating plasma DNA testing in patients with advanced cancers[J]. PLoS One, 2012 7(11): e47020.
[19] FUJIWARA K, FUJIMOTO N, TABATA M, et al.Identification of epigenetic aberrant promoter methylation in serum DNA is useful for early detection of lung cancer[J].Clin Cancer Res, 2005, 11(3): 1219-1225.
[20] DIEHL F, SCHMIDT K, CHOTI M A et al. Circulating mutant DNA to assess tumor dynamics[J]. Nat Med, 2008, 14(9):985-990.
[21] IGNATIADIS M, DAWSON S J. Circulating tumor cells and circulating tumor DNA for precision medicine: dream or reality?[J]. Ann Oncol, 2014 25(12): 2304-2313.
[22] SALVI S, CASADIO V, CONTEDUCA V, et al. Circulating cell-free AR and CYP17A1 copy number variations may associate with outcome of metastatic castration-resistant prostate cancer patients treated withabiraterone[J]. Br J Cancer, 2015 112(10): 1717-1724.
[23] LIANOS G D, MANGANO A, KOURAKLIS G, et al. Dynamic sequencing of circulating tumor DNA: novel noninvasive cancer biomarker[J]. Biomark Med, 2014, 8(5): 629-632.
[24] ALLEN D, BUTT A, CAHILL D, et al. Role of cell-free plasma DNA as a diagnostic marker for prostate cancer[J].Ann N Y Acad Sci, 2004, 1022: 76-80.
[25] ALTIMARI A, GRIGIONI A D, BENEDETTINI E, et al.Diagnostic role of circulating free plasma DNA detection in patients with localized prostate cancer[J]. Am J Clin Pathol, 2008, 129(5): 756-762.
[26] KIENEL A, PORRES D, HEIDENREICH A, et al. cfDNA as a prognostic marker of response to taxane based chemotherapy in patients with prostate cancer[J]. J Urol, 2015, 194(4):966-971.
[27] LALLOUS N, VOLIK S V, AWREY S, et al. Functional analysis of androgen receptor mutations that confer antiandrogen resistance identified in circulating cell-free DNA from prostate cancer patients[J]. Genome Biol, 2016, 17:10.
[28] AZAD A A, VOLIK S V, WYATT A W, et al. Androgen receptor gene aberrations in circulating cell-free DNA:biomarkers of therapeutic resistance in castration-resistant prostate cancer[J]. Clin Cancer Res, 2015, 21(10): 2315-2324.
Research progress on circulating tumor biomarkers in prostate cancer
LI Gaoxiang, YANG Yunjie,DAI Bo (Department of Urology, Fudan University Shanghai Cancer Center, and Department of Oncology,Shanghai Medical College, Fudan University, Shanghai 200032, China)
DAI Bo E-mail: bodai1978@126.com
Prostate cancer is one of the most common malignant tumors. Although (prostate-specif i c antigen,PSA) screening and multidisciplinary therapy had largely improved the therapy effects, new biological markers are needed to achieve individual treatment for prostate cancer. Circulating tumor biomarkers originate from primary tumor tissues and have close relationship with cancer metastases and prognosis. This review summarized the circulating tumor biomarkers detection methods and relevant clinical research in recent years.
Prostate cancer; Circulating tumor biomarkers; Detection; Individual treatment
10.19401/j.cnki.1007-3639.2017.10.012
R737.25
A
1007-3639(2017)10-0833-06
戴 波 E-mail:bodai1978@126.com
2017-04-02
2017-09-02)

