直肠癌术前扩散加权成像层面及感兴趣区的选择对ADC值一致性及重复性的影响
孙轶群,顾雅佳,童 彤,信 超,彭卫军
1. 复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032;
2. 上海影像医学研究所,上海200032
直肠癌术前扩散加权成像层面及感兴趣区的选择对ADC值一致性及重复性的影响
孙轶群1,2,顾雅佳1,童 彤1,信 超1,彭卫军1
1. 复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032;
2. 上海影像医学研究所,上海200032
背景与目的:扩散加权成像(diffusion weighted imaging,DWI)定量参数即表观扩散系数(apparent diffusion coefficient,ADC)的一致性及可重复性是众多研究关注的重点。既往研究结果显示b值、感兴趣区(region of interest,ROI)的选择等因素对ADC值一致性及可重复性均有一定影响。本研究将探讨直肠癌术前DWI层面及ROI的选择对ADC值一致性及重复性的影响。方法:回顾性分析80例病理证实为直肠腺癌的患者资料,此组患者均行直肠MR及DWI检查。2名不同年资的医师分别在ADC图像上采用肿瘤中心法及轮廓法勾画ROI,层面选择了肿瘤最大层、肿瘤最大层及其上下两层及肿瘤全层三种方法。其中肿瘤轮廓法采用手动勾画模式,尽量沿肿瘤轮廓勾画ROI。肿瘤中心法使用圆形ROI工具,肿瘤实性部分尽可能圈入而避开病变内坏死或囊变区。两名医师用三种层面和两种ROI放置法间隔2周进行重复测量。使用ANOVA法比较不同层面之间ADC值差异,配对t检验比较两种ROI之间ADC值差异。计算组内相关系数(interclass correlation coefficient,ICC),并分别比较同一医师前后两次及两名医师之间测量值的可重复性(Bland-Altman法)。结果:将三种层面法测得ADC值进行两两比较,差异均无统计学意义(P>0.05)。相同层面的情况下,肿瘤轮廓法测得ADC值均大于肿瘤中心法,且差异有统计学意义(P<0.05)。选择肿瘤全层-肿瘤中心法及轮廓法测量ADC值,组内及组间一致性可达到0.931、0.803和0.913、0.822。医师1前后两次分别采用肿瘤中心法及肿瘤轮廓法测定ADC值,测得的ADC值95%一致性区间为(-0.089 3~0.083 1)×10-3mm2/s(P:Mean=0,P>0.05),(-0.066 8~0.096 3)×10-3mm2/s(P:Mean=0,P<0.05);医师1与医师2使用采用肿瘤中心法及肿瘤轮廓法测定ADC值,测得的ADC值95%一致性区间为(-0.127 5~0.141 6)×10-3mm2/s(P:Mean=0,P>0.05),(-0.112 0~0.150 2)×10-3mm2/s(P:Mean=0,P<0.05)。Bland-Altman散点图显示,肿瘤中心法较轮廓法在同一医师前后两次间及两名医师间重复测量一致性区间小,重复性好。结论:不同层面选择对直肠癌ADC值影响不大;而轮廓法测得ADC值大于中心法。肿瘤全层-肿瘤轮廓法及中心法测得ADC值一致性均较高。但肿瘤全层-中心法重复性稍好且操作简便;而肿瘤全层-轮廓法重复性较中心法稍差,但能反映肿瘤整体情况。
直肠癌;扩散加权成像;表观扩散系数;感兴趣区
扩散加权成像(diffusion weighted imaging,DWI)是一种MR功能成像技术,可通过测量表观扩散系数(apparent diffusion coefficient,ADC)反映活体组织中水分子的扩散运动,从细胞及分子水平了解病变内部结构变化,包括细胞密度、细胞膜完整性及坏死等[1-5]。许多研究不仅证实ADC值与直肠癌分化程度、肿瘤细胞增殖及活性密切相关[6-10],而且对于评价直肠癌恶性程度、监测疗效也具有重要的临床意义[11-13]。DWI定量参数的可重复性是临床关注的重点,既往研究结果显示,扫描序列、b值及感兴趣区(region of interest,ROI)的选择等因素对ADC值测量的重复性均有一定影响[14-16],尤其是恶性肿瘤组织异质性的特性,使得ROI的选择成为影响ADC值的重要因素。为了确保ADC值结果可靠性高,即具有较高的可重复性,此次研究采用 3.0 T MR对直肠癌患者术前行DWI序列扫描,旨在探讨不同层面及不同ROI的选取对ADC值一致性及重复性的影响。
1 资料和方法
1.1 一般资料
符合以下标准的患者纳入研究。纳入标准:① 2016年2月—2016年11月经复旦大学附属肿瘤医院病理证实为直肠腺癌的患者;② 患者均接受直肠MR检查,包括DWI序列;③ 患者在直肠MR检查前未接受过任何针对肿瘤的治疗;④ 患者在接受直肠MR检查后2周内接受手术治疗。排除标准:① 肿瘤体积过小,在DWI及ADC图像上肿瘤信号不明显;② 图像质量不佳。此次共有80例患者纳入研究,其中男性45例、女性35例;年龄30~83岁,中位年龄60岁。T1-4期分别有3、34、42及1例患者,T4期患者因肠梗阻直接行手术治疗。
1.2 扫描方法
MR扫描前患者尽量排空内容物,未经药物抑制肠道蠕动,未使用肠道对比剂。SIEMENS(德国Healthcare公司,MAGNETOM Skyra)3.0 MR进行扫描,使用相控阵表面线圈完成图像采集,患者仰卧位,脚先进。主要扫描序列包括常规T1WI、薄层T2WI序列以及DWI序列,以上均为轴位序列。主要扫描参数见表1。
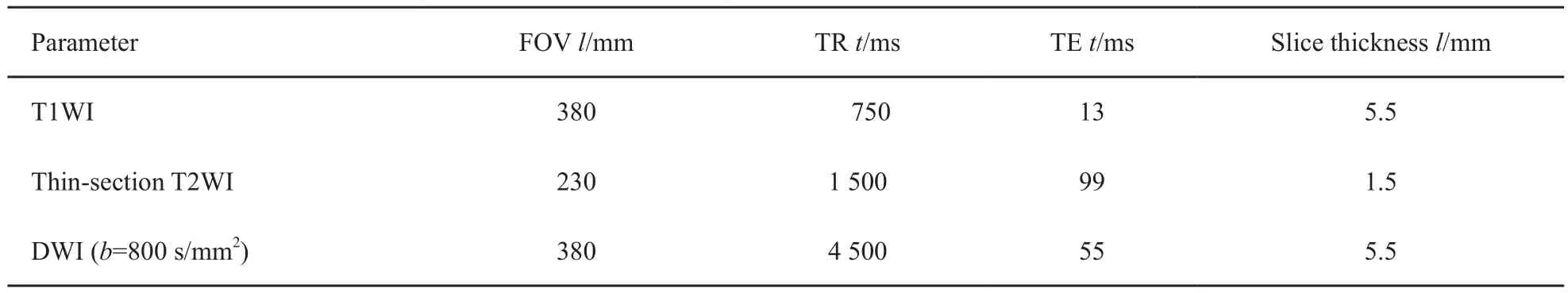
表1 直肠MR主要序列参数Tab. 1 Main sequence parameters of rectal MR
1.3 图像处理及分析
将扫描原始图像传至SIEMENS后处理工作站,由2名影像专业医师(一名医师从事直肠影像研究4年即医师1,一名医师从事直肠影像研究10年即医师2)在不知病理结果的情况下,独立应用SIEMENS后处理软件对图像进行处理和测量分析。参照薄层T2WI图像,选择ADC图肿瘤低信号区域进行勾画,ROI采用以下2种:
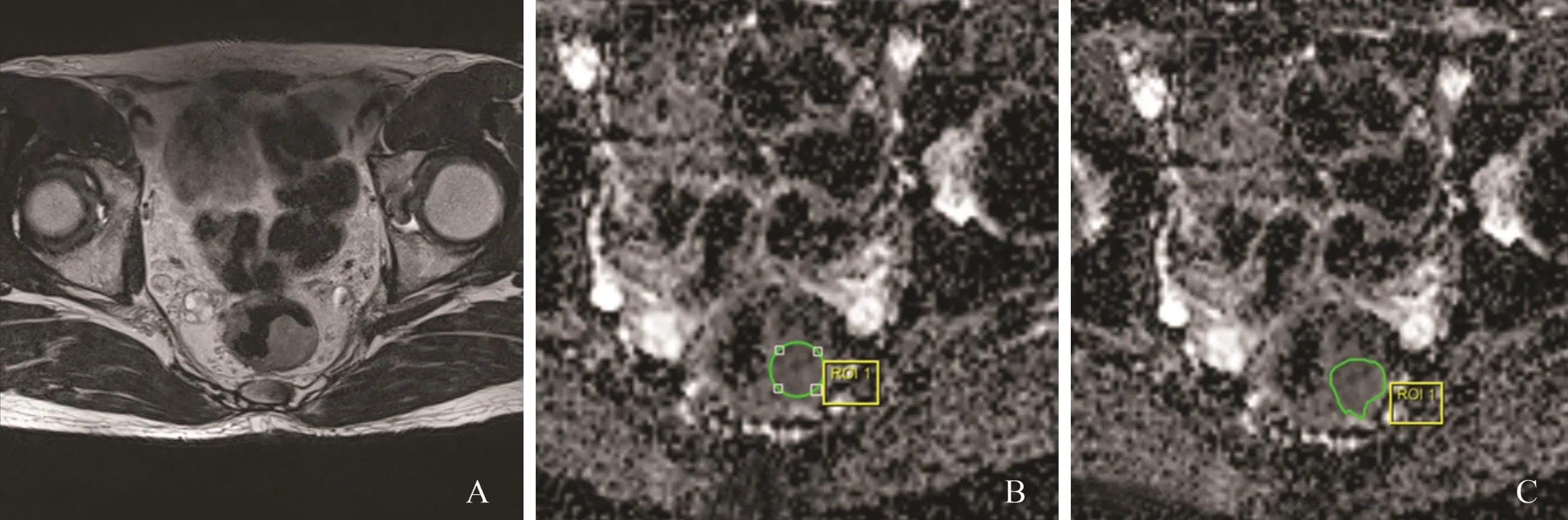
图 1 ROI勾画方式Fig. 1 ROI protocols
① 中心法:使用圆形ROI工具,并尽可能圈入肿瘤但避开病变内坏死或囊变区;② 轮廓法:采用手动勾画模式,尽量沿着肿瘤的轮廓勾画ROI,避开肉眼可辨的肠管内气体或液体(图1)。放置两种ROI的层面又分为3种[12-13]:肿瘤最大层面、肿瘤最大层面及其上下两层即“三层面”、以及肿瘤全部层面,后两种层面最终ADC为几个层面测量的平均值。每名医师间隔2周重复测量,每人前后各6组共12组数据。
1.4 统计学处理
不同层面选取法所得ADC值(参与统计的ADC值为两个医师前后两次所测ADC值的平均值)的比较使用ANOVA分析。医师1、2使用相同的层面选取法但不同ROI勾画法测量所得ADC值(参与统计的ADC值为两个医师前后两次所测ADC值的平均值)的比较使用配对t检验。两名医师及同一医师前后两次测量的ADC值一致性用组内相关系数(intraclass correlation coefficient,ICC)评价,ICC为0.00~0.20为一致性差,0.21~0.40为一致性一般,0.41~0.60为一致性中等,0.61~0.80为一致性良好,0.81~1.00为一致性好。使用Bland-Altman方法评价测量值的可重复,计算差值的95%CI。P<0.05为差异有统计学意义。使用MedCalc 11.5.0和SPSS 19.0统计学软件进行数据统计。P<0.05为差异有统计学意义。
2 结 果
2.1 不同层面测得肿瘤ADC值的比较
将三种层面测得ADC值两两比较,差异均无统计学意义(P>0.05,表2)。
2.2 不同ROI测得肿瘤ADC值的比较
同一种层面情况下,ROI轮廓法测定的ADC值均大于肿瘤中心法的测量值,且差异有统计学意义(P<0.05,表3)。
2.3 ADC值的一致性
两名医师使用不同层面及不同ROI勾画法对直肠癌ADC值进行测量,每名医师间隔2周重复测量,每人前后各6组共12组数据。肿瘤全部层面的一致性均较其他两种层面好,其中肿瘤中心法及轮廓法的组内及组间一致性可达到0.931、0.803和0.913、0.822(表4)。
2.4 ADC值的重复性
医师1前后两次分别采用肿瘤中心法及肿瘤轮廓法测定ADC值,测得的ADC值95%一致性区间为 (-0.089 3~0.083 1)×10-3mm2/s(P:Mean=0,P>0.05),(-0.066 8~0.096 3)×10-3mm2/s (P<0.05,表5),Bland-Altman散点图显示肿瘤中心法较轮廓法在同一医师前后两次间测量的ADC值更集中,重复性好(图2)。
医师1与医师2采用肿瘤中心法及肿瘤轮廓法测定ADC值,测得的ADC值95%一致性区间为(-0.127 5~0.141 6)×10-3mm2/s(P:Mean=0,P>0.05),(-0.112 0~0.150 2)×10-3mm2/s(P<0.05),Bland-Altman散点图显示肿瘤中心法较轮廓法在不同医师间测量的ADC值更集中,重复性好(图3)。
表 2 不同层面选取法测得肿瘤ADC值的比较Tab. 2 Comparison of three different slices for ADC values
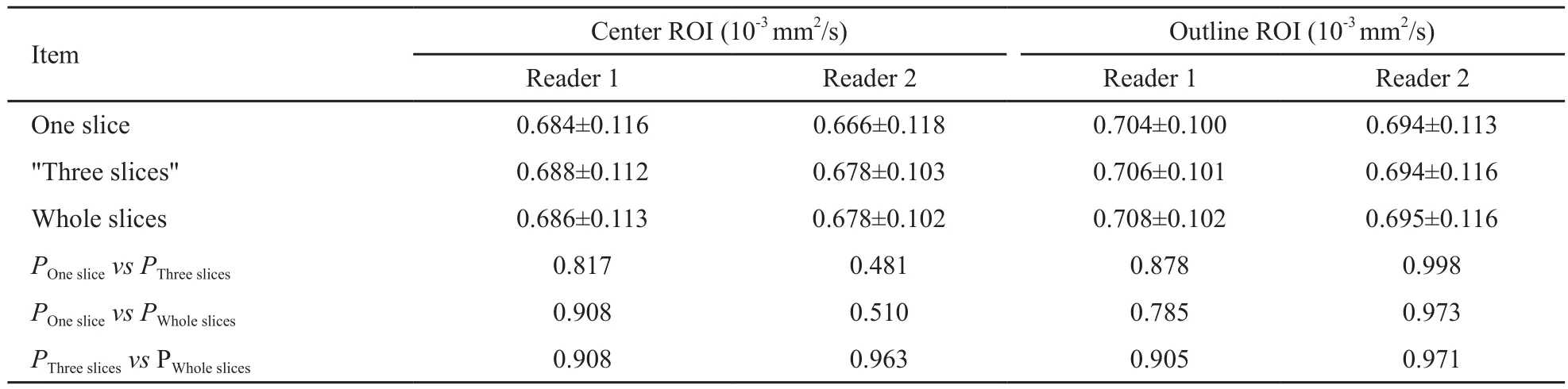
表 2 不同层面选取法测得肿瘤ADC值的比较Tab. 2 Comparison of three different slices for ADC values
Item Center ROI (10-3 mm2/s) Outline ROI (10-3 mm2/s)Reader 1 Reader 2 Reader 1 Reader 2 One slice 0.684±0.116 0.666±0.118 0.704±0.100 0.694±0.113"Three slices" 0.688±0.112 0.678±0.103 0.706±0.101 0.694±0.116 Whole slices 0.686±0.113 0.678±0.102 0.708±0.102 0.695±0.116 POneslice vs PThreeslices 0.817 0.481 0.878 0.998 POneslice vs PWholeslices 0.908 0.510 0.785 0.973 PThreeslices vs PWholeslices 0.908 0.963 0.905 0.971
表 3 不同 ROI选取方法测得的肿瘤ADC值的比较Tab. 3 Comparison of center and outline ROI for ADC values
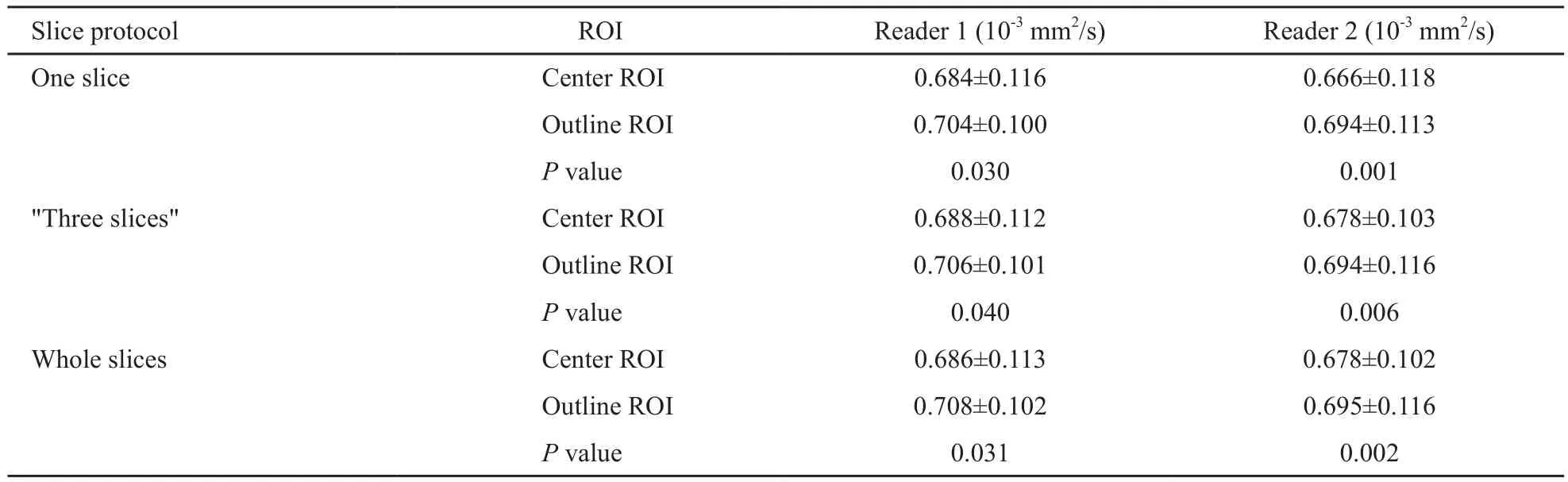
表 3 不同 ROI选取方法测得的肿瘤ADC值的比较Tab. 3 Comparison of center and outline ROI for ADC values
Slice protocol ROI Reader 1 (10-3 mm2/s) Reader 2 (10-3 mm2/s)One slice Center ROI 0.684±0.116 0.666±0.118 Outline ROI 0.704±0.100 0.694±0.113 P value 0.030 0.001"Three slices" Center ROI 0.688±0.112 0.678±0.103 Outline ROI 0.706±0.101 0.694±0.116 P value 0.040 0.006 Whole slices Center ROI 0.686±0.113 0.678±0.102 Outline ROI 0.708±0.102 0.695±0.116 P value 0.031 0.002
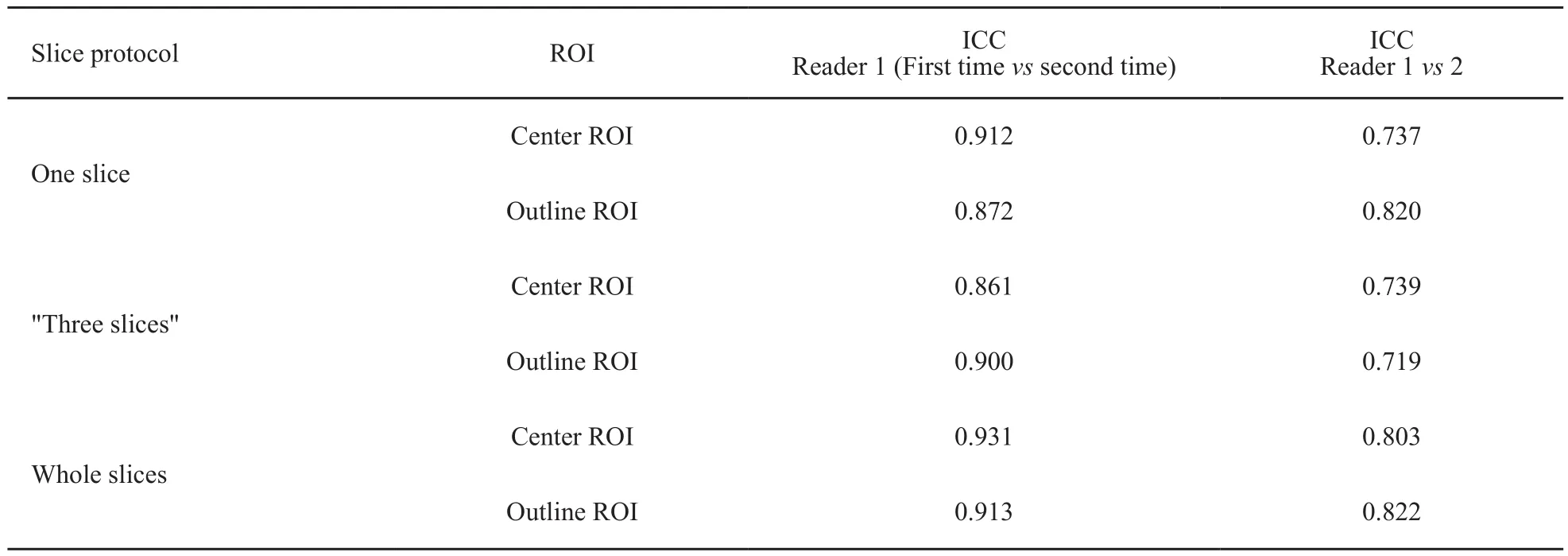
表 4 观察者ADC值的一致性Tab. 4 Intraclass correlation coefficients between the repetitions of one reader, two readers about the ADC values
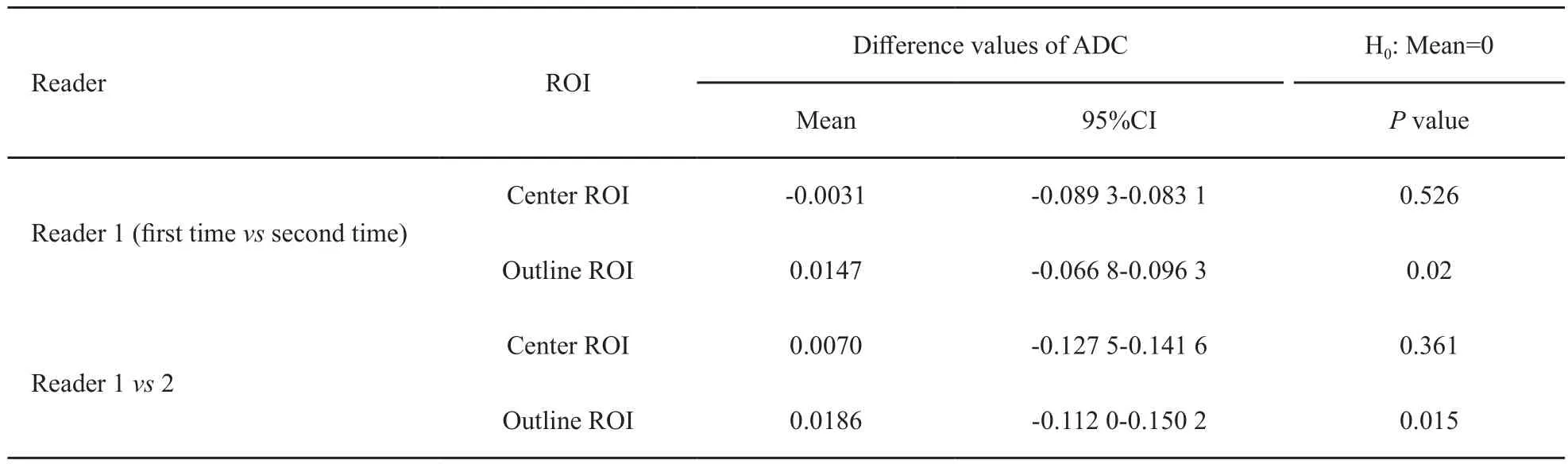
表 5 同一医师前后两次及两名医师对直肠癌患者采用肿瘤全层-中心法及轮廓法测得ADC值差值Tab. 5 Compare the difference values of ADC between whole slices-center ROI and the whole slices-outline ROI
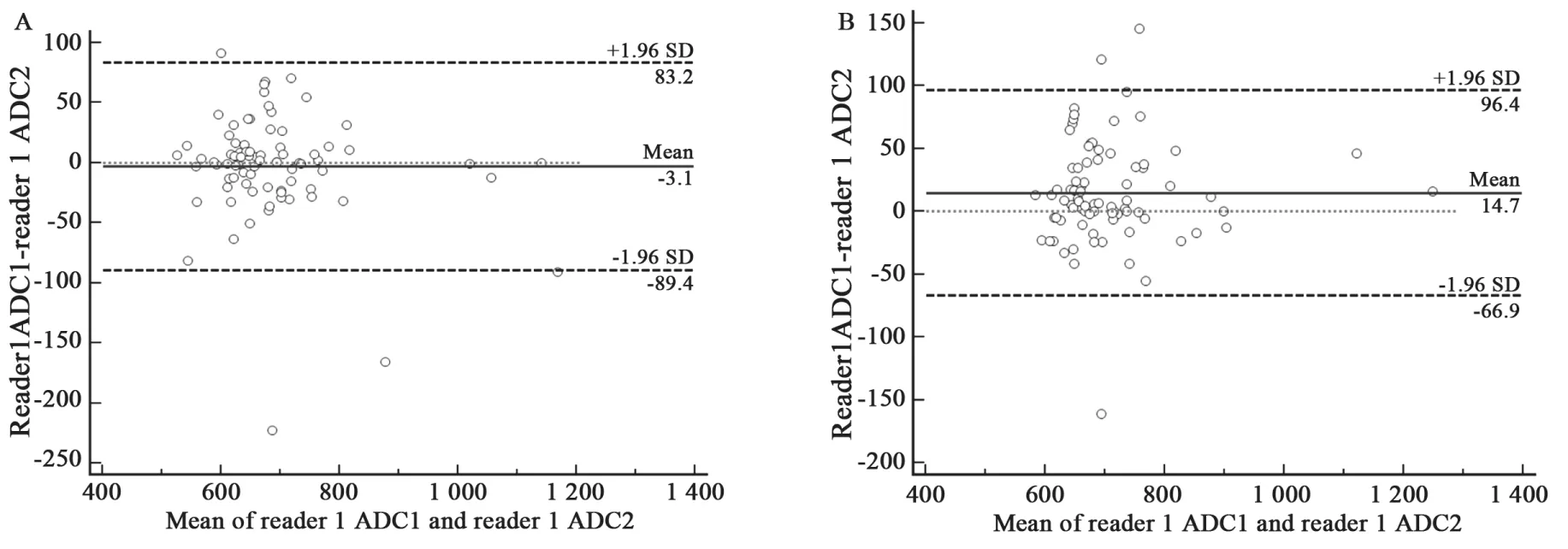
图 2 同一观察者前后两次测得ADC的重复性Fig. 2 Interobserver variability for fi rst and second measurements(the same reader) by the different ROI protocols
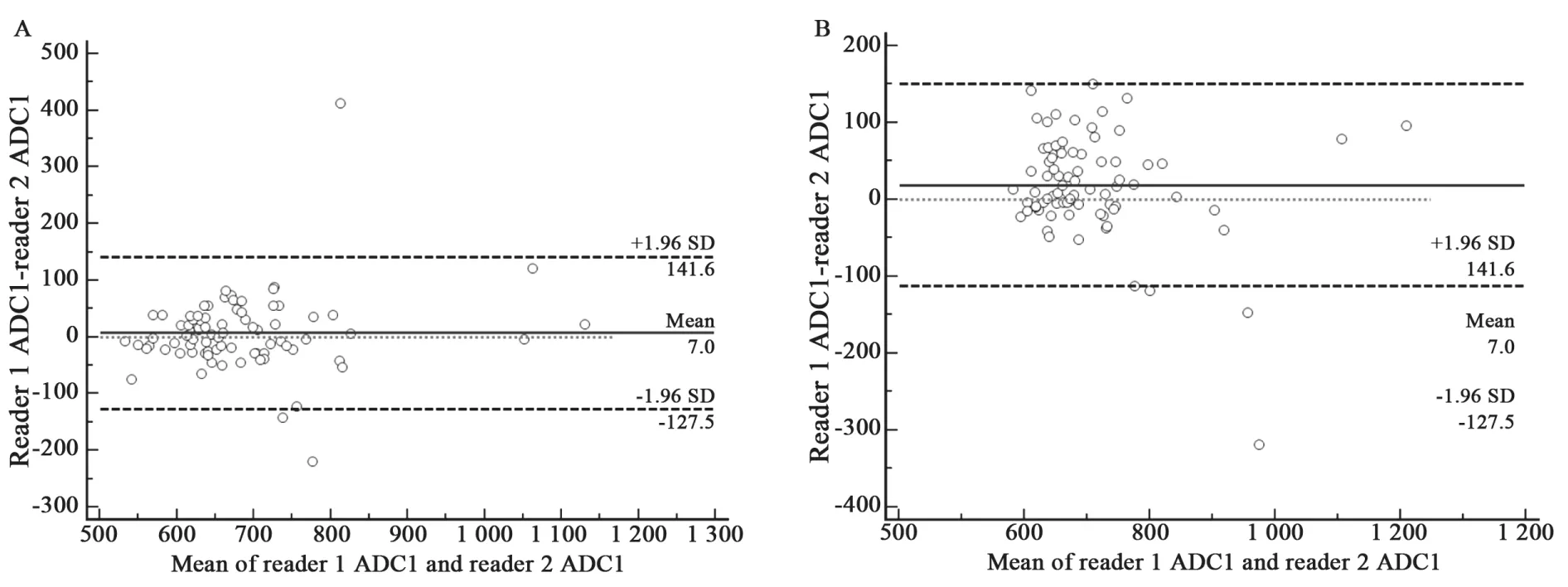
图 3 两名观察者测得ADC的重复性Fig. 3 Interobserver variability for two readers’ measurement by the different ROI protocols
3 讨 论
DWI在直肠癌定性和新辅助治疗疗效评估中有非常重要的价值,但仍存在一些焦点问题。如目前较多学者认为,ADC对预测及评价直肠癌治疗反应有临床意义,但各研究ADC值的诊断界值不同[17-18],原因可能是ADC值的测定受外界因素干扰,如b值的选择、医师经验及ROI的画法(大小、数目及位置等)等[14-16]。随着DWI在临床中角色越来越重要,因此ADC值的测量方法亟待组织多中心研究加以规范。为提高本团队研究结果可信度,也为了使研究结果在各研究平台和研究团队之间进行比较,本研究重点评价直肠癌术前ADC值测量一致性及可重复性,尽量将测量方式标准化以减少其对研究结果的影响。
直肠癌ADC值测量层面的选择,大部分研究中使用以下几种:肿瘤最大层面、肿瘤最大层面及其相邻的上下两层(小于等于3层)及肿瘤全层。ROI的勾画方式多为:固定ROI大小法即选取相同面积大小的圆形ROI,避开病变内坏死或囊变区域;肿瘤中心法:使用圆形ROI工具,肿瘤实性部分尽可能圈入而避开病变内坏死或囊变区;肿瘤轮廓法即采用手动勾画模式,尽可能沿着肿瘤的轮廓勾画ROI。此次研究中,笔者使用了以上3种层面选择方式。考虑到固定ROI大小法难以推广,原因在于放置多少个像素的类圆形ROI比较合理及对于小于此ROI大小的直肠肿瘤如何处理不确定。结合临床可操作性,因此本研究中ROI勾画方式使用了肿瘤中心法及肿瘤轮廓法,该方法操作灵活且ROI大小视肿瘤本身情况而定。
本研究结果显示层面选择不同,测所得的ADC值差异无统计学意义(P>0.05),提示层面选择对ADC值影响较小,Lambregts等[14]研究结果显示,全肿瘤容积测量与单层面测量的ADC值间差异无统计学意义,也支持本次研究结果。两名医师采用轮廓法所得ADC值均高于中心法。分析原因在于:中心法ROI内肿瘤病灶更偏实性,囊变坏死区少,病灶单位体积内肿瘤细胞更多,ADC值较低[19-20];轮廓法则将所选择层面的所有肿瘤信号都圈入在内,更能反映影像尚不足以显示出来的细小灶性坏死等改变,当然肿瘤边缘区域的部分容积效应影响也会使轮廓法测得的ADC值偏高。
此外本研究结果显示,使用肿瘤全部层面-肿瘤中心法及轮廓法,对于同一观察者不同时间所测结果及不同观察者所测的ADC值间一致性好(ICC大于0.8),与Lambregts等[14]报道相似,该研究也认为全肿瘤容积测量ADC值一致性好。相比较单个层面和三个层面的选择会产生选择性偏倚不同,肿瘤全部层面的勾画会使层面选择的偏倚降低,因此会有较好的一致性。Bland-Altman散点图显示,同一医师前后两次及不同医师间肿瘤中心法测量ADC值的重复性均高于轮廓法,且肿瘤中心法操作简单节省时间,因此该方法最容易在临床上推广使用。肿瘤轮廓法尽可能的沿着肿瘤轮廓进行ROI的勾画,最能反映肿瘤整体信息,但重复性较中心法稍差;并且工作量大、耗时长。考虑到临床工作实际情况且综合以上分析结果,笔者推荐使用肿瘤全层-中心法ROI测量直肠癌患者ADC值。
本研究有一定局限性:① 仅考虑到层面选择及ROI勾画对ADC值一致性及重复性的影响,未涉及其他因素的影响;② 对手术患者勾画ROI,未对新辅助治疗的直肠癌患者勾画测量;③ 患者样本量不足够大,未能联合多家单位进行多中心研究;④ 肿瘤体积较小即仅显示1~2个层面,此时“三层面”及“全部层面”可能为一层或两层。
综上所示,不同层面所得直肠癌ADC值无明显差异,中心法测得ADC值低于轮廓法。而肿瘤全层-肿瘤轮廓法及中心法测得ADC值一致性高。两种方法各有优缺点,肿瘤中心法重复性较轮廓法稍好并且操作简便;肿瘤轮廓法最能反映肿瘤整体情况但繁琐耗时,笔者推荐使用前者。在临床操作过程中各位医师可根据研究需要及工作情况灵活选择。
[1] KOH D M, PADHANI A R. Diffusion-weighted MRI: a new functional clinical technique for tumour imaging [J]. Br J Radiol, 2006, 79(944): 633-635.
[2] KOH D M, COLLINS D J. Diffusion-weighted MRI in the body: applications and challenges in oncology[J]. Am J Roentgenol, 2007, 188(6): 1622-1635.
[3] PATTERSON D M, PADHANI A R, COLLINS D J.Technology insight: water diffusion MRI--a potential new biomarker of response to cancer therapy[J]. Nat Clin Pract Oncol, 2008, 5(4): 220-233.
[4] PADHANI A R, LIU G, MU-KOH D, et al. Diffusionweighted magnetic resonance imaging as a cancer biomarker:consensus and recommendations[J]. Neoplasia, 2009,11(2): 102-125.
[5] ZHU H B, ZHANG X Y, ZHOU X H, et al. Assessment of pathological complete response to preoperative chemoradiotherapy by means of multiple mathematical models of diffusion-weighted MRI in locally advanced rectal cancer:A prospective single-center study[J]. J Magn Reson Imaging, 2016, [Epub ahead of print].
[6] CHARLES-EDWARDS, ELIZABETH M. Diffusion-weighted magnetic resonance imaging and its application to cancer[J]. Cancer Imaging, 2006, 6(1): 135-143.
[7] PADHANI A R, LIU G, MU-KOH D, et al. Diffusionweighted magnetic resonance imaging as a cancer biomarker:consensus and recommendations [J]. Neoplasia, 2009,11(2): 102-125.
[8] SUN Y S, CUI Y, TANG L, et al. Early evaluation of cancer response by a new functional biomarker: apparent diffusion coefficient[J]. Am J Roentgenol, 2011, 197(1): 23-29.
[9] DE COBELLI F, GIGANTI F, ORSENIGO E, et al. Apparent diffusion coefficient modifications in assessing gastrooesophageal cancer response to neoadjuvant treatment:comparison with tumour regression grade at histology[J].Eur Radiol, 2013, 23(8): 2165-2174.
[10] KIM Y C, LIM J S, KEUM K C, et al. Comparison of diffusionweighted MRI and MR volumetry in the evaluation of early treatment outcomes after preoperative chemoradiotherapy for locally advanced rectal cancer[J]. J Magn Reson Imaging,2011, 34(3): 570-576.
[11] IANNICELLI E, DI PIETROPAOLO M, PILOZZI E, et al.Value of diffusion-weighted MRI and apparent diffusion coefficient measurements for predicting the response of locally advanced rectal cancer to neoadjuvant chemoradiotherapy[J]. Abdom Radiol, 2016, 41(10): 1906-1917.
[12] SUN Y, TONG T, CAI S, et al. Apparent diffusion coefficient(ADC) value: a potential imaging biomarker that reflects the biological features of rectal cancer[J]. PloS one, 2014,9(10): e109371.
[13] TONG T, YAO Z, XU L, et al. Extramural depth of tumor invasion at thin-section MR in rectal cancer: Associating with prognostic factors and ADC value[J]. J Magn Reson Imaging, 2014, 40(3): 738-744.
[14] LAMBREGTS D M J, BEETS G L, MAAS M, et al. Tumour ADC measurements in rectal cancer: effect of ROI methods on ADC values and interobserver variability [J]. Eur Radiol,2011, 21(12): 2567-2574.
[15] INOUE C, FUJII S, KANEDA S, et al. Apparent diffusion coefficient (ADC) measurement in endometrial carcinoma:effect of region of interest methods on ADC values[J]. J Magn Reson Imaging, 2014, 40(1): 157-161.
[16] FUKUKURA Y, SHINDO T, HAKAMADA H, et al.Diffusion-weighted MR imaging of the pancreas: optimizing b-value for visualization of pancreatic adenocarcinoma[J].Eur Radiol, 2016, 26(10): 3419-3427.
[17] CHEN Y G, CHEN M Q, GUO Y Y, et al. Apparent diffusion coefficient predicts pathology complete response of rectal cancer treated with neoadjuvantchemoradiotherapy[J]. PloS one, 2016, 11(4): e0153944.
[18] MONGUZZI L, IPPOLITO D, BERNASCONI D P, et al.Locally advanced rectal cancer: value of ADC mapping in prediction of tumor response to radiochemotherapy[J]. Eur J Radiol, 2013, 82(2): 234-240.
[19] KONO K, INOUE Y, NAKAYAMA K, et al. The role of diffusion-weighted imaging in patients with brain tumors[J]. Am J Neuroradiol, 2001, 22(6): 1081-1088.
[20] RAZEK A A K A, GABALLA G, ELHAWAREY G, et al.Characterization of pediatric head and neck masses with diffusion-weighted MR imaging[J]. Eur Radiol, 2009,19(1): 201-208.
ADC value of rectal cancer at DWI: effect of slice protocol and region of interest on measurement consistency of parameters
SUN Yiqun1,2, GU Yajia1,TONG Tong1, XIN Chao1, PENG Weijun1(1.Department of Diagnostic Radiology, Fudan University Shanghai Cancer Center; Department of Oncology,Shanghai Medical College, Fudan University, Shanghai 200032, China; 2.Shanghai Institute of Medical Imaging, Shanghai 200032, China)
GU Yajia E-mail: cjr.guyajia@vip.163.com
Background and purpose:The apparent diffusion coefficient (ADC) values are the quantitative parameters of diffusion weighted imaging (DWI) which are influenced by many factors, such as b values and region of interest (ROI), and have become the concerns of research. Our study aimed to determine the measurement consistency of ADC in rectal cancer based on different ROIs.Methods:Eighty patients with histologically proven rectal cancer were examined using echo-planar DW MRI values (b value=800 s/mm2). ADC values were measured on ADC map.Mean tumor ADCs were measured according to three distinct slice protocols: ‘whole-slices’,‘single-slice of largest tumor’ and ‘tumor parts of largest independent tumor-containing slices and two adjacent slices’. The freehand ROI was drawn along the border of the high signal of the tumor on the b=800 images to cover the entire tumor area of each slice. Another ROI was drawn using circle tool to cover the entire tumor solid parts as large as possible. After 2 weeks of repeating the measurement between the two physicians. Differences in ADC values were measured using one-way ANOVA. The two protocols were compared for differences in ADC values using paired t-test. We calculated intra- and inter-observer variability using intraclass correlation coefficient (ICC) and Bland-Altman plot.Results:No signi fi cant difference was observed by ROIs for three distinct slice protocols (P>0.05). The ADC values obtained by ROIs for the outlined were higher than the ADC values obtained by ROIs for the center analysis (P<0.05). Intraand inter-observer ICC were 0.931, 0.803; 0.913, 0.822 by whole-slices-center and outline ROI respectively. The intraobserver 95% limits of consistency of ADC values were (-0.089 3 to 0.083 1)×10-3mm2/ s (P: Mean=0, P>0.05), (-0.066 8 to 0.096 3)×10-3mm2/s (P<0.05) with center and outline ROI, respectively. The inter-observer 95% limits of consistency of perfusion parameters were (-0.127 5 to 0.141 6)×10-3mm2/s (P>0.05), (-0.112 0 to 0.150 2)×10-3mm2/s (P<0.05) with center and outline ROI, respectively. Bland-Altman plot showed that whole-slices-center ROI could provide more reproducible and stable results.Conclusion:There was no statistically significant difference among three distinct slice protocols analysis of ADC values in rectal cancer. ADC values by whole-slices-center ROI protocol appropriately improved intra- and inter-observer consistency and could provide more reproducible and stable results with less time. ADC values by whole-slices-outlined ROI protocol appropriately indicated the overall situation, but needed more time.
Rectal cancer; Diffusion weighted imaging; Apparent diffusion coefficient; Region of interest
10.19401/j.cnki.1007-3639.2017.10.007
R735.3+7
A
1007-3639(2017)10-0801-08
国家自然科学基金(81501437)。
顾雅佳 E-mail:cjr.guyajia@vip.163.com
2017-05-12
2017-08-18)

