高脂联合小剂量链脲佐菌素建立实验性2型糖尿病大鼠模型
吴 瑛,张 勇,姚合斌
高脂联合小剂量链脲佐菌素建立实验性2型糖尿病大鼠模型
吴 瑛,张 勇,姚合斌
目的探讨建立具有胰岛素抵抗、近似人2型糖尿病特征的SD大鼠模型。方法将36只SD大鼠随机分为A组(对照组即普通饲料组)6只、B组(高脂饲料组)6只、C组[普通饲料+小剂量链脲佐菌素(streptozotocin,STZ)组]12只、D组(高脂饲料+小剂量STZ组)12只共4组。C组、D组大鼠分别在普通饲料和高脂饲料喂养4周后使用小剂量STZ(30 mg/kg)腹腔注射5 d。随机血糖>16.7 mmol/L且持续2周为建模成功。结果C组、D组能建立2型糖尿病SD大鼠模型,成模率分别为66.7%(8/12)、91.7%(11/12)。结论高脂饲料+小剂量STZ发病过程接近自然,成模率更高,模型稳定,是值得推广的2型糖尿病动物模型。
2型糖尿病;血糖;高脂;链脲佐菌素;模型,大鼠
糖尿病(diabetes mellitus,DM)及其慢性并发症已成为严重影响人类健康的全球性公共卫生问题之一。预计到2035年,全球将有近5.92亿人患DM[1],其中2型DM(type 2 DM,T2DM)占90%以上。目前DM的病因及发病机制并未完全阐明,因此建立可靠的动物模型,对T2DM发病机制的研究、治疗和预防至关重要。目前复制T2DM动物模型的方法有很多种,如膳食诱导、药物诱导、基因敲除、自发性模型等[2],但存在建模时间长、胰岛损伤重、经费高、不能完全模拟人类T2DM的发生过程等诸多问题。本研究用链脲佐菌素(streptozotocin,STZ)加高脂饲料诱导建立T2DM大鼠模型,以筛选出更适合建立此模型的STZ剂量和饲料配方,为优化方法提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性SD大鼠36只,无特定病原体级,体重150~180 g,由第三军医大学动物中心[SCXK-(渝)-2016-0004]提供。
1.1.2 饲料 普通饲料由第三军医大学实验动物中心提供。普通饲料含碳水化合物53%、脂肪25%、蛋白质22%;高脂饲料为普通饲料添加10%猪油、1%胆固醇混合加工而成,其中含碳水化合物39%、脂肪42%、蛋白质19%。
2 结果
2.1 成模 C组成模率为66.7%(8/12)、D组成模率为91.7%(11/12)。建模后,T2DM大鼠较正常大鼠逐渐出现进食与水量增多、排尿增多、体重下降、精神委靡、毛色枯黄、形体消瘦等特征。
2.2 体重 建模前各组大鼠体重差异无统计学意义(P>0.05);建模后的C组、D组体重明显低于A组,差异均有统计学意义(t分别为3.257、4.804,P分别为0.009、0.001),且D组体重下降明显。见表1。
2.3 随机血糖 建模前,各组随机血糖值均在正常范围(4~6 mmol/L)。建模后,A组、B组随机血糖值仍维持在正常水平,C组8只、D组11只随机血糖值维持在16.7 mmol/L以上且持续2周。C组、D组在建模后随机血糖值高于A组,差异均有统计学意义(t分别为14.290、21.244,P均为0.000)。见表1。
2.4 空腹血糖和胰岛素水平 建模后C组、D组空腹血糖高于A组(t分别为16.023、14.290,P均为0.000),B组空腹胰岛素高于A组(t=2.999、P=0.013)。见表1。
表1 建模前后大鼠体重、随机血糖、空腹血糖、空腹胰岛素(±s)
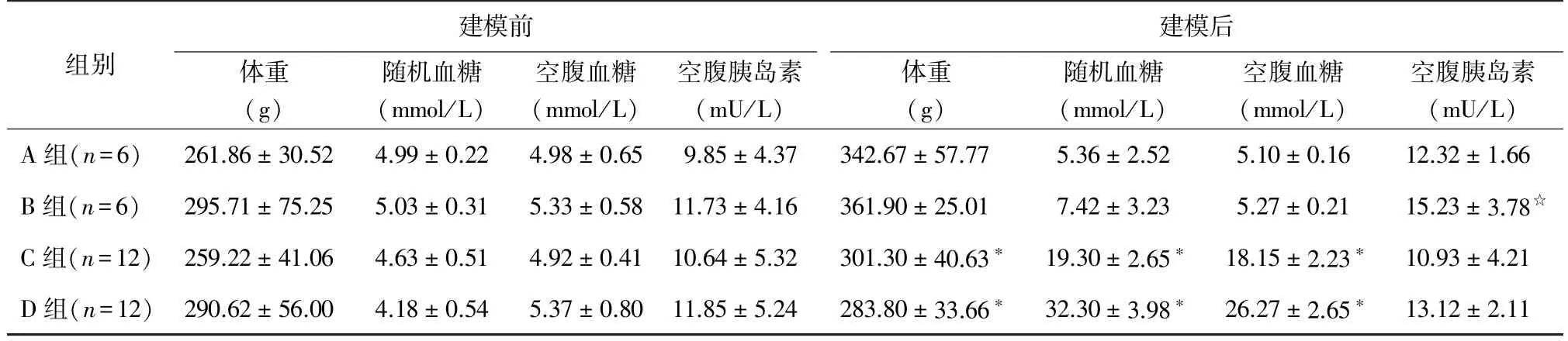
表1 建模前后大鼠体重、随机血糖、空腹血糖、空腹胰岛素(±s)
注:与A组比较,∗P<0.01,☆P<0.05
组别建模前体重(g)随机血糖(mmol/L)空腹血糖(mmol/L)空腹胰岛素(mU/L)建模后体重(g)随机血糖(mmol/L)空腹血糖(mmol/L)空腹胰岛素(mU/L)A组(n=6)261.86±30.524.99±0.224.98±0.659.85±4.37342.67±57.775.36±2.525.10±0.1612.32±1.66 B组(n=6)295.71±75.255.03±0.315.33±0.5811.73±4.16361.90±25.017.42±3.235.27±0.2115.23±3.78☆C组(n=12)259.22±41.064.63±0.514.92±0.4110.64±5.32301.30±40.63∗19.30±2.65∗18.15±2.23∗10.93±4.21 D组(n=12)290.62±56.004.18±0.545.37±0.8011.85±5.24283.80±33.66∗32.30±3.98∗26.27±2.65∗13.12±2.11
3 讨论
理想的DM动物模型应该具有相似的发病诱因、发病过程和临床特征,高血糖动物模型是否能在一定程度上代表临床T2DM的病理特征,是评判动物实验模型成功的关键。本研究将高脂饮食与STZ干预相结合,采用成年SD大鼠高脂喂养1个月后,产生胰岛素抵抗,再给予小剂量STZ腹腔注射成功诱导出病理、生理改变接近于人类的T2DM模型。
3.1 实验动物的选择 目前国内外对DM动物模型的研究很多,常根据不同的实验目的选择不同的动物,国内临床研究采用最多的是SD、Wistar大鼠。由于大鼠在建模过程中会出现多饮、多食、多尿及体重明显减轻等DM症状,SD大鼠与Wistar大鼠相比病死率低,抵抗力更强[3],且少见自发缓解现象[4-5],因此本实验选用了无特定病原体级的成年SD大鼠作为研究对象。
3.2 方法的选择 由于单纯高脂饲料喂养周期长,饲料成本较高,因此许多研究都选择药物联合诱导的方法;然而药物诱导DM模型也因药物选择、给药方式、给药剂量的不同,其成模效果也不同。给动物大剂量注射四氧嘧啶或STZ后破坏胰岛细胞,导致胰岛素分泌障碍,比较符合1型DM特征;多次小剂量注射STZ、高脂饮食+小剂量STZ联合使用诱发DM模型比较符合T2DM特征[6-7]。本实验采取高脂饮食+小剂量STZ腹腔注射,对组织毒性小,动物存活率高,且更好地模拟了人类DM的发生过程;实验结果也显示,高脂饮食可使大鼠体重明显增加,形成胰岛素抵抗,再给予小剂量STZ血糖明显升高且保持稳定水平,成模率较高。在注射部位选择上本实验采取腹腔注射,方法易于掌握,避免了静脉注射中因用药过量和速度过快导致心力衰竭[8],注射部位固定也可保证成模后血糖数据的稳定性[9]。
3.3 注射剂量的确定 关于STZ的用量,很多研究报道不一,小剂量一般在25~40 mg/kg、大剂量一般在50~70 mg/kg[10-13],病死率也随着用药剂量的增大而增高[13]。反复小剂量或大剂量一次性注射易造成胰岛细胞直接损伤,比较了有关文献报道后本实验选择30 mg/kg的剂量;实验结果也显示,此剂量条件下成模大鼠血糖值和胰岛素水平明显升高,具有胰岛素抵抗、高血糖、高胰岛素血症的T2DM临床特征。
3.4 成模标准的确定 关于DM大鼠成模水平的判断,目前国内外的研究对DM模型判定标准不一,大多数研究倾向于空腹血糖>7.8 mmol/L或随机血糖≥16.7 mmol/L[14-15]。由于空腹时间大于12 h,易造成低血糖且容易造成DM症状较重的大鼠死亡,因此选择随机血糖更为灵活、操作性更强。为了避免病情自发缓解的问题,分别在建模后第3、7、14天测定血糖,以建模后14 d随机血糖仍维持在16.7 mmol/L以上作为模型成功的标志,确保了模型的稳定性。
DM是一种由代谢系统紊乱引起的内分泌疾病,其主要发病机制为胰岛素相对不足且伴随有胰岛素抵抗。本研究在借鉴前人研究的基础上将高脂饮食与STZ干预相结合,采用成年SD大鼠高脂喂养联合小剂量STZ腹腔注射的方法诱导实验鼠出现多饮、多食、多尿等DM症状,体重明显下降,血糖明显升高且出现胰岛素抵抗,其病理、生理改变接近于人类T2DM模型,具有时间短、成模率高、血糖水平稳定的特点,是值得推广的T2DM模型。
[1]Xu Y,Wang L,He J,et al.Prevalence and control of diabetes in Chinese adults[J].JAMA,2013,310(9):948-959.
[2]娄伟成,宣金,吴赛华,等.2型糖尿病大鼠模型研究概况[J].中国中医药咨讯,2011,3(18):88-90.
[3]农慧,盛庆寿,梁健,等.STZ诱导糖尿病大鼠模型的研究[J].广西医科大学学报,2010,27(1):69-72.
[4]余娇,王繁麟,徐兵,等.卡托普利对糖尿病肾病大鼠血浆同型半胱氨酸和肾功能的影响[J].解放军医药杂志,2016,28(5):28-31.
[5]陈欣,文武,郁正亚.高糖高脂饲料联合小剂量链脲佐菌素制备SD大鼠2型糖尿病模型[J].中国医药导刊,2015,17(5):737-738,740.
[6]汤球.2型糖尿病大鼠模型的制备与评价[J].四川医学,2011,32(4):463-465.
[7]祁秀茹,王红杰.高脂饮食联合链脲佐菌素诱导2型糖尿病大鼠模型的研究进展[J].河北医药,2015,37(21):3308-3310.
[8]殷成坤,刘燕,李晓霞,等.高脂饮食联合STZ建立2型糖尿病大鼠模型稳定性观察[J].川北医学院学报,2016,31(2):178-182.
[9]章成昌,谢光荣,姜玉涛,等.链脲菌素制备2型糖尿病大鼠模型的研究[J].安徽医药,2012,16(9):1241-1244.
[10]蒋朝晖,吕玉晶,赵芳,等.高脂高糖饮食结合链脲佐菌素建立2型糖尿病大鼠模型的改良[J].中国比较医学杂志,2011,21(1):33-35,44.
[11]Tian ZH,Miao FT,Zhang X,et al.Therapeutic effect of okra extract on gestational diabetes mellitus rats induced by streptozotocin[J].Asian Pac J Trop Med,2015,8(12):1038-1042.
[12]Fukuoka CY,Torres Schröter G,Nicolau J,et al.Low-power laser irradiation in salivary glands reduces glycemia in streptozotocin-induced diabetic female rats[J].J Biophotonics,2016,9(11/12):1246-1254.
[13]Afrin R,Arumugam S,Wahed MI,et al.Attenuation of endoplasmic reticulum stress-mediated liver damage by mulberry leaf diet in streptozotocin-induced diabetic rats[J].Am J Chin Med,2016,44(1):87-101.
[14]黄焱,陈恩玉,陈雅芬,等.链脲佐菌素结合高糖高脂饮食诱导2型糖尿病大鼠模型[J].实用医学杂志,2010,26(13):2299-2301.
[15]王春田,王莉,石岩.糖尿病动物模型制备方法探讨[J].实用中医内科杂志,2011,25(4):27-30.
Study of streptozotocin and high-fat diet inducing type 2 diabetes in a rat model
WU Ying1,ZHANG Yong2,YAO Hebin3
(1.Department of Nutrition,Navy General Hospital,Beijing 100048,China;2.Chinese People’s Liberation Army 32150,Xinxiang Henan 453000,China;3.Department of Endocrinology,Navy General Hospital,Beijing 100048,China)
ObjectiveTo set up a SD rat model similar to human type 2 diabetes mellitus with insulin resistance.MethodsThirty-six SD rats were randomized into four groups,normal group(group A,n=6),high-fat diet group(group B,n=6),low-does streptozotocin group[group C,streptozotocin(STZ),30 mg/kg,n=12],and high-fat diet and low-does STZ(30 mg/kg)group(group D,n=12).Group C and D were induced by an injection of low-does STZ(30 mg/kg)after 4 weeks of normal chow feeding and high-fat chow feeding respectively.Rats with random plasma glucose levels>16.7 mmol/L for 2 weeks were modeling success.ResultsBoth normal chow feeding associated with low-does STZ(30 mg/kg)and high-fat chow feeding associated with low-does STZ(30 mg/kg)can establish type 2 diabetes animal model.The diabetes morbidity was 66.7%(8/12)in group C,and 91.7%(11/12)in group D.ConclusionGroup D has moderately high blood sugar,insulin resistance,the success rate is high,and can be used as a good model of type 2 diabetes mellitus in relevant research.
Type 2 diabetes mellitus;Blood glucose;High fat;Streptozotocin(STZ);Model,rat
R587.1-332
A
2095-3097(2017)06-0355-03
10.3969/j.issn.2095-3097.2017.06.009
解放军总后勤部保健专项课题(CWS14BJ38)
100048北京,海军总医院营养科(吴 瑛);453000河南新乡,中国人民解放军32150部队医院(张 勇);100048北京,海军总医院内分泌科(姚合斌)
1.1.3 试剂及仪器 STZ(美国Sigma公司)-20℃冻存,柠檬酸、柠檬酸三钠(天津市津宏化工有限公司);微量血糖仪及配套血糖试纸(美国强生公司),BS224S电子天平(德国赛多利斯公司)。
1.2 方法
1.2.1 建模方法
1.2.1.1 用药及制备 使用柠檬酸和柠檬酸三钠配制成0.01 mol/L、pH 4.5的柠檬酸缓冲液,4~8℃冷藏保存。使用前用STZ配制成2%的STZ溶液。
1.2.1.2 动物饲养及分组 所有SD大鼠饲养环境为室温(23±1)℃,明暗周期12 h,相对湿度50%~60%,自由进食、水。适应性饲养1周后随机分为A组(对照组即普通饲料组)6只、B组(高脂饲料组)6只、C组(普通饲料+小剂量STZ注射组)12只、D组(高脂饲料+小剂量STZ注射组)12只4组。
1.2.1.3 给药途径和剂量 4组大鼠在分组4周后,禁食、不禁水12 h,测空腹血糖,并同时称体重。A组、B组大鼠按30 mg/kg注射柠檬酸缓冲液,C组、D组大鼠按30 mg/kg连续5 d腹腔注射2%STZ柠檬酸缓冲液。
1.2.1.4 成模标准 随机血糖≥16.7 mmol/L且持续2周为造模成功。
1.2.2 观察指标
1.2.2.1 一般状况 每日观察各组大鼠进食、饮水、排尿量及死亡情况,每周称重1次。
1.2.2.2 血清生化指标 建模后分别于第3、7、14天尾静脉测定血糖。实验大鼠于处死前空腹12 h禁食、不禁水,测完空腹血糖和体重后乙醚麻醉大鼠,静脉采血,放射免疫分析法测定空腹胰岛素。
1.2.2.3 苏木精-伊红染色 大鼠处死后,立即取出骨骼肌组织,放入甲醛溶液中浸泡;肌肉组织石蜡包埋,切片后行苏木精-伊红染色,观察大鼠骨骼肌组织变化。
1.3 统计学处理 应用SPSS 18.0软件,计量资料以均数±标准差(¯x±s)表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2016-12-02 本文编辑:徐海琴)

