食蟹猴脑与结肠中寡聚化和磷酸化α-突触核蛋白的增龄性变化的相关性分析
杨巍巍 李 昕 李旭冉 于 顺*
(1.首都医科大学宣武医院神经生物学研究室 北京市老年病医疗研究中心,北京 100053;2.首都医科大学帕金森病临床诊疗与研究中心,北京 100053;3.帕金森病北京市重点实验室和教育部神经变性病重点实验室,北京 100053;4.国家老年疾病临床医学研究中心,北京 100053)
·Alpha-突触核蛋白的致病机制·
食蟹猴脑与结肠中寡聚化和磷酸化α-突触核蛋白的增龄性变化的相关性分析
杨巍巍1,2,3,4李 昕1,2,3,4李旭冉1,2于 顺1,2,3,4*
(1.首都医科大学宣武医院神经生物学研究室 北京市老年病医疗研究中心,北京 100053;2.首都医科大学帕金森病临床诊疗与研究中心,北京 100053;3.帕金森病北京市重点实验室和教育部神经变性病重点实验室,北京 100053;4.国家老年疾病临床医学研究中心,北京 100053)
目的研究寡聚化和磷酸化α-突触核蛋白(α-synuclein,α-Syn)在食蟹猴结肠和脑中的增龄性变化及其相关性。方法ELISA方法检测寡聚化和磷酸化α-Syn在不同年龄段食蟹猴结肠与脑中不同部位含量的变化,分析结肠和脑中寡聚化和磷酸化α-Syn含量变化的相关性。结果寡聚化与磷酸化α-Syn含量随年龄增加而增加,其中老年猴与青年及中年猴比较,差异有统计学意义(P<0.01)。结肠中的寡聚化和磷酸化α-Syn水平与颞叶、海马、纹状体和丘脑中的水平有相关性。结论食蟹猴结肠和脑中寡聚化和磷酸化α-Syn含量随老化而增加,结肠和脑中寡聚化和磷酸化α-Syn含量变化呈正相关。
α-突触核蛋白;结肠;脑;食蟹猴;老化
帕金森病(Parkinson’s disease,PD)是临床上常见的神经系统退行性疾病之一。PD患者的临床症状除了表现为静止震颤、运动迟缓、肌肉僵直和姿势不稳定等典型运动症状之外,早期还出现各种非运动症状(non-motor symptoms,NMS),其中消化道功能紊乱是最常见的早期非运动症状之一[1]。目前认为,运动症状的产生主要是中脑黑质多巴胺能神经元大量丢失所致,而消化道功能紊乱被认为是由肠神经系统(enteric nervous system,ENS)的异常引起的。导致黑质多巴胺神经元丢失和肠神经系统功能异常的原因均被认为与异常的α-突触核蛋白(α-synuclein,α-Syn)聚集所形成路易体(Lewy body,LB)病变有关[2-3]。根据Braak理论,LB病变最早可能出现在消化道的壁内神经丛,然后通过迷走神经扩散到延髓,并进一步上行扩散到中脑黑质和纹状体,引起典型的运动症状[4-6]。最新研究[7]表明,PD患者粪便样本中微生物群的变化与临床表型的严重程度呈正相关,进一步印证了肠-脑轴在PD病理发展中的重要性。
虽然聚集的α-Syn纤维被认为是LB病变的主要成分,但目前广泛认为寡聚化和磷酸化的α-Syn是该蛋白的主要毒性分子形式[8]。这种分子形式的α-Syn在PD早期发生何种变化尚不清楚。已知,老化是PD发病的重要危险因素,老化的神经组织也存在LB病变,虽然其数量较PD患者少。但老化神经组织中可溶性的寡聚化和磷酸化的α-Syn发生何种变化,尤其是其在脑和肠神经丛中的变化的规律及其相关性尚不清楚。本论文利用老化食蟹猴模型对上述问题进行了探讨。
1 材料和方法
1.1 材料
健康食蟹猴青年、中年、老年各4只(4~16岁),共计12只,购自广西雄森灵长动物养殖中心,实验动物许可证号:SYXK(桂)2009-0006,所有动物均有详细出生档案和检疫证书,动物研究方案经动物福利委员会(Institutional Animal Care and Use Committee,IACUC)认证批准。青年猴4只(4岁),中年猴4只(10~11岁),老年猴4只(15~16岁)。兔抗人磷酸化α-Syn多克隆抗体(Santa Cruz公司,美国);鼠抗人α-Syn单克隆抗体3D5由本室制备;HRP标记山羊抗兔IgG,HRP标记山羊抗小鼠IgG(中杉公司),生物素化的鼠单克隆抗体(康为世纪标记公司);4-硝基磷酸二钠盐(pNPP)(Sigma公司,美国);ELISA 96孔酶标板(Corning公司,美国);酶标仪(Tecan公司,瑞士);其他试剂为分析纯。
1.2 方法
1)组织匀浆的制备:灌流后取出食蟹猴的一部分结肠及不同部位脑组织并立即置于液氮中速冻,然后转移到-80 ℃冰箱中保存。为了制备全细胞匀浆,将结肠和脑组织在裂解液中研磨、裂解,12 000 g离心于4 ℃离心30 min,取上清即为全细胞匀浆,BCA法测定蛋白质浓度。
2)寡聚化α-Syn的ELISA检测[9]:用质量浓度为1 × 10-3g/L的3D5单抗包被96孔酶标板,100 μL/孔,37 ℃孵育2 h,4 ℃过夜,PBST洗板。10%(质量分数)BSA封闭,200 μL/孔,37 ℃孵育2 h,PBST洗板。加入倍比稀释的重组人α-Syn(0.5、0.25、0.125、0.006 25、0.031 25、0 mol/L)和待测样品,100 μL/孔,37 ℃孵育2 h。PBST洗板,然后加入生物素化的3D5(1 × 10-3g/L)100 μL/孔,37 ℃孵育2 h,PBST洗板,再加入亲和素标记的碱性磷酸酶(1∶5 000),100 μL/孔,37 ℃孵育1 h,PBST洗板,最后加入pNPP,100 μL/孔,37 ℃显色30 min,405 nm处测定吸光度值。每次每个样品重复3孔,重复3次。
3)磷酸化α-Syn的ELISA检测:用质量浓度为1 × 10-3g/L的磷酸化α-syn多抗包被96孔酶标板,100 μL/孔,37 ℃孵育2 h,4 ℃过夜,PBST洗板。10%(质量分数) BSA封闭,200 μL/孔,37 ℃孵育2 h,PBST洗板。加入倍比稀释的重组人磷酸化α-Syn(0.5、0.25、0.125、0.006 25、0.031 25、0 mol/L)和待测样品,100 μL/孔,37 ℃孵育2 h。此后使用试剂盒操作过程与检测寡聚化α-Syn的ELISA相同。
1.3 统计学方法

2 结果
2.1 结肠中寡聚化和磷酸化α-Syn的增龄性变化
在食蟹猴结肠中,寡聚化和磷酸化α-Syn水平随年龄增加而增高,老化组寡聚化和磷酸化α-Syn水平与青年组及中年组比较,差异均有统计学意义(P<0.05),详见图1。
2.2 不同脑区中寡聚化和磷酸化α-Syn呈增龄性变化
ELISA结果显示,在食蟹猴的颞叶、海马、纹状体和丘脑中,寡聚化α-Syn的水平随年龄增长而增加,且差异有统计学意义(P<0.01),前额叶和枕叶中的寡聚化α-Syn虽然也有增龄性变化的趋势,但是差异无统计学意义(P>0.05,图2A);磷酸化α-Syn在所有脑区中均有显著的增龄性变化,且差异有统计学意义(P<0.05,图2B)。
A:o-α-Syn;B:p-α-Syn.*P<0.01vsyoung monkeys,#P<0.05vsmiddle aged monkeys,n=4.o-α-Syn:α-synuclein oligomers;p-α-Syn: phosphorylated α-synuclein.
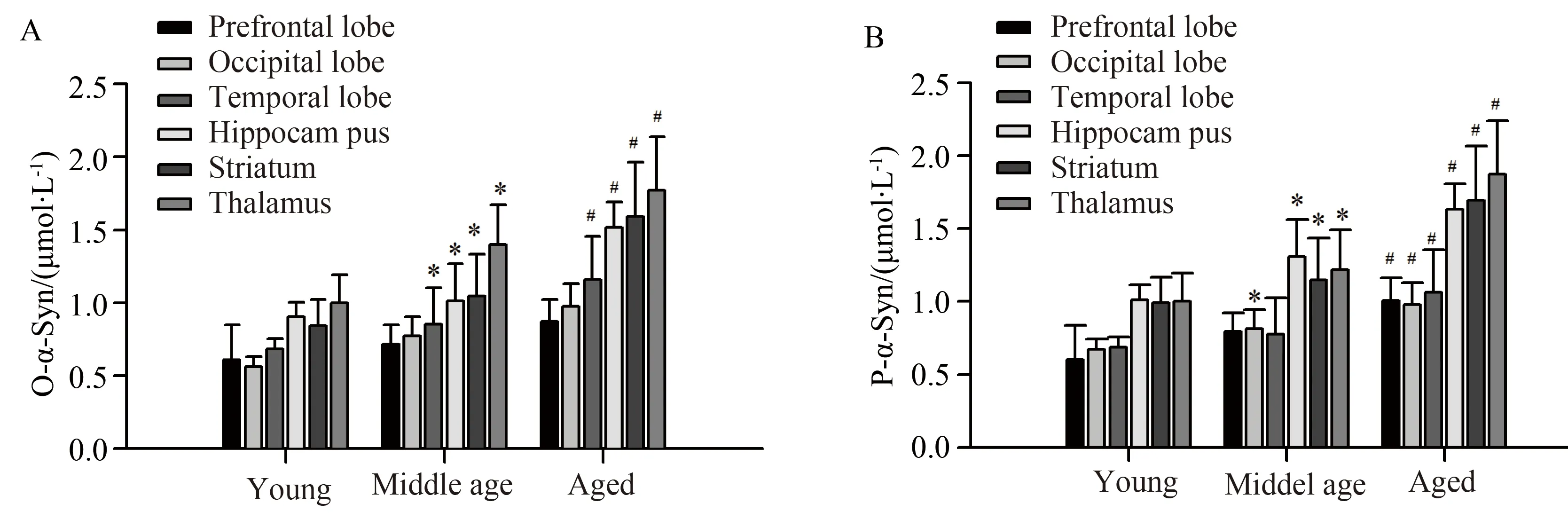
图2 寡聚化和磷酸化α-Syn在食蟹猴不同脑区中的表达Fig.2 Levels of o-α-Syn and p-α-Syn in different brain regions of aging cynomolgus monkeys
A: levels of o-α-Syn differ between brain regions and increases with age.B: p-α-Syn levels also differ between brain regions and increases with age.The levels of o-α-Syn and p-α-Syn in the extracts isolated from different regions of the brain were measured by ELISA.*P<0.01vsyoung monkeys,#P<0.05vsmiddle age monkeys,n=4.o-α-Syn: α-synuclein oligomers;p-α-Syn: phosphorylated α-synuclein.
2.3 结肠与脑中寡聚化和磷酸化α-Syn的相关性分析
结肠中的寡聚化α-Syn浓度与颞叶、海马、纹状体和丘脑中的寡聚化α-Syn浓度呈显著正相关,与枕叶中的寡聚化α-Syn浓度有相关性,但与前额叶中的寡聚化α-Syn浓度没有相关性(图3)。与寡聚化α-Syn相同,结肠中磷酸化α-Syn浓度也与颞叶、海马、纹状体和丘脑中的磷酸化α-Syn浓度呈正相关,与枕叶中的磷酸化α-Syn浓度有相关性,但与前额叶中的寡聚化α-Syn浓度没有相关性(图4)。
3 讨论
本文利用本室建立的ELISA方法,首次对不同年龄食蟹猴的结肠和不同脑区的寡聚化和磷酸化α-Syn的增龄性变化进行了研究。结果显示,寡聚化和磷酸化α-Syn浓度在结肠均随老化而明显增高;在脑中,寡聚化和磷酸化α-Syn虽然也表现出随龄性增加趋势,但在不同脑区的变化明显不同。其中,在丘脑、海马、纹状体和颞叶变化比较明显,而在前额叶和枕叶变化较小。导致寡聚化和磷酸化α-Syn发生上述增龄性变化的原因很可能是结肠的壁内神经和局部脑中的调节α-Syn磷酸化的酶在老化过程中发生变化的结果。研究[9]表明,α-Syn的磷酸化是该蛋白发生聚集的主要原因。以往研究[10]证明,脑组织中促进使α-Syn磷酸化和去磷酸化的酶——PLK2和PP2A,呈现年龄及脑区依赖性的变化,并且是引起磷酸化和寡聚化a-Syn在不同脑区含量不同和随龄性变化的主要原因。由此推测,在食蟹猴结肠的壁内神经以及本研究所观察的不同脑区组织中,也存在PLK2及PP2A活力的随龄性变化,并因此通过影响α-Syn的磷酸化而影响其寡聚化。在老化过程中是否有其他机制影响α-Syn的磷酸化和寡聚化尚不清楚。
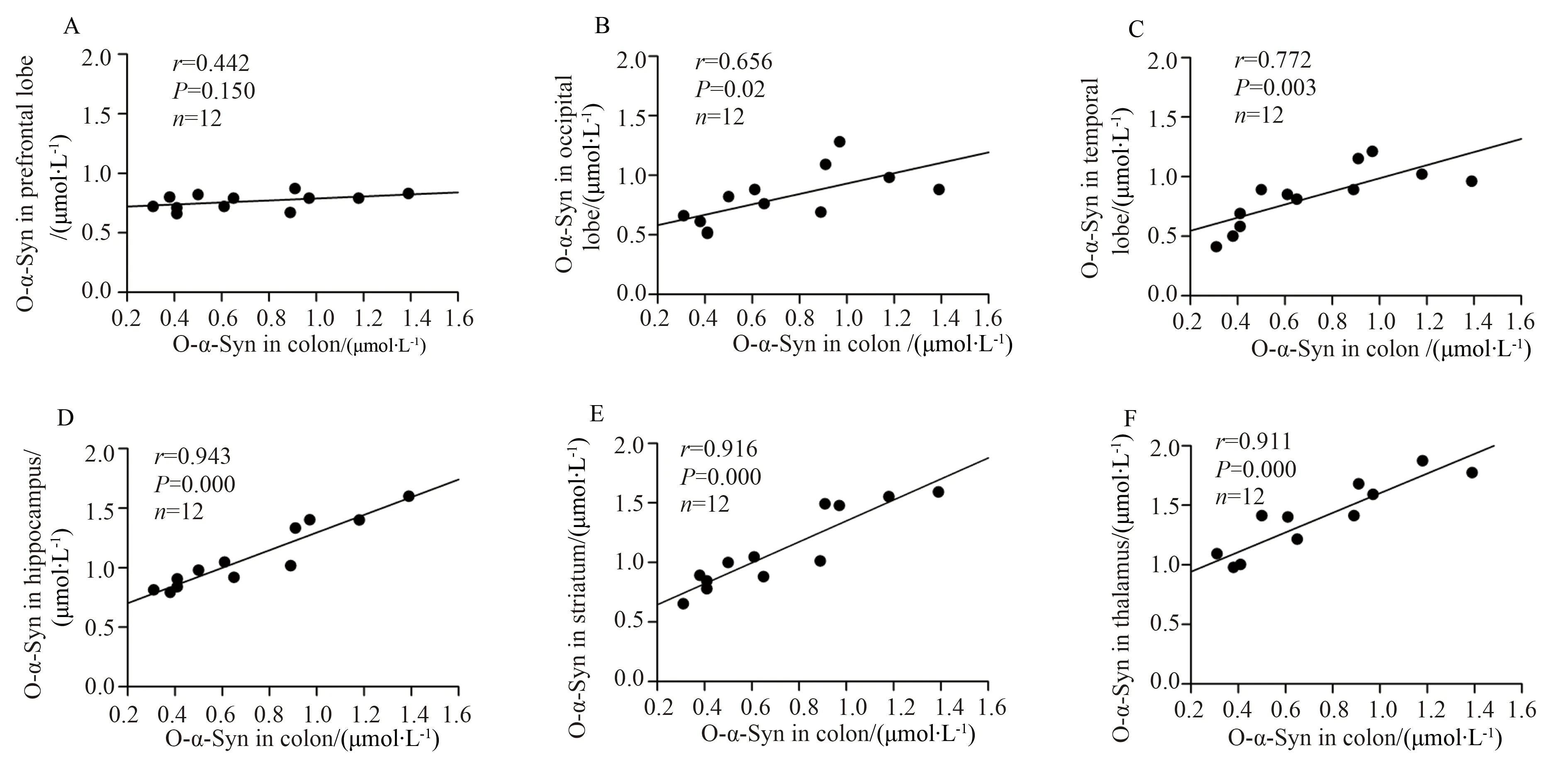
图3 寡聚化α-Syn浓度在结肠和不同脑区中的相关性分析Fig.3 Correlation analysis for levels of o-α-Syn between the colon and different regions of the brain
A:prefrontal lobs;B:occipital lobe;C:temporal lobe;D:hippocampus;E:striatum;F:thalamus;Levels of o-α-Syn in the colon were correlated with those in the occipital lobe (B),temporal lobe(C),hippocampus (D),striatum (E) and thalamus (F) but not in the prefrontal lobe (A);o-α-Syn: α-synuclein oligomers.
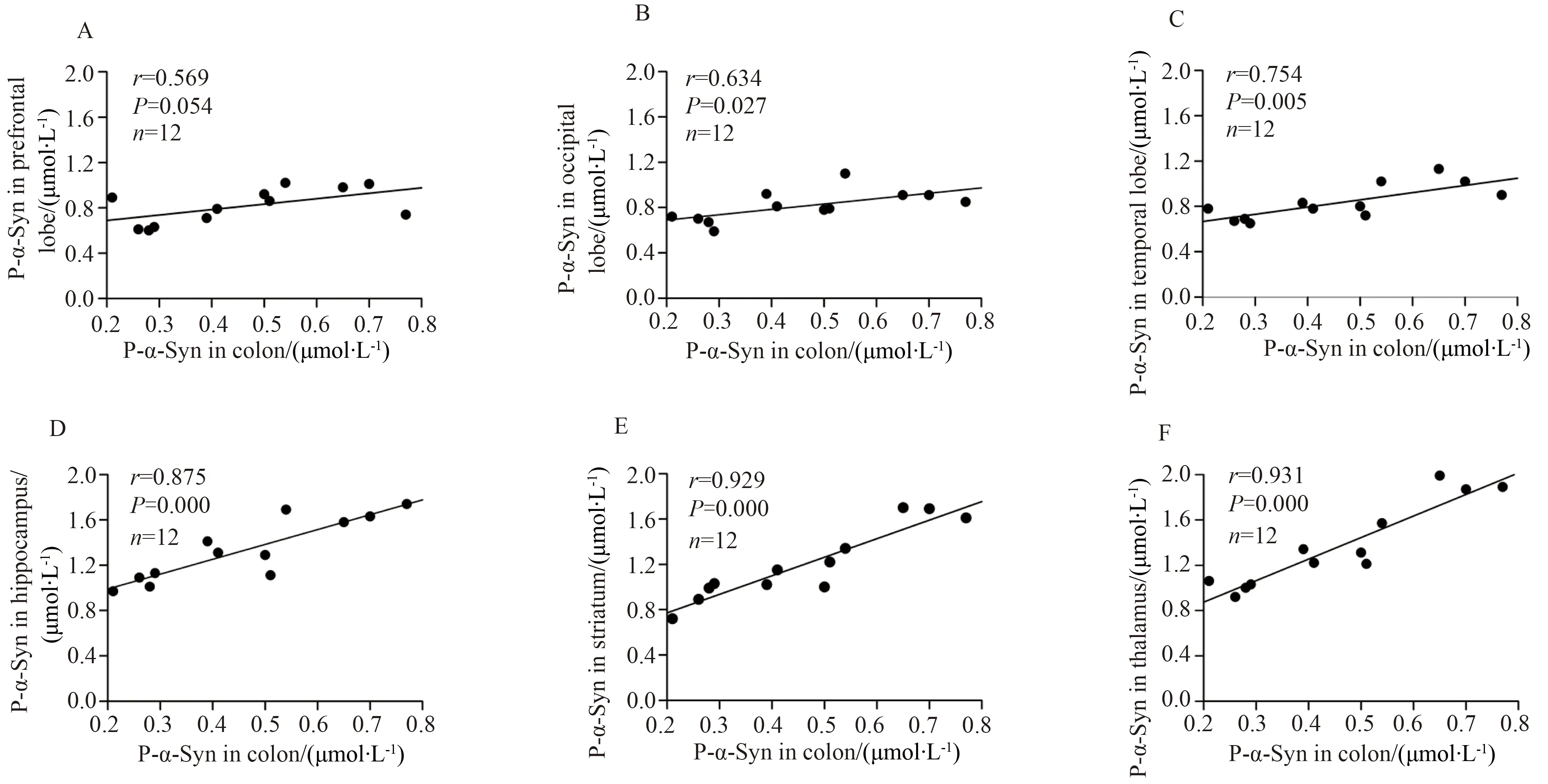
图4 磷酸化α-Syn浓度在结肠和不同脑区中的相关性分析Fig.4 Correlation analysis for levels of p-α-Syn between the colon and different regions of the brain
A:prefrontal lobs;B:occipital lobe;C:temporal lobe;D:hippocampus;E:striatum;F:thalamus;Levels of p-α-Syn in the colon were correlated with those in the occipital lobe (B),temporal lobe(C),hippocampus (D),striatum (E) and thalamus (F) but not in the prefrontal lobe (A);p-α-Syn:α-synuclein oligomers.
肠神经系统是胃肠道神经元的综合网络,是肠-脑轴的主要参与者[11]。已有文献[4-6]报道,在PD发病早期,肠道首先形成致病性α-Syn寡聚体,通过迷走神经首先传播到脑中。本研究发现,α-Syn的寡聚化及磷酸化同步发生在老化的食蟹猴大脑以及结肠中,提示大脑和胃肠道之间有潜在联系。为了证明这种联系,本研究对结肠中寡聚化和磷酸化α-Syn与其在不同脑区中的水平进行了相关性分析,发现结肠中寡聚化和磷酸化α-Syn的变化与一些脑区如纹状体,海马,丘脑和颞叶的变化呈正相关。相比之下,结肠α-Syn磷酸化和寡聚化的改变与前额叶中的变化无相关性。上述相关性的机制尚不清楚。可能的原因是由于老化过程中的局部代谢环境变化,例如PLK2和PP2A活性改变,导致肠神经系统和中枢神经系统中的α-Syn的磷酸化和聚集在老化过程中同步发生。尽管这些机制尚不明确,但目前的研究[12-14]表明,在老化过程中肠道和脑中磷酸化和寡聚化α-Syn的增加虽然是老化过程中的生理现象,但却增加了PD发病风险。结肠与脑中α-Syn磷酸化和寡聚化变化具有相关性的结果也为结肠活检监测PD脑中病理变化提供了理论依据。
[1] Jellinger K A.Neuropathoiology of non-motor symptoms in parkinson disease [J].J Neural Transm,2015,122 (10): 1429-1440.
[2] Jellinger K A.The pathomechanisms underlying parkinson’s disease [J].Expert Rev Neurother,2014,14 (2): 199-215.
[3] Yu S,Chan P.Role of α-synuclein in neurodegeneration: implications for the pathogenesis of Parkinson’s disease[J].Essays Biochem,2014,56: 125-135.
[4] Braak H,deVos R A,Bohl J,et al.Gastricα-synucleinimmunoreactive inclusions in Meissner’s and Auerbach’splex-uses in cases staged for Parkinson’s disease-related brain pathology [J].Neurosci Lett,2006,396 (1): 67-72.
[5] Abbott R D,Petrovitch H,White L R,et al.Frequency of bowelmovements and the future risk of Parkinson’ s disease [J].Neurology,2001,57 (3): 456-462.
[6] Claassen D O,Josephs K A,Ahlskog J E,et al.REM sleep behavior disorder preceding otheraspects of synucleinopathies by up to half a century [J].Neurology,2010,75 (6): 494-499.
[7] Scheperjans F,Aho V,Pereira P A,et al.Gut microbiota are related to Parkinson’s disease and clinical phenotype [J].Mov Disord,2015,30(3): 350-358.
[8] Stemberger S,Poewe W,Wenning G K,et al.Targeted over expression of humanα-synuclein in oligodendroglia induces lesions linked to MSA-like progressive autonomic failure [J].Exp Neurol,2010,224 (2): 459-464.
[9] 李昕,杨巍巍,李雁,等.一种检测帕金森病患者血浆促进α-突触核蛋白寡聚体形成能力的方法[J].首都医科大学学报,2013,34 (6): 830-834.
[10] Chen M,Yang W,Li X,et al.Age-and brain region-dependent α-synucleinoligomerization is attributed to alterations in intrinsic enzymes regulating α-synuclein phosphorylation in aging monkey brains[J].Oncotarget,2016,7 (8): 8466-8480.
[11] Cryan J F,Dinan T G.Mind-altering microorganisms: the impact of the gut microbiota on brain and behavior [J].Nat Rev Neurosci,2012,13 (10): 701-712.
[12] Muntané G,Ferrer I,Martinez-Vicente M.α-Synuclein phosphorylation and truncation are normal events in the adult human brain [J].Neuroscience,2012,200: 106-119.
[13] Kalia L V,Kalia S K,McLean P J,et al.α-Synuclein oligomers and clinical implications for Parkinson disease [J].Ann Neurol,2013,73 (2): 155-169.
[14] Lane M A.Nonhuman primate models in biogerontology [J].Exp Gerontol,2000,35 (5): 533-541.
Correlationbetweenthebrainandage-dependentα-synucleinphosphorylationandoligomerizationinthegutofcynomolgusmonkeys
Yang Weiwei1,2,3,4,Li Xin1,2,3,4,Li Xuran1,2,Yu Shun1,2,3,4*
(1.DepartmentofNeurobiology,XuanwuHospital,CapitalMedicalUniversity,BeijingInstituteofGeriatrics,Beijing100053,China;2.ClinicalCenterforParkinson’sDisease,CapitalMedicalUniversity,Beijing100053,China;3.BeijingKeyLaboratoryforParkinson’sDiseaseandKeyLaboratoryofNeurodegenerativeDiseases,MinistryofEducation,Beijing100053,China;4.NationalClinicalResearchCenterforGeriatricDisorders,Beijing100053,China)
ObjectiveTo explore age-dependent alterations in oligomeric and phosphorylated α-synuclein(o-α-Syn and p-α-Syn) in the colon and brain,analyze the correlation for levels of o-α-Syn and p-α-Syn between the colon and different regions of the brain.MethodsELISA methods specific for o-α-Syn and p-α-Syn were used to measure the levels of o-α-Syn and p-α-Syn in the colon and brain of different ages of cynomolgus monkeys.ResultsLevels of o-α-Syn and p-α-Syn increased significantly with age in the colon and brain,statistically significant difference was observed between the old monkeys and the young and middle-aged monkeys (P<0.01).Levels of o-α-Syn and p-α-Syn in the colon were positively correlated with those in the temporal lobe,hippocampus,striatum and thalamus of the brain.ConclusionLevels of o-α-Syn and p-α-Syn increase with age in the colon and brain and positively correlated between the colon and some vulnerable brain regions.
α-synuclein;colon;brain;cynomolgus monkeys;aging
国家自然科学基金(81371200,81071014,81401042),北京市医院管理局“使命”计划专项经费资助项目(SML20150803),北京市科学技术委员会资助项目(Z161100005116011,Z171100000117013),北京市卫生和计划生育委员会项目(PXM2017_026283_000002)。This study was supported by National Natural Science Foundation of China (81371200,81071014,81401042),Beijing Municipal Administration of Hospitals’ Mission Plan (SML20150803),Beijing Municipal Science &Technology Commission (Z161100005116011,Z171100000117013),Beijing Municipal Commission of Health and Family Planning (PXM2017_026283_000002).
*Corresponding author,E-mail:yushun103@163.com
时间:2017-12-13 21∶25
http://kns.cnki.net/kcms/detail/11.3662.R.20171213.2125.060.html
10.3969/j.issn.1006-7795.2017.06.019]
R 338
2017-10-23)
编辑 慕 萌

