TRPC3参与α-突触核蛋白引起的线粒体损伤
卢勇泉 陈 敏 高 歌 段春礼 鲁玲玲 杨 慧
(首都医科大学基础医学院神经生物学系,北京脑重大疾病研究院帕金森病研究所,教育部神经变性病重点实验室,北京 100069)
·Alpha-突触核蛋白的致病机制·
TRPC3参与α-突触核蛋白引起的线粒体损伤
卢勇泉 陈 敏 高 歌 段春礼 鲁玲玲 杨 慧*
(首都医科大学基础医学院神经生物学系,北京脑重大疾病研究院帕金森病研究所,教育部神经变性病重点实验室,北京 100069)
目的探讨经典型瞬时受体电位通道3(transient receptor potential canonical channel 3,TRPC3)是否参与α-突触核蛋白(α-synuclein,α-syn)引起的线粒体损伤。方法在α-syn过表达原代培养神经元、α-syn转基因及敲除小鼠模型,利用免疫印迹和免疫荧光技术检测TRPC3和α-syn在线粒体内的定位和表达;在原代培养神经元,运用MTT和乳酸脱氢酶法检测细胞活力和受损情况,JC-1法检测线粒体膜电势,观察敲减TRPC3对α-syn过表达引起的线粒体损伤和细胞损伤的影响。结果TRPC3和α-syn共同表达于线粒体,过表达α-syn增加TRPC3在线粒体的分布,敲除α-syn则下调TRPC3在线粒体的分布。敲减TRPC3明显减轻过表达α-syn引起的线粒体膜电势下降和细胞毒性。结论TRPC3可能参与过表达α-syn引起的线粒体损伤。
帕金森病;神经元;α-突触核蛋白;瞬时受体电位通道3;线粒体
帕金森病(Parkinson’s disease,PD)的主要病理特征为中脑黑质多巴胺能神经元进行性变性缺失以及残存的多巴胺能神经元中路易体(Lewy bodies,LB)的形成。LB的重要组成成分是α-突触核蛋白(α-synuclein,α-syn)[1-2]。α-syn在神经元内异常积聚和聚集可以增加细胞膜的通透性,损伤蛋白酶体和溶酶体系统及造成线粒体功能障碍,最终导致神经元的死亡[3-7]。本课题组的前期研究结果[8-12]表明,过表达α-syn可以引起神经元内活性氧(reactive oxygen species,ROS)生成增加,线粒体膜孔异常开放以及膜电势降低,但其机制尚不完全清楚。
经典型瞬时受体电位(transient receptor potential canonical,TRPC)通道是一类非选择性钙离子通道,该家族包含7个成员[13]。TRPC通道主要分布于胞质及质膜,维持细胞内的钙离子稳态[14]。研究[15-16]表明,TRPC家族的成员通过影响细胞钙离子的稳态参与包含PD在内的神经疾病。TRPC3是TRPC家族唯一定位于线粒体上的亚型,参与调控线粒体钙摄取和膜电势[17]。TRPC3是否参与过表达α-syn引起的线粒体膜电势改变,进而导致线粒体功能紊乱尚不清楚。
1 材料和方法
1.1 材料
实验动物:实验动物均由首都医科大学实验动物部提供服务,动物许可证号为SYXK(京)2015-0012。3只孕14 d SD大鼠从北京维通利华实验动物技术有限公司引进,4只Thy-1-hα-syn转基因小鼠从美国Jackson laboratory公司引进,4只α-syn敲除小鼠从南京大学模式动物研究所引进。伦理编号:AEEI-2014-111和AEEI-2015-177。
原代神经元培养试剂:神经元基础培养基A、50×B27 添加剂、0.5 mmol/L L-谷氨酰胺、100 U/mL青霉素和100 U/mL 链霉素、胎牛血清(fetal bovine serum,FBS)均购自美国Gibco公司,多聚-L-赖氨酸(poly-L-lysine,PLL)购自美国Sigma公司。
抗体:抗人源α-syn(human α-syn,hα-syn)抗体(3D5,1∶5 000)由首都医科大学宣武医院于顺教授惠赠,TRPC3(1∶500)购自美国Sigma公司,α-syn(1∶1 000)购自美国BD公司,β-actin(1∶2 000)购自美国Sigma公司,COX 4(1∶1 000)购自美国CST公司,Tom20 (1∶250)购自美国Santa Cruz公司。
LV-sh-TRPC3(5′-CCACCAAAGCGCAGCAGTA-3′)和LV-hα-syn购自上海吉凯基因化学技术有限公司,线粒体提取试剂盒购自美国Inventbiotech公司,5,5′,6,6′-四氯-1,1′,3,3′-甲基苯并咪唑氢碘化物(tetrechloro-tetraethylbenzimidazolcarbocyanine iodide,JC-1)购自美国Sigma公司,3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐[(3-4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)购自美国Sigma公司,乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒购自瑞士Roche公司。
1.2 方法
1.2.1 原代神经元培养及慢病毒感染
分离出胎鼠大脑皮质,置于盛有6%(质量分数)葡萄糖的PBS小皿中,剪碎后用0.125%(质量分数)的胰蛋白酶,37 ℃水浴消化10 min。加入含有10%(体积分数)FBS的普通细胞培养基终止消化,离心1 000 g,5 min。弃上清,加入普通细胞培养基,重悬细胞,用40 μm的细胞滤筛进行过滤后按密度4×104个/cm2接种至多聚-L-赖氨酸预处理的培养皿,在37 ℃,5%(体积分数)CO2培养箱中培养。待神经元贴壁后改为Neurobasal-A培养。72 h后加入慢病毒,感染48 h后进行后续实验。
1.2.2 Western blotting分析TRPC3和α-syn的表达
收集慢病毒感染的原代神经元、α-syn转基因和敲除小鼠及其同窝对照小鼠的中脑,运用细胞组分提取试剂盒提取线粒体、胞质组分及全细胞蛋白。采用5%(质量分数)积层胶70 V,30 min;12%(质量分数)SDS-PAGE分离胶120 V,1 h进行凝胶电泳分离蛋白,用半干法将蛋白质转印至PVDF膜。5%(质量分数)脱脂牛奶封闭1 h。分别孵育相应的抗体后,放入Odyssey扫描成像系统(LI-COR公司,美国)中成像。
1.2.3 细胞免疫荧光化学法检测TRPC3和α-syn在线粒体上的定位
4%(质量分数)多聚甲醛室温固定原代神经元后,用1%(体积分数)PBST孵育10 min,5%(体积分数)山羊血清室温孵育1 h,加入一抗4 ℃孵育过夜;用PBST清洗3次,后加入相应源性的二抗室温孵育1 h;于共聚焦显微镜下拍照分析。
1.2.4 MTT法检测细胞活力
将皮质原代神经元种植于96孔板,按照实验分组进行慢病毒感染。感染48 h后,向各孔加入MTT(5 mg/mL)20 μL,37 ℃,5%(体积分数)CO2培养箱继续培养4 h。后吸弃培养基,每孔加入100 μL DMSO,避光振荡10 min,置于酶标仪中读取490 nm波长处的吸光度值。
1.2.5 LDH释放法检测细胞损伤
将皮质原代神经元种植于96孔板中,待神经元贴壁生长良好后,换上新的培养液。慢病毒感染48 h后,将细胞上清按每孔100 μL小心转移到新的96孔板中,并对应加入100 μL反应混合液,室温孵育30 min,终止反应后,将96孔板置于酶标仪中读取490 nm波长处的吸光度值。
1.2.6 线粒体膜电势检测
将皮质原代神经元种植于96孔板,慢病毒感染48 h后,将JC-1染色液按终浓度10μg/mL加入各孔中,于37 ℃,5%(体积分数)CO2培养箱内继续培养10 min。吸弃染色液,用Neurobasal-A培养基洗涤细胞后。用激发波长490 nm,发射波长580 nm观察红色荧光;激发波长490 nm,发射波长520 nm观察绿色荧光。
1.3 统计学方法
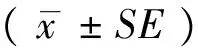
2 结果
2.1 α-syn和TRPC3共表达于线粒体上
在LV-hα-syn感染的SD大鼠皮质原代神经元中,用细胞免疫荧光技术分别标记线粒体和TRPC3。结果显示,α-syn和TRPC3广泛表达于线粒体(图1A)。Western blotting检测结果显示,在提取的线粒体蛋白中可以检测到TRPC3和α-syn(图1B)。上述结果提示TRPC3和α-syn共表达于线粒体上。
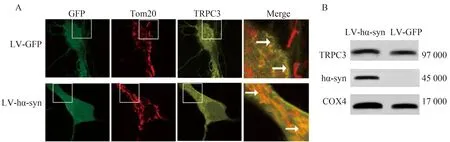
图1 TRPC3和α-syn共表达于线粒体Fig.1 Co-expression of TRPC3 and α-syn in mitochondria
A:Images of fluorescent immunocytochemical labeling.TRPC3 (yellow) and α-syn(green) signals,LV-hα-syn were merged on the mitochondrial marker(Tom20,red).scale bar=10 μm;Mergers were 4 times magnified.B: Representative Western blotting for TRPC3 and α-syn.Proteins were extracted from primary cortical neuron infected by LV-h α-syn for 48 hours.LV: lentivirus;GFP: green fluorescent protein;hα-syn: human α-synuclein;TRPC3:transient receptor potential canonical 3;COX4:cytochrome C oxidase subunit Ⅳ.
2.2 过表达α-syn增加线粒体TRPC3水平
取α-syn转基因和α-syn敲除小鼠及其同窝对照小鼠的中脑。Western blotting检测线粒体及胞质内α-syn及TRPC3的表达,结果显示,转基因组α-syn较对照组显著升高2.5倍,敲除组无表达(P<0.01,n=4);在全细胞和胞质组分,TRPC3在转基因组与野生型和敲除组的表达比较差异均无统计学意义(P>0.05,n=4);但在线粒体组分中,转基因组TRPC3的表达较对照组显著升高约1.4倍,差异有统计学意义(P<0.01,n=4),详见图2。以上结果提示,线粒体中TRPC3随α-syn的升高而增加。
2.3 敲减TRPC3减轻α-syn的细胞毒性
LV-sh-TRPC3和LV-hα-syn感染SD大鼠皮质原代神经元48 h后,提取细胞蛋白。Western blotting检测TRPC3的表达,结果显示:LV-sh-TRPC3感染组中TRPC3的表达明显下降,提示在过表达α-syn的细胞中成功敲减TRPC3(图3A)。MTT及LDH的检测结果显示,LV-hα-syn组细胞活力下降40%,LDH活性显著升高25%;共感染LV-sh-TRPC3和LV-hα-syn组的细胞活力较LV-hα-syn组显著升高20%,并LDH活性显著下降10%与对照组和LV-hα-syn组比,差异有统计学意义(图3B)。以上结果提示,抑制TRPC3能减轻过表达α-syn所致的细胞毒性。
2.4 敲减TRPC3减轻α-syn引起的线粒体膜电势降低
LV-sh-TRPC3和LV-hα-syn感染SD大鼠皮质原代神经元48 h后,应用JC-1检测线粒体膜电势。结果显示,LV-hα-syn组线粒体的膜电势下降明显,而LV-sh-TRPC3和LV-hα-syn共感染组线粒体的膜电势降低的程度明显低于LV-hα-syn组(红色荧光与绿色荧光比值升高),与对照组和LV-hα-syn组比,差异有统计学意义。以上结果提示,敲减TRPC3能减轻过表达α-syn引起的线粒体膜电势降低。详见图4。
3 讨论
线粒体功能紊乱在PD的发生发展过程中起到重要作用。本研究显示,α-syn和TRPC3可以共表达于线粒体,且线粒体TRPC3随α-syn增加而增加,其机制可能与α-syn通过某些途径提高细胞中磷脂酶C活性有关;此外,由于α-syn具有分子伴侣特性[18],TRPC3可能与之发生直接相互作用而共同进入线粒体。TRPC3主要存在于线粒体内膜上,是维持正常线粒体膜电位(mitochondrial membrane potential,MMP)的组成部分,α-syn异常表达导致MMP下降,而抑制TRPC3的表达能有效恢复MMP,表明TRPC3参与α-syn积聚引起的线粒体功能障碍。以往研究[11,19]表明,α-syn可以通过和线粒体相关蛋白相互作用使其膜电势下降,如电压依赖性离子通道(voltage-dependent anion channel,VDAC)和腺嘌呤核苷酸转运体(adenine nucleotide translocator,ANT)。虽然本研究不能排除VDAC和ANT参与的膜电势降低,但本研究的结果提示α-syn也可能通过调控TRPC3导致线粒体膜电势下降和功能障碍。TRPC3不依赖于线粒体钙离子单向转运蛋白调节线粒体的Ca2+摄入,其在线粒体表达增加,导致线粒体Ca2+摄入大量增加致钙稳态失衡;MMP的下降引起线粒体的通透性发生变化,各种凋亡因子从线粒体释放到细胞质中,表现为细胞活力显著降低。抑制TRPC3表达能有效反转上述现象,提示TRPC3参与α-syn所致细胞活力下降。
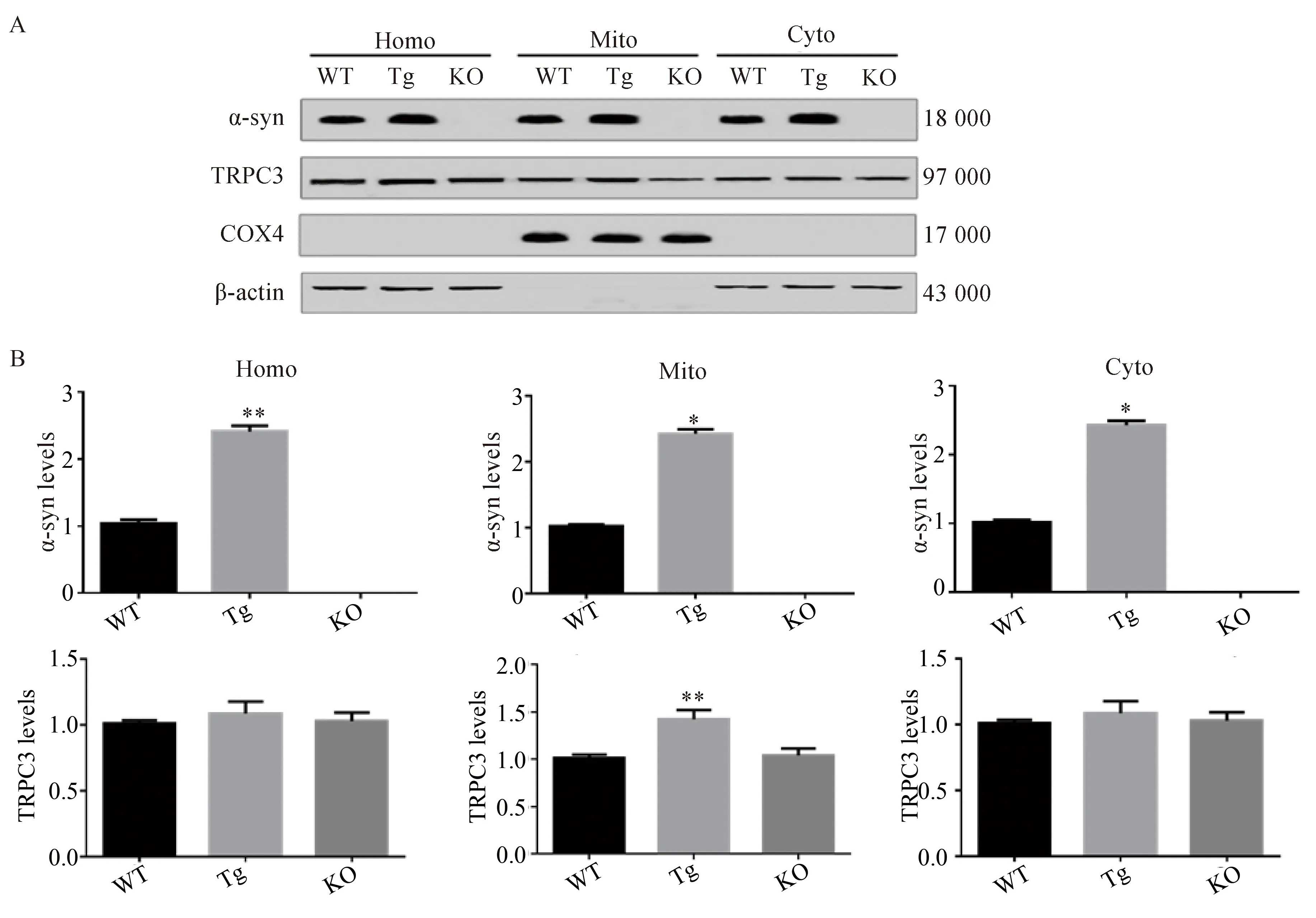
图2 TRPC3和α-syn的表达分布Fig.2 Distribution of TRPC3 and α-syn
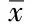
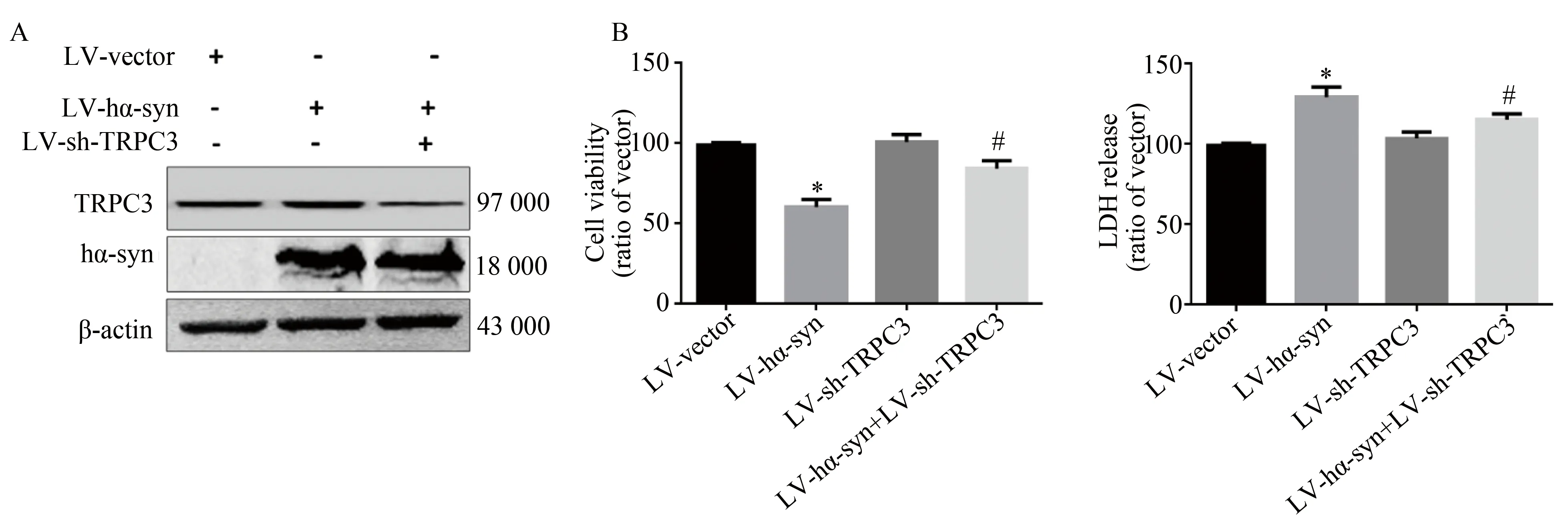
图3 细胞活力和LDH释放检测Fig.3 Cell viability and LDH release assay
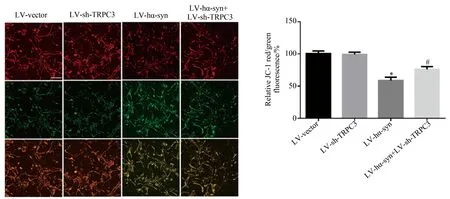
图4 线粒体膜电势检测Fig.4 Mitochondrial membrane potential assay
A: Images for primary cortical neurons were infected by LV-hα-syn and LV-sh-TRPC3 for 48 hours and probed by JC-1.B: Statistical data for JC-1red/green fluorescence ratios.scale bar=100 μm;*P<0.05vsvector,#P<0.05vsLV-hα-syn;n=4 in each group;LV: lentivirus;hα-syn: human α-synuclein;sh: short hairpin RNA;TRPC3:transient receptor potential canonical 3.
本研究为脑老化及PD脑的退行性改变中α-syn所致的线粒体功能障碍提供新的研究线索和实验依据。
[1] Baba M,Nakajo S,Tu P H,et al.Aggregation of alpha-synuclein in Lewy bodies of sporadic Parkinson’s disease and dementia with Lewy bodies[J].Am J Pathol,1998,152(4):879-884.
[2] Kalia L V,Kalia S K.alpha-synuclein and Lewy pathology in Parkinson’s disease[J].Curr Opin Neurol,2015,28(4):375-381.
[3] Surmeier D J,Halliday G M,Simuni T.Calcium,mitochondrial dysfunction and slowing the progression of Parkinson’s disease[J].Exp Neurol,2017,[Epub ahead of print].
[4] Subramaniam S R,Chesselet M F.Mitochondrial dysfunction and oxidative stress in Parkinson’s disease[J].Prog Neurobiol,2013,106-107:17-32.
[5] 李瑛,刘光伟,李昕,等.α-突触核蛋白促进过氧化氢诱导的多巴胺能神经细胞凋亡[J].首都医科大学学报,2011,32(6): 771-776.
[6] Volpicelli-Daley L A,Luk K C,Lee V M.Addition of exogenous alpha-synuclein preformed fibrils to primary neuronal cultures to seed recruitment of endogenous alpha-synuclein to Lewy body and Lewy neurite-like aggregates[J].Nat Protoc,2014,9(9):2135-2146.
[7] Gonzalez-Horta A.The Interaction of alpha-synuclein with membranes and its implication in parkinson’s disease: a literature review[J].Nat Prod Commun,2015,10(10):1775-1778.
[8] Zhang H,Liu J,Wang X,et al.V63 and N65 of overexpressed alpha-synuclein are involved in mitochondrial dysfunction[J].Brain Res,2016,1642:308-318.
[9] Wang Y,Liu J,Chen M,et al.The novel mechanism of rotenone-induced alpha-synuclein phosphorylation via reduced protein phosphatase 2A activity[J].Int J Biochem Cell Biol,2016,75:34-44.
[10] Du T T,Wang L,Duan C L,et al.GBA deficiency promotes SNCA/alpha-synuclein accumulation through autophagic inhibition by inactivated PPP2A[J].Autophagy,2015,11(10):1803-1820.
[11] Zhu Y,Duan C,Lu L,et al.alpha-Synuclein overexpression impairs mitochondrial function by associating with adenylate translocator[J].Int J Biochem Cell Biol,2011,43(5):732-741.
[12] Shen J,Du T,Wang X,et al.alpha-Synuclein amino terminus regulates mitochondrial membrane permeability[J].Brain Res,2014,1591:14-26.
[13] Clapham D E.TRP channels as cellular sensors[J].Nature,2003,426(6966):517-524.
[14] Zhu X,Jiang M,Peyton M,et al.trp,a novel mammalian gene family essential for agonist-activated capacitative Ca2+entry[J].Cell,1996,85(5):661-671.
[15] Lessard C B,Lussier M P,Cayouette S,et al.The overexpression of presenilin2 and Alzheimer’s-disease-linked presenilin2 variants influences TRPC6-enhanced Ca2+entry into HEK293 cells[J].Cell Signal,2005,17(4):437-445.
[16] Selvaraj S,Sun Y,Singh B B.TRPC channels and their implication in neurological diseases[J].CNS Neurol Disord Drug Targets,2010,9(1):94-104.
[17] Feng S,Li H,Tai Y,et al.Canonical transient receptor potential 3 channels regulate mitochondrial calcium uptake[J].Proc Natl Acad Sci USA,2013,110(27):11011-11016.
[18] Yu S,Chan P.Role of alpha-synuclein in neurodegeneration: implications for the pathogenesis of Parkinson’s disease[J].Essays Biochem,2014,56:125-135.
[19] Lu L,Zhang C,Cai Q,et al.Voltage-dependent anion channel involved in the alpha-synuclein-induced dopaminergic neuron toxicity in rats[J].Acta Biochim Biophys Sin (Shanghai),2013,45(3):170-178.
TRPC3participatesinα-synuclein-inducedmitochondrialdamage
Lu Yongquan,Chen Min,Gao Ge,Duan Chunli,Lu Lingling,Yang Hui*
(DepartmentofNeurobiology,SchoolofBasicMedicalSciences,CapitalMedicalUniversity,CenterforParkinson’sDisease,BeijingInstituteforBrainDisorders,KeyLaboratoryforNeurodegenerativeDiseaseoftheMinistryofEducation,Beijing100069,China)
ObjectiveTo investigate the role of transient receptor potential canonical channel 3 (TRPC3)in the mitochondrial damage induced by aberrant α-synuclein (α-syn) accumulation.MethodsExpressions of TRPC3 and α-syn in mitochondria were detected by Western blotting and immunofluorescence in α-syn-overexpressing primary neurons and α-syn transgenic and knock-out mice.The detection of mitochondrial membrane potential(MMP) by JC-1 showed mitochondrial damage and the detection of cell viability used MTT and lactated dehydrogenase(LDH) release assays in α-syn-overexpression primary neurons which TRPC3 was knocked down.ResultsTRPC3 and α-syn co-expressed in mitochondria.Neurons overexpressing α-syn increased mitochondrial TRPC3 expression and decreased MMP and cell viability.Suppressing TRPC3 expression partially reversed the α-syn-induced reductions in MMP and cell viability.ConclusionMitochondrial TRPC3 may participate in α-syn-induced mitochondrial damage.
Parkinson’s disease;neuron; α-synuclein;transient receptor potential canonical channel 3 (TRPC3);mitochondria
国家重点研究发展计划(2016YFC1306002),国家自然科学基金(81371398,81371200),北京市自然科学基金(7131001),北京市创新团队建设提升计划(IDHT20140514),北京市教育委员会科技发展计划一般项目(KM201710025001)。This study was supported by National Key Research and Development Plan of China (2016YFC1306002),National Natural Science Foundation of China (81371398,81371200),Natural Science Foundation of Beijing (7131001),Project of Construction of Innovative Teams and Teacher Career Development for Universities and Colleges Under Beijing Municipality (IDHT20140514),Scientific Research Common Program of Beijing Municipal Commission of Education (KM201710025001).
*Corresponding author,E-mail:huiyang@ccmu.edu.cn
时间:2017-12-13 21∶25
http://kns.cnki.net/kcms/detail/11.3662.R.20171213.2125.042.html
10.3969/j.issn.1006-7795.2017.06.016]
Q189
2017-10-23)
编辑 孙超渊

