出生后营养干预对宫内发育迟缓大鼠学习记忆的影响
徐世明 王宏娟* 李中秋 古同男 许子华 盛树力
(1.首都医科大学燕京医学院生化与分子生物学教研室,北京 101300;2.首都医科大学宣武医院中心实验室,北京 100053)
·神经系统疾病的基础和临床研究·
出生后营养干预对宫内发育迟缓大鼠学习记忆的影响
徐世明1王宏娟1*李中秋1古同男1许子华1盛树力2
(1.首都医科大学燕京医学院生化与分子生物学教研室,北京 101300;2.首都医科大学宣武医院中心实验室,北京 100053)
目的研究营养干预对宫内发育迟缓(intrauterine growth retardation,IUGR)大鼠学习记忆的影响,探讨阿尔茨海默病(Alzheimer’s disease,AD)等神经变性病可能的发育起源及营养相关机制。方法应用热量限制法制备IUGR大鼠模型。对出生后的对照大鼠(control,C)和IUGR大鼠(I)在哺乳期和断乳后分别给予自由取食标准饲料(ad libitum food intake,A)、限制取食70%标准饲料(restricted food intake,R)及自由取食高脂饲料(high fat food intake,H)处理,得到6组大鼠:对照自由取食(control with ad libitum food intake,CA)组、对照限制取食(control with restricted food intake,CR)组、对照自由取食高脂(control with high fat food intake,CH)组、IUGR自由取食(IUGR with ad libitum food intake,IA)组、IUGR限制取食(IUGR with restricted food intake,IR)组和IGRU自由取食高脂(IUGR with high fat food intake,IH)组。于新生、断乳和成年3个不同时期取材,比较各组大鼠体质量、脑质量、脑/体质量比、血糖、血三酰甘油和总胆固醇等指标的变化。应用Morris水迷宫实验,比较各组成年大鼠空间学习记忆能力的变化。结果新生IUGR大鼠的血糖和总胆固醇浓度与对照组相比降低,差异有统计学意义(P<0.05)。断乳期,血三酰甘油在IA和IH组较正常出生体质量组升高(P<0.05);血总胆固醇在CR组低于CA组(P<0.05),CH、IA和IH组高于CR组(P<0.05),IR组低于IA组(P<0.05)。成年大鼠血总胆固醇浓度在CH、IA和IH组均高于CA组(P<0.05)。断乳大鼠体质量,CH组高于CA组(P<0.05),CR、IA和IR组均低于CA组(P<0.05);脑质量,CR、IA、IH、IR组均低于CA组(P<0.05);脑/体质量比在CR和IR组高于CA组(P<0.05),CH组低于CA组(P<0.05)。成年大鼠的脑、体质量变化与断乳时期相似。Morris水迷宫实验中,撤除平台后,CH及IR两组大鼠穿过平台的次数均多于CA组(P<0.05);CH组大鼠在平台象限停留时间多于CA、CR和IR组,差异有统计学意义(P<0.05)。结论出生后的不同营养干预可造成IUGR大鼠血糖、血脂等血液生物化学指标的变化,伴脑、体质量的差异及成年后空间学习记忆的改变,提示AD等神经变性病的脑内变化可能起源于生命早期,并受到生后营养状况的影响。
宫内发育迟缓;营养干预;脑/体质量比;Morris水迷宫
宫内发育迟缓(intrauterine growth retardation,IUGR)不仅造成胎儿出生体质量降低,更可能对子代个体出生后的生长发育造成近期或远期的影响[1]。已有证据[2]表明IUGR与2型糖尿病、缺血性心脏病、高血压、肥胖症及神经变性病等多种成年期疾病具有相关关系,但机制尚不清楚。IUGR胎儿可能为适应不利的宫内环境,通过胰岛素抵抗等机制永久改变敏感组织器官的结构与功能,以优化营养配置保证生存。当预先的“编程”与出生后的环境不匹配时,成年后患慢性疾病的风险就会增加[3]。近年来,以阿尔茨海默病(Alzheimer’s disease,AD)为代表的神经变性病的发病起源问题得到越来越多的关注。生命早期因营养缺乏引起的脑内胰岛素抵抗及出生后营养状况与神经变性病易感性之间的相关关系日益成为新的研究热点。
本课题组[4]之前的研究显示,新生IUGR大鼠的体质量、脑质量均显著降低,但脑/体质量比显著升高,说明IUGR大鼠在营养缺乏条件下存在脑保护效应。本实验在此基础上进一步比较断乳和成年大鼠脑、体质量的变化;测定血糖、血三酰甘油及胆固醇在新生、断乳和成年时期的变化;观察成年大鼠在Morris水迷宫实验中学习记忆能力的变化。探讨AD等神经变性病可能的早期营养相关机制。
1 材料与方法
1.1 实验动物及饲料
SPF级Sprague-Dawley(SD)大鼠36只,雌雄各半,12~15周龄,体质量220~250 g,北京维通利华实验动物技术有限公司提供,实验动物合格证号:SCXK(京)2012-0001。动物饲养在首都医科大学实验动物中心SPF级实验室,动物实验室许可证号:SYXK(京)2010-0020。大小鼠维持饲料及高脂高热量饲料由北京华阜康生物科技股份有限公司提供,许可证编号:SCXK(京)2009-0008(表1)。
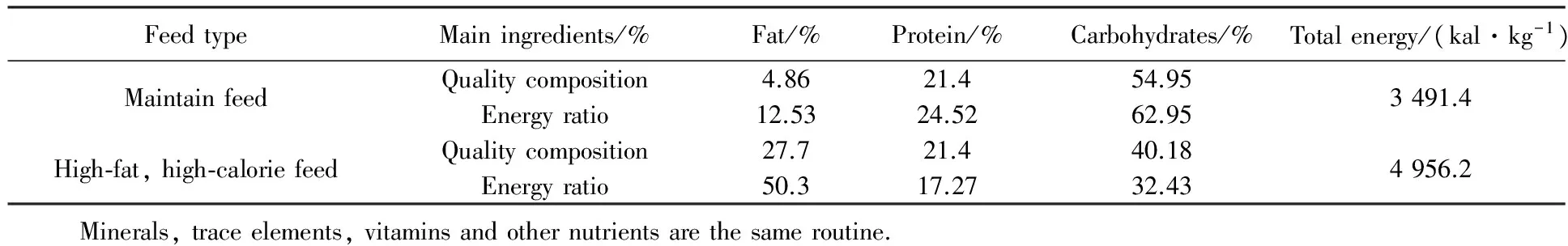
表1 动物饲料主要成分含量Tab.1 Main ingredients of animal feed
1.2 实验仪器和试剂
酶标仪(美国Thermo公司);Morris 水迷宫系统和视频分析软件(美国Actimetrics公司);葡萄糖测定试剂盒(葡萄糖氧化酶法,产品批号:153431)、三酰甘油测定试剂盒(GPO-PAP法,产品批号:157231)、总胆固醇测定试剂盒(COD-PAP法,产品批号:141761)均由中生北控生物科技股份有限公司提供。
1.3 动物模型制备
雌雄SD大鼠按1∶1比例合笼,次日晨见阴栓计为妊娠第1天。18只孕鼠单笼饲养,采用数字表法随机分为对照(control,Con)组和IUGR组(每组 9只):对照组自由取食标准食水;IUGR组于妊娠第1~10天自由取食标准饲料,第11~21天给予同孕龄对照组孕鼠50%(质量分数)饲料量。2组孕鼠分娩当日均自由取食标准食水。IUGR新生仔鼠体质量低于对照组2个标准差为IUGR纳入标准[5]。
1.4 动物分组与生后营养干预处理
孕鼠分娩后,每窝仔鼠调整为7只。9窝Con仔鼠采用数字表法随机分为3组,每组3窝,各组仔鼠在哺乳期(21 d)及断乳后进行营养干预:(1)对照自由取食(control with ad libitum food intake,CA)组:对照组哺乳期母鼠及断乳后仔鼠自由取食标准饲料,每天记录取食量;(2)对照限制取食(control with restricted food intake,CR)组:Con哺乳期母鼠及断乳后仔鼠每天给予CA组饲料量的70%(质量分数)标准饲料;(3)对照自由取食高脂(control with high fat food intake,CH)组:Con哺乳期母鼠及断乳后仔鼠自由取食高脂高热量饲料。9窝IUGR仔鼠也采用数字表法随机分为3组,每组3窝,各组仔鼠在哺乳期及断乳后进行营养干预:(1)IUGR自由取食(IUGR with ad libitum food intake,IA)组:IUGR哺乳期母鼠及断乳后仔鼠自由取食标准饲料,每天记录取食量;(2)IUGR限制取食(IUGR with restricted food intake,IR)组:IUGR哺乳期母鼠及断乳后仔鼠每天给予IA组饲料量的70%标准饲料;(3)IUGR自由取食高脂(IUGR with high fat food intake,IH):IUGR哺乳期母鼠及断乳后仔鼠自由取食高脂高热量饲料。
新生(0日龄)、断乳(21日龄)及成年(90日龄)大鼠断头取脑,记录脑、体质量并计算脑/体质量比值,留取血液测定各项生物化学指标。
1.5 大鼠行为学测试
各组大鼠喂养90 d后,采用Morris水迷宫(Morris water maze,MWM)实验评价其空间记忆能力。实验共6 d:(1)前5 d进行定位航行训练,每天训练1次,120 s未找到平台者,将其引至平台上,放置30 s。(2)第6天撤除平台,进行空间探索实验,记录大鼠120 s内在无平台的水迷宫中穿越平台所在位置的次数和平台所在象限内停留的时间。
1.6 血液生物化学指标检测
新生大鼠断头采血,断乳及成年大鼠于实验结束时经颈动脉采血,血液经肝素抗凝,取血浆备用。按照试剂盒相关说明,使用酶标仪进行血糖、血三酰甘油和血总胆固醇等血液生物化学指标检测。
1.7 统计学方法

2 结果
2.1 新生大鼠血糖、三酰甘油和总胆固醇等生理参数的变化
新生IUGR大鼠的血糖浓度低于Con组(P<0.05,n=10),总胆固醇浓度显著降低(P<0.01,n=10),三酰甘油浓度在两组间差异无统计学意义(表2)。
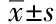
表2 新生大鼠血糖、三酰甘油及总胆固醇等生理参数的变化Tab.2 Changes of blood sugar,triglycerides and total cholesterol in newborn rats (mmol/L,)
Con: control;IUGR:intrauterine growth retardation.
2.2 断乳大鼠血糖、三酰甘油和总胆固醇等生理参数的变化
断乳期,各组大鼠血糖值差异无统计学意义(P>0.05),但与CA组相比均有升高趋势,尤以IA和IH两组升高明显;与Con各组仔鼠相比,血三酰甘油浓度在IA和IH两组均有升高(P<0.05,n=10),与IR组比较,IH组的三酰甘油浓度也有升高(P<0.05,n=10);血胆固醇总量,CR组低于CA、CH、IA和IH组(P<0.05,n=10),IR组低于IA组(P<0.05,n=10)(表3)。
2.3 成年大鼠血糖、三酰甘油和总胆固醇等生理参数的变化
各组成年大鼠血糖值差异均无统计学意义(P>0.05),但IH组与其他各组相比有升高趋势;血三酰甘油浓度在CH和IA组有升高趋势,但各组间差异无统计学意义(P>0.05);血总胆固醇浓度,CH、IA和IH组高于CA组(P<0.05,n=10),CR和IR组低于CH组(P<0.05,n=10)(表4)。
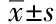
表3 断乳大鼠血糖、三酰甘油及总胆固醇等生理参数的变化Tab.3 Changes of blood sugar,triglycerides and total cholesterol in weanling rats (,mmol/L)
CA:control with ad libitum food intake;CR:control with restricted food intake;CH:control with high fat food intake;IA:IUGR with ad libitum food intake;IR:IUGR with restricted food intake;IH:IUGR with high fat food intake;IUGR:intrauterine growth retardation.
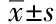
表4 成年大鼠血糖、三酰甘油及总胆固醇等生理参数的变化Tab.4 Changes of blood sugar,triglycerides and total cholesterol in adult rats (,mmol/L)
CA:control with ad libitum food intake;CR:control with restricted food intake;CH:control with high fat food intake;IA:IUGR with ad libitum food intake;IR:IUGR with restricted food intake;IH:IUGR with high fat food intake.
2.4 断乳大鼠的脑质量、体质量和脑体质量比
断乳时,CH组大鼠体质量高于CA组(P<0.05,n=10),IH组与CA组相比,差异无统计学意义(P>0.05),其余3组大鼠体质量均低于CA组(P<0.05,n=10),尤以CR和IR组体质量降低最为显著;脑质量的测定结果与体质量测定结果相似,CH组与CA组差异无统计学意义(P>0.05),其余4组均低于CA组(P<0.05,n=10),以IR组的脑质量最低;脑/体质量比CR和IR 2组明显高于CA组(P<0.05,n=10),CH组则低于CA组(P<0.05,n=10),IA和IH 2组与CA组相近(表5)。
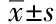
表5 断乳大鼠脑质量、体质量及脑/体质量比等生理参数的变化Tab.5 Changes of brain mass,body mass and brain/body mass ratio in weanling rats ()
CA:control with ad libitum food intake;CR:control with restricted food intake;CH:control with high fat food intake;IA:IUGR with ad libitum food intake;IR:IUGR with restricted food intake;IH:IUGR with high fat food intake.
2.5 成年大鼠的脑质量、体质量和脑体质量比
成年期大鼠体质量和脑质量的变化与断乳期变化相似。脑/体质量比CR和IR两组仍明显高于CA组(P<0.05,n=10),CH和IH两组低于CA组,但差异无统计学意义(P>0.05),IA组与CA组相近(表6)。
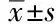
表6 成年大鼠的脑质量、体质量和脑体质量比Tab.6 Changes of brain mass,body mass and brain/body mass ratio in adult rats ()
CA:control with ad libitum food intake;CR:control with restricted food intake;CH:control with high fat food intake;IA:IUGR with ad libitum food intake;IR:IUGR with restricted food intake;IH:IUGR with high fat food intake.
2.6 成年大鼠Morris水迷宫测定结果
MWM测定发现,撤除平台后CH组大鼠穿过平台的次数多于CA、CR和IA组(P<0.05,n=10);IR组大鼠穿过平台的次数也多于CA组(P<0.05,n=10);CH组大鼠在平台象限停留时间多于CA、CR和IR组(P<0.05,n=10),其余各组间差异无统计学意义(P>0.05),但IA和IH组在平台象限停留的时间与CR和IR组相比有升高趋势(表7)。
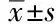
表7 成年大鼠Morris水迷宫测定结果Tab.7 Morris water maze test results of adult rats ()
CA:control with ad libitum food intake;CR:control with restricted food intake;CH:control with high fat food intake;IA:IUGR with ad libitum food intake;IR:IUGR with restricted food intake;IH:IUGR with high fat food intake.
3 讨论
研究[6]表明AD患者及动物模型均存在脑内胰岛素信号通路障碍及糖、脂代谢紊乱。脑内胰岛素抵抗学说作为AD等神经变性病发病机制的重要假说,已经被人们广泛接受[7]。然而脑内胰岛素抵抗的营养学起源及营养变化对脑学习记忆能力的影响仍不清楚。
本实验血糖测定结果显示,新生IUGR大鼠呈明显低血糖状态,可能与母体的低糖状态及新生大鼠内分泌系统发育不成熟或受到损伤有关[5]。至断乳期,IUGR大鼠的血糖水平明显改善,甚至IA和IH组与CA组相比有升高趋势。这种升高趋势在IH组持续到成年期。结合之前新生IUGR大鼠脑内胰岛素信号通路异常的结果[4],推测血糖的异常可能是IUGR大鼠包括脑在内的整体胰岛素抵抗的结果。这种“隐藏”的胰岛素抵抗更多的反映在血脂的紊乱。
与对照组相比,尽管新生IUGR大鼠血三酰甘油水平差异无统计学意义(P>0.05),但总胆固醇浓度是显著降低的。提示IUGR大鼠可能通过减少三酰甘油的储存、降低体质量等方式稳定血三酰甘油的含量,但血胆固醇的浓度却不受此影响。至断乳期,IA组和IH 2组的血三酰甘油浓度显著升高,有趣的是同样食用高脂饲料的CH组并没有明显升高,热量限制的IR组也没有明显降低。提示正常出生体质量的大鼠和限食的IUGR大鼠都可以通过调节体内三酰甘油的储存和动员来维持血三酰甘油的稳定,然而IA和IH组大鼠的这种调节作用似乎并不灵敏。血胆固醇的含量在CR组与IR组都是降低的,提示减少食物热量供给对降低血胆固醇的效应是显著的。随着机体发育成熟,成年期各组大鼠血三酰甘油浓度差异无统计学意义(P>0.05),但CH组和IA组仍有升高趋势。血胆固醇浓度在CH和IH组升高,在CR与IR组降低,依然延续热量供给对胆固醇含量的正向影响,所不同的是在IA组也出现比CA组升高的胆固醇浓度,提示在正常饮食的成年IUGR仔鼠体内开始显现脂代谢紊乱。而这些血脂异常的变化可能恰恰起源于早期的子宫内营养不良所产生的代谢适应[2]。“代谢适应”的机制目前还不清楚,越来越多的证据[1-4]支持胰岛素抵抗学说,脑内的胰岛素信号通路障碍无疑会影响出生后不同营养条件下的脑功能。
尽管新生IUGR大鼠的脑、体质量显著降低[4],但到了断乳期,IH组大鼠已经完成追赶生长,体质量和脑质量均与CA组相近。脑/体质量比则以限食的CR和IR组最高,提示正常出生体质量及IUGR大鼠在生后热量限制过程中均存在明显的脑保护效应。到成年期,CH组比CA组大鼠体质量显著增加但脑质量差异无统计学意义(P>0.05),IH组大鼠体质量仍保持与CA组接近但脑质量低于CA组,CR、IA和IR组的脑质量和体质量均低于CA组,IA组并没有按照预想完成追赶生长。限食的CR和IR组的脑体质量比仍高于CA组,延续低热量供给状态下的脑保护效应[4]。
AD以学习记忆障碍伴行为学异常为主要表现。为了进一步评价正常出生体质量和IUGR大鼠在生后受到不同营养干预后学习记忆能力的变化,本研究对成年大鼠进行了Morris水迷宫实验[8]。在空间探索实验中高脂饲养的CH组和IH组大鼠的表现优于CA组,且CH组大鼠表现出更强的空间学习记忆能力,可能与高脂饮食提供的脂肪酸等营养素对脑发育的促进作用有关[9]。这一结果与研究[10]报道有所不同,可能与造模方法及营养干预的模式和时间存在差别有关。另一方面,这一结果也提示,至少到成年期,充足的脂类供应对于维持正常出生体质量的大鼠及IUGR大鼠的学习记忆能力都是十分必要的。正如Kim等[11]在线虫的研究中发现,一点多余的脂肪有助于降低AD等神经变性病的风险。必要的营养素供应对维持胰岛素适当的敏感性是必要的[9]。最近的流行病学调查[12]结果同样支持适当的脂类摄入对健康的有益作用。当然,倡导脂类在膳食营养中的重要性的前提是维持适当的血脂水平以避免对心血管等系统的不利影响。笔者注意到,尽管IR组大鼠穿过平台的次数增加,但在空间探索实验中,它们在平台象限停留的时间却很短,提示其学习记忆能力存在问题的同时,还可能存在焦虑等应激状态下的心理变化,这一现象同AD的临床表现[13]也是契合的。有研究[14]发现在IUGR动物模型存在血浆肾上腺素和去甲肾上腺素的紊乱,然而IR组大鼠是否存在心理问题还需要更多的证据加以证明。此外,同为IUGR仔鼠,IA组和IH组大鼠的学习记忆能力与CR和IR组相比有升高趋势,可见单纯的热量限制并不利于促进脑发育、提升脑功能,尤其对于低出生体质量的个体,更应在生后保证充足的热量,特别是脂肪酸类营养物质的供应[15]。
总之,脑发育不仅受到生命早期营养供应状况的“编程”,还受到生后营养状况的影响;不当的营养摄入不仅影响脑的学习记忆能力,还可能成为老年时期AD等神经变性病的易感因素;脂肪酸类营养物质的补充对于预防生命早期脑内胰岛素抵抗、改善生后脑功能是十分必要的。
[1] Powell K L,Stevens V,Upton D H,et al.Role for the thromboxane A2 receptor beta-isoform in the pathogenesis of intrauterine growth restriction[J].Sci Rep,2016,6(1): 28811.
[2] Thorn S R,Rozance P J,Brown L D,et al.The intrauterine growth restriction phenotype: fetal adaptations and potential implications for later life insulin resistance and diabetes[J].Semin Reprod Med,2011,29(3): 225-236.
[3] Polat A,Barlow S,Ber R,et al.Volumetric MRI study of the intrauterine growth restriction fetal brain[J].Eur Radiol,2017,27(5): 2110-2118.
[4] 王宏娟,徐世明,李中秋,等.新生IUGR大鼠脑内胰岛素信号通路相关蛋白表达的变化[J].基础医学与临床,2013,33(10): 1061-1065.
[5] 陈璐,刘翠萍,袁庆新,等.宫内发育迟缓对新生大鼠胰腺发育及功能的影响[J].南京医科大学学报:自然科学版,2008,28(3): 278-281.
[6] Duarte A I,Candeias E,Correia S C,et al.Crosstalk between diabetes and brain: glucagon-like peptide-1 mimetics as a promising therapy against neurodegeneration[J].Biochim Biophys Acta,2013,1832(4): 527-541.
[7] Hoyer S.Is sporadic Alzheimer disease the brain type of non-insulin dependent diabetes mellitus? A challenging hypothesis[J].J Neural Transm,1998,105(4-5): 415-422.
[8] Benoit J D,Rakic P,Frick K M.Prenatal stress induces spatial memory deficits and epigenetic changes in the hippocampus indicative of heterochromatin formation and reduced gene expression[J].Behav Brain Res,2015,281(1): 1-8.
[9] Goodspeed D,Seferovic M D,Holland W,et al.Essential nutrient supplementation prevents heritable metabolic disease in multigenerational intrauterine growth-restricted rats[J].FASEB J,2015,29(3): 807-819.
[10] Dong W,Wang R,Ma L N,et al.Influence of age-related learning and memory capacity of mice: different effects of a high and low caloric diet[J].Aging Clin Exp Res,2016,28(2): 303-311.
[11] Kim H E,Grant A R,Simic M S,et al.Lipid biosynthesis coordinates a mitochondrial-to-cytosolic stress response[J].Cell,2016,166(6): 1539-1552.
[12] Dehghan M,Mente A,Zhang X,et al.Associations of fats and carbohydrate intake with cardiovascular disease and mortality in 18 countries from five continents (PURE): a prospective cohort study[J].Lancet,2017,390(10107): 2050-2062.
[13] 王升武.阿尔茨海默病的临床特征及综合治疗效果的评价[J].医学理论与实践,2016,29(3): 319-321.
[14] Macko A R,Yates D T,Chen X,et al.Adrenal demedullation and oxygen supplementation independently increase glucose-stimulated insulin concentrations in fetal sheep with intrauterine growth restriction[J].Endocrinology,2016,157(5): 2104-2115.
[15] 王玉惠.早产儿不同肠外营养方案的临床探讨[J].吉林医学,2014,35(25): 5624-5626.
Effectofpostnatalnutritionalinterventiononlearningandmemoryofintrauterinegrowthretardationrats
Xu Shiming1,Wang Hongjuan1*,Li Zhongqiu1,Gu Tongnan1,Xu Zihua1,Sheng Shuli2
(1.DepartmentofBiochemistryandMolecularBiology,YanjingMedicalCollege,CapitalMedicalUniversity,Beijing101300,China;2.CentralLaboratory,XuanwuHospital,CapitalMedicalUniversity,Beijing100053,China)
ObjectiveIn order to explore the possible developmental origins and related mechanisms of nutrition in neurodegenerative disease like Alzheimer disease (AD),we observed the changes of learning and memory ability of rats with intrauterine growth retardation (IUGR) under different nutritional intervention.MethodsIUGR rats were induced by calorie restriction on pregnant rats.After birth,control (C) rats and IUGR (I) rats were fed with ad libitum food intake (A),70% restricted food intake (R) and high fat food intake (H) respectively,and 6 groups of rats with different nutritional intervention were obtained: control with ad libitum food intake (CA),control with restricted food intake (CR),control with high fat food intake(CH),IUGR with ad libitum food intake (IA),IUGR with restricted food intake (IR) and IUGR with high fat food intake (IH).Body mass,brain mass,brain: body mass ratio,blood sugar,triglyceride and total cholesterol were determined at the period of newborn,weaning and adult.Morris water maze (MWM) was used to detect the changes of learning and memory ability in adult rats.SPSS 18.0 was applied to analyze the data.ResultsCompared with the control group,the blood sugar (P<0.05) and the total cholesterol (P<0.01) from newborn IUGR rats were decreased.In weaning rats,triglyceride increased in the IA and IH groups compared to all the control groups (P<0.05);total cholesterol was lower in CR group compared with CA group (P<0.05),while it was higher in CH,IA and IH groups than in CR group (P<0.05),and lower in IR group than in IA group (P<0.05).In adult rats,total cholesterol was higher in CH,IA and IH groups compared with the CA group (P<0.05).The body mass of weaning rats of CH group increased(P<0.05)and that of CR,IA and IR groups decreased(P<0.05)compared to the CA group;the brain mass in weaning rats decreased in CR,IA,IH and IR groups compared to the CA group(P<0.05);brain-to-body mass ratio in weaning rats increased in CR and IR groups(P<0.05)and decreased in CH group(P<0.05)compared to CA group.The varieties of body and brain mass in adult rats were similar to that in weaning rats.In Morris water maze test,when the platform was removed,it was detected that rats of CH and IR groups crossed the platform more frequently than the ones from CA group(P<0.05);the rats of CH group stayed in the quadrant where the platform was placed before for a longer time than the rats of CA,CR and IR group(P<0.05).ConclusionNutritional interventions on IUGR rats resulted in the changes of blood sugar,triglyceride and total cholesterol,which thus affected the body and brain mass,which might be involved in the variety of ability of learning and memory in adult rats.It indicated that the changes in the brain of neurodegenerative disease like AD might derived from early life and be affected by the nutritional circumstance after birth.
intrauterine growth retardation;nutritional intervention;brain-body mass ratio;Morris water maze
北京市自然科学基金(7132033),首都医科大学基础-临床合作基金(16JL14),燕京医学院科研基金(15QD02,15QD08,17QD05)。This study was supported by Natural Science Foundation of Beijing (7132033),Basic-clinical Cooperation Fund of Capital Medical University(16JL14),Yanjing Medical College Research Fund(15QD02,15QD08,17QD05).
*Corresponding author,E-mail:whj1006@163.com
时间:2017-12-13 21∶09
http://kns.cnki.net/kcms/detail/11.3662.R.20171213.2109.024.html
10.3969/j.issn.1006-7795.2017.06.015]
R722
2017-10-01)
编辑 慕 萌

