傣族发酵淘米水的初步研究
,,,, , ,*
(1.云南民族大学化学与环境学院,云南昆明 650500;2.云南省勐海县农产品质量安全监测站,云南勐海 666200;3.云南与诺生物工程有限公司,云南昆明 650000;4.云南民族大学民族药资源化学国家民族事务委员会,教育部重点实验室,云南昆明 650500)
傣族发酵淘米水的初步研究
杨海英1,胡秋月1,王忠诚2,黄开心3,刘赟4,杜刚4,*
(1.云南民族大学化学与环境学院,云南昆明 650500;2.云南省勐海县农产品质量安全监测站,云南勐海 666200;3.云南与诺生物工程有限公司,云南昆明 650000;4.云南民族大学民族药资源化学国家民族事务委员会,教育部重点实验室,云南昆明 650500)
本文对傣族淘米水的发酵菌株及物质基础进行初步研究,为傣族淘米水在日化领域的开发应用提供实验依据。从传统发酵的淘米水中分离发酵菌株,结合菌株形态和分子生物学方法进行菌株鉴定,通过凯氏定氮法检测不同时间发酵淘米水的总氮及非蛋白氮含量,采用高效液相色谱法分析测定淘米水发酵液中的乳酸和乙酸含量。结果表明,从发酵淘米水样品中分离得到1株乳酸菌和1株酵母菌,通过16S rRNA基因序列及26S rRNA序列分析,结合表形特征,初步鉴定两株菌为乳杆菌属菌株和毕赤酵母属菌株。经48 h发酵,与未发酵淘米水相比,总氮含量提高105%,非蛋白氮含量提高77%,乳酸含量提高551%,乙酸含量提高342%。
发酵淘米水,菌株鉴定,总氮,非蛋白氮,有机酸
云南傣族有用发酵淘米水洗发的传统,淘米水中的微粒具有去污功能,去头屑、润发、亮发和促使头发变黑、变粗等作用[1]。淘米水主要含有米糠和糊粉层的营养成分,包括淀粉、蛋白质、油脂含量、膳食纤维、谷维素、维生素、矿物质和生育酚等多种生物活性成分[2]。米糠蛋白具备低过敏性、抗癌活性和保健功能[3],米糠脂类物质可降低人体血清胆固醇[4],米糠多糖成分具有抗肿瘤[5],增强免疫力[6]及降血糖[7]的活性,米糠的植酸钙能促进人体新陈代谢、骨骼组织生长发育等[8]。米糠肽是米糠蛋白经蛋白酶水解得到的低分子量多肽,具有低过敏性、易溶解、无腥味的特点[9]。在米糠肽中还发现多种功能活性,Fujita等通过酶解黄酒发酵后的酒糟获得了九种抑制ACE(血管紧张素转化酶)活性的肽[10],Chen等[11]采用离体豚鼠回肠(GPI)检定法检测米糠蛋白酶解物的类阿片拮抗活性,曲晓婷[12]等发现米糠肽能促进脾淋巴细胞增殖。韩国新罗大学的Choi等[13]对米糠进行CO2超临界萃取,提取物表现出良好的生发效果,毛囊显著增多,其效果与3%的生发药物米诺地尔相当。针对雄激素性脱发进行16周的随机双盲实验,实验表明萃取产物可显著增加男性样本的头发密度和头发直径,且未出现任何不良反应[14]。
本文对发酵淘米水中的菌株进行分离鉴定,检测发酵过程中总氮、非蛋白氮以及有机酸含量的变化,为传统发酵淘米水在日化工业的开发提供实验依据,尚未见对发酵淘米水的菌株及物质基础进行研究的报道。
1 材料与方法
1.1 材料与仪器
淘米水 云南省西双版纳傣族自治州勐腊县曼那村传统发酵3 d的淘米水;傣族香米 云南省勐海县傣乡米厂;甲醇为色谱纯 Fisher公司;实验用水 超纯水和蒸馏水;乙酸、乳酸纯度大于99%;NaH2PO4(AR)、磷酸(AR)、柠檬酸三铵(AR)、CH3COONa(AR)、MnSO4(AR)、MgSO4(AR)、KH2PO4(AR)、葡萄糖、蛋白胨、牛肉膏、酵母膏等 国药集团化学试剂有限公司。
Agilent 1200高效液相色谱仪 美国安捷伦公司;LE204E电子天平、FE20K pH计 Mettler Toledo公司;台式离心机 上海安亭/飞鸽;LDZX-40BI蒸汽灭菌锅 上海申安医疗器械厂;HP-900隔水式恒温培养箱 上海一恒科技有限公司;双目显微镜 上海华岩仪器设备有限公司;TGL-15B高速冷冻离心机 上海安亭科学仪器厂;5331型PCR仪 德国 Eppendorf公司;Tanon 2500凝胶成像系统 上海天能科技有限公司;HYP-3智能消化炉、KDN-102C定氮仪蒸馏装置 上海纤检仪器有限公司;GUJS-50型发酵罐 镇江东方生物工程设备技术有限责任公司。
1.2 实验方法
1.2.1 培养基 MRS培养基:葡萄糖20 g,蛋白胨10 g,牛肉膏10 g,酵母膏5 g,柠檬酸三铵2 g,CH3COONa 1 g,MnSO40.25 g,MgSO40.58 g,KH2PO42 g,蒸馏水1000 mL,pH自然。
YPD培养基:葡萄糖20 g,蛋白胨20 g,琼脂20 g,酵母膏20 g,蒸馏水1000 mL,pH自然。
1.2.2 发酵淘米水的制备 传统淘米水发酵方式为:把每天的淘米倒入盆或桶中厌氧发酵,温度30 ℃,48~96 h。傣族香米与水比例为1∶2,浸泡1 h,得到淘米水。以勐腊县曼那村传统发酵3 d的淘米水作种子,接种量为发酵体积的10%,用50 L发酵罐装量20 L,模拟传统淘米水发酵方式进行厌氧发酵,121 ℃灭菌30 min,发酵温度30 ℃,搅拌速率120 r/min,每12 h搅拌30 min。
1.2.3 菌株的分离纯化 在无菌条件下,取勐腊县曼那村传统发酵淘米水样品1 mL加入99 mL 无菌生理盐水中,摇匀后取1 mL加入9 mL 无菌生理盐水的试管中,作10-3~10-10梯度稀释。吸取稀释液各200 μL 涂布于MRS培养基,每个稀释度3个平行,32 ℃下培养48 h。挑取单个菌落,划线法分离纯化,观察菌株的菌落形态特征及显微形态特征。
1.2.4 细菌和酵母的分子生物学鉴定 斜面菌种活化后,细菌接种于30 mL MRS液体培养基,32 ℃培养24 h,酵母接种于30 mL YPD液体培养基,取5 mL培养物12000 r/min离心10 min,收集菌体,液氮冻融-CTAB法提取DNA。
细菌16S rDNA引物27f:5′-AGAGTTTGATCC TGGCTCAG-3′和1495r:5′-CTACGGCTACCTT GTTACGA-3′;酵母26S rDNA D2引物NL1:5′-GCATATCAATAAGCG GAGGAAAAG-3′和NL4:5′-GGTCCGTGTTTCAAG-3。PCR反应体系为:Taq MIX 25 μL,引物各2 μL,模板5 μL,加无酶水补足50 μL。程序为:95 ℃ 预热5 min,94 ℃ 变性1 min,55 ℃退火30 s,72 ℃延伸 2 min,30个循环后72 ℃末端延伸 10 min,4 ℃ 保存。PCR产物以琼脂糖电泳检测送生工生物工程(上海)股份有限公司测序。
细菌所得DNA序列用DNAMAN生物软件进行拼接,用MEGA6.0进行细菌和酵母序列的同源性比对(Alignment)和系统发育树构建。
1.2.5 总氮含量测定 用凯氏定氮法[15]测定淘米水发酵时间为0、6、12、18、24、30、36、42、48 h样品的总氮含量,每个样品平行测定三次,每次测定样品量为3 mL发酵液。
1.2.6 非蛋白氮含量测定 测定发酵时间为0、6、12、18、24、30、36、42、48 h样品的非蛋白氮含量。取3 mL发酵液样品加入等体积的乙醇溶液(75%),振荡5 min,于4000 r/min下离心15 min,取上清液,以上步骤重复三次。再加入3 mL的5%磺基水杨酸检测体系中有无蛋白质,确定无蛋白质后,敞开管口于115 ℃条件下蒸干样品内溶剂,所得样品以凯式定氮法测定其含氮量。
1.2.7 有机酸的检测
1.2.7.1 HPLC色谱条件 色谱柱:Agilent Zorbax SB-Aq(4.6 mm×150 mm,5 μm);流动相:甲醇-20 mmol/L NaH2PO4缓冲溶液(pH2.0),体积比为1∶99;流速:0.4 mL/min;进样量:3 μL;柱温:25 ℃;检测波长:210 nm。
1.2.7.2 样品预处理 取5 mL淘米水发酵液,经12000 r/min离心10 min后取上清液,用0.45 μm滤膜过滤即得待测样品溶液。
1.2.7.3 标准品溶液的配制及标准曲线的绘制 精确称取乙酸、乳酸标准品适量,置于100 mL容量瓶中,用超纯水溶解并定容,制成每毫升含24.75 mg乳酸、3.93 mg乙酸的混合标准溶液,4 ℃冰箱保存。
将混合标准溶液按比例稀释成不同质量浓度的标准溶液,按照“1.2.7.1“的色谱条件测定,以峰面积A对质量浓度C(mg/mL)进行线性回归,得标准曲线方程。
1.2.7.4 淘米水发酵液样品中乙酸和乳酸的含量测定 测定发酵时间为0、6、12、18、24、30、36、42、48 h样品中乙酸和乳酸的含量,按“1.2.7.2”项对样品进行预处理,按照“1.2.7.1”的色谱条件,记录各个峰的保留时间和峰面积。根据保留时间确定样品中有机酸的种类,根据峰面积和标准曲线计算发酵液中乙酸和乳酸的含量。
1.2.7.5 pH的测定 样品溶液用pH计测定溶液pH。
1.3 数据统计分析
检测数据通过Excel求得平均值和标准偏差,以SigmaPlot 12.5软件作图。
2 结果与分析
2.1 菌株的分离纯化及分子鉴定
菌株YNCA9102形态结构如图1,菌落湿、薄小、光滑、扁平、不透明、正反面匀为白色,菌体为分离的杆状细胞,革兰氏染色阳性。菌株YNCA9102形态结构如图2,菌落湿、薄小、光滑、隆起、不透明、正反面匀为白色;菌体呈卵圆形,具藕节状假菌丝,碘液染色肝糖粒呈红色。
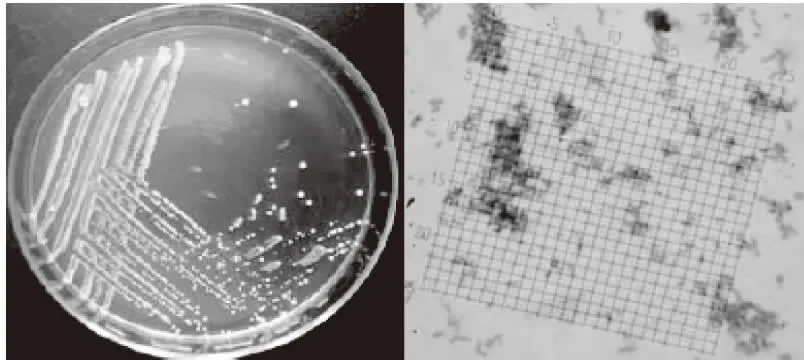
图1 菌株YNCA9101菌落及显微结构(1000×)Fig.1 Culture characteristics and morphological characteristics of YNCA9101(1000×)
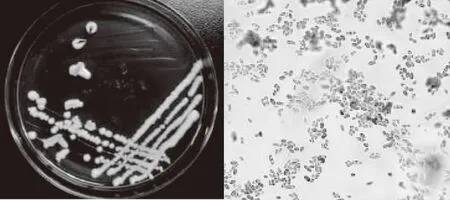
图2 菌株YNCA9102菌落特征及显微结构(1000×)Fig.2 Culture characteristics and morphological characteristics of YNCA9102(1000×)
2.2 菌株的分子鉴定
菌株YNCA9101以16S rDNA通用引物27f:5′-AGAGTTTGATCCTGGCTCAG-3′和1495r:5′-CTACGGC TACCTTGTTACGA-3′进行PCR扩增,在1500 bp左右有条带;菌株YNCA9102以酵母菌26S rDNA D2通用引物NL1:5′-GCATATCAATAAGCG GAGGAAAAG-3′和NL4:5′-GGTCCGTGTTTCAAG-3进行PCR扩增,在500~700 bp之间有条带。测序结果用Blast在GenBank中进行同源性比对,选取模式菌株以领域连接法构建系统发育树。由图3可知,菌株YNCA9101与植物乳杆菌(Lactobacillusplantarum)聚为一簇,与菌株Lactobacillusplantarumstrain JCM 1149相似度为99%,结合其形态特征,菌株YNCA9101初步鉴定为乳杆菌属菌株(Lactobacillussp.)。由图4可知,菌株YNCA9102与毕赤酵母属(Pichia)菌株聚为一簇,与菌株Pichiakudriavzeviiculture-collectionCBS:5147相似度为99%,结合其形态特征,菌株YNCA9102初步鉴定为毕赤酵母属(Pichia)菌株。

图3 乳杆菌YNCA9101基于16S rDNA的系统发育树Fig.3 Phylogenetic analysis of YNCA9101 based on 16S rDNA

图4 酵母菌YNCA9102基于26S rDNA D1/D2区域的系统发育树Fig.4 Phylogenetic analysis of YNCA9102 based on 26SrDNA D1/D2
2.3 淘米水发酵过程中总氮及非蛋白氮含量的变化

图5 淘米水发酵过程中的总氮及非蛋白氮含量Fig.5 The content of total nitrogen and nonprotein nitrogen in the process of fermentation of washing water of rice
发酵淘米水中总氮及非蛋白氮含量随发酵时间变化如图5所示。从图中可以看出,淘米水发酵过程中总氮含量逐步上升,发酵42 h后趋于平缓,发酵48 h后总氮含量发酵初始的0.19%提高到发酵完成的0.39%,比发酵初始提高了105%,发酵过程中总氮含量有一定起伏,因发酵过程中酵母菌和乳酸菌部分菌体沉降和漂浮可能导致取样不均匀。对淘米水发酵液中非蛋白氮含量的测定结果表明,开始发酵时非蛋白氮含量为0.13%,发酵48 h后,非蛋白氮的含量为0.23%,增加了77%;在前18 h增加幅度较为大,发酵36 h后趋于稳定。总氮与非蛋白氮在发酵完成后含量增加,主要由于菌株发酵过程中释放和水解了淘米水中不溶的蛋白质,同时发酵菌株也能合成蛋白质和多肽的。非蛋白氮含量增加反映出发酵淘米水中氨基酸和肽的含量增加。蛋白质、肽和氨基酸都有毛发保湿作用,头发保持一定水分,可以防止过度干燥,减少头发静电增加、乱发及毛燥等发生机率,还能使头发感觉更柔软[16]。
2.4 淘米水发酵液不同阶段有机酸含量分析
2.4.1 标准曲线的绘制 各标准品的回归方程、线性范围、相关系数结果见表1。

表1 2种有机酸的线性回归方程、线性范围、相关系数Table 1 Regression equations,linear ranges, correlation coefficients of the 2 organic acids
2.4.2 发酵液中有机酸含量分析及pH变化 通过对样品溶液和标准品进行检测,确定淘米水发酵样品中含有乳酸和乙酸两种有机酸,有机酸标样和样品的HPLC色谱图如图6和图7。

图6 有机酸标样HPLC色谱图Fig.6 HPLC chromatogram of organic acid standards

图7 淘米水发酵样品HPLC色谱图Fig.7 HPLC chromatogram of fermentation broth sample of washing water of rice
淘米水发酵过程中乳酸、乙酸含量及pH随发酵时间的变化见图8。由图8可以看出,淘米水发酵样品中乙酸和乳酸随发酵时间的延长含量增加,乳酸的含量变化更为显著,42 h后趋于稳定。乙酸和乳酸初始含量分别为0.26、1.66 mg/mL,经过48 h发酵时间,乙酸和乳酸最终含量分别为1.15、10.80 mg/mL,分别增加342%和551%,发酵开始的乙酸和乳酸由种子液带入。

图8 淘米水发酵过程中乙酸、乳酸的含量及pH变化Fig.8 Changes of the content of organic acids and pH during fermentation of washing water of rice
随有机酸含量增加,20 h内pH由初始发酵的6.2下降到4.0以下,42 h后pH稳定在3.1,pH的下降与有机酸的增加有较强的相关性。
3 结论
从发酵的淘米水样品中分离到两株菌,结合菌体形态和分子鉴定,初步鉴定为植物乳杆菌(L.plantarum)和毕赤酵母(Pichiasp.)。对淘米水发酵过程中0、6、12、18、24、30、36、42、48 h样品进行分析,淘米水发发酵48 h后总氮含量提高了105%,非蛋白氮的含量增加了77%,乙酸含量增加了342%,乳酸含量增加了551%。与未发酵淘米水比较,淘米水经发酵后总氮、非蛋白氮、乙酸和乳酸含量都有显著增加。
[1]可畅. 孔雀公主刀美兰的养发经[J]. 新天地,2009,3:50.
[2]周显青,夏稳稳,张玉荣. 我国糯米粉加工及其质量控制技术现状与展望[J].粮油食品科技,2013,21(3):1-6.
[3]Han SW,Chee KM,Cho SJ. Nutritional quality of rice bran protein in comparison to animal and vegetable protein[J]. Food Chemistry,2015,172(3):766.
[4]Mendel F. Rice bran,rice bran oils,and rice hulls:composition,food and industrial uses,and bioactivities in humans,animals,and cells[J]. Agricultural and Food Chemistry,2013,61(45):10626-10641.
[5]Wang L,Li X,Chen Z. Sulfated modificat ion of the polysaccharides obtained from defatted rice bran and their antitumor activities[J]. International Journal of Biological Macromolecules,2009,44(2):211-214.
[6]Park H Y,Lee KW,Choi HD,et al. Rice bran constituents:immunomodulatory and therapeutic activities[J]. Food & Function,2017,8(3):935-943.
[7]Liu Q,Cao X,Zhuang X,et al. Rice bran polysaccharides and oligosaccharides modified by Grifola frondosa fermentation:Antioxidant activities and effects on the production of NO[J]. Food Chemistry,2017,223:49-53.
[8]Li,Y,Meng S,Shi M,et al. Bioactivity Evaluation of Crude Polysaccharide from Rice Bran Fermented by Preussia Aemulans and the Changes in its Nutritional Contents[J]. Journal of Food Biochemistry,2016,40(5):664-672.
[9]朱磊,汪学德,于新国. 米糠蛋白的综合研究进展[J]. 中国油脂,2013,38(2):81-83.
[10]Fujita H,Yamagami T,Ohshima K. Effects of an ace-inhibitory agent,katsuobushi oligopeptide,in the spontaneously hypertensive rat and in borderline and mildly hypertensivesubjects 1[J]. Nutrition Research,2001,21(8):1149-1158.
[11]Chen J W,Sun Q J,Yao H Y. Opioid Antagonist Activities of Enzymatic Hydrolysates from Rice Bran Protein[J]. Food Science,2005,26(6):141-145.
[12]曲晓婷. 米糠肽及其免疫调节作用的研究[D].广州:华南理工大学,2007.
[13]Jae-Suk C,Min-Hee J,Woi-Sook M,et al.Invivohair growth-promoting effect of rice bran extract prepared by supercritical carbon dioxide fluid[J]. Biological & Pharmaceutical Bulletin,2014,37(1):44-53.
[14]Choi J S,Park J B,Moon W S,et al. Safety and Efficacy of Rice Bran Supercritical CO2Extract for Hair Growth in Androgenic Alopecia:A 16-Week Double-Blind Randomized Controlled Trial[J]. Biological & Pharmaceutical Bulletin,2015,38(12):1856-1863.
[15]陈钧辉. 生物化学实验(第四版)[M]. 北京:科学出版社,2008:59-62.
[16]Pierard-Franchimont C,Pieraed G E,Hair weathering and hair capacitance mapping:a pilot study[J]. Journal of Cosmetic Dermatology,2012,11(3):179-182.
Preliminarystudyonfermentedrice-washingwaterofDai
YANGHai-ying1,HUQiu-yue1,WANGZhong-cheng2,HUANGKai-xin3,LIUYun4,DUGang4,*
(1.School of Chemistry and Environment,Yunnan Minzu University,Kunming 650500,China;2.Menghai Agricultural Products Quality Security Inspection Testing Center,Menghai 666200,China;3.Yunnan Yunuo Bioengineering Company Limited,Kunming 650000,China;4.Key Laboratory of Chemistry in Ethnic Medicinal Resources,State EthnicAffairs Commission & Ministry of Education,Kunming 650500,China)
The fermentation strain and material basis of fermented rice-washing water of Dai were preliminary studied for supporting the development and application of fermented rice-washing water of Dai in the field of daily chemicals. The fermentation strains were isolated from the sample of fermented rice-washing water of Dai in Xishuangbanna and identified by phylogenetic analyses of 16SrRNA gene and 26R rRNA gene respectively,combined with phenotypic characteristics. The content of total nitrogen and non-protein nitrogen were detected by Kjeldahl determination and the concentration of lactic acid and acetic acid were detected by HPLC. The results showed that a lactic acid bacteria and a yeast were isolated from the sample of fermented rice-washing water and were primarily identified asLactobacillussp. andPichiasp.. Compared with unfermented rice-washing water,the non-protein nitrogen was increased 105%,the protein nitrogen was increased 77%,the lactic acid and acetic acid were increased 551% and 342% respectively after 48 h fermentation.
fermented rice-washing water;strain identification;total nitrogen;non-protein nitrogen;organic acid
2017-05-25
杨海英(1975-),女,硕士,教授,研究方向:微生物化学,E-mail:yanghy200401@126.com。
*通讯作者:杜刚(1973-),男,博士,副教授,研究方向:微生物,E-mail:18372454@qq.com。
国家自然科学基金项目(21462051);云南省教育厅科学研究基金重点项目(2015Z111)。
TS210.9
A
1002-0306(2017)23-0019-05
10.13386/j.issn1002-0306.2017.23.005

