婴幼儿及儿童头孢曲松结石的外科治疗
杜源 李钧 肖荆 王文营 田野
1首都医科大学附属北京友谊医院泌尿外科 100050 北京
论著
婴幼儿及儿童头孢曲松结石的外科治疗
杜源1李钧1肖荆1王文营1田野1
1首都医科大学附属北京友谊医院泌尿外科 100050 北京
目的探讨婴幼儿及儿童头孢曲松结石的外科治疗方法。方法回顾性分析2015年8月~2016年4月5例确诊为头孢曲松结石患儿资料,探讨其临床表现、影像学特征及手术治疗方式。结果5例患儿中4例表现为肾绞痛或腹部疼痛,4例表现为无尿,1例出现急性肾功能不全。B超、CT等影像学检查发现肾结石和(或)输尿管结石,患侧肾、输尿管积水。经手术或保守治疗均已痊愈,结石成分分析为头孢曲松,短期随访肾功能均正常,无结石残留或复发。结论头孢曲松钠因广谱抗菌、半衰期长、安全性好,在婴幼儿及儿童患者中使用广泛。但因其在尿液中和游离钙结合形成不溶解的头孢曲松钙结晶,易导致药物源性结石形成。因此使用头孢曲松患儿需增加液体摄入量,B超动态监测。出现头孢曲松结石引起急性梗阻,应及时留置输尿管支架管解除梗阻,促进结石排出。
婴幼儿;儿童;头孢曲松结石
头孢曲松钠(Ceftriaxone, CTX)是三代半合成头孢菌素,广泛用于不同细菌感染。因其抗菌谱广、半衰期长(7~8 h)、每日单次给药和较好的用药安全性的特性,在临床中使用频次较高,尤其是儿童感染患者[1],但患儿使用后可出现急性肾后性肾功能不全。我们于2015年8月~2016年4月诊治头孢曲松结石患儿5例,经治疗均已痊愈,短期随访肾功能良好,现报告如下。
1 资料与方法
1.1 临床资料
头孢曲松结石患儿5例,男4例,女1例,年龄13个月~13岁,平均78.2个月。患儿发病前均经CTX治疗的疾病为肺炎、淋巴结炎、脊髓神经根切断术后和包皮环切术后预防用药,用药时间3~7 d。5例患儿中1例患儿双肾结石合并单侧输尿管结石,3例双侧输尿管结石,1例单侧输尿管结石。
例1,男,13个月。主因“排尿困难2 d,腹痛、间断排石2个月余”于2015年8月入院。入院前2个月因肺炎,予以CTX抗感染治疗4 d后出现腹痛、间断排石,当地医院拟诊为肾结石,建议保守治疗。后患儿出现排尿困难,B超检查提示双肾结石,口服解痉药保守治疗。患儿服药后无明显缓解,行CT检查提示双肾结石(图1)。
例2,女,24个月。主因“间断腹痛1周”于2016年3月入院。入院前1个月前因肺炎,予以CTX抗感染治疗5 d。1周前无明显诱因出现腰痛,哭闹,进食差,无尿频、尿急、尿痛,无肉眼血尿,行B超发现左肾积水,左输尿管结石。行泌尿系CT提示左输尿管上段类圆形高密度影,直径约0.3 cm,上段输尿管及肾盂扩张。右输尿管近膀胱处点状高密度影。左肾及左输尿管上段周围脂肪间隙模糊(图2)。
例3,男,4岁。主因“突发无尿1 d”于2016年1月入院。入院前4 d行脊髓神经根切断术,术后予CTX抗感染4 d出现无尿。24 h尿量5 ml,伴发热39℃,查血清肌酐200 μmol/L。
例4,男,13岁。主因“腹痛、呕吐4 d,发现肌酐升高1 d”于2016年1月入院。入院前4 d因包皮环切术予以CTX抗感染治疗3 d出现腹痛,伴呕吐。行B超发现双肾积水,双输尿管上段扩张。查血清肌酐662.7 μmol/L,急诊收入当地医院治疗,当地医院建议转我院治疗。
例5,男,13岁。主因“间断腹痛1个月”于2016年4月就诊。就诊前1个月因急性淋巴结炎予以CTX抗感染治疗6 d后出现间断腹痛。行B超发现双肾集合系统多发星点状强回声,右肾积水,右输尿管上段扩张,胆囊多发结石。
1.2 内镜下治疗方式
患儿于全麻下行输尿管镜镜检,镜下观察膀胱内是否有絮状沉积物或结石,0.35''/150 cm输尿管导丝(HiWireTMCOOK)经输尿管镜直视下置入输尿管,遇阻力时上下反复活动导丝,直至导丝顺利置入肾脏,沿导丝置入12~16 cm F4.7(Universa©Soft COOK)输尿管支架管,2~4周后行B超、KUB平片检查,确认结石排出、无肾积水后拔出输尿管支架管(图3)。
1.3 结石成分分析
头孢曲松结石多呈絮状或砂砾样结晶,较难收集。5例患儿中仅例1患儿收集到整体结石样本(图4),其他均为收集尿液中絮状物并经干燥后进行结石成分分析。分析仪器为结石红外光谱自动分析系统(蓝莫德科学仪器有限公司)。
2 结果
第1、2、3例患儿接受手术治疗,手术均为经输尿管镜下一期留置输尿管支架管,4周后复查第1、3例患儿未见结石残留,拔除输尿管支架管后恢复良好。第4、5例患儿门诊就诊进行泌尿系B超检查未见结石,未见肾积水及输尿管积水,行保守治疗。例2患儿既往皮肌炎病史,激素治疗6个月,留置输尿管支架管1个月后行B超检查,可见高回声光团,拟诊为输尿管结石,二期拔除支架管时行输尿管镜镜检,发现患侧输尿管有明显纤维狭窄环,可见纤维瘢痕包裹结石,清除结石同时取黏膜组织送病理学检查,结果提示:纤维组织中见钙盐沉积,未见被覆上皮。患儿结石样本经结石成分分析,证实为头孢曲松结石(图5)。

图1 例1患儿CT平扫、重建

图2 例2患儿腹部CT平扫
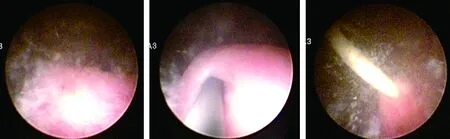
图3 内镜下膀胱内探查、输尿管导管引导下留置输尿管支架管
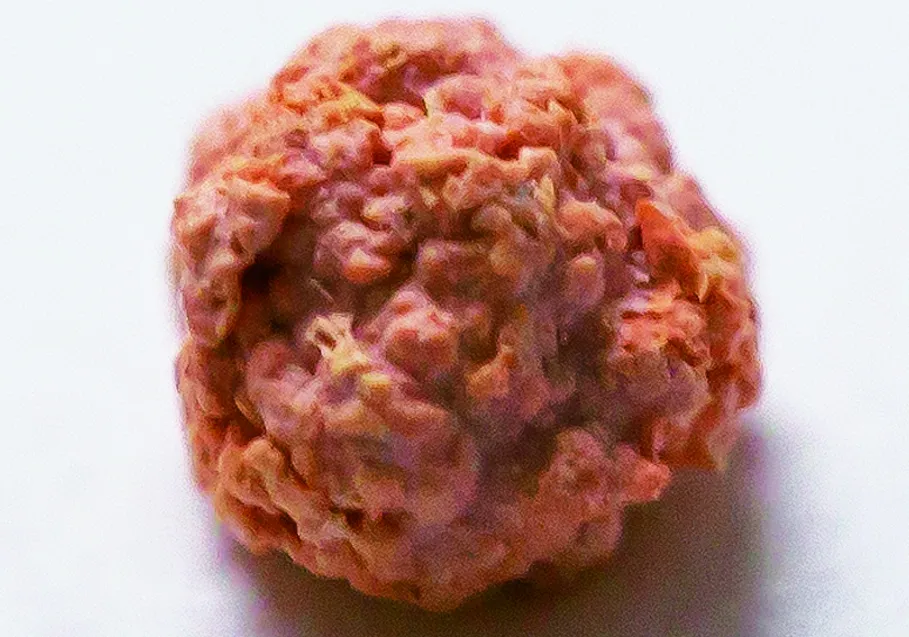
图4 头孢曲松结石样本

图5 头孢曲松结石样本红外光谱仪分析图谱
3 讨论
CTX是一种无菌半合成广谱头孢菌素抗生素,可经静脉滴注或肌肉注射。静脉滴注85%~95% CTX和血清白蛋白结合进入组织。CTX在人体内不被代谢,约55%的药物以原形自尿中排出,45%自胆道分泌[2]。胆汁内CTX的浓度是血液内浓度的20~150倍。当胆囊内的浓度超过了阈值,可通过与钙离子结合沉淀[3]。在生理条件下血液经肾小球滤过,产生的尿液中尿钙超过95%经肾小管重吸收,约70%的钙在近端小管吸收,Henle袢吸收20%~30%,5%~10%在远端小管重吸收,剩余的钙(5%)出现在肾集合管中[4]。既往有研究的结果表明治疗量的CTX在尿液中排泄就可以直接与生理浓度尿中的游离钙结合生成CTX/Ca晶体[5]。CTX的原型经由肾脏滤出,和尿液中游离钙按1∶1摩尔比结合成不溶性的钙盐。尿量较少、高剂量CTX、高尿钙都是引起头孢曲松结石的高危因素。CTX所致尿沉淀可能是无症状的,通常经B超检查可发现,但某些患者可能出现血尿或肾绞痛[6~13]。但Murata等[14]研究发现禁食和卧床休息是形成头孢曲松结石的高危因素,并且禁食周期和卧床时间都是独立的风险因素。从药物代谢动力学角度考虑,既往观点认为药物剂量是形成头孢曲松结石的重要因素,Murata等[14]的研究中发现不同药物剂量对结石形成并无差异。Stojanovic等[15]曾经报道过儿童因UPJO引起肾结石的病例。
回顾既往的研究,结合本研究中诊治的患儿具体情况,我们认为摄入量减少、尿量降低、高尿钙、卧床休息、UPJO是引起头孢曲松结石的高危因素。在我们的研究中,例1患儿因肺炎抗感染治疗,发病时合并高热,患儿饮水量明显减少,抗感染治疗未进行补液,摄入量减少和尿量降低的因素有利于头孢曲松结石形成。例2患儿因重度皮肌炎长期卧床,口服激素治疗,日饮水量明显少于同龄儿童。术中输尿管镜探查患儿输尿管,发现肾盂输尿管连接部有一明显纤维瘢痕狭窄环,并且在狭窄环黏膜内可见多发散在结石嵌顿。该患儿有卧床、摄入量少、输尿管连接部狭窄、口服激素引起尿钙增高,共4个高危因素。例3患儿行包皮环切手术,术后预防用药使用CTX。患儿术后出现手术切口局部阴茎红肿,排尿时出现一过性疼痛。为避免出现排尿疼痛,患儿自行减少水量摄入,且多次憋尿。该患儿存在水摄入量不足、尿量降低的高危因素。例4患儿因急性淋巴结炎抗感染治疗,发病时中患儿高热,水摄入不足,尿量减少均为头孢曲松结石形成高危因素,且患儿就诊时发现胆囊结石合并右输尿管结石。例5患儿因行脊髓神经根切断术,术后长时间卧床时间,围手术期禁食、禁水等因素亦为头孢曲松结石高危因素。
5例患儿中有3例患儿行一期输尿管支架管置入。置入过程中先经输尿管口置入引导导丝,导丝在肾-输尿管内上下反复活动,可将大量絮状头孢曲松结晶引导排出至膀胱。根据患儿年龄置入12~16 cm F4.7输尿管支架管,保留2~4周后拔除输尿管支架管。术后复查B超,均未见肾-输尿管结石残留。
依据我们积累的经验,出现肾积水、血尿、急性尿闭患儿需详细询问近期用药病史,如可疑头孢曲松结石梗阻,应急诊行膀胱镜检,应用泥鳅导丝反复活动促进药物性结石、结晶排出,镜下留置梗阻侧输尿管支架管,观察2~4周,观察期嘱患儿多饮水,B超检查梗阻结石位置,待结石排净后拔除输尿管支架管。婴幼儿及儿童输尿管排石能力强,在保证支架管引流通畅的情况下,头孢曲松结石均可排净。
[1] Katzung BG, Masters SB, Trevor AJ. Basic & clinical pharmacology. New York: McGraw-Hill Medical, 2011:781-784.
[2] Brogden RN, Heel RC, Speight TM, et al. Cefuroxime: a review of its antibacterial activity, pharmacological properties and therapeutic use. Drugs, 1979,17(4):233-266.
[3] Park HZ, Lee SP, Schy AL. Ceftriaxone-associated gallbladder sludge. Identification of calcium-ceftriaxone salt as a major component of gallbladder precipitate. Gastroenterology, 1991,100(6):1665-1670.
[4] Portale AA, Perwad F. "Calcium And Phosphorus," Avner ED, Pediatric Nephrology (2004) 5th edition. Lippincott Williams & Wilkins: Philadelphia, PA. 2004:209.
[5] Chutipongtanate S, Thongboonkerd V. Ceftriaxone crystallization and its potential role in kidney stone formation. Biochem Biophys Res Commun, 2011,406(3): 396-402.
[6] Biner B, Öner N, Çeltik C, et al. Ceftriaxone-associated biliary pseudolithiasis in children. J Clin Ultrasound, 2006,34(5):217-222.
[7] Prince JS, Senac MO. Ceftriaxone-associated nephrolithiasis and biliary pseudolithiasis in a child. Pediatr Radiol, 2003,33(9):648-651.
[8] De Moor RA, Egberts ACG, Schröder CH. Ceftriaxone-associated nephrolithiasis and biliary pseudolithiasis. Eur J Pediatr, 1999,158(12):975-977.
[9] Acun C, Erdem LO, Söüt A, et al. Gallbladder and urinary tract precipitations associated with ceftriaxone therapy in children: a prospective study. Ann Trop Paediatr, 2004,24(1):25-31.
[10] Avci Z, Koktener A, Uras N, et al. Nephrolithiasis associated with ceftriaxone therapy: a prospective study in 51 children. Arch Dis Child, 2004,89(11):1069-1072.
[11] Cochat P, Cochat N, Jouvenet M, et al. Ceftriaxone-associated nephrolithiasis. Nephrol Dial Transplant, 1990,5(11):974-976.
[12] Mohkam M, Karimi A, Gharib A, et al. Ceftriaxone associated nephrolithiasis: a prospective study in 284 children. Pediatr Nephrol, 2007,22(5):690-694.
[13] Tasic V, Sofijanova A, Avramoski V. Nephrolithiasis in a child with acute pyelonephritis: Answer. Pediatr Nephrol, 2005,20(10):1510-1511,1512-1513.
[14] Murata S, Aomatsu T, Yoden A, et al. Fasting and bed rest, even for a relatively short period, are risk factors for ceftriaxone-associated pseudolitiasis. Pediatr Int, 2015,57(5):942-946.
[15] Stojanovic V, Djuric Vijatov G. Nephrolithiasis caused by ceftriaxone in a 3-year-old child with ureteropelvic junction obstruction. Case Rep Med, 2009,2009:365962.
Surgicaltreatmentofinfantsandchildrenwithceftriaxone-inducedurolithiasis
DuYuan1LiJun1XiaoJing1WangWenying1TianYe1
(1Department of Urology, Beijing Friendship Hospital, Capital Medical University, Beijing 100050, China)
Li Jun, lljun@yeah.net
Objective: To investigate the treatment of ceftriaxone-induced urolithiasis in infants and children.MethodsA retrospective analysis was performed on 5 children diagnosed with ceftriaxone-induced urolithiasis from August 2015 to April 2016 in our hospital. The clinical features, imaging characteristics and surgical treatments of ceftriaxone-induced urolithiasis were discussed.ResultsThere were 4 cases or renal colic or bellyache, 4 case of anuria and 1 case of acute renal failure. All cases were diagnosed as having urolithiaiss and/or hydronephhrosis by ultrasonography, and CT. All cases were cured by operation or conservative treatment. Urinary calculi composition was analyzed by Fourier transform infrared spectroscopy (FTIR; LIIR type, Lambda, China). The renal function in all cases was normal and there were no recurrent calculi after short-term follow-up.ConclusionsCeftriaxone is wided used in infants and children. However, ceftriaxone-induced crystals are composed of calcium and ceftriaxone. Therefore, in children given ceftriaxone, it is necessary to increase fluid intake, and carry out ultrasonography monitoring. Once acute obstruction occurs due to ceftriaxone-induced calculis, indwelling ureteral stent is placed quickly to relieve the obstruction and promote the removal of the calculi.
infant; children; ceftriaxone-induced urolithiasis
李钧,lljun@yeah.net
2017-07-14
R691.4
A
10.19558/j.cnki.10-1020/r.2017.06.008
首都医科大学基础-临床科研合作课题(14JL30);首都临床特色应用研究与成果推广(Z121100004015106)
——导丝概述及导丝通过病变技巧