pH、温度和盐度对单环刺螠消化酶和溶菌酶活力的影响
许星鸿,朱晓莹,阙义进,徐国成,徐加涛,霍 伟,甘宏涛,冯喜悦
( 淮海工学院 海洋生命与水产学院,江苏 连云港 222005 )
pH、温度和盐度对单环刺螠消化酶和溶菌酶活力的影响
许星鸿,朱晓莹,阙义进,徐国成,徐加涛,霍 伟,甘宏涛,冯喜悦
( 淮海工学院 海洋生命与水产学院,江苏 连云港 222005 )
采用L25(56)正交试验法测定了不同pH(6、7、8、9、10)、温度(10、15、20、25、30 ℃)和盐度(15、20、25、30、35)对体质量为(71.2±8.5) g的单环刺螠肠蛋白酶、淀粉酶、纤维素酶和脂肪酶活力的影响,以及不同盐度对单环刺螠血液溶菌酶活力的影响。试验结果表明,单环刺螠肠消化酶活力的最适环境条件分别为,蛋白酶:pH 8、温度30 ℃、盐度35;淀粉酶:pH 9、温度25 ℃、盐度25;纤维素酶:pH 6、温度30 ℃、盐度35;脂肪酶:pH 6、温度25 ℃、盐度30。盐度15和20两组单环刺螠血液溶菌酶活力均先降后升再降,而盐度30和35两组则先升后降。至处理第4 d,各试验组溶菌酶活力依次为:盐度30>25>35>20>15,盐度15和20两组溶菌酶活力显著低于盐度较高试验组(P<0.05)。盐度25~35、pH 6~9为单环刺螠适宜的环境条件,高温(25~30 ℃)下其消化酶活力较高,而低盐度(15~20)下其消化酶活力和免疫能力明显降低。
pH;温度;盐度;单环刺螠;消化酶;溶菌酶
单环刺螠(Urechisunicinctus)肉味鲜美、营养丰富[1],为我国、韩国和日本沿海地区名贵的海鲜食品。目前关于单环刺螠的研究多集中于其对硫化物的解毒代谢[2]以及纤溶酶的提取和溶栓作用[3],而环境因子对其消化生理及免疫功能的影响仅有少量的报道。邱旭春等[4]运用冰冻切片和酶组织化学方法研究了久效磷对单环刺螠体壁和肠道的乙酰胆碱酯酶、细胞色素C氧化酶、碱性磷酸酶活性的影响;李金龙等[5]探讨了铜离子对单环刺螠抗氧化酶活性的影响。笔者采用正交试验法研究了不同盐度、pH及温度对单环刺螠肠消化酶活力的影响,测定了不同盐度下单环刺螠溶菌酶活力的变化规律,以探讨单环刺螠肠消化酶活力最高时3个环境因子的最佳组合,为人工养殖水环境调控提供参考。
1 材料与方法
1.1 材料
单环刺螠体长为(17.8±1.5) cm,体质量(71.2±8.5) g,2015年4月购自连云港市海州湾,用循环养殖系统暂养7 d。暂养期间,盐度25,pH 8,水温15 ℃,自然光照,连续充气,日投喂2次藻液[小球藻(Chlorellasp.)∶中肋骨条藻(Skeletonemacostatum)为1∶1;藻液密度104个/mL;投喂量10 mL/L]。选择体表无损伤、活力强的单环刺螠用于试验。
1.2 方法
1.2.1 主要环境因子对单环刺螠消化酶活力影响的正交试验设计
由文献[6-7]可知,单环刺螠对pH、水温和盐度的耐受范围分别为4~10.5、-2~31 ℃、13.8~36。本试验采用L25(56)的正交表进行设置:A因子pH取6、7、8、9和10共5个梯度;B因子温度取10、15、20、25 ℃和30 ℃等5个梯度;C因子盐度取15、20、25、30和35共5个梯度。
将单环刺螠饥饿24 h后,随机取3条置于冰盘内解剖,分离出肠道,用预冷超纯水冲掉内容物,滤纸吸干水分后称量质量,加入9倍体积(m/V)4 ℃超纯水,冰浴下匀浆10 min,取部分匀浆液直接测定脂肪酶活力,其余匀浆液4 ℃,10 000 r/min离心15 min,取上清液-80 ℃保存,用以测定消化酶活力。
采用福林—酚法测定蛋白酶活力[8];淀粉酶和纤维素酶活力分别参照文献[9]中的淀粉—碘显色法和3,5-二硝基水杨酸显色法测定;脂肪酶活力采用NaOH滴定法[10]测定。根据正交试验表中各组试验条件,采用缓冲液和氯化钠调节反应介质的pH和盐度,采用生化培养箱或恒温水浴锅控制试验反应温度。蛋白定量测试盒购自南京建成生物工程研究所。消化酶活力以比活力表示,即每毫克可溶性蛋白质所含酶活力单位数。
1.2.2 盐度对单环刺螠溶菌酶活力的影响
本试验设5个盐度梯度组:15、20、25、30和35,用曝气自来水和海水晶将过滤后的天然海水调节至所需盐度,pH为8。每组设3个平行,每个平行随机取20条单环刺螠,于70 cm×50 cm×40 cm水族缸中饲养4 d。水温、投饵、充气等养殖条件与暂养相同。每日定时换水2次,每次换水50%。于试验0、0.25、0.5、1、2、3、4 d,每个平行取3条单环刺螠,用双蒸水冲洗单环刺螠体表,滤纸吸干水分,剪开体壁,用移液枪吸取血液,4 ℃,12 000 r/min离心5 min,取上清液即为血清,-80 ℃保存备用。溶菌酶活力采用Hultmark法[11]进行测定。
血清溶菌酶活力/U·mL-1=(A反应终-A反应初)/(A反应终×反应液体积)×稀释倍数
1.3 数据分析
试验数据用“平均值±标准差”表示。采用SPSS 16.0软件进行单因子方差分析,LSD多重比较和Duncan检验。显著水平设为0.05。
正交数据处理方法:
各因素同一水平之和(T值)的计算:A因子所对应的T1值是正交表第1列数字“1”所对应的试验结果之和,T2值是正交表第1列数字“2”所对应的试验结果之和,以此类推,可计算出其他T值。各因素同一水平的平均值(X值)的计算:A因子所对应的X1值为T1值/正交表第1列数字“1”的重复次数,X2值为T2值/正交表第1列数字“2”的重复次数,以此类推,可计算出其他X值。极差(R值)能表明因素的主次顺序,即R值越大,该因子的水平变化对结果的影响越大,该因子就越重要。A因子所对应的R值为A因子所对应的X1、X2、X3、X4和X5中最大值减去最小值,同理可得出B、C因子的R值。
2 结 果
2.1 环境因子对单环刺螠消化酶活力的影响
正交试验结果见表1。正交试验数据分析见表2。
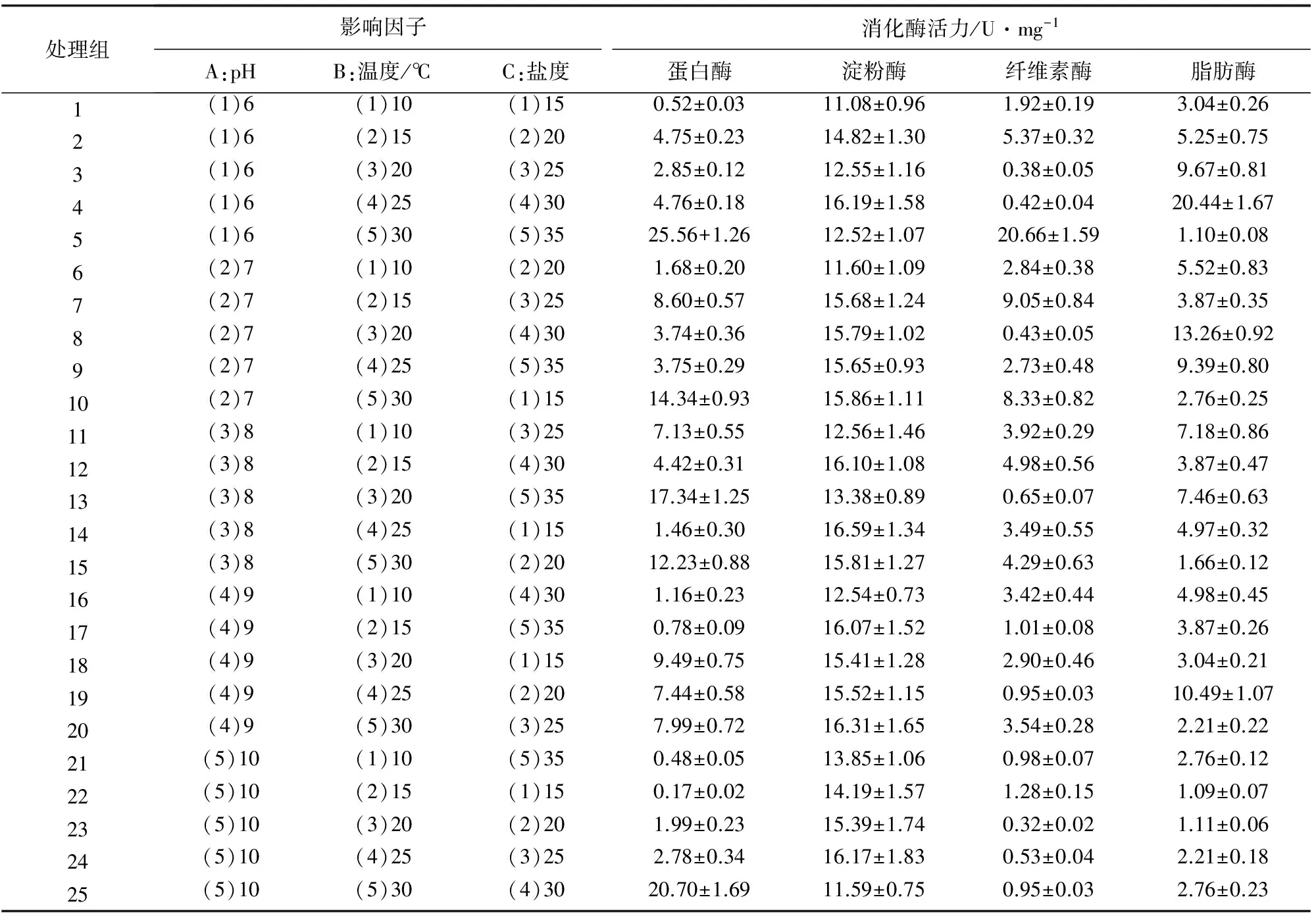
表1 单环刺螠消化酶活力正交试验结果
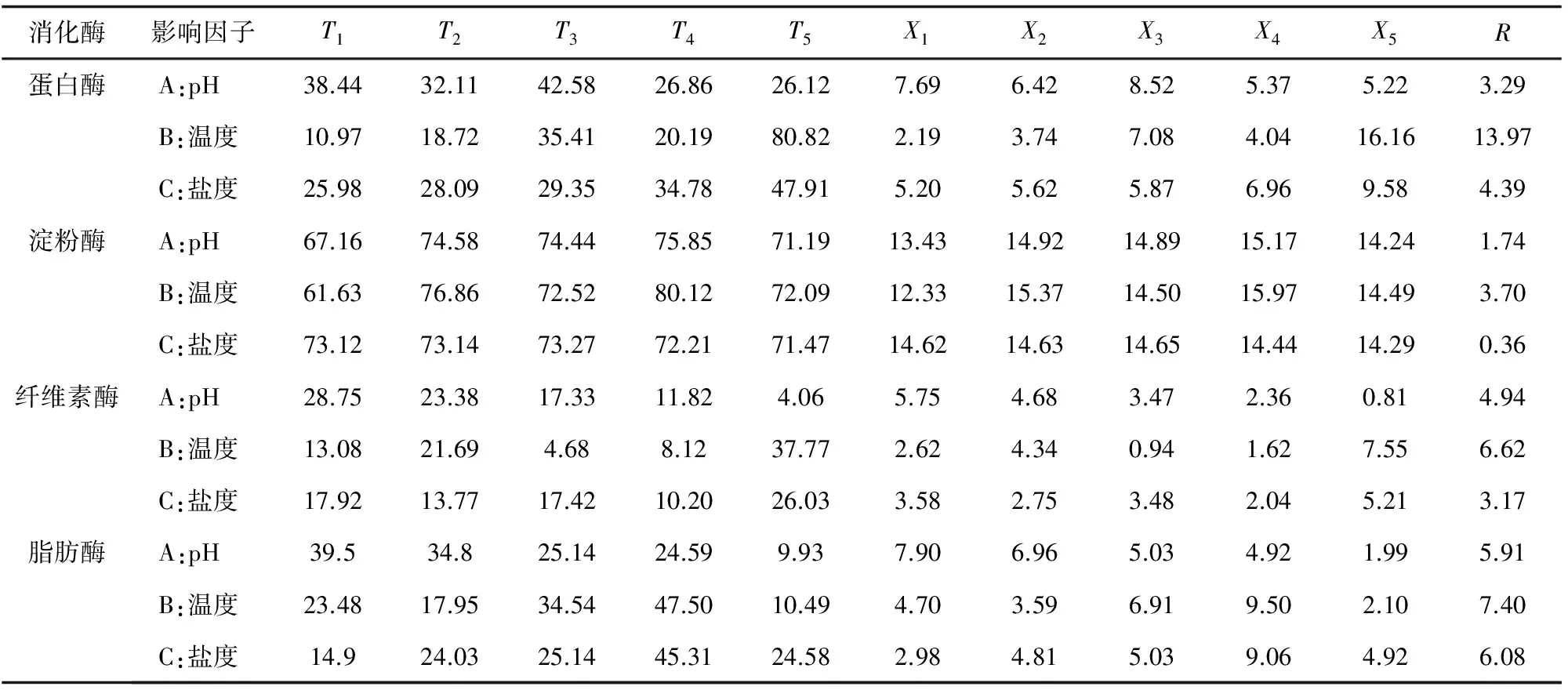
表2 单环刺螠消化酶活力正交试验分析
由表1可见,在本试验的25个组合中,蛋白酶和淀粉酶分别以处理组合A1B5C5(pH 6、温度30 ℃、盐度35)和处理组合A3B4C1(pH 8、温度25 ℃、盐度15)活力最高,与由T值所计算的结果不同。纤维素酶和脂肪酶分别以处理组合A1B5C5(pH 6、温度30 ℃、盐度35)和处理组合A1B4C4(pH 6、温度25 ℃、盐度30)活力最高(同表2)。
由表2各T值可知,单环刺螠消化酶活力的最适环境条件分别为:蛋白酶-A3B5C5,即pH 8、温度30 ℃、盐度35;淀粉酶-A4B4C3,即pH 9、温度25 ℃、盐度25;纤维素酶-A1B5C5,即pH 6、温度30 ℃、盐度35;脂肪酶-A1B4C4,即pH 6、温度25 ℃、盐度30。各消化酶的B因子—温度的R值均为最大,所以温度是影响单环刺螠消化酶活力的主要因子;蛋白酶和脂肪酶盐度的R值高于pH,表明盐度对蛋白酶和脂肪酶活力的影响大于pH;而对于淀粉酶和纤维素酶活力的影响程度则pH大于盐度。
正交试验的验证性试验:按照A3B5C5和A1B5C5两种组合进行蛋白酶活力的测定试验,A3B5C5组合的蛋白酶活力为(27.59±1.16) U/mg,A1B5C5组合的蛋白酶活力为(25.83±1.33) U/mg,两者差异显著(P<0.05),表明单环刺螠蛋白酶活力的最佳环境因子组合为pH 8、温度30 ℃、盐度35。按照A4B4C3和A3B4C1两种组合进行淀粉酶活力的测定试验,A4B4C3组合的淀粉酶活力为(18.61±1.34) U/mg,A3B4C1组合的蛋白酶活力为(16.46±1.29) U/mg,两者差异显著(P<0.05),表明单环刺螠淀粉酶活力的最佳环境因子组合为pH 9、温度25 ℃和盐度25。
2.2 盐度对单环刺螠血液溶菌酶活力的影响
试验期间盐度25组溶菌酶活力略有波动,其他试验组溶菌酶活力呈现两种变化规律:盐度15和20两组溶菌酶活力为先降后升再降,而盐度30和35两组则为先升后降(图1)。处理0.25 d时,盐度15和20组溶菌酶活力均低于盐度25组,以盐度15组下降幅度较大,而盐度30和35组溶菌酶活力均明显升高。处理0.5 d时,盐度15组降至最低值,随后有所回升,而盐度35组升至最高,随后下降。处理1 d盐度20组溶菌酶活力降至最低,第2 d回升后下降。盐度30组溶菌酶活力持续升高至处理1 d后下降。第4 d,各试验组溶菌酶活力大小为:盐度30>25>35>20>15,盐度15和20组溶菌酶活力显著低于盐度较高组(P<0.05)。

图1 不同盐度对单环刺螠溶菌酶活力的影响图中上标不同小写字母表示同一测试时间不同盐度组间差异显著(P<0.05).
3 讨 论
3.1 环境因子对单环刺螠消化酶活力的影响
本研究的正交试验结果表明,温度对单环刺螠消化酶活力的影响程度大于盐度和pH,因为单环刺螠属变温动物,机体内生理生化反应直接受栖息环境温度的影响。酶催化反应速度随着温度的升高而加快,使单位时间内酶活力升高;但当温度超过某一临界值时,消化酶会变性和失活,酶活力降低[12]。薛素燕等[13]发现,中华原钩虾(Eogammaruspossjeticus)蛋白酶和淀粉酶活力在15~20 ℃,随温度升高而增加,在20~25 ℃处于较高水平。沈文英等[14]测得凡纳滨对虾(Litopenaeusvannmei)肠道的蛋白酶、淀粉酶和脂肪酶的最适温度分别为35 ℃、55~65 ℃和37 ℃。范德朋等[15]报道,缢蛏(Sinonovaculaconstricta)蛋白酶和淀粉酶的最适温度分别为55 ℃和65 ℃。可见不同物种栖息于不同的生态位置,生活环境和食性的差异导致其消化酶性质亦差别较大。本研究结果表明,单环刺螠主要消化酶的最适温度为25~30 ℃,高于其栖息水温,所以在养殖生产中应适当升高水温,提高其消化能力。
pH可影响底物与消化酶的结合,改变酶的活性。而当pH超过一定范围时则会改变酶的构象,导致消化酶变性失活[16]。据报道,甲壳类蛋白酶的最适pH为7~8[17],仿刺参(Apostichopusjaponicus)中肠蛋白酶在pH 7~8.6时活力较高[12],与本试验中测得的单环刺螠蛋白酶最适pH 8较为接近。张凌飞等[18]发现,华贵栉孔扇贝(Chlamysnobilis)淀粉酶和纤维素酶的最适pH均为5;中国龙虾(Panulirusstimpsoni)肠淀粉酶和纤维素酶最适pH分别为7和4.2[16]。本研究结果显示,单环刺螠纤维素酶最适pH为6,表明酸性条件下纤维素酶活力较高,与以往报道相一致,而淀粉酶活力最适pH为9,与其他动物差异较大,可能与种的特异性有关。不同物种的食性及生态习性不同,其消化酶活性有所差异。单环刺螠脂肪酶的最适pH为6,与仿刺参前肠脂肪酶活力出现峰值的pH[12]相近,而与凡纳滨对虾脂肪酶最适pH[14]有一定差异。
盐度变化会导致水体无机离子含量的变化,进而影响到消化酶活力[19-20]。随着盐度24降至16,仿刺参消化酶活力逐渐降低[21];许星鸿等[22]亦发现,当盐度降至15,日本蟳(Charybdisjaponica)消化酶活力显著下降;当盐度降低时,日本囊对虾(Marsupenaeusjaponicus)耗氧率明显升高[23]。本试验中,单环刺螠4种消化酶活力最适盐度均≥25,在养殖生产中要注意水体的盐度不能过低。
3.2 盐度对单环刺螠免疫功能的影响
盐度变化时,水生动物要调节机体内外渗透压平衡而影响到免疫、呼吸等多种生理功能[24]。将凡纳滨对虾由初始盐度25转移至低盐度(5和15)中,免疫反应降低,处理12 h时其酚氧化酶活力、血细胞吞噬活力等均显著下降[25]。在低盐度(≤10)或高盐度(≥27.3)胁迫下,长蛸(Octopusvariabilis)的超氧化物歧化酶、过氧化氢酶等保护酶活力均呈下降趋势[26]。本试验中,单环刺螠由盐度为25的暂养水体转移至不同盐度后,溶菌酶活力变化明显。试验期间溶菌酶活力出现峰值后下降,表明盐度变化刺激能引起机体的应激反应,提高一定的免疫力,但长时间的盐度胁迫则导致免疫抗病能力下降。本研究结果显示,低盐度(15~20)试验组单环刺螠溶菌酶活力下降较为显著,表明低渗环境对单环刺螠免疫机能的影响大于高渗环境。低盐度胁迫使机体细胞吸水膨胀,影响溶酶体等与免疫相关的细胞器功能,保护酶活力降低,机体免疫力减弱[26]。养殖池塘盐度可能受台风暴雨、持续降雨等气候因素的影响而大幅下降,对养殖对象造成低盐度胁迫,这在养殖生产中要尤为关注。
综合所述,盐度25~35、pH 6~9为单环刺螠较适宜的环境条件,温度较高(25~30 ℃),消化酶活力也较高,低盐度(15~20)会明显降低其消化酶活力和免疫能力。在单环刺螠养殖中,首先要保障水体适宜的盐度,并通过适当升温来促进其生长。
[1] 杨桂文,安利国,孙忠军.单环刺螠营养成分分析[J].海洋科学,1999,23(6):13-14.
[2] Ma Y B,Zhang Z F,Shao M Y,et al. Sulfide:quinone oxidoreductase from echiuran wormUrechisunicinctus[J]. Marine Biotechnology,2011,13(1):93-107.
[3] 刘万顺,成慧中,韩宝芹,等.单环刺螠纤溶酶UFEI药效作用和免疫原性的初步研究[J].中国海洋大学学报:自然科学版,2012,42(1/2):88-92.
[4] 邱旭春,朱丽岩,刘光兴,等.久效磷对单环刺螠体内几种酶活性影响的初步研究[J].海洋科学,2006,30(9):42-48.
[5] 李金龙,秦贞奎,史晓丽,等.铜离子对单环刺螠虫的毒性及对体壁抗氧化酶活性的影响[J]. 海洋湖沼通报,2012(2):77-83.
[6] 李诺,宋淑莲,唐永政.单环刺螠[J].生物学通报,1998,38(8):12-14.
[7] 郑岩,白海娟,王亚平.单环刺螠对水温、盐度和pH的耐受性的研究[J].水产科学,2006,25(10):513-518.
[8] 李建武,萧能赓,余瑞元,等.生物化学实验原理和方法[M].北京:北京大学出版社,1994:168-171.
[9] 王福荣.生物工程分析与检验[M].北京:中国轻工业出版社,2005:200-212.
[10] 江慧芳,王雅琴,刘春国.三种脂肪酶活力测定方法的比较及改进[J]. 化学与生物工程,2007,24(8):72-75.
[11] Hultmark D,Steiner H,Rasmuson T,et al. Insect immunity:purification and properties of three inducible bactericidal proteins from hemolymph of immunized pupae ofHyalopheracecropia[J]. European Journal of Biochemistry,1980,106(1):7-16.
[12] 姜令绪,杨宁,李建,等.温度和pH对刺参(Apostichopusjaponicus)消化酶活力的影响 [J]. 海洋与湖沼,2007,38(8):72-75.
[13] 薛素燕,毛玉泽,赵法箴,等.温度对中华原钩虾(Eogammaruspossjeticus)摄食率和消化酶活力的影响[J].渔业科学进展,2015,36(4):94-99.
[14] 沈文英,胡洪国,潘雅娟.温度和pH对南美白对虾(Penaeusvannamei)消化酶活性的影响[J].海洋与湖沼,2004,35(6):543-548.
[15] 范德朋,潘鲁青,肖国强,等.温度、pH对缢蛏消化酶活力的影响[J].海洋湖沼通报,2003(4):69-73.
[16] 姜永华,颜素芬.pH值对中国龙虾消化酶活力的影响[J].动物学报,2008,54(2):317-322.
[17] Pavasovic M,Richardson N A,Anderson A J,et al. Effect of pH,temperature and digestive enzyme profiles in the mud crab,Scyllaserrata[J]. Aquaculture,2004,242(1/4):641-654.
[18] 张凌飞,李俊辉.温度与pH对华贵栉孔扇贝淀粉酶和纤维素酶活力的影响[J].水产养殖,2008(5):4-6.
[19] Squires E J,Haard N F, Feltham L A. Gastric proteases of the Greenland codGadusogac. Ⅱ. Structural properties[J]. Biochemical Cell Biology,1986,64(3):215-212.
[20] 田相利,任晓伟,董双林,等.温度和盐度对半滑舌鳎幼鱼消化酶活性的影响[J].中国海洋大学学报,2008,38(6):895-901.
[21] 赵斌,胡炜,李成林,等.低盐环境对3种规格刺参(Apostichopusjaponicus)幼参生长与消化酶活力的影响[J].渔业科学进展,2015,36(1):91-96.
[22] 许星鸿,阎斌伦,徐加涛,等.盐度对日本蟳免疫生理指标及消化酶活力的影响[J].水产科学,2013,32(7):373-379.
[23] Dalla V G J. Salinity response of the juvenile penaeid shrimpPenaeusjaponicasI. Oxygen-consumption and estimation of productivity[J]. Aquaculture,1986,55(4):297-306.
[24] Li E C,Chen L Q,Zheng C. Growth, body composition, respiration and ambient ammonia nitrogen tolerance of the juvenile white shrimp,Litopenaeusvannamei, at different salinities [J]. Aquaculture,2007,265(1/4):358-390.
[25] Wang L U, Chen J C. The immune response of white shrimpLitopenaeusvannameiand its susceptibility toVibrioalgiolytieusat different salinity levels[J]. Fish and Shellfish Immunology, 2005,18(4):269-278.
[26] 张玉玉,王春琳,李来国,等.长蛸的盐度耐受性及盐度胁迫对其血细胞和体内酶活力的影响[J].台湾海峡,2010,29(4):452-458.
EffectsofpH,WaterTemperatureandSalinityonActivitiesofIntestinalDigestiveEnzymesandSerumLysozymeinEchiuranWormUrechisunicinctus
XU Xinghong,ZHU Xiaoying,QUE Yijin,XU Guocheng,XU Jiatao,HUO Wei,GAN Hongtao,Feng Xiyue
( College of Marine Life and Fisheries,Huaihai Institute of Technology,Lianyungang 222005,China )
The effects of pH of 6, 7, 8, 9, and 10, temperature of 10 ℃, 15 ℃, 20 ℃, 25 ℃, and 30 ℃, and salinity of 15, 20, 25, 30, and 35 on activities of intestinal digestive enzymes and effects of salinity of 15, 20, 25, 30, and 35 on activities of serum lysozyme activity in hemolymph were studied in echiuran wormUrechisunicinctusby an orthogonal experiment. The results showed that the maximal protease activity was observed under conditions of pH 8, 30 ℃ and salinity of 35; amylase under pH 9, 25 ℃, and salinity of 25; cellulase under pH 6, 30 ℃, and salinity of 35; and lipase under pH 6, 25 ℃, and salinity of 30. The lysozyme activity in the echiuran worm at salinity of 15 and 20 were shown to be first decreased, then increased, and dropped again, while the lysozyme activity in a salinity of 30 and 35 were shown to be increased first and then declined. The order of lysozyme activity at various salinities in 4 days was descendantly arranged as salinity 30>25>35>20>15, and the lysozyme activities were significantly lower in a salinity of 15 and 20 than that in other treatments with higher salinity. The findings indicated that echiuran worm had a suitable salinity of 25—35 and pH 6—9, and the higher digestive enzyme activity under temperature of 25—30 ℃.However, significantly lower activities of digestive enzymes and lysozyme were found at low salinity of 15—20.
pH;temperature;salinity;Urechisunicinctus;digestive enzyme;lysozyme
10.16378/j.cnki.1003-1111.2017.02.003
2016-04-14;
2016-06-15.
江苏省优势学科建设工程项目(KYCX19);连云港市科技局农业攻关项目(CN1411).
许星鸿(1970-),女,教授,博士;研究方向:海洋动物繁育生物学及增养殖技术.E-mail:xhxu119@163.com.
S968.9
A
1003-1111(2017)02-0138-05

