大白猪群中CTSL基因多态性与生长性状的关联分析
聂光伟,王恩森,李明杨,毛 翠,毛慧敏,王国水,左 波,徐在言*
(1.华中农业大学动科动医学院,湖北武汉 430070;2. 浙江天蓬集团有限公司,浙江江山324111)
大白猪群中CTSL基因多态性与生长性状的关联分析
聂光伟1,王恩森1,李明杨1,毛 翠2,毛慧敏2,王国水2,左 波1,徐在言1*
(1.华中农业大学动科动医学院,湖北武汉 430070;2. 浙江天蓬集团有限公司,浙江江山324111)
组织蛋白酶L(CTSL)基因属于组织蛋白酶(cathepsin)家族成员之一,该基因在调控肉质嫩度上发挥着重要作用,可以作为猪生长和胴体性状的候选基因。实验采用PCR-RFLP技术在大白猪群体中对CTSL基因第5外显子g.143 C>T单核苷酸多态性位点进行检测,分析该位点与生长及胴体性状的关联性。结果表明:在大白猪群体中共有3种基因型,分别是TT、TC和CC基因型,CC基因型个体达100 kg体重日龄天数显著小于TT基因型个体(P<0.05),但其他性状关联分析结果未达到显著水平。
猪;CTSL基因;多态性;关联分析;生长性状
组织蛋白酶(cathepsin)属于肽酶家族,主要存在于骨骼肌的溶酶体中,以肌动蛋白、肌球蛋白及其相关蛋白作为其反应基质[1]。不仅能水解肌纤维中的蛋白,而且还能使动物的结缔组织变松散,进而影响动物屠宰后肌肉嫩度[2]。组织蛋白酶主要分为天冬氨酸蛋白酶、半胱氨酸蛋白酶、金属蛋白酶和丝氨酸蛋白酶四大类[3]。同时,组织蛋白酶种类很多,从组织蛋白酶A到Z都已有报道。组织蛋白酶L(CTSL)属于溶酶体木瓜蛋白酶家族半胱氨酸蛋白酶成员,其空间结构主要由α螺旋构成的L结构域以及由β折叠构成的R结构域组成[4]。组织蛋白酶L参与促进激素的生成和降解过程,可能涉及到脂肪的生成与肌肉质量的增加[5]。Yamazaki等[6]在小鼠骨骼肌中研究发现,CTSL是FOXO1发挥作用的直接靶基因,阐明了FOXO1/CTSL通路在快速诱导骨骼肌代谢变化和肌萎缩过程中,所起的关键作用。
据报道,猪组织蛋白酶基因多态性与平均日增重、背膘厚、瘦肉量和肌内脂肪含量具有相关性。汪亮亮等[7]对猪CTSL基因启动子区筛查出7个SNPs位点,其中T-1129C、T-1137C、T-1463C 3个位点中TT基因型频率在本地猪种中要高于外国猪种,为优势基因型。Fontanesi等[8]在猪CTSL基因启动子区发现1个SNP位点(g.143 C>T),在意大利大白猪群体中关联分析结果得出,与平均日增重、背膘厚和瘦肉量具有显著相关性。Russo等[9]研究了部分蛋白酶基因单核苷酸多态性,发现与猪生长及胴体性状存在相关性。因此,对CTSL基因多态性的深入研究,为其作为猪重要经济性状候选基因标记,将具有重要意义。
1 材料与方法
1.1 实验猪群及性状测定 美系大白猪(586头),体重在85~135 kg,使用一次性采血器在前腔静脉处采集血液。基因组DNA采用血液基因组DNA中量提取试剂盒(离心柱型)提取,于-80℃超低温冰箱中保存。样本采集及数据收集于浙江开盛生态农业发展有限公司。性状记录包括达100 kg体重日龄、体长、初生重、活体背膘厚和眼肌面积。活体背膘厚和眼肌面积采用B超仪测定,测定部位在倒数第3、4肋骨间,距离背中线4~5 cm处。所有数据经GBS5.0育种软件校正之后,用于关联分析。

表1 基因引物序列
1.2 引物设计及PCR扩增 根据Fontanesi等[5]已发表的引物序列由上海生物工程技术服务有限公司合成引物。
PCR 反应体系为10 μL :2×Es Taq Master Mix(含染料)5.0 μL ;ddH2O 3.0 μL ;Sense primer(10 mmol/L)0.5 μL;Antisense primer(10 mmol/L) 0.5 μL;DNA 1.0 μL。PCR反应程序:95℃,5 min;35个循环(95℃,30 s;64℃,30 s;72℃,30 s);72℃,5 min;25℃,1 min。PCR产物于琼脂糖凝胶电泳检测,以5 μL的DNA Marker DL2000 作为参照。电泳结束后利用凝胶成像系统观察扩增结果。
1.3 酶切反应 本研究采用PCR-RFLP方法对多态性位点基因分型。反应结束后,进行酶切,其体系为 20 μL:PCR production 10.0 μL;10×FastDigest Green buffer 2.0 μL;FastDigestTaqI0.5 μL;ddH2O 7.5 μL。65℃消化1 h。然后利用3%的琼脂糖凝胶电泳检测,在凝胶成像系统下拍照并保存图片,统计基因型。
1.4 基因效应分析 采用SAS统计 软件中的一般线性模型(GLM)自编程序进行基因型和表型值之间的关联分析及显著性检验,同时采用reg程序计算基因加性效应和显性效应。分析模型为Tijkl=u+Gi+Fj+Sk+Pl+eijklm。式中,Tijkl为性状表型值;u为平均值;Gi为基因型效应(包括基因加性效应和显性效应;加性效应用-1,0和1分别代表纯合子TT、杂合子TC和纯合子CC基因型,显性效应用1和-1分别代表纯合子TT和CC基因型、杂合子TC基因型);Fj、Sk、Pl作为固定效应,分别代表家系、性别、批次,eijklm为残差效应。
2 结果与分析
2.1CTSL基因的PCR-TaqI-RFLP多态性检测 本研究用于检测CTSL基因多态性的扩增片段产物长度为380 bp(图1)。利用TaqI限制性内切酶酶切后产生218 bp和162 bp的片段,根据条带类型的不同共检测到3种基因型(图2),分别命名为TT基因型(380 bp)、TC基因型(380 bp+218 bp+162 bp)和CC基因型(218 bp+162 bp)。
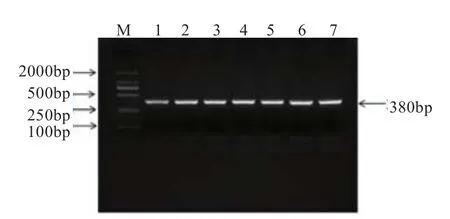
图1 CTSL基因PCR产物凝胶电泳结果
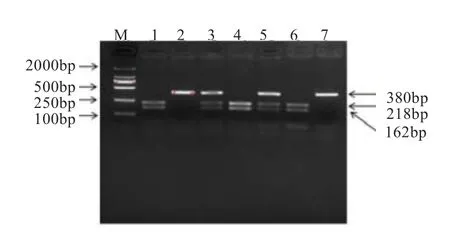
图2 CTSL基因PCR-TaqI-RFLP酶切分型结果
2.2CTSL基因在大白猪中的基因频率分布及与生长和胴体性状的关联分析
2.2.1CTSL基因在大白猪群体中的基因频率分布 采用PCR-TaqI-RFLP技术对大白猪CTSL基因第5外显子g.143 C>T单核苷酸多态性位点进行检测,在该群体中共检测到3种基因型。由表2可见,在美系大白猪群体中CTSL基因的CC基因型频率高于TT和TC基因型,且C等位基因为优势等位基因。经哈迪-温伯格平衡检验,CTSL基因在美系大白猪群体中处于遗传平衡状态(P>0.05)。
2.2.2CTSL基因多态性与美系大白猪生长及胴体性状的关联分析 由表3得出,CC基因型个体达100 kg体重日龄显著低于TT和TC基因型个体(P<0.05),且加性效应达到显著水平(P<0.05)。说明CC基因型猪生长性能要优于TT和TC基因型。另外,CC基因型猪活体背膘厚低于TT基因型,眼肌面积则大于TT基因型;而TT基因型猪体长和初生重则要高于TC和CC基因型,但是均未达到显著水平。

表2 大白猪CTSL基因TaqI-RFLP基因型频率和等位基因频率
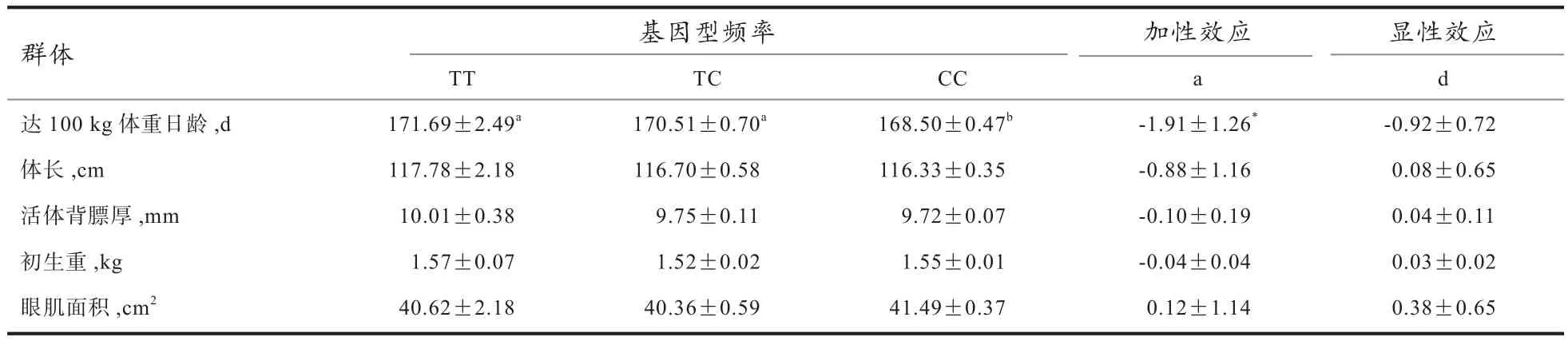
表3 CTSL基因多态性与大白猪生长、胴体性状的关联分析(平均值±标准误)
3 讨 论
本实验对CTSL基因的SNP(g.143 C>T)位点,及在美系大白猪群体中的基因型分布频率进行了检测。在该群体中TT、TC和CC基因型均有分布,其中C等位基因频率为0.82,是优势等位基因。关联分析结果显示,与达100 kg体重日龄显著相关,但与体长、活体背膘厚、初生重和眼肌面积各性状间没有达到显著水平,这与Fontanesi等[8]的研究结果不同。其原因可能是两者研究所用实验群体和环境效应不同以及分析模型、个体数量上的差异所致。
据在杜洛克猪种上的研究结果显示,CTSL基因多态性与背膘厚和日增重具有显著性趋势,对瘦肉量的影响达到显著性水平,且具有明显的加性效应[10]。Russo等[9]选择意大利大白猪、长白猪、杜洛克猪、皮特兰猪、比利时长白猪、汉普夏猪和梅山猪7个不同猪种,研究了CTSL基因的多态性及各基因型分布频率,结果发现只有杜洛克猪种存在3种基因型(TT、TC和CC)。所以实验群体的不同,也是影响关联分析结果的原因。由于CTSL基因标记的突变碱基虽然位于第5外显子,但并没有引起氨基酸的改变,因此不是功能性突变。此外,CTSL基因图谱位于猪10号染色体,是猪重要经济性状平均日增重和背膘厚的QTLs定位区域。本研究结果也证明,CTSL基因多态性与猪达100 kg体重日龄具有相关性。因此,对CTSL基因重测序寻找其他具有功能性的SNP位点,在更大群体中验证标记的效应,将会对该基因在猪遗传育种上的研究提供更多理论支撑。
4 结 论
本实验结果得出,CTSL基因第5外显子g.143 C>T单核苷酸多态性位点与美系大白猪达100 kg体重日龄具有显著性差异,但与初生重、活体背膘厚、眼肌面积和体长性状关联分析结果不显著。
[1]Etherington D J. The contribution of proteolytic enzymes to postmortem changes in muscle[J]. J Anim Sci, 1984,59(6):1644-1650.
[2]Virgili R, Schivazappa C, Parolari G,et al. Proteases in fresh pork muscle and their influence on bitter taste formation in dry-cured ham[J]. J Food Biochem, 1998,22(1):53-63.
[3]Chwieralski C E, Welte T, Bühling F. Cathepsin-regulated apoptosis[J]. Apoptosis, 2006, 11(2):143-149.
[4]杨东辉, 刘宇, 肖蓉,等. 组织蛋白酶L的结构与功能[J].中国生物化学与分子生物学报, 2012, (12):1093-1099.
[5]Funkelstein L, Toneff T, Mosier C,et al. Major role of cathepsin L for producing the peptide hormones ACTH,beta-endorphin, and alpha-MSH, illustrated by protease gene knockout and expression[J]. J Biol Chem, 2008,283(51):35652.
[6]Yamazaki Y, Kamei Y, Sugita S,et al. The cathepsin L gene is a direct target of FOXO1 in skeletal muscle[J]. Biochem J, 2010, 427(1):171.
[7]汪亮亮, 梅盈洁, 李加琪. 猪CTSL基因启动子区SNP检测及多态性分析[C]. 第十一次全国畜禽遗传标记研讨会, 青岛: 中国畜牧兽医学会畜禽遗传标记学分会,2008.
[8]Fontanesi L, Speroni C, Buttazzoni L,et al. Association between cathepsin L ( CTSL ) and cathepsin S ( CTSS )polymorphisms and meat production and carcass traits in Italian Large White pigs[J]. Meat Sci, 2010, 85(2):331.
[9]Russo V, Fontanesi L, Scotti E,et al. Single nucleotide polymorphisms in several porcine cathepsin genes are associated with growth, carcass, and production traits in Italian Large White pigs[J]. J Anim Sci, 2008,86(12):3300-3314.
[10]Fontanesi L, Speroni C, Buttazzoni L,et al. Association between polymorphisms in cathepsin and cystatin genes with meat production and carcass traits in Italian Duroc pigs: confirmation of the effects of a cathepsin L ( CTSL )gene marker[J]. Mol Biol Rep, 2012, 39(1):109.
Association Analysis of Polymorphism of CTSL with Growth Traits in Large White Pigs
NIE Guang-wei1, WANG En-sen1, LI Ming-yang1, MAO Cui2, MAO Hui-min2, WANG Guo-shui2, ZUO Bo1, XU Zai-yan1*
(1. College of Animal Science and Veterinary Medicine,Huazhong Agricultural University, Hubei Wuhan 430070, China;2. Zhejiang tianpeng group co, LTD, Zhejiang Jiangshan 324111, China)
CTSLgene, one member of cathepsin family, plays an important role in the regulation meat tenderness and can be used as candidate genes for growth and carcass traits of in pigs. In this study we used PCR-RFLP to detect the SNP g.143 C>T in 5th exon ofCTSLgene in Large White pigs, and analyzed the association of SNP with growth and carcass traits. The results showed that three genotypes (TT, TC and CC) existed in Large white group, and pigs with genotype CC had lower values of days at 100 kg than those with TT genotype (P<0.05), while no signi fi cant difference was observed for other traits.
Pig;CTSLgene; Polymorphism; Association analysis; Growth traits
S828.2
A
10.19556/j.0258-7033.2017-12-026
2017-06-01;
2017-08-03
国家科技支撑计划(2014BAD20B01);湖北省农业科技创新中心创新团队资助
聂光伟(1992-),男,河南商丘人,农业推广(养殖)硕士,主要从事动物遗传育种与繁殖方面的研究,E-mail:1101799071@qq.com
*通讯作者:徐在言(1976-),女,山东海阳人,副教授,硕士生导师,主要研究方向为猪分子生物学,E-mail:xuzaiyan@mail.hzau.edu.cn

