高脂诱导胰岛素抵抗大鼠对不同脂肪组织水通道蛋白7的影响
潘伟 沈飞霞 谷雪梅
高脂诱导胰岛素抵抗大鼠对不同脂肪组织水通道蛋白7的影响
潘伟 沈飞霞 谷雪梅
目的 研究胰岛素抵抗大鼠不同脂肪组织水通道蛋白7(AQP7)的表达水平,探讨AQP7与脂肪组织发生胰岛素抵抗的关系。方法 20只雄性SD大鼠随机分为对照组(CG)和高脂喂养诱导胰岛素抵抗模型组(IRG)。观察两组大鼠体重变化,检测TG、TC、HDL-C、LDL-C、甘油、空腹血糖(FBG)、空腹胰岛素(FINS)及脂肪因子的水平,同时比较皮下脂肪和附睾脂肪组织AQP7 mRNA、蛋白以及不同脂肪组织蛋白激酶B(PKB)及磷酸化蛋白的表达水平。结果 至12周末,IRG组较CG组血清LDL、FBG、FINS、IL-6、TNF-α 及胰岛素抵抗指数(HOMA-IR)明显升高(P<0.05或 0.01),而 HDL、脂联素水平下降(P<0.05)。对mRNA和蛋白检测发现,在IRG组中内脏脂肪组织AQP7表达水平高于皮下脂肪组织,并且较CG组升高。在IRG组中内脏脂肪组织PKB磷酸化蛋白表达水平较皮下脂肪表达下降,并且较CG组下降。结论 内脏脂肪组织AQP7的异常表达,可能与胰岛素抵抗的发生有关。
水通道蛋白7 脂肪组织 胰岛素抵抗
随着社会发展和人们生活方式的改变,肥胖症在世界范围内已形成流行趋势,可引起2型糖尿病、心血管疾病、肿瘤等一系列慢性非传染性疾病,给人类社会造成了巨大的经济、心理负担。随着人们对脂肪组织认识的不断加深,近年来关于肥胖的研究越来越集中于在体液代谢紊乱方面。肥胖,尤其是内脏脂肪的堆积,与胰岛素抵抗关系密切,最近研究发现,水通道蛋白7(AQP7)能够促进脂肪细胞内甘油向细胞外排泄,减少细胞内TG的合成,从而抑制脂肪细胞的肥大,而且不同脂肪组织AQP7表达不同[1]。因此,了解AQP7在脂肪组织的分布差异,以及与胰岛素抵抗的关系,可为肥胖症的防治提供了新的研究方向。笔者通过检测胰岛素抵抗大鼠不同脂肪组织AQP7的表达水平,探讨AQP7与脂肪组织发生胰岛素抵抗的关系。
1 材料和方法
1.1 材料
选择健康SD雄性大鼠20只,鼠龄4周,体重100~120g,由温州医科大学实验动物中心提供,自由摄食、饮水,室温(22±1)℃,湿度(50±5)%,12h昼夜交替,每日更换干净垫料。主要仪器和试剂:Western blot装置(美国Bio-Rad公司),StepOne PlusTMReal-time quantitative PCR仪(美国ABI公司),酶标仪(美国Thermo scientific公司),AQP7兔多克隆抗体(#32826,1∶500,美国Abcam公司),蛋白激酶B(PKB)兔多克隆抗体(#9272,1∶1 000,美国CST公司),磷酸化蛋白激酶B(p-PKB)(Ser473)小鼠多克隆抗体(#4051,1∶1 000,美国CST公司),蛋白定量试剂盒(江苏碧云天生物技术有效公司),甘油检测试剂盒(美国BioVision公司),ELISA试剂盒(南京建成生物工程研究所),PCR试剂(大连宝生物公司);引物由上海博蕴生物科技有效公司合成。
1.2 方法
1.2.1 分组及模型建立 20只SD大鼠适应性喂养1周后,随机分为高脂饮食诱导胰岛素抵抗组(IRG)和对照组(CG),每组10只。CG组喂养普通饲料,IRG组喂养高脂饲料(基础饲料80%,猪油18%,胆固醇2%),喂养12周后两组大鼠体重差异显著,检测胰岛素抵抗指数(HOMA-IR)评估胰岛素抵抗。HOMA-IR=空腹胰岛素(FINS,mmol/L)×空腹血糖(FBG,mIU/L)/22.5。
1.2.2 标本采集 分别于实验第0、2、4、6、8、12周给每组大鼠称重,至12周后禁食12h,次日采用2%戊巴比妥钠(0.3ml/100g)腹腔注射麻醉,打开大鼠腹腔,腹腔静脉采血8~10ml离心取血清,采用全自动生化分析仪检测 FBG、TG、TC、HDL-C、LDL-C 等指标;采用甘油检测试剂检测血清甘油水平;采用ELISA法检测血清瘦素、脂联素、抵抗素、TNF-α、IL-6;采用放射免疫法检测血清胰岛素水平;同时分离皮下及附睾脂肪组织(代表内脏脂肪组织),部分取新鲜组织检测,部分立即液氮冻存后备检,所有操作在冰浴上进行。
1.2.3 real-time PCR检测脂肪组织AQP7 mRNA的表达 将超低温冻结的大鼠脂肪组织称量后用液氮预冷的研钵研磨,用Trizol法抽提脂肪组织总RNA,经ND2000测定浓度后逆转录cDNA。Primer-Express 3.0软件设计引物。AQP7的上下游引物分别为:5′-TCGGTGTCAACTTGGGTTTTG-3′,5′-GAGATGCCGCCTGCTACAT-3′(64bp);β-actin 的上下游引物分别为:5′-CTTCTTTGCAGCTCCTTCG-3′,5′-TTCTGACCCATTCCCACC-3′(198bp)。反应条件:95℃预变性 30s,95℃变性 5s,60℃退火 30s,共进行 40 个循环。以 2-△△CT表示处理组相对于正常对照组的变化倍数,实验重复3次。
1.2.4 蛋白免疫印迹法检测脂肪组织AQP7、PKB、p-PKB的表达 分离脂肪组织,在蛋白裂解液中制成匀浆,离心后取上清液,BCA法测定蛋白浓度。行蛋白电泳、转膜、封闭后加一抗(AQP7兔多克隆抗体、PKB兔多克隆抗体、p-PKB小鼠多克隆抗体),4℃ 孵育过夜。TBST漂洗滤膜3次,加入HRP标记的二抗(辣根过氧化物酶标记山羊抗小鼠IgG、辣根过氧化物酶标记山羊抗兔IgG)振荡孵育1h。TBST洗膜,显色后曝光。采用Image J软件进行吸光度度分析,以 β-actin为内参,结果用目的蛋白与β-actin吸光度的比值表示其相对含量。
1.3 统计学处理
2 结果
2.1 两组大鼠体重变化的比较
分组前两组大鼠的体重相近,在高脂饮食喂养过程中,IRG组大鼠的体重逐渐高于CG组,在第6~12周时差异均有统计学意义(P<0.05或 0.01),详见表 1。

表1 两组大鼠体重变化的比较(g)
2.2 两组大鼠FBG、FINS及HOMA-IR的比较
第12周时,IRG组大鼠FBG、FINS较CG组明显升高,进一步计算HOMA-IR,结果显示IRG组HOMA-IR明显高于CG 组(P<0.01),详见表 2。
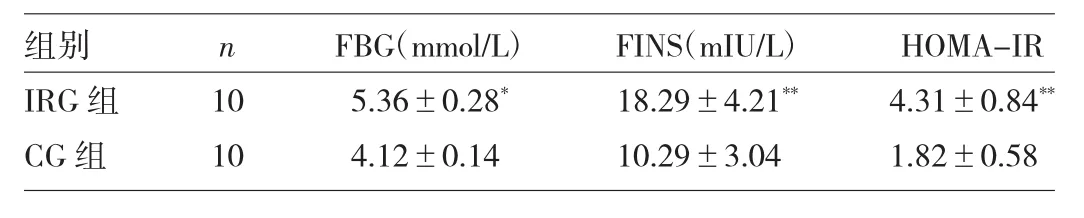
表2 两组大鼠FBG、FINS及HOMA-IR的比较
2.3 两组大鼠血脂及甘油水平的比较
IRG组HDL明显低于CG组(P<0.05),而LDL明显升高(P<0.05),两组TG、TC、甘油水平均无统计学差异(均P>0.05),详见表3。
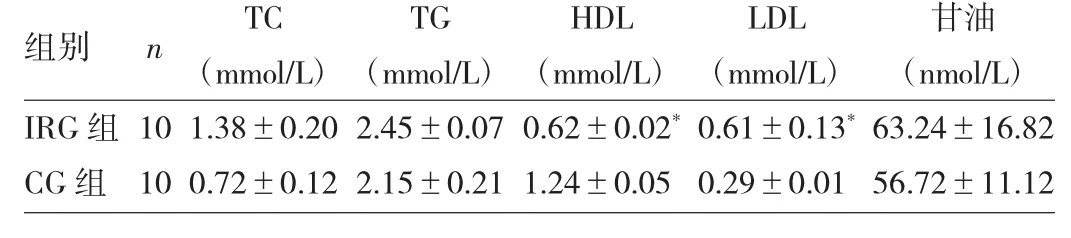
表3 两组大鼠血脂及甘油水平的比较
2.4 两组大鼠脂肪细胞因子的比较
IRG组脂联素水平低于CG 组(P<0.05),而 TNF-α 明显升高(P<0.05),IL-6差异更明显(P<0.01),两组瘦素、抵抗素均无统计学差异(均P>0.05),详见表4。
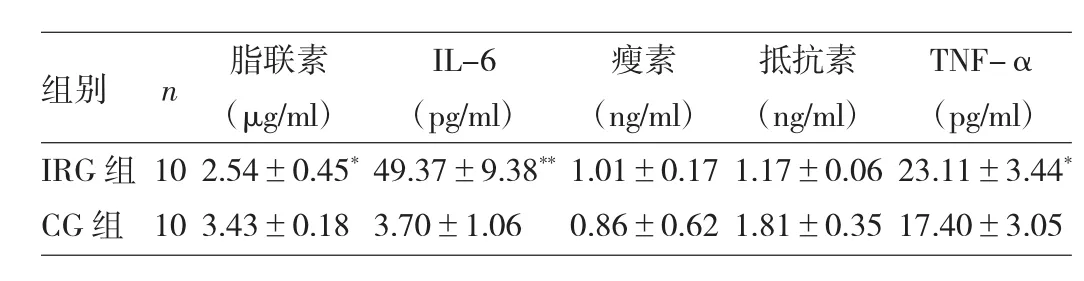
表4 两组大鼠脂肪细胞因子的比较
2.5 两组大鼠不同脂肪组织AQP7 mRNA和蛋白表达水平的比较 CG组大鼠内脏脂肪和皮下脂肪AQP7 mRNA表达无明显差异,IRG组内脏脂肪AQP7 mRNA表达高于皮下脂肪组织(P<0.05);相比CG组,IRG组内脏脂肪组织AQP7 mRNA表达显著增加(P<0.01),在蛋白水平其表达趋势一致,详见图1。
2.6 两组大鼠不同脂肪组织PKB、p-PKB水平的比较 CG组内脏脂肪和皮下脂肪p-PKB水平无明显差异,IRG组内脏脂肪p-PKB表达较皮下脂肪组织减少(P<0.05);相比CG组,IRG组内脏脂肪组织p-PKB表达明显下降(P<0.05),详见图 2。
3 讨论
现代生活方式的改变、高脂饮食的流行导致机体摄入过多的能量,最终会引起与肥胖相关的一系列以胰岛

图1 两组大鼠不同脂肪组织AQP7 mRNA和蛋白水平的比较(a:不同脂肪组织AQP7 mRNA水平比较;b:不同脂肪组织AQP7水平比较;与CG组比较,*P<0.05,**P<0.01;与皮下脂肪组织比较,△P<0.05)

图2 两组大鼠不同脂肪组织PKB磷酸化蛋白水平的比较(与CG 组比较,*P<0.05,**P<0.01;与皮下脂肪组织比较,△P<0.05)
素抵抗为病理基础的疾病。笔者采用高脂饲料诱导胰岛素抵抗模型,旨在模拟人类营养性肥胖代谢紊乱的自然病理过程。实验结果显示,与CG组相比,IRG组体重明显增加,血糖、血脂升高,胰岛素敏感性下降,表明模型建立成功。
脂肪组织是肥胖、胰岛素抵抗发生的重要部位。脂肪组织存在区域性分布差异,约有80%分布在皮下,其余分布在腹部内脏周围[2]。内脏脂肪组织相比皮下脂肪组织除了代谢产物能直接通过门静脉入肝之外,其脂肪合成、分解代谢较皮下脂肪更为活跃,这种差异导致了在激素刺激下内脏脂肪组织会水解释放更多的游离脂肪酸和甘油进入肝脏,而皮下脂肪组织摄取游离脂肪酸合成TG,避免脂质在非脂肪组织的异位沉积[3]。内脏脂肪组织不仅是储能器官,而且是一个功能活跃的内分泌器官,可以分泌多种细胞因子,如瘦素、IL-6、TNF-α、抵抗素、脂联素等,这些因子与胰岛素抵抗的发生、发展密切相关[1]。本研究中发现IRG组分泌过多的IL-6、TNF-α,而脂联素的分泌量却是减少的,这些细胞因子的异常分泌导致发生胰岛素抵抗的风险增加。
胰岛素生物学效应的发挥有赖于细胞内各级信号分子的逐级转导。任何一种信号分子的抑制或降解,均会导致机体出现糖脂代谢紊乱等胰岛素抵抗现象。正常情况下,胰岛素在细胞表面与胰岛素受体结合,诱导胰岛素受体底物(IRS)的酪氨酸磷酸化,该底物被激活。IRS激活后,引起下游PI3K介导的PKB丝氨酸残基磷酸化,这个过程是胰岛素介导葡萄糖转运的关键环节[4]。本研究发现在高脂饲料喂养后,内脏脂肪组织P-PKB表达下降,证实了Sandeep等[5]研究显示内脏脂肪更易导致胰岛素抵抗。
肥胖不仅表现为脂肪组织质量和体积增加,更体现在脂肪组织内TG代谢的异常。AQP7作为水通道蛋白家族成员之一,在脂肪组织中大量表达,参与介导甘油转运[6-7],促进脂肪细胞内甘油向细胞外排泄,减少甘油在脂肪细胞内的积聚,与糖脂代谢密切相关[8],进一步研究发现:这种肥胖是由于AQP7的缺乏,甘油向细胞外转运减少,激活甘油激酶,TG合成增加,最终引起脂肪细胞体积增加。在AQP7基因敲除小鼠的研究中发现,缺乏AQP7出现肥胖和胰岛素抵抗[9-10]。本课题组前期实验通过地塞米松处理3T3-L1脂肪细胞诱导胰岛素抵抗,发现AQP7表达下降,在转染高表达AQP7的腺病毒之后可以改善胰岛素抵抗,其机制可能与PKB信号通路有关[11]。在人类研究中发现,在肥胖伴2型糖尿病患者内脏脂肪中AQP7 mRNA表达升高更明显[12-13],不仅如此,Rodriguez等[14]在蛋白水平也同样证实这一现象,推测内脏脂肪组织AQP7的表达与胰岛素抵抗密切相关。内脏脂肪蓄积过多会转移到肝脏、骨骼肌、心脏等其他组织,不仅产生脂毒性、造成脏器损伤,而且会引起一系列代谢紊乱疾病,本研究发现AQP7 mRNA在内脏脂肪组织中高表达,同时也在蛋白水平证实了AQP7在肥胖个体是增高的,从转录水平到蛋白水平表达趋势一致。由此推测AQP7在内脏脂肪中表达升高,可能与机体的代偿性调节有关。
综上所述,本研究以通过高脂饮食构建胰岛素抵抗模型,发现主要是内脏脂肪的AQP7与肥胖和糖尿病的发生相关,对其深入发掘可能为肥胖、糖尿病的防治提供一个崭新的思路。
[1]da Silva I V,Soveral G.Aquaporins in Obesity[J].Adv Exp Med Biol,2017,969:227-238.
[2]Rodr guez A,Cataln V,Gmez-Ambrosi J,et al.Visceral and subcutaneous adiposity:are both potential therapeutic targets for tackling the metabolic syndrome?[J].Curr Pharm Des,2007,13(21):2169-2175.
[3]Ibrahim M M.Subcutaneous and visceral adipose tissue:structuraland functionaldifferences[J].Obes Rev,2010,11(1):11-18.
[4]Schinner S,Scherbaum W A,Bornstein S R,et al.Molecular mechanisms ofinsulin resistance[J].Diabet Med,2005,22(6):674-682.
[5]Sandeep S,Gokulakrishnan K,Velmumgan K,et al.Visceral&subcutaneous abdominal fatin relation to insulin resistance&metabolic syndrome in nondiabetic south Indians[J].Indian J Med Res,2010,131(5):629-635.
[6]Katano T,Ito Y,Ohta K,et al.Functional characteristics of aquaporin 7 as a facilitative glycerolcarrier[J].Drug Metab Pharmacokinet,2014,29(3):244-248.
[7]Mendez-Gimenez L,Rodriguez A,Balaguer I,et al.Role of aquaglyceroporins and caveolins in energy and metabolic homeostasis[J].MolCellEndocrinol,2014,397(1-2):78-92.
[8]Lebeck J.Metabolic impact of the glycerol channels AQP7 and AQP9 in adipose tissue and liver[J].J Mol Endocrinol,2014,52(2):R165-178.
[9]Hibuse T,Maeda N,Funahashi T,et al.Aquaporin 7 deficiency is associated with development of obesity through activation of adipose glycerol kinase[J].Proc Natl Acad Sci U S A,2005,102(31):10993-10998.
[10]Hara-Chikuma M,Sohara E,Rai T,et al.Progressive adipocyte hypertrophy in aquaporin-7-deficient mice:adipocyte glycerol permeability as a novel regulator of fat accumulation[J].J Biol Chem,2005,280(16):15493-15496.
[11]Shen F X,Gu X,Pan W,et al.Overexpression of AQP7 contributes to improve insulin resistance in adipocytes[J].Experi-mentalCellResearch,2012,318(18):2377-2384.
[12]Tinahones F J,Garrido-Sanchez L,Miranda M,et al.Obesity and insulin resistance-related changes in the expression of lipogenic and lipolytic genes in morbidly obese subjects[J].Obes Surg,2010,20(11):1559-1567.
[13]Miranda M,Escote X,Ceperuelo-Mallafre V,et al.Paired subcutaneous and visceral adipose tissue aquaporin-7 expression in human obesity and type 2 diabetes:differences and similarities between depots[J].J Clin Endocrinol Metab,2010,95(7):3470-3479.
[14]Rodriguez A,Catalan V,Gomez-Ambrosi J,et al.Insulin-and Leptin-Mediated Control ofAquaglyceroporins in Human Adipocytes and Hepatocytes Is Mediated via the PI3K/Akt/mTOR Signaling Cascade[J].J Clin Endocrinol Metab,2011,96(4):586-597.
Effects of aquaporin 7 in different adipose tissues of rats with insulin resistance
PAN Wei,SHEN Feixia,GU Xuemei.Department of Endocrinology,the First Affiliated Hospital of Wenzhou Medical University,Wenzhou 325000,China
Objective To investigate the expression of aquaporin 7(AQP7)in different adipose tissues of insulin resistance rats. Methods Male SD rats were randomly divided into insulin resistant and control groups with 10 animals in each.The insulin resistance model was induced by feeding with high-fat diet.The changes of body weight,serum triglyceride,cholesterol,high density lipoprotein,low density lipoprotein,glycerol,fasting blood glucose,insulin and adipokines in two groups were observed.The expression of AQP7 mRNA and protein,and the expression of PKB and phosphorylated protein in subcutaneous adipose tissue(SAT)and epididymal adipose tissue(visceral adipose tissue,VAT)were detected and compared. Results Compared to control group,the serum low density lipoprotein,fasting blood glucose,insulin,IL-6,TNF-α and HOMA-IR in insulin resistance group were higher(P<0.01 or P<0.05),while high density lipoprotein and adiponectin were lower(P<0.05)at 12th week after high diet feeding.The level of AQP7 expression in VAT was higher than that in SAT,and the expression of AQP7 in VAT of insulin resistance group was higher than that of control group in both gene and protein level.The expression of PKB phosphorylated protein in VAT was lower than that in SAT,and the expression level in insulin resistance group was lower than that in control group. Conclusion The abnormal expression of AQP7 in visceral adipose tissue may be related to the occurrence of insulin resistance.
AQP7 Adipose tissue Inulin resistance
10.12056/j.issn.1006-2785.2017.39.22.2017-990
国家自然科学基金青年资助项目(81000356);浙江省自然科学基金(Y2080418)
325000 温州医科大学附属第一医院内分泌科
沈飞霞,E-mail:sfx301@163.com
2017-05-01)
严玮雯)

