肺癌小鼠模型中删除MDSCs对CD8+T细胞的影响
王慧茹 潘健
肺癌小鼠模型中删除MDSCs对CD8+T细胞的影响
王慧茹 潘健
目的 在路易斯肺癌LLC荷瘤小鼠模型中通过删除外周血中骨髓来源的抑制细胞(MDSCs),探讨MDSCs对CD8+T细胞数量和功能、体内肿瘤生长及小鼠生存期的影响。方法 将C57小鼠皮下接种LLC,尾静脉注射Gr-1抗体删除荷瘤小鼠血液中的MDSC或注射对照抗体,于不同时间点采尾血,应用流式细胞术检测外周血中MDSC和CD8+T细胞的变化,记录肿瘤生长情况和小鼠生存期,比较两组荷瘤小鼠的脾细胞对LLC细胞的杀伤作用。结果 LLC荷瘤7 d后小鼠中MDSCs比例(%)(23.870±1.350)显著高于正常小鼠(7.600±0.677)(P<0.001),CD8+T细胞比例(%)(7.906±0.428)显著低于正常小鼠(11.220±0.606)(P<0.001); 荷瘤7 d注射Gr-1删除抗体或对照抗体,3 d后删除组外周血MDSCs比例(%)较未删除组显著降低(分别为1.578±0.299 vs 38.340±3.214,P<0.001),CD8+T细胞比例(%)显著高于未删除组(分别为9.464±0.820 vs 4.024±0.488,P<0.001); 抗体注射10 d后删除组MDSCs比例(%)较之前显著增加(31.980±3.595),但仍然低于普通荷瘤组(63.660±5.763)(P=0.001 6),CD8+T细胞比例(%)较之前降低(5.806±0.554),仍高于普通荷瘤组(2.894±0.330)(P=0.001 9);MDSCs删除组小鼠肿瘤生长减缓(P<0.05)、生存期延长(P=0.036,中位生存期46 d vs 53 d)。结论 在LLC荷瘤小鼠中删除MDSC能解除其对CD8+T细胞的抑制,减缓肿瘤生长,延长小鼠生存期。
肺癌 骨髓来源的抑制细胞 CD8+T细胞 免疫抑制
据国家癌症中心统计,肺癌是我国发病和致死率最高的肿瘤,严重威胁人群生命健康[1]。机体免疫监视功能下降是肿瘤发病和进展的重要特征之一,研究表明多种复杂因素参与其中。其中骨髓来源的抑制细胞(myeloid-derived suppressor cells,MDSCs)是一群异质性病理激活的未成熟骨髓细胞,在肿瘤微环境中显著增加,发挥抑制抗肿瘤免疫的功能,而去除MDSCs的抑制作用或诱导其转化为树突状细胞(dendritic cells,DC)等,可能在肿瘤治疗研究中发挥积极意义[2]。现以路易斯肺癌LLC荷瘤小鼠模型经删除血液中MDSCs,探讨MDSCs对CD8+T细胞数量和功能、体内肿瘤生长及小鼠生存期的影响。
材料与方法
1 材料
1.1 细胞系:小鼠Lewis肺癌细胞LLC细胞由中国医学科学院肿瘤研究所免疫实验室保存。DMEMF12培养基加10%胎牛血清用于LLC细胞培养,培养条件为饱和湿度、37℃、5%CO2,每3天左右当细胞达到90%左右融合时,用0.25%胰蛋白酶-EDTA消化传代培养。
1.2 实验动物:6~8周雌性C57BL/6小鼠购自北京维通利华公司,体重18~20 g,于中国医学科学院肿瘤医院实验动物中心饲养。
1.3 主要试剂和仪器:Gr-1删除抗体(RB6-8C5)、FITC标记的CD11b抗体、PE标记的Gr-1抗体、CD8-PE、CD3-PE/CY7购自BioLegend公司。流式细胞仪为Millipore Guava。
2 实验方法
2.1 动物实验:消化收集LLC细胞,PBS洗涤,台盼蓝染色细胞活力大于95%,细胞计数。用PBS调整浓度为1×107/ml,混匀后皮下接种于8周雌性C57小鼠背部,每只接种100 μl约1×106,待肿瘤长到直径约3~6 mm时(约第7天),剔除肿瘤大小不合规定的小鼠,将剩余小鼠随机分为2组,每组5只,实验组尾静脉注射Gr-1删除抗体100 μg,对照组尾静脉注射兔IgG100 μg。在抗体注射后的第3、7、10天分别留取血液进行细胞检测。同时每3~4天测量肿瘤直径,肿瘤大小计算公式为v=0.52×a×b×b,同时记录小鼠生存时间。
2.2 流式细胞仪检测:在规定时间减去小鼠尾巴一小段,留取血液约20 μl,红细胞裂解液裂解红细胞后,调整白细胞浓度为1×107/ml,检测MDSCs,用抗体CD11b-FITC和Gr-1-PE标记染色,CD8+T细胞用CD3-PE/CY7、CD8-PE染色,流式细胞仪检测。数据分析应用FlowJo 7.6软件。
3 统计学处理 应用GraphPad Prism V软件,数据用表示。组间差异采用t检验,小鼠生存期的比较采用Kaplan-Meier 分析,P<0.05表示差异有统计学意义。
结 果
1 C57小鼠荷LLC肿瘤细胞1周后,肿瘤生长直径约为3~6 mm的椭球状,外周血中CD11b+Gr-1+的MDSCs比例(%)为23.870±1.350,显著高于对照非荷瘤小鼠的7.600±0.677(P<0.001),同时CD8+T细胞比例(%)7.906±0.428显著低于正常小鼠(11.22±0.606)(P=0.0021),提示随着LLC肿瘤的生长,外周血中出现了大量MDSCs,同时抑制了CD8+T细胞的比例(见图1)。

图1 C57小鼠荷瘤7 d后外周血中MDSC和CD8+T细胞的变化(每组5只小鼠)
2 荷瘤小鼠注射Gr-1抗体或对照抗体3 d后检测外周血中MDSCs比例(%),删除组为1.578±0.299,显著低于对照组38.340±3.214(P<0.001),表明删除抗体有效消除了MDSCs;(图2A)。删除MDSCs的小鼠外周血中CD8+T细胞比例(%)为9.464±0.820,显著高于对照未删除组4.024±0.488(P<0.001),提示删除MDSCs能有效消除其对CD8+T细胞的抑制(图2B)。
3 C57小鼠荷瘤17 d时,此时删除MDSCs的实验组小鼠已经距注射Gr-1抗体10 d,检测两组小鼠外周血发现对照组小鼠中MDSCs比例(%)已经升高为63.660±5.763,虽然也显著高于删除组的31.980±3.595(P=0.0016),但结果已提示随着时间的推移,删除抗体的效果已大大减弱。(图3A)。同时对照组小鼠的CD8+T细胞比例(%)继续减少为2.894±0.330,仍显著低于删除MDSCs组的5.806±0.554(P=0.0019)(图3B)。

图2 C57小鼠荷瘤10 d注射不同抗体后外周血中MDSC和CD8+T细胞的变化(每组5只小鼠)
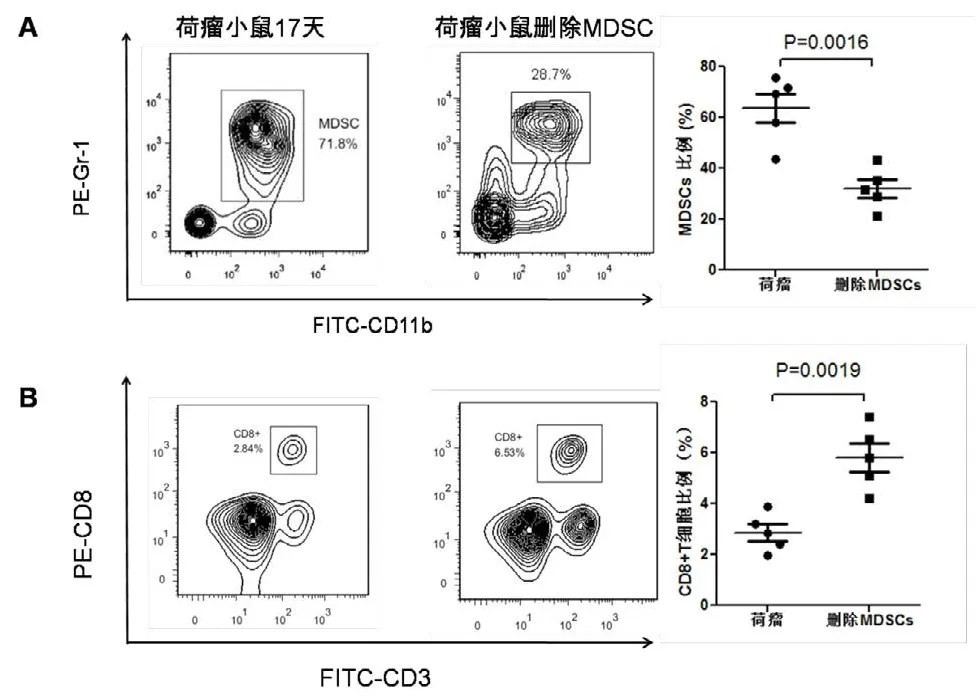
图3 C57小鼠荷瘤17 d注射不同抗体后外周血中MDSC和CD8+T细胞的变化(每组5只小鼠)

图4 C57小鼠荷瘤注射不同抗体后肿瘤生长曲线
4 两组小鼠的肿瘤生长曲线结果显示,如图4所示,注射Gr-1抗体删除MDSCs能显著抑制小鼠肿瘤生长(第13天,P=0.025;第17天,P=0.043),但随着抗体的代谢消除,肿瘤生长重新恢复,两组之间的差异无统计学意义(第21天,P=0.052)。图5的生存曲线显示,注射删除MDSCs组的小鼠中位生存时间为53 d,显著高于对照组小鼠的46 d(P=0.036)。
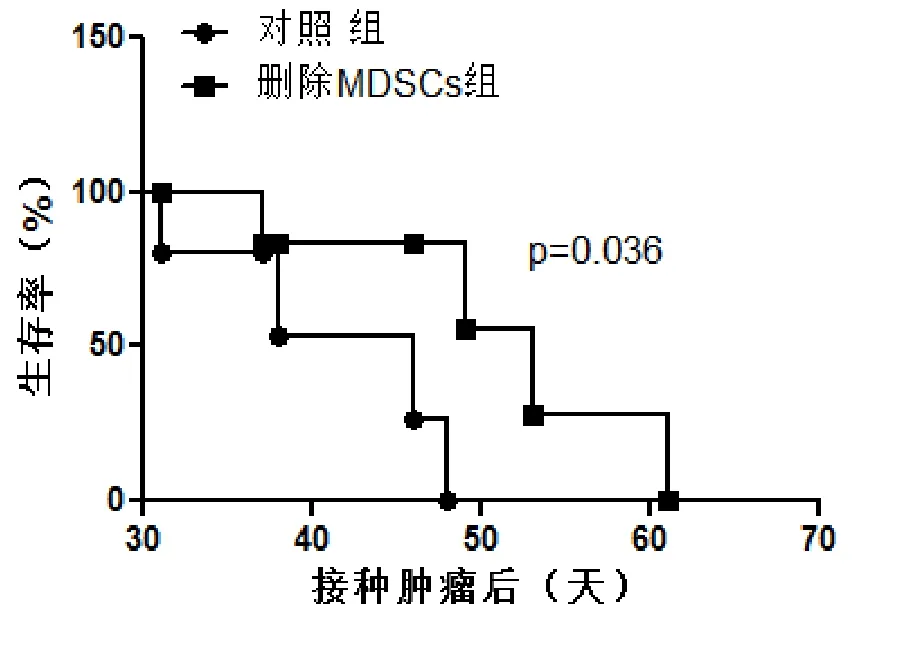
图5 C57小鼠荷瘤注射不同抗体后的生存曲线(每组5只小鼠)
讨 论
肿瘤免疫治疗被科学杂志评为2013年度十大科学进展首位,表明肿瘤免疫逃逸在肿瘤的发病和进展中发挥重要作用,而逆转免疫细胞的抑制状态可能对肿瘤治疗发挥积极的意义[3]。MDSCs和Treg是两个发挥免疫抑制作用的细胞群,MDSCs主要由未成熟的巨噬细胞、树突状细胞以及粒细胞组成。人类MDSCs被确定为CD33+CD11b+HLADRlow,小鼠 MDSCs被确定为Gr1+CD11b+[4,5]。本研究通过建立小鼠LLC皮下肿瘤删除MDSCs模型,连续检测外周血MDSCs、CD8+T细胞的比例变化和特点,探索删除MDSCs在免疫治疗中的意义。
正常状态下,小鼠体内MDSCs主要集中在骨髓,外周血和脾脏中的比例较少。本实验结果显示正常C57小鼠外周血MDSC的比例为(7.600±0.677)%,而接种LLC肿瘤的小鼠,7 d后虽出瘤不久,但外周血中MSDCs比例已显著提升约3倍(23.870±1.350)%。随着肿瘤的生长,10 d后MDSCs比例不断攀升为(38.340±3.214)%,17 d后MDSC已上升为外周血中白细胞的主要成分(63.660±5.763)%,其原因可能为肿瘤生长过程中分泌的众多细胞因子诱导骨髓造血干细胞不断分化发育为MDSCs,向周围器官和肿瘤微环境迁移,导致其大量聚集于骨髓、外周血、脾脏、淋巴结和肿瘤组织周围,发挥免疫负调控的功能[6]。本结果显示,在注射Gr-1删除抗体3 d后,外周血中MDSCs大部分已被删除,仅为(1.578±0.299)%,此时CD8+T细胞比例已恢复至(9.464±0.820)%,虽然低于非荷瘤小鼠的(11.220±0.606)%,但已显著高于同时间段未删除MDSC的荷瘤小鼠(4.024±0.488)%,提示此时减少的MDSCs降低了其对CD8+T细胞的免疫抑制作用。研究表明MDSCs可通过表达高水平的ARGl,分解环境中存在的T细胞活化所必需的氨基酸—精氨酸,从而导致CD4+和CD8+T细胞活化受阻;MDSC还能下调TCR相关ζ链,ζ链缺失导致CD4+和CD8+T细胞活化信号不能传递[7];MDSC也可诱导T细胞阻滞在G0/G1周期;通过消耗环境中T细胞活化所必需的半胱氨酸,阻断T细胞活化[8];MDSC经下调naive T细胞淋巴结归巢必需的分子CD62L表达,使naive T细胞不能有效迁移到能够接受肿瘤抗原刺激的淋巴结,导致活化的CD4+和CD8+T细胞数量减少[9]。调节性T细胞是另一种重要的免疫抑制细胞,研究表明MDSC 细胞可作为抗原提呈细胞摄取、处理并向调节性T细胞呈递耐受原,进而介导调节性T细胞的募集和扩增,发挥联合抑制反应[10]。我们推测删除MDSC后小鼠体内调节性T细胞比例也会减小,共同减轻免疫抑制反应,从而得到较长的生存期。
本研究是通过一次注射抗体删除MDSCs,其效果持续时间在第3天最显著,注射抗体10 d后,MDSCs比例又开始迅速升高,与此同时CD8+T细胞由于MDSCs的免疫抑制作用,受到抑制比例显著下降,小鼠肿瘤也生长得更快,与对照组的差异开始消失。由于肿瘤生长过程中释放的多种细胞因子等能诱导骨髓细胞分化为MDSCs,因此持续消除MDSCs的免疫抑制作用需要间隔多次注射抗体,才能取得更好的抑制肿瘤生长的效果。然而,小鼠的生存期显示虽荷瘤20多天后两组小鼠的原位肿瘤生长无明显差异,删除MDSC组小鼠的生存期却高于对照小鼠,提示干预免疫功能更大的意义在于改善生存期,而其抑制肿瘤生长的作用较为有限。肝癌的临床研究也表明较高的MDSCs细胞比例与较差的预后相关[11]。
本研究在小鼠肺癌模型中删除MDSCs细胞,证实MDSCs细胞的减少能显著解除其对CD8+T细胞的抑制作用,同时减缓肿瘤生长及改善小鼠生存期。关于MDSCs细胞抑制抗肿瘤免疫及改善生存期的具体分子机制等有待更深入的研究。
1 Chen W,Zheng R,Baade P D,et al. Cancer statistics in China,2015[J]. CA Cancer J Clin,2016,66(2):115-132.
2 Gabrilovich D I,Nagaraj S. Myeloid-derived suppressor cells as regulators of the immune system[J].Nat Rev Immunol,2009,9(3):162-174.
3 Couzin-Frankel J. Breakthrough of the year 2013. Canc er immunotherapy[J]. Science,2013,342(6165):1432-1433.
4 Youn J I,Nagaraj S,Collazo M,et al. Subsets of myeloid-derived suppressor cells in tumor-bearing mice[J]. J Immunol,2008,181(8):5791-5802.
5 Obermajer N,Muthuswamy R,Odunsi K,et al.PGE(2)-induced CXCL12 production and CXCR4 expression controls the accumulation of human MDSCs in ovarian cancer environment[J]. Cancer Res,2011,71(24):7463-7470.
6 Sevko A,Umansky V. Myeloid-derived suppressor cells interact with tumors in terms of myelopoiesis,tumorigenesis and immunosuppression:thick as thieves[J]. J Cancer,2013,4(1):3-11.
7 Rodriguez P C,Quiceno D G,Ochoa A C. L-arginine availability regulates T-lymphocyte cell-cycle progression[J]. Blood,2007,109(4):1568-1573.
8 Yang R,Cai Z,Zhang Y,et al. CD80 in immune suppression by mouse ovarian carcinoma-associated Gr-1+CD11b+ myeloid cells[J]. Cancer Res,2006,66(13):6807-6815.
9 Hanson E M,Clements V K,Sinha P,et al. Myeloidderived suppressor cells down-regulate L-selectin expression on CD4+ and CD8+ T cells[J]. J Immunol,2009,183(2):937-944.
10 Serafini P,Mgebroff S,Noonan K,et al. Myeloidderived suppressor cells promote cross-tolerance in B-cell lymphoma by expanding regulatory T cells[J].Cancer Res,2008,68(13):5439-5449.
11 Diaz-Montero C M,Salem M L,Nishimura M I,et al. Increased circulating myeloid-derived suppressor cells correlate with clinical cancer stage,metastatic tumor burden,and doxorubicin-cyclophosphamide chemotherapy[J]. Cancer Immunol Immunother,2009,58(1):49-59.
The Influence of MDSC Depletion on CD8+ T Cells in Lung Carcinoma of Mouse Model
WANG Hui-ru,PAN Jian.Anhui Provincial Hospital23001
Objective To explore the effect of MDSCs on the number and function of CD8+T cells,tumor growth in vivo and survival in Lewis lung cancer mice. Methods LLC tumor cells were inoculated into the flank of C57 LB/6 mice.MDSC were depleted by intravenous administration of Gr-1 blocking antibody. Tail blood was collected and CD8+T cells,MDSCs and splenocyte cytotoxicity of LLC were detected by flow cytometry. Tumor growth and survival of tumor bearing mice were recorded. Results On day 7 after tumor inoculation,the percentages of MDSCs from tumor bearing mice were significantly higher than the control (23.87±1.35% vs 7.600±0.677%,P<0.001) and CD8+T cells were declined compared with the control (7.906±0.428%) vs (11.22±0.606%,P<0.001). Gr-1 blocking antibody was administered to deplete MDSCs. On day 3 after administration,the percentages of MDSCs were rapidly decreased(1.578±0.299% vs 38.34±3.214%,P<0.001) and CD8+T cells were significantly higher than control mice(9.464±0.820 vs 4.024±0.488,P<0.001). On day 10 after administration,MDSCs percentages were increased,but decreased when compared to control mice(1.578±0.299%) vs(38.34±3.214%,P=0.0016) and CD8+T cells were deceased but elevated compared with control mice(9.464±0.820%)vs( 4.024±0.488%,P=0.0019). Tumor growth in mice with MDSCs depletion was markedly inhibited compared with control group(P<0.05). The survival of mice with MDSCs depletion was notably longer than control mice(P=0.036,median survival 46 vs 53). Conclusion MDSCs depletion in LLC tumor bearing mice eliminated the inhibition of CD8+T cells by MDSCs Leading to a restriction of tumor growth and prolonged survival.
Lung carcinoma Myeloid-derived suppressor cells CD8+Tcells Immunosuppression
R734.2 R392.11
A
1671-2587(2017)06-0543-04
10.3969/j.issn.1671-2587.2017.06.003
230001 合肥,安徽省立医院输血科
王慧茹(1987–),女,安徽合肥人,检验技师,博士,主要从事肿瘤免疫相关研究工作,(E-mail)wanghuiruru@163.com。
潘健,男,副主任技师,硕士,(E-mail)707957231@qq.com。
2017-05-21)
(本文编辑:王虹)

