比较中辨析 对比中深化
——化学键性质大比拼
山东 孙 晶
比较中辨析 对比中深化
——化学键性质大比拼

比较是把内容相同、相近、相反、相异、相关等可比较性的知识放在一起进行对照,分析其特点,察同求异,以加深对概念的理解。现将《物质结构与性质》模块中涉及化学键与分子间作用力有关内容多角度、全方位地辨析,以加深理解与深化。
一、辨析中理解离子键、共价键、金属键
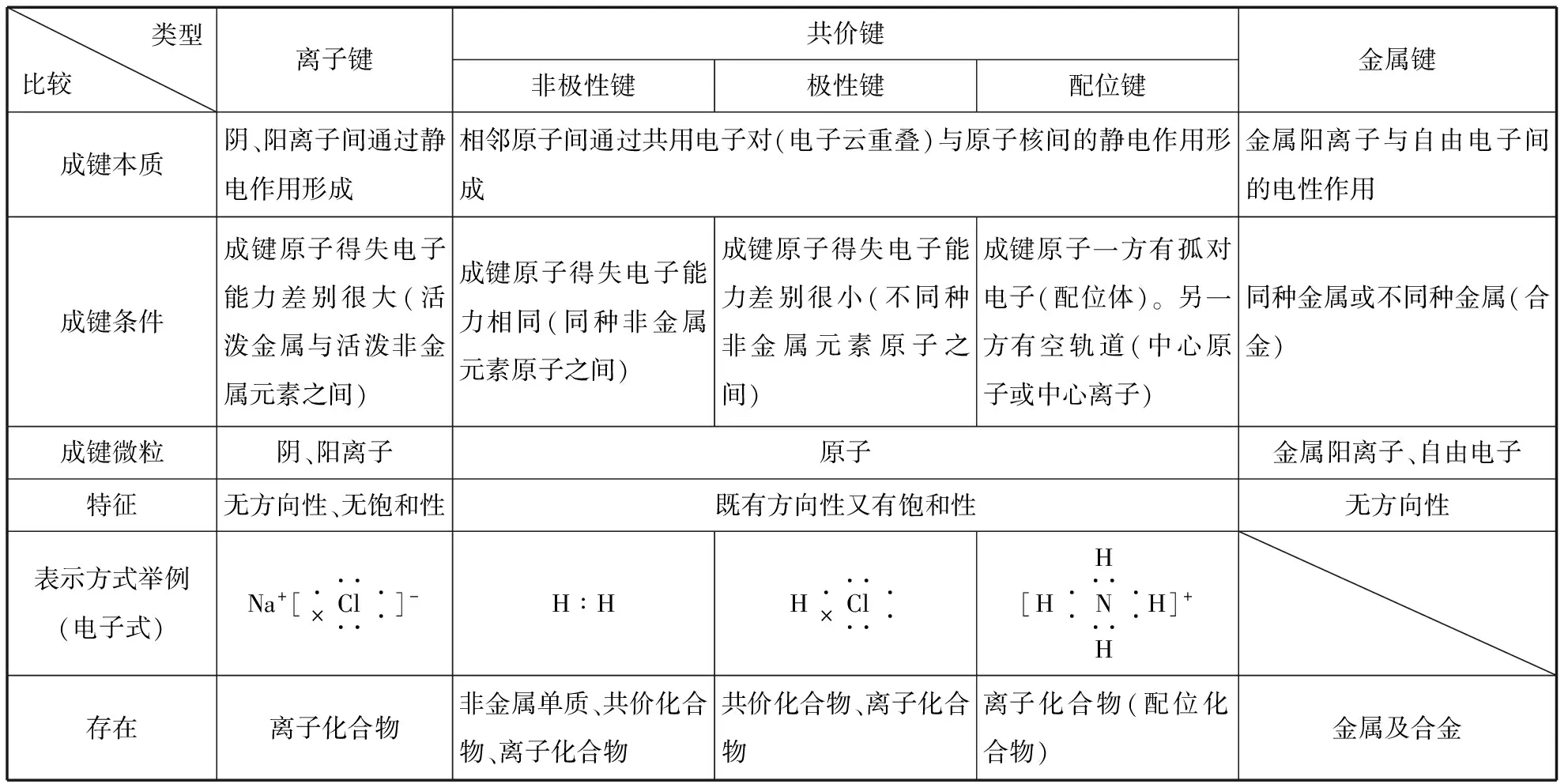
类型比较 离子键共价键非极性键极性键配位键金属键成键本质阴、阳离子间通过静电作用形成相邻原子间通过共用电子对(电子云重叠)与原子核间的静电作用形成金属阳离子与自由电子间的电性作用成键条件成键原子得失电子能力差别很大(活泼金属与活泼非金属元素之间)成键原子得失电子能力相同(同种非金属元素原子之间)成键原子得失电子能力差别很小(不同种非金属元素原子之间)成键原子一方有孤对电子(配位体)。另一方有空轨道(中心原子或中心离子)同种金属或不同种金属(合金)成键微粒阴、阳离子原子金属阳离子、自由电子特征无方向性、无饱和性既有方向性又有饱和性无方向性表示方式举例(电子式)Na+[·×Cl······]-H∶HH·×Cl······[H··N····HH··H]+存在离子化合物非金属单质、共价化合物、离子化合物共价化合物、离子化合物离子化合物(配位化合物)金属及合金
二、对比中理解化学键与分子间作用力

内容化学键分子间作用力定义分子里相邻的原子间强烈的相互作用使分子聚集在一起的作用力存在范围分子(广义的)内相邻的原子(广义的)之间同种或异种分子(狭义的)之间强弱程度很强烈,键能一般为100~600kJ·mol-1,克服它需要较高的能量很微弱,作用能一般为几个至数十个千焦/摩,克服它只需要较低的能量作用主要影响物质的化学性质,影响不是由分子组成的物质的物理性质主要影响由分子组成的物质(含稀有气体)的物理性质(熔沸点、溶解性等),对这些物质的化学性质无影响
三、对比中理解范德华力与氢键
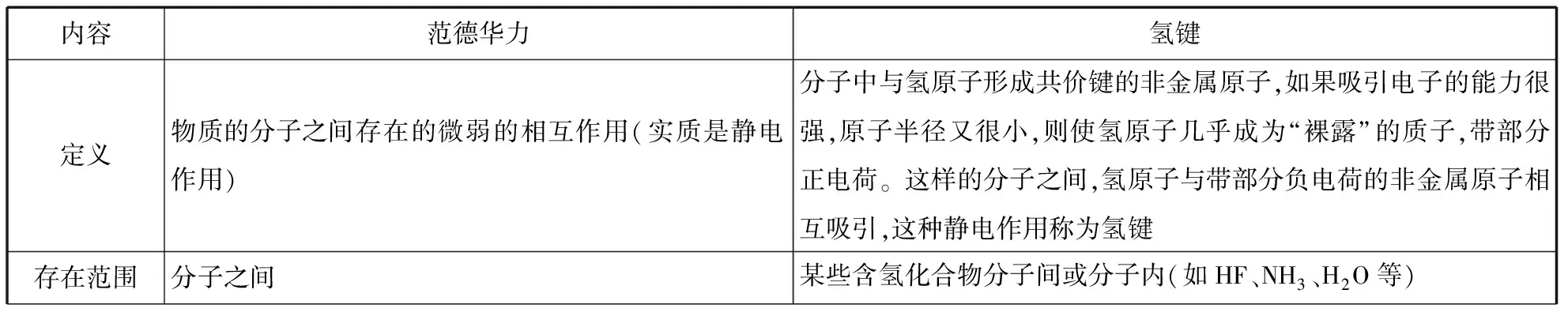
内容范德华力氢键定义物质的分子之间存在的微弱的相互作用(实质是静电作用)分子中与氢原子形成共价键的非金属原子,如果吸引电子的能力很强,原子半径又很小,则使氢原子几乎成为“裸露”的质子,带部分正电荷。这样的分子之间,氢原子与带部分负电荷的非金属原子相互吸引,这种静电作用称为氢键存在范围分子之间某些含氢化合物分子间或分子内(如HF、NH3、H2O等)
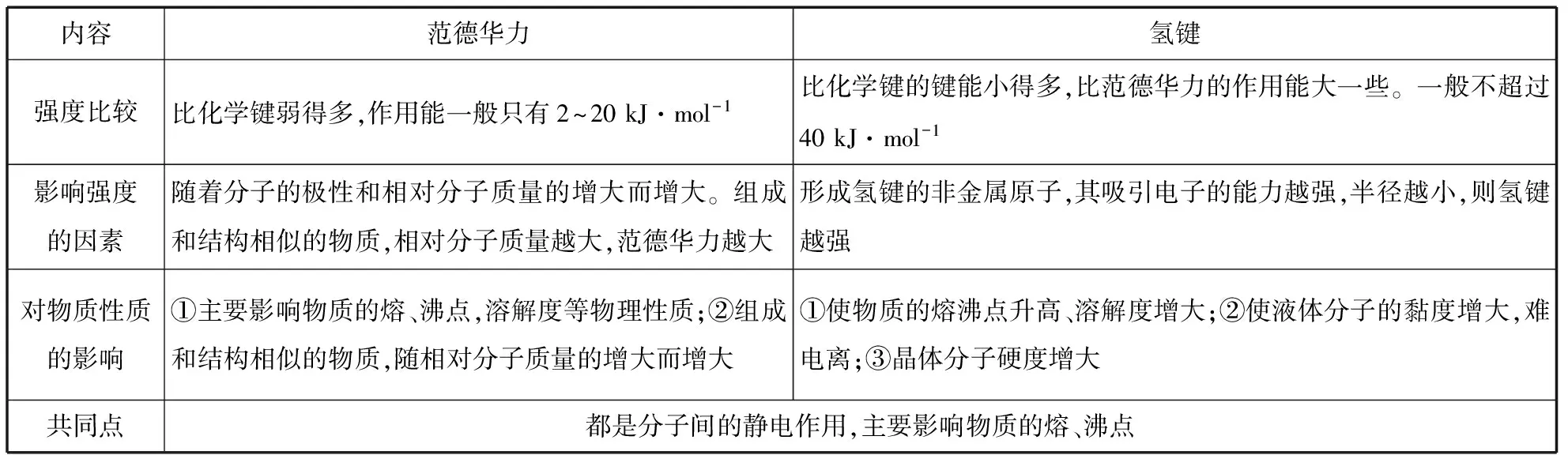
续表
四、典例追踪
角度1离子键
例1下列四种离子晶体KCl、NaCl、CaO、BaO中,熔沸点由高到低的顺序是
( )
A.KCl>NaCl>BaO>CaO
B.NaCl >KCl>CaO>BaO
C.CaO>BaO>NaCl>KCl
D.CaO>BaO>KCl>NaCl
解析:离子晶体熔沸点的高低与离子键成正比,离子键越强,熔沸点越高,反之则相反。而离子键的强弱正比于阴、阳离子电荷数,反比于离子半径。而离子半径O2-
答案:C
角度2电负性与共价键
例2下列各组分子中,按共价键极性由强至弱排序正确的是
( )
A.HF、H2O、NH3、CH4
B.CH4、NH3、H2O、HF
C.H2O、HF、CH4、NH3
D.HF、H2O、CH4、NH3
解析:按共用电子对是否偏移分类,共价键分为非极性键和极性键,而共价键的极性比较,主要看成键的两个原子吸引电子能力的差别,差别越大,则电子对偏移程度越大,键的极性越强,其实质是原子电负性的差值。F、O、N、C四种元素的电负性依次减小,则它们吸引电子能力也依次减弱,形成的氢化物的极性也依次减弱。
答案:A
角度3极性键和非极性键
例3下列反应过程中,同时有极性键和非极性键的断裂和形成的反应是
( )




解析:A、B项中都没有非极性键的断裂和形成;C项中有Cl—Cl非极性键的断裂,但没有非极性键的形成;只有D选项中反应前有O—O非极性键、C—O极性键的断裂,反应后有氧分子中O—O非极性键及Na2CO3中的C—O极性键的形成,符合题意。
答案: D
角度4金属键
例4物质结构理论指出:金属晶体中金属离子与自由电子之间的强烈相互作用,叫金属键。金属键越强,其金属的硬度越大,熔沸点越高,且据研究表明,一般说来金属原子半径越小,价电子数越多,则金属键越强。由此判断下列说法错误的是
( )
A.镁的硬度大于铝
B.镁的熔沸点低于钙
C.镁的硬度大于钾
D.钙的熔沸点高于钾
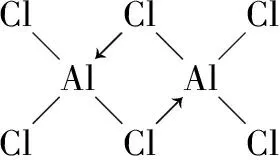
解析:价电子数Al>Mg,原子半径Al 答案:AB 角度5配位键 解析:题中Al的价电子构型为3s23p1,显然具有空轨道,而Cl的价电子构型为3s23p5,含有孤对电子,符合配位键的形成条件。 对Al而言,与三个Cl原子形成三条共价键后,最外层电子数变为3+3=6个,仍含有空轨道,缺2个电子,故能接受Cl原子提供的孤对电子,配位键为Cl→Al。 角度6氢键 例6水是地球生命之源,分子式是H2O,水分子形成的冰是分子晶体。 (1)水分子中存在两个O—H共价键,从氢原子与氧原子的电子云重叠方式来看,O—H共价键属于 键。 (2)在酸性溶液中,水分子容易得到一个H+,形成水合氢离子(H3O+),应用价层电子对互斥理论(或模型)推测H3O+的形状为 。 (3)如图是二氧化碳(干冰)晶体的晶胞图,冰的晶体类型跟这个晶胞类似,那么一个冰晶胞中水分子的个数是 个。 (4)在冰晶体中,除存在共价键和范德华力外,还存在的作用力是 。 解析:(1)水分子中存在两个O—H共价键,每个氧原子和氢原子的电子云都是采取“头碰头”式的重叠,所以属于σ共价键。 (2)H3O+的中心原子是氧原子,氧原子外层有6个电子,另外两个氢原子提供两个电子,所以在H3O+中心原子氧原子周围是8个电子,即4对电子,所以有3对电子与2个氢原子形成共价键,与氢离子形成一个配位键,另外一对是孤对电子,所以H3O+是三角锥形(跟氨气分子类似)。 答案:(1)σ (2)三角锥形 (3)4 (4)氢键 通过比较可以把握概念的内涵与外延,发现知识的内在脉络,因而比较是一切理解和思维的基础,是学习上的的一把“解剖刀”。在学习上我们要善于利用比较法去领会、把握、深化知识。 反馈练习: 1.下列物质的分子中,只有σ键没有π键的是 ( ) A.CH2=CH-CH3B.N2C.HCl D.C2H2 2.下列叙述中正确的是 ( ) A.分子中含有共价键的纯净物一定是共价化合物 B.由极性键形成的分子一定是极性分子 C.以离子键结合的化合物是离子化合物 D.以非极性键结合而成的双原子分子是非极性分子 3.把CoCl2溶解于水后加氨水直到先生成的沉淀 Co(OH)2又溶解后,再加氨水,使之生成 [Co(NH3)6]2+。此时向溶液中通入空气,得到的产物中有一种其组成可用CoCl3·5NH3表示。把分离出的CoCl3·5NH3溶于水后立即加入硝酸银溶液,则析出AgCl沉淀。经测定,每1mol CoCl3·5NH3反应有2 mol AgCl生成。请写出表示此配合物结构的化学式: ,此配合物中Co的化合价为 。 参考答案: 2.CD 提示:A项不一定,如H2中含有共价键,但它不是化合物而是单质;B项由极性键形成的分子是否有极性还要从分子的空间结构分析,若空间结构对称,如直线形、正三角形、正四面体形等则为非极性分子,若空间结构不对称,如V形、三角形、变形四面体形等,则为极性分子;C项化合物中只要有离子键就一定是离子化合物;D项双原子分子若以非极性键相结合就一定是非极性分子。 3.[Co(NH3)5Cl]Cl2+3 山东省莒县第四中学)