脑胶质瘤的外科手术近代观点
吴劲松 周良辅
(1复旦大学神经外科研究所 上海 200040; 2复旦大学附属华山医院神经外科脑胶质瘤中心 上海 200040)

专家简介周良辅,中国工程院院士(2009年当选)。1941 年出生,1965 年毕业于上海第一医学院,先后在上海华山医院普外科、骨科、手外科和神经外科任住院医师、主治医师。1984年起任华山医院神经外科主任,1985年赴美国明尼苏达大学医院神经外科、Mayo Clinic、Lahey Clinic和UCLA 神经外科考察学习,并任客座教授。1988年被聘为正教授,1989年被批准为博士生导师。
现任复旦大学神经外科研究所所长、上海市神经外科临床医学中心主任、上海市神经外科急救中心主任、WHO 神经研究和培训中心副主任、博士生导师。中华神经外科学和上海中华神经外科学会荣誉主任委员、复旦大学上海医学院学术委员会委员、中央保健局专家组成员。美国Neurosurgery,欧洲NeurosurgicalReview,日本NeurogiaDico-Chirugica杂志国际编委、《中国临床神经科学》等多种专业杂志副主编或编委。
因神经显微外科和脑血管重建技术在脑动脉瘤治疗中的应用等项目而获得1986 年度《中国医学论坛报》杰出外科医生奖,“难治性颅内动脉瘤的诊断和治疗的研究”获1988 年国家科技进步三等奖。1988 年入选卫生部主办“走向世界”讲座报告人,并被评为国家有特殊贡献专家。1995 年“前颅底肿瘤的基础和临床研究”获国家科技进步三等奖。2009 年“新手术入路和技术治疗颅内难治病变”获国家科技进步二等奖。曾获省部级一等奖和二等奖6项、国家有贡献中青年专家(1988年)、卫生部全国先进工作者(1994年)、全国五一劳动勋章(1996年)、上海市医学荣誉奖(1997年)、光华医学奖(1998年)、中国医师奖(2008年)、全国先进工作者(2010年)等荣誉。2012年被世界神经外科联盟官方杂志WorldNeurosurgery评选为年度封面人物,2014年获选世界神经外科联盟亚太代表,成为全球每4年获选的5人之一,并被授予荣誉勋章和奖状。
主要从事微侵袭神经外科如显微外科、颅底外科、神经导航外科、内镜外科和立体定向放射外科等的研究和应用,近来也从事细胞分子神经外科的研究工作。擅长脑动脉瘤、颅内和脊髓肿瘤等神经外科多种疾病的诊疗。已培养博士后和博士生32 人、硕士生37 人,正在培养博士后2人、博士生2 人。1998年起在国内举办颅底外科、内镜及脑血管学习班等,至今已培训了来自全国各地的颅底外科高级人才近1 000 人,促进了我国神经外科的发展。积极推动国内与国外神经外科间的学术交流,多次在国际学术会议上作学术报告,是美国和日本多所医院的客座教授和访问教授。多次获得世界神经外科联合会主席、著名神经外科专家Takanori Fukushima 教授的赞誉和高度评价。
自1984 年任华山医院神经外科主任至今,科室医生由21 人增至现在的106 人,年均手术量由600 台增至14 000 台。70%的患者来自全国各地,5%来自亚太地区。每年接收6~8位来自国外的青年医生参观学习。华山医院神经外科被评为上海改革开放医学十大成果之一。2007年世界神经外科联盟主席Brotchi教授在美国神经外科官方杂志Neurosurgery上评论:“在不到60年内,华山神经外科在各方面所取得的成就令人瞩目,已成为世界上最好的神经外科中心之一。”
上海医学院创建90周年寄语兴国育才
脑胶质瘤的外科手术近代观点
吴劲松1,2周良辅1,2△
(1复旦大学神经外科研究所 上海 200040;2复旦大学附属华山医院神经外科脑胶质瘤中心 上海 200040)
当今,脑胶质瘤手术的首要目标是:争取最大程度和安全切除,减少肿瘤细胞负荷,保障患者生活质量,为术后放疗、化疗(靶向治疗)以及免疫治疗等个体化综合治疗创造最优条件。综合运用神经导航、iMRI术中实时影像导航、多模态影像导航、术中荧光显像技术、唤醒麻醉以及术中电生理监测等新技术,实现多模态脑功能精确定位和保护及脑肿瘤定量切除,不仅可达到脑胶质瘤手术的目标,而且有助我国脑计划研究的实现。
脑胶质瘤; 手术; 神经导航; 功能磁共振成像; 脑功能定位
历史回顾和人体其他部位肿瘤相似,脑胶质瘤的手术理念也几经起伏,并由争论到一致。50年前,神经外科先驱Dandy就曾经尝试扩大切除范围,以求根治。但最后发现即使切除长瘤一侧的大脑半球,依然不能阻止恶性脑胶质瘤最终复发,并致死。基于降低致残风险考虑,胶质瘤手术曾一度保守。特别是脑胶质母细胞瘤(glioblastoma,GBM)。GBM约占脑胶质瘤的40%,术后辅助放化疗5年存活率仅为5.5%,而中位生存时间(overall survival,OS)约14个月[1-3]。因此,20世纪80、90年代的主流观点认为“切多切少一个样”,活检明确病理诊断成为手术主要目标。
21世纪以来,越来越多的循证医学研究证实:虽然脑胶质瘤患者的OS受多因素影响,但肿瘤切除程度(extent of resection,EOR)是主要原因之一。例如,GBM对于手术全切的中位OS是15.5个月,次全切除及未行手术的中位OS则分别为11.7 和5.9个月[4]。争取达到脑胶质瘤影像学全切除,不仅利于其他综合治疗,如放疗、化疗或免疫治疗,还可有效延长肿瘤复发时间、患者生存期和患者术后生存质量[5-12]。目前一般认为要达到显著生存获益的EOR阈值,GBM为78%~98%[10,13],低级别胶质瘤为75%~90%[14-15]。
外科手术在胶质瘤个体化综合治疗中的作用基于EOR对于提升胶质瘤疗效的重要性[16],美国、欧盟以及中国的中枢神经系统肿瘤治疗指南均推荐[17-20],对于低级别胶质瘤或高级别胶质瘤,治疗的首要步骤都是采取手术实现基于影像学的最大程度安全切除肿瘤(maximal safe resection)[21]。由于胶质瘤组织病理学浸润范围要超出MRI所显示的边界,因此最近提出真正意义上的肿瘤全切应该定义为超越MRI显示的肿瘤边界的切除,逼近皮质以及皮质下的功能边界[22-24]。通过切除超过传统RANO标准所建议的T1W增强或T2W FLAIR所显示的“真实”肿瘤范围[25-27],延缓高级别胶质瘤复发时间和低级别胶质瘤恶变时间。当今胶质瘤手术的首要目标是:应用各种技术,争取最大程度和安全切除,减少肿瘤细胞负荷,保障患者生活质量,为术后放疗、化疗(靶向治疗)以及免疫治疗等个体化综合治疗创造最优条件[28]。
手术辅助新技术
神经导航 1997年我国第一台神经导航系统被引进华山脑胶质瘤中心(以下简称“中心”)。神经导航的临床应用使脑胶质瘤手术定位精度由原来的厘米级别提高到毫米级别,更趋于精准。近10年,国产神经导航设备自主研发也已取得突破,例如复旦大学数字医学研究中心研发的复旦数字医疗Excelim-04TM手术导航系统于2006年获国家批准上市[29]。目前,国内各级神经外科中心导航设备装机量已超300台。仅本中心累计神经导航手术已逾万例(图1)。

图1 华山医院12 449例多模态影像导航手术统计(1997—2016年)Fig 1 The 12 449 cases of multimodal image-guided surgery in Huashan hospital (1997-2016)
术中实时影像导航 精度是神经导航的核心问题。神经导航的精度受空间立体定位精度、术前配准精度和术中脑组织变形三方面影响。一般空间立体定位精度在0.35 mm左右,术前配准精度小于2 mm,而脑组织变形(脑移位)对导航精度的影响是前两个因素的4~5倍。对于应用术前影像的神经导航下胶质瘤开颅手术,脑移位可导致肿瘤残留或术后严重神经功能障碍。因此,解决脑移位误差是神经导航技术发展的瓶颈。术中实时影像是监测及纠正脑移位误差的最有效解决方案。早期临床采用的术中影像技术是(B型)超声和CT。前者简便价廉,易于普及,但对颅脑解剖结构分辨力不高。后者虽然弥补了这一缺陷,但对患者和医生有放射性损伤。磁共振不仅分辨力明显优于CT和超声,而且无放射性,可多模态成像(解剖、功能和代谢)。自20世纪90年代开始,MRI软硬件技术迅猛发展,使MRI从诊断室进入手术室,从固定磁体向可移动磁体,从永磁体到超导磁体,从低场强向高场强,从单一结构成像向多模态成像发展。高场强术中MRI(intraoperative MRI,iMRI)以其近实时,时空分辨力高、可脑功能与代谢成像等技术优势,尤其适用于胶质瘤手术,体现了精准外科的临床应用[30]。因此,iMRI是脑胶质瘤手术辅助新技术中的一大突破[31]。
2010年,“中心”引进并建成了国内首个集成3.0 T超高场强iMRI的数字一体化神经外科手术室。截止2016年底,“中心”已实施iMRI实时影像导航手术近2 000例(图2)。“中心”还在国际上率先开展“3.0T iMRI在脑胶质瘤手术中的应用:前瞻性、随机、三盲对照临床试验”(NCT01479686)。该研究于2013年10月在全美神经外科医师协会(CNS)年会上获得年度神经肿瘤奖(Journal of Neuro-Oncology Award)[32]。研究中期报告显示:iMRI组全切率明显高于对照组(86%vs.45%,Plt;0.000 1);对于功能区高级别胶质瘤,iMRI组的无进展生存期(progression-free survival,PFS)(未达中位数vs.13.2个月,P=0.012)及总体OS(未达中位数vs. 21.5个月,P=0.003)均明显优于对照组[33]。该研究结果证实了3.0T iMRI引导下最大程度安全切除胶质瘤的临床有效性。
在临床常规应用的基础上,“中心”还在国际上率先实现了3.0T iMRI环境下的唤醒开颅联合术中脑功能定位技术在功能区胶质瘤手术中的应用[34-35],实现了iMRI多模态实时影像引导下的脑内病灶穿刺活检手术[36],术中实时脑功能和代谢成像等临床技术创新[37-38]。
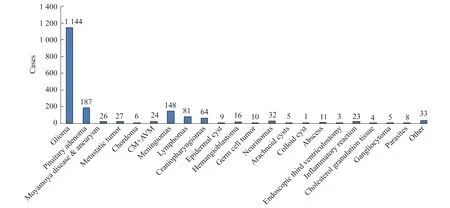
图21867例iMRI手术病例统计(2011—2016年)
Fig2Diseasedistributionof1867iMRI-guidedsurgeries(2011-2016)
多模态影像导航 多模态影像导航是借助计算机图像处理技术,把颅脑结构影像、肿瘤代谢影像以及脑功能影像等融合,三维重建个体化数字头模,用于术前计划和术中引导。例如,任务态BOLD(blood oxygen level dependent)和静息态BOLD。前者在患者完成一定指令下进行MRI扫描成像,后者则不依赖于患者的主动配合,进行MRI扫描成像。两者均可以显示功能皮质及其网络,临床应用前景广阔。另外,一种神经传导束显像技术——弥散张量成像术(diffusion tensor imaging,DTI)[39],它是依据脑白质纤维内水分子弥散运动的各向异性成像,可以实现皮质下神经功能传导通路(例如,锥体束、视辐射、听辐射、语言通路等白质纤维束)的3D示踪成像(tractography),显示它们的形态、结构和投射方向[30,40]。
BOLD和DTI可以分别显示多种功能皮质和皮质下神经传导通路,借助多模态影像融合技术,可以直观地引导术中脑功能定位与保护,但其真实性和可靠性还需要得到临床验证。“中心”开展了一系列临床试验研究,证实BOLD用于运动皮质定位,其AUC值分别为0.82(任务态)和0.89(静息态),临床适用。而BOLD用于语言皮质定位,其AUC值分别为0.61(任务态)和0.69(静息态),临床可以参考[41]。
“中心”开展了术中直接皮质下电刺激,因此金标准技术验证运动通路及其重建有效性的试验研究,测量DTI运动通路的手术安全距离为8.0~8.6 mm。中心还在国际上率先完成DTI功能影像导航应用于脑运动区胶质瘤手术的临床试验研究(n=238)。结果以Ⅰ级循证医学证据证实:(1) 运用新技术可以使功能区脑胶质瘤的手术全切率由51.7%提高至72.0%(Plt;0.001);(2)术后近期致残率由32.8%降低至15.3%(Plt;0.001);(3)研究还证实功能神经导航具有独立生存优势(P=0.048),可以使功能区高级别脑胶质瘤(WHO Ⅲ-Ⅳ级)患者的术后死亡风险降低43.0%[42-43]。
与结构影像相比,磁共振波谱(magnetic resonance spectroscopy,MRS)能提供更接近组织病理学属性的肿瘤代谢信息。以MRS引导手术将显著提高脑肿瘤立体定向穿刺活检的成功率,并有助于精准切除肿瘤至生物学边界。“中心”通过:(1)将3D MRS与脑结构影像融合;(2)根据Cho/NAA指数(CNI)绘制肿瘤代谢轮廓图;(3)对CNI肿瘤体积进行定量分析并指导精准手术,提出基于3D MRS代谢影像的脑肿瘤精准手术新策略,实现按照代谢边界切除肿瘤,延长患者OS[44]。
术中神经电生理监测(intraoperative neurophysiological monitoring,IONM) 通常,术前麻醉医生、电生理医生和术者共同讨论,根据手术计划,针对术中易损功能皮质或皮质下神经通路,选择麻醉方法、监测模式和监测参数。常用的监测模式包括:体感诱发电位(感觉通路监测)、运动诱发电位(运动通路监测)、直接皮质电刺激(运动和语言皮质定位)和直接皮质下电刺激(运动和语言通路定位)。对于优势半球和功能区手术,采用唤醒麻醉,有利于术中脑功能定位。
依据术中是否应用IONM分组,并匹配年龄、性别、肿瘤级别、IDH、MIB-1及术前KPS评分,我们把856例原发脑胶质瘤分为两组。IONM组(439例)与non-IONM组(417例)在前述信息匹配上无显著差异。但IONM组中肿瘤位于主侧半球和功能区的比例高于non-IONM组。IONM组术后住院天数(P=0.044)、术后远期语言障碍(5.3%vs. 9.3%,P=0.034)、运动障碍(8.4%vs. 13.0%,P=0.045)及总体神经功能障碍率(12.4%vs. 18.9%,P=0.014)均显著低于non-IONM组,显示IONM可以降低术后神经功能障碍率。但是,IONM如何改善功能区胶质瘤手术EOR? IONM是否患者OS的独立保护因素?这些临床问题的解答仍需要基于大样本队列的长期随访证据。
术中荧光显像技术 近十几年来出现并迅速发展的术中荧光显像是一种可以用来实现肿瘤细胞浸润组织边缘可视化的新技术,具有应用简便、灵敏度和特异度较高等优点。根据荧光剂的分类,主要有5-氨基乙酰丙酸(5-ALA)、荧光素钠(sodium fluorescein)、纳米荧光探针(nanoparticles)、吲哚氰绿(ICG)、内源性荧光物质(endoginous fluorophonres)、5-氨基荧光人血白蛋白(AFLHSA)等。目前成熟应用于临床的主要有5-ALA和荧光素钠。
5-氨基乙酰丙酸(5-aminolevulinic acid,5-ALA) 5-ALA是一种常存在于多种生物体中的生物物质,在细胞内被转化为原卟啉Ⅸ,它是血色素合成的前体。在波长为410 nm的蓝光激发下,原卟啉Ⅸ发射出红色荧光。在恶性肿瘤细胞中,产生原卟啉Ⅸ的酶的活性要强于正常细胞,而催化原卟啉Ⅸ转化成血色素的酶的活性要低于正常细胞,因此肿瘤细胞中累积了大量的原卟啉Ⅸ,成为肿瘤细胞的代谢标记物。德国Stummer团队完成了恶性脑胶质瘤(WHO Ⅲ和Ⅳ级)的5-ALA荧光引导手术的Ⅲ期临床试验[45],证实5-ALA术中荧光显像技术可以提高恶性胶质瘤全切除率(试验组和对照组,63.6%vs.37.6%,Plt;0.000 1)和6个月PFS(试验组和对照组,20.5%vs.11.0%,Plt;0.015 2)。欧洲和韩国分别于2007年9月和2011年1月批准5-ALA用于成年患者恶性胶质瘤手术。不过,值得注意的是Stummer团队的该项临床研究没有证实5-ALA技术使患者的OS获益(试验组和对照组,14.3个月vs.13.6个月,P=0.9170)。
手术病例需要在麻醉诱导前3 h口服5-ALA。手术显微镜下,经蓝光激发后肿瘤细胞会发出肉眼可分辨的红色荧光,而肿瘤周边正常脑组织则不显色,因此可清楚显示肿瘤细胞浸润边界。这种荧光效应可持续数小时之久,为手术操作提供了足够的时间。5-ALA固有的特性使得术中不仅可以标识荧光显微镜下呈深红色的实体胶质瘤组织(强荧光),也可以辨识出周围组织的胶质瘤细胞浸润带(淡粉色弱荧光)。5-ALA国际上已广泛应用,但目前国内尚无国家药监局批准的5-ALA药物上市。上海复旦张江生物医药股份有限公司计划2017年底发起“口服盐酸氨酮戊酸冻干粉”化药3类仿制药注册申请。5-ALA价格较昂贵,临床应用还存在患者皮肤光过敏风险,需要术后避光一段时间。
荧光素钠(fluorescein sodium,FLS) FLS是一种化合物染料,具有荧光特性,呈现出黄绿色的荧光。FLS应用安全、性质稳定,在临床主要用于眼科诊断和术中血管造影的荧光造影剂。患者手术麻醉诱导前静脉注射FLS (1~5 mg/kg)。由于血脑屏障的存在,荧光素钠不会进入正常脑组织。在高级别胶质瘤组织,由于血管内皮细胞的紧密连接超微结构被破坏,血脑屏障失去了原有的功能,通透性增强,导致FLS透过血脑屏障进入肿瘤组织内部蓄积。在荧光激发装置显微镜下,激发波长为460~500 nm蓝光,吸收波长为540~690 nm黄光,呈现黄绿色荧光。FLS荧光显像可持续数小时,而周围正常脑组织无荧光显示,很容易被观察到与术前MRI增强区域相吻合的肿瘤边界(非肿瘤浸润带)。FLS目前市场上有售,价格低廉,不良反应小。理论上FLS荧光染色区域对应于组织内血脑屏障破坏区域,而非肿瘤细胞本身,因此FLS荧光显像的特异性较5-ALA差。FLS也不能用低级别胶质瘤。目前还没有FLS荧光引导手术的Ⅲ期临床试验报告,因此其临床价值尚存在争议。
唤醒麻醉与术中脑功能定位 术中脑功能定位成为了脑功能区胶质瘤手术的最优策略。在不同的术中脑功能定位方法中,在唤醒状态下直接皮质与皮质下脑功能定位要比全麻下脑功能定位有多方面的优势:(1)可以测试更多的神经功能,例如语言、感觉、视觉和空间意识,这些脑功能定位需要在唤醒状态下进行;(2)唤醒状态下的刺激电流强度比全麻下低,可以降低术中癫的危险性并提高精确度;(3)运动功能定位时,除了上述效益,唤醒下还可以测试自主运动能力(例如,辅助运动区域和顶叶区域的阴性运动区域);(4)唤醒下脑功能定位可以使手术医生持续监测患者的高级认知功能,例如:注意力、判断力、计算力与精神状态。
1965年11月,华山医院陈公白、唐镇生和江澄川3位医生共同完成了历史上首例在针刺麻醉下的开颅手术,该手术更是中国神经外科史上第一例清醒手术[46]。使用针刺麻醉时,患者在手术全程保持清醒,靠少量镇静药物辅助。然而,针刺麻醉的诱导期与效应期时间较长,并且镇痛效果并不稳定,警觉镇静评分OAA/S(1=完全镇定;5=不镇定)无法得到平稳控制,患者时常在术中感到疼痛与不适,从而导致无法配合完成术中任务。因此,针刺麻醉逐渐淡出了历史舞台。
50多年后的今天,现代唤醒麻醉的方式已与往日的针刺麻醉大相径庭。首先,从机制上说,针刺麻醉达到镇痛和镇定的方式是通过针刺穴位,增加脑内啡肽与强啡肽的分泌;而现代唤醒麻醉则直接吸入或注入镇静及镇痛药物。相比于针刺麻醉,唤醒麻醉的患者并非在手术全程保持完全清醒,而是采用“镇静-唤醒-镇静”的方式。在切开头皮及开颅时OAA/S可以控制在2~3(中度镇静),使用喉罩或鼻咽通气道保持呼吸道畅通。术中脑功能定位前唤醒患者,此时患者OAA/S为4,使其能平稳并较高效地配合完成术中任务指令。在切除肿瘤以及关颅时,可以再次加深镇静程度,以免患者在伤口缝合时感受到疼痛或不适。
自2011到2016年,本团队共完成239例唤醒麻醉合并术中脑功能定位的胶质瘤手术。患者平均年龄为40岁(14~76岁),其中148名男性,91名女性。149例是低级别胶质瘤,90例是高级别胶质瘤。术后肿瘤平均切除率是91.0%,其中130例(56.3%)患者达到肿瘤全切,术中癫发生率为4.1%。在术中语言定位的183例患者,126例(68.9%)获得语言功能阳性刺激位点,51例(27.9%)出现短期语言功能减退,6例(3.3%)出现长期语言功能障碍。在术中运动定位的114例患者中,94例(82.5%)获得了运动功能阳性刺激位点,29例(25.4%)在短期出现运动功能减退,10例(8.8%)出现长期运动功能障碍。与国际同行报道的数据相比,术中并发症(术中癫)和术后的神经功能障碍的发生率均达到领先水平。
唤醒麻醉合并术中脑功能定位有助于实现功能区脑胶质瘤的最大程度安全切除。例如,本组资料的Kaplan-Meier生存分析发现,术后的运动功能状态显著影响患者生存时间(Log-rank test,P=0.029)。术后运动功能障碍是一个独立死亡风险因素,与术后远期运动功能稳定的患者相比,术后运动功能障碍患者的死亡风险显著提升近5倍(HR 4.926,95%CI为1.154~21.029,P=0.031)。该研究揭示运动功能区胶质瘤手术能保护患者运动功能并得到明显生存获益。
术中多模态脑功能定位技术规范的建立华山脑胶质瘤中心综合运用神经导航、iMRI术中实时影像导航、多模态影像导航、唤醒麻醉以及术中电生理监测等新技术,实现多模态脑功能精确定位、实时保护与脑肿瘤定量切除,使得功能区脑胶质瘤的临床预后达到与非功能区相当水平。为了便于新技术在国内应用推广,借助“十二五”科技支撑计划项目资助,“中心”建立了术中多模态脑功能定位技术标准与个体化手术规范(图3)。
脑胶质瘤手术的亚专科化能否改善患者预后?借助上述各项手术辅助新技术,脑胶质瘤手术日趋亚专科化。目前并无关于手术医生影响胶质瘤患者预后的报道。但有报道大手术体量医生的患者预后更优[47-48]。英国的一项关于颅内肿瘤的研究表明,大手术体量的神经肿瘤外科医生能够显著降低患者的术后30天死亡率[47,49]。而美国的研究发现,大手术体量的神经肿瘤外科医生能够显著降低患者的术后并发症,并能改善其预后[48]。正是基于此类研究,欧洲神经肿瘤协会(European Association for Neuro-oncology,EANO)建议脑胶质瘤患者应该接受大手术体量的神经肿瘤外科医生的手术治疗[8]。
手术切除对于胶质瘤是首要的治疗手段。然而,手术医生作为独立预后因素之一,至今对其仍无准确的评价系统。因此,我们团队利用年手术量、神经导航(结构及功能导航)、术中电生理、监测唤醒麻醉以及术中磁共振的应用等6项指标,建立对复旦大学附属华山医院神经外科医生的综合评分系统,6项指标各1分,最高6分,最低0分。总分大于等于4分被定义为神经肿瘤外科医生(neuro-oncological surgeons,NOS),而小于4分的为普通神经外科医生(general neurosurgeons,GNS)。

图3多模态脑功能定位在脑胶质瘤个体化手术中的技术规范
Fig3Thestandardblueprintofmultimodalbrainmappinginindividualizedgliomasurgery
基于此分组,我们采用华山医院神经外科胶质瘤库中的750例在我院手术且术后接受放化疗胶质母细胞瘤患者(NOS 组463例,GNS组287例)的相关临床及随访信息,研究手术医生对胶质母细胞瘤患者预后的影响。两组患者在年龄分布、性别组成、肿瘤部位及数目、手术次数、术后放化疗以及IDH1突变、MGMT启动子区甲基化等均未见明显差异(Pgt;0.05)。结果发现,复旦大学附属华山医院的胶质母细胞瘤患者总体中位OS及PFS分别为17.97个月和11.83个月。而NOS组的中位OS(GNS 和NOS,16.53个月vs. 20.30个月; HR 1.357,95% CI为1.042~1.687,P=0.023)及PFS(GNS和NOS,9.70个月vs. 13.07个月; HR 1.419,95% CI为1.103~1.825,P=0.006)皆明显优于GNS组。综上所述,我们认为手术医生是决定胶质母细胞瘤预后的独立影响因素。为提升胶质母细胞瘤预后,该类患者的手术切除治疗应该由神经肿瘤外科医生完成,其中最重要的承载就是前面所述的多模态手术辅助新技术的熟练运用。
脑重大疾病诊治技术的研发——“中国脑计划”的重要一翼随着世界各大国家纷纷步入老龄化社会,我国疾病谱逐渐由传统感染性疾病转移到各类非传染慢性病,脑卒中、脑肿瘤、阿尔茨海默病、帕金森病、精神分裂症等脑疾患在现代社会人类疾病中所占的比例已越来越高。在我国脑计划中,脑重大疾病诊治技术的研发是“两翼”之一[50],其目的在于战胜脑疾病,促进健康,减轻脑疾病所造成的巨大的社会经济负担。
神经外科作为诊治脑疾病的最前沿阵地,同时也赋予了神经外科医生近距离研究人脑的特权。通过脑手术,神经外科医生可以打开大脑并直接与人脑“对话”,获得对脑疾病诊治及人脑功能机制的第一手资料。譬如目前对脑功能测绘的无创手段,如功能磁共振、脑电图、脑磁图等,都只能间接反映人脑功能变化。而神经外科可以采用唤醒开颅,术中对皮层及皮层下进行直接电刺激,精准定位人脑功能,对其他技术手段的检测结果进行验证。同时还可以直接获得特定脑区的电活动信号,并加以干预。又譬如药物治疗无效的难治性癫,通过术中皮层脑电可精确定位癫灶并行手术切除,治愈癫。另外还有多种神经调控技术,如深部脑刺激(脑起搏器)、经颅磁刺激,目前已用于对帕金森病及抑郁症的治疗,也取得了较好的临床疗效。故此,神经外科手术及相关诊疗技术在我国脑计划中不仅承担着评判脑疾病诊治技术疗效的试金石,同时也是实现脑计划目标中保护脑、防治脑疾病的桥头堡。
我国脑计划以脑认知原理研究为主体,目标是认识脑[51]。其实,神经外科相关的脑疾病本身也是探索脑的构造和机制的窗口。早在1861年,法国外科医生Broca就通过对卒中患者大脑解剖,发现了负责人类运动语言功能的大脑区域。现代神经科学研究发现,人脑结构和功能不是简单的一一对应关系。相反结构和功能呈网络化,这是构成脑代偿和功能重塑的物质基础。通过前述各类先进技术手段,观察脑疾病对人脑结构的破坏及高级认知功能的损伤,以及损伤后脑结构功能的重组重塑现象,我们可以据此阐明相应脑功能的神经环路构筑及其运行原理。
显而易见,神经外科在实现我国脑计划中“认识脑、保护脑”这两大目标中扮演着不可替代的重要角色。神经外科医生应与有关学科密切合作,发挥各自优势和特长,在诊治和攻克脑疾病同时,为“中国脑计划”作出应有的贡献。
[1] STUPP R,MASON WP,VAN DEN BENT MJ,etal.Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma[J].NEnglJMed,2005,352(10):987-996.
[2] OSTROM QT,GITTLEMAN H,XU J,etal.CBTRUS statistical report:primary brain and other central nervous system tumors diagnosed in the United States in 2009-2013[J].NeuroOncol,2016,18(Suppl 5):v1-v75.
[3] PERRY JR,LAPERRIERE N,O'CALLAGHAN CJ,etal. Short-course radiation plus temozolomide in elderly patients with glioblastoma[J].NEnglJMed,2017,376(11):1027-1037.
[4] IORGULESCU B.OS04.3 Extent of resection and overall survival in risk adjusted and exact matched analyses of 22,928 glioblastoma (all molecular subtypes) patients[J].NeuroOncol,2017,19(Suppl 3):iii7.
[5] WIRTZ CR,KNAUTH M,STAUBERT A,etal.Clinical evaluation and follow-up results for intraoperative magnetic resonance imaging in neurosurgery[J].Neurosurgery,2000,46(5):1112-1120.
[6] VIVES KP,PIEPMEIER JM.Complications and expected outcome of glioma surgery[J].JNeurooncol,1999,42(3):289-302.
[7] HENTSCHEL SJ,SAWAYA R.Optimizing outcomes with maximal surgical resection of malignant gliomas[J].CancerControl,2003,10(2):109-114.
[8] WHITTLE IR.Surgery for gliomas[J].CurrOpinNeurol,2002,15(6):663-669.
[9] LAWS ER,PARNEY IF,HUANG W,etal.Survival following surgery and prognostic factors for recently diagnosed malignant glioma:data from the Glioma Outcomes Project[J].JNeurosurg,2003,99(3):467-473.
[10] LACROIX M,ABI-SAID D,FOURNEY DR,etal.A multivariate analysis of 416 patients with glioblastoma multiforme:prognosis,extent of resection,and survival[J].JNeurosurg,2001,95(2):190-198.
[11] BUCCI MK,MAITY A,JANSS AJ,etal.Near complete surgical resection predicts a favorable outcome in pediatric patients with nonbrainstem,malignant gliomas:results from a single center in the magnetic resonance imaging era[J].Cancer,2004,101(4):817-824.
[12] AMMIRATI M,VICK N,LIAO YL,etal. Effect of the extent of surgical resection on survival and quality of life in patients with supratentorial glioblastomas and anaplastic astrocytomas[J].Neurosurgery,1987,21(2):201-206.
[13] SANAI N,POLLEY MY,MC DERMOTT MW,etal. An extent of resection threshold for newly diagnosed glioblastomas[J].JNeurosurg,2011,115(1):3-8.
[14] SMITH JS,CHANG EF,LAMBORN KR,etal.Role of extent of resection in the long-term outcome of low-grade hemispheric gliomas[J].JClinOncol,2008,26(8):1338-1345.
[15] SANAI N,POLLEY MY,BERGER MS.Insular glioma resection:assessment of patient morbidity,survival,and tumor progression[J].JNeurosurg,2010,112(1):1-9.
[16] CHANG EF,CLARK A,SMITH JS,etal. Functional mapping-guided resection of low-grade gliomas in eloquent areas of the brain:improvement of long-term survival.Clinical article[J].JNeurosurg,2011,114(3):566-573.
[17] BREM SS,BIERMAN PJ,BLACK PM.NCCN clinical practice guidelines in oncology-v.1.2009:central nervous system cancers[R/OL].(2009-04-27) [2017-09-22]. https://www.nccn.org/professionals/physician_gls/f_guidelines.asp.
[18] WELLER M,VAN DEN BENT M,TONN JC,etal.European Association for Neuro-Oncology (EANO) guideline on the diagnosis and treatment of adult astrocytic and oligodendroglial gliomas[J].LancetOncol,2017,18(6):e315-e329.
[19] NABORS LB,PORTNOW J,AMMIRATI M,etal.Central nervous system cancers,version 2.2014.Featured updates to the NCCN Guidelines[J].JNatlComprCancNetw,2014,12(11):1517-1523.
[20] STUPP R,BRADA M,VAN DEN BENT MJ,etal.High-grade glioma:ESMO Clinical Practice Guidelines for diagnosis,treatment and follow-up[J].AnnOncol, 2014,25 (Suppl 3):iii93-iii101.
[21] SANAI N,BERGER MS.Glioma extent of resection and its impact on patient outcome[J].Neurosurgery,2008,62(4):753-764.
[22] DE BENEDICTIS A,MORITZ-GASSER S,DUFFAU H.Awake mapping optimizes the extent of resection for low-grade gliomas in eloquent areas[J].Neurosurgery,2010,66(6):1074-10844.
[23] DUFFAU H,MANDONNET E.The “onco-functional balance” in surgery for diffuse low-grade glioma:integrating the extent of resection with quality of life[J].ActaNeurochir(Wien),2013,155(6):951-957.
[24] SANAI N,BERGER MS.Intraoperative stimulation techniques for functional pathway preservation and glioma resection[J].NeurosurgFocus,2010,28(2):E1.
[25] VAN DEN BENT MJ,WEFEL JS,SCHIFF D,etal.Response assessment in neuro-oncology (a report of the RANO group):assessment of outcome in trials of diffuse low-grade gliomas[J].LancetOncol, 2011,12(6):583-593.
[26] VOGELBAUM MA,JOST S,AGHI MK,etal. Application of novel response/progression measures for surgically delivered therapies for gliomas:Response Assessment in Neuro-Oncology (RANO) Working Group[J].Neurosurgery,2012,70(1):234-243.
[27] EISELE SC,WEN PY,LEE EQ.Assessment of brain tumor response:RANO and its offspring[J].CurrTreatOptionsOncol,2016,17(7):35.
[28] 《中国中枢神经系统胶质瘤诊断和治疗指南》编写组.中国中枢神经系统胶质瘤诊断与治疗指南(2015)[J].中华医学杂志,2016,96(7):485-509.
[29] 金毅,吴劲松,陈衔城,等.基于体模的Excelim-04TM神经导航系统实验研究[J].复旦学报(医学版),2007,34(5):741-743.
[30] 周良辅,吴劲松.神经导航外科的现状和未来[M]//中国工程院.中国科学技术前沿.第12卷.北京:高等教育出版社,2010:387-420.
[31] 周良辅.现代神经外科学[M].2版.上海:复旦大学出版社,2015:1369-1389.
[32] WU JS,GONG X,SONG YY,etal.3.0-T intraoperative magnetic resonance imaging-guided resection in cerebral glioma surgery:interim analysis of a prospective,randomized,triple-blind,parallel-controlled trial[J].Neurosurgery,2014,61(Suppl 1):145-154.
[33] GONG X,YAO CJ,YUAN SW,etal. 3.0T iMRI-guided resection of eloquent high-grade gliomas:preliminary results of a randomised controlled trial[J].Lancet,2015,386(Suppl 1):S11.
[34] LU JF,ZHANG H,WU JS,etal.“Awake” intraoperative functional MRI (ai-fMRI) for mapping the eloquent cortex:Is it possible in awake craniotomy? [J].NeuroimageClin,2012,2:132-142.
[35] GHINDA D,ZHANG N,LU J,etal.Contribution of combined intraoperative electrophysiological investigation with 3-T intraoperative MRI for awake cerebral glioma surgery:comprehensive review of the clinical implications and radiological outcomes[J].NeurosurgFocus,2016,40(3):E14.
[36] YAO C,LV S,CHEN H,etal.The clinical utility of multimodal MR image-guided needle biopsy in cerebral gliomas[J].IntJNeurosci,2016,126(1):53-61.
[37] GUO J,YAO C,CHEN H,etal. The relationship between Cho/NAA and glioma metabolism:implementation for margin delineation of cerebral gliomas[J].ActaNeurochir(Wien),2012;154(8):1361-1370.
[38] TANG C,GUO J,CHEN H,etal. Gene mutation profiling of primary glioblastoma through multiple tumor biopsy guided by 1H-magnetic resonance spectroscopy[J].IntJClinExpPathol,2015,8(5):5327-5335.
[39] PIERPAOLI C,JEZZARD P,BASSER PJ,etal. Diffusion tensor MR imaging of the human brain[J].Radiology,1996,201(3):637-648.
[40] 吴劲松.功能神经导航技术在运动区脑肿瘤手术中的应用[M]//周良辅.神经导航外科学.上海:上海科技教育出版社,2008.
[41] QIU TM,YAN CG,TANG WJ,etal.Localizing hand motor area using resting-state fMRI:validated with direct cortical stimulation[]J.ActaNeurochir(Wien),2014,156(12):2295-2302.
[42] WU JS,ZHOU LF,TANG WJ,etal.Clinical evaluation and follow-up outcome of diffusion tensor imaging-based functional neuronavigation:a prospective,controlled study in patients with gliomas involving pyramidal tracts[J].Neurosurgery,2007,61(5):935-948.
[43] MISSIOS S,BARNETT GH.Surgical navigation for brain tumors[M].//WINN HR.Youmans and Winn neurological surgery.Philadelphia:Elsevier,2016,132:973-980.
[44] ZHANG J,ZHUANG DX,YAO CJ,etal.Metabolic approach for tumor delineation in glioma surgery:3D MR spectroscopy image-guided resection[J].JNeurosurg,2016,124(6):1585-1593.
[45] STUMMER W,PICHLMEIER U,MEINEL T,etal.Fluorescence-guided surgery with 5-aminolevulinic acid for resection of malignant glioma:a randomised controlled multicentre phase III trial[J].LancetOncol,2006,7(5):392-401.
[46] JIN L,WU JS,CHEN GB,etal.Unforgettable ups and downs of acupuncture anesthesia in China[J].WorldNeurosurg, 2017,102:623-631.
[47] WILLIAMS M,TREASURE P,GREENBERG D,etal. Surgeon volume and 30 day mortality for brain tumours in England[J].BrJCancer, 2016,115(11):1379-1382.
[48] TRINH VT,DAVIES JM,BERGER MS.Surgery for primary supratentorial brain tumors in the United States,2000-2009:effect of provider and hospital caseload on complication rates[J].JNeurosurg,2015,122(2):280-296.
[49] WELLER M,VAN DEN BENT M,TONN JC,etal. European Association for Neuro-Oncology (EANO) guideline on the diagnosis and treatment of adult astrocytic and oligodendroglial gliomas[J].LancetOncol,2017,18(6):e315-e329.
[50] POO MM,DU JL,IP NY,etal. China brain project:basic neuroscience,brain diseases,and brain-inspired computing[J].Neuron,2016,92(3):591-596.
[51] 韩雪,阮梅花,王慧媛,等.神经科学和类脑人工智能发展:机遇与挑战[J].生命科学,2016,28(11):1295-1307.
Up-to-dateviewpointofcerebralgliomasurgery
WU Jin-song1,2, ZHOU Liang-fu1,2△
(1InstituteofNeurosurgery,FudanUniversity,Shanghai200040,China;2GliomaSurgeryDivision,
Today,the primary goal of cerebral glioma surgery is to achieve maximum safe resection.The cytoreductive surgery ensures the sensitivity to postoperative radiotherapy,chemotherapy (targeted therapy) and immunotherapy and other individualized adjuvant treatment,while limits sacrifice of the quality of life of patients.Comprehensive use of neuronavigation,iMRI intraoperative real-time image guidance,multimodal functional and metabolic image guidance,intraoperative fluorescence technology,awake craniotomy and intraoperative electrophysiological monitoring and other new technologies to achieve accurate positioning of multi-mode brain function,real-time protection and quantitative control of extent of tumor resection,are not only achieving the promising goal of cerebral glioma surgeries,but enhancing the realization of the China Brain Project.
cerebral glioma; surgery; neuronavigation; functional magnetic resonance imaging; brain mapping
R739.41
A
10.3969/j.issn.1672-8467.2017.06.007
“十二五”国家科技支撑计划(2014BAI04B05)
△Corresponding author E-mail:lfzhouc@126.com
DepartmentofNeurosurgery,HuashanHospital,FudanUniversity,Shanghai200040,China)
*Thisworkwassupportedbythe12thFive-yearNationalKeyTechnologyRamp;DProgramofChina(2014BAI04B05).
2017-09-25;编辑:张秀峰)

