栉孔扇贝酶解液制备条件优化及其抗氧化性研究
严超,牟建楼,陈志周,刘亚琼,赵欢,齐晓茹
(河北农业大学 食品科技学院,河北 保定 071000)
栉孔扇贝酶解液制备条件优化及其抗氧化性研究
严超,牟建楼*,陈志周,刘亚琼,赵欢,齐晓茹
(河北农业大学 食品科技学院,河北 保定 071000)
以栉孔扇贝为原料,以水解度和DPPH自由基清除率为指标,在单因素试验基础上,采用Box-Behnken方法,通过响应面试验优化酶解制备具有抗氧化性多肽的扇贝酶解液工艺,并对扇贝酶解液的DPPH自由基清除率、羟自由基清除率、总抗氧化活力和抗超氧阴离子活力进行测定。研究了蛋白酶种类、酶解时间、酶解温度、加酶量和固液比对栉孔扇贝酶解液抗氧化性的影响。结果表明:扇贝最佳酶解条件为选择中性蛋白酶、酶解时间4.7 h、酶解温度43 ℃、加酶量3.5%、固液比(m/V)1∶5。在此条件下,DPPH自由基清除率达到68.21%,羟自由基清除率为33.74%,总抗氧化活力为0.086 U/mg prot,抗超氧阴离子活力为106.27 U/g prot。
栉孔扇贝;酶解;水解度;抗氧化性
栉孔扇贝(Chlamysfarreri)隶属于软体动物门(Mollusca)、瓣鳃纲(Lamellibranchia)、翼形亚(Pterimorphia)、珍珠贝目(Pterioida)、扇贝科(Pectinidae)[1],是我国重要的海产贝类,其味道鲜美,受到广大消费者的喜爱。扇贝富含丰富的营养物质,不仅包括蛋白质、维生素、脂肪、微量元素等营养成分,还含有非常丰富的多不饱和脂肪酸及缩醛磷脂[2];扇贝多肽有很多生理功能,具有天然的抗肿瘤成分活性和天然的抗氧化性,能够阻挡紫外线的氧化损伤[3]。
扇贝通过酶解制备的酶解液中含有丰富的生物活性肽,生物活性肽具有免疫活性、抗氧化、抗高血脂、抗高血压、抑制肿瘤等功能[4,5]。肽类比同一氨基酸组成的蛋白质的消化吸收率要高,且风味优于单个氨基酸[6],同时多肽具有极易溶于水、粘度低、抗凝胶等特性,因此在食品和化妆品中有广泛应用[7],而且扇贝酶解液具有天然的海鲜风味,是理想的海鲜风味调味品的基料[8]。因水产品中含有丰富的蛋白质及其特殊的氨基酸组成,现在生物活性肽的制备方面具有广泛应用[9-12]。通过酶解制备的多肽酶解液具有抗氧化活性,制备的酶解液可以用于产品的抗氧化性质的加强,开拓了良好的食品、保健品市场。
本文以栉孔扇贝为原料,通过单因素试验和响应面分析法优化了制备具有抗氧化性扇贝酶解液的条件,并对其体外抗氧化性进行了研究。
1 材料与方法
1.1 材料与仪器
栉孔扇贝 河北农业大学科技市场,冷冻保存;蛋白酶 北京奥博星生物技术有限公司;甲醛(分析纯) 天津市福晨化学试剂有限公司;DPPH 梯希爱化成工业发展有限公司;总抗氧化能力(T-AOC)试剂盒、抗超氧阴离子试剂盒(A052) 南京建成生物工程研究所;谷胱甘肽 上海源叶生物技术有限公司。
HH-2电热恒温水浴锅 上海比朗仪器有限公司;79-2单、双向磁力加热搅拌器 金坛市杰瑞尔电器有限公司;Neofuge15R高速冷冻离心机 上海力申科学仪器有限公司;752紫外可见分光光度计 上海菁华科技仪器有限公司;AR423CN型电子天平 奥豪斯仪器(上海)有限公司;JJ-2组织匀浆机 金坛市亿通电子有限公司;PHS-3C智型pH 计 上海虹益仪器有限公司。
1.2 试验方法
1.2.1 扇贝预处理
将冷冻的扇贝解冻后,除杂,清洗,切成颗粒状,再放入组织匀浆机捣成肉糜状,放置冰箱冷冻备用。
1.2.2 扇贝酶解工艺流程
扇贝肉糜→加水匀浆→调节pH→加入蛋白酶→保温酶解→100 ℃灭酶→4500 r/min离心15 min→取上清液→扇贝酶解液。
1.2.3 蛋白酶的选择
其中温度和pH均为推荐值,加酶量1%,酶解时间5 h,固液比1∶5,对扇贝进行酶解。分别测定各种酶解液水解度和DPPH自由基清除率。试验重复3次,确定适宜的蛋白酶。各种蛋白酶最适的酶解条件见表1。
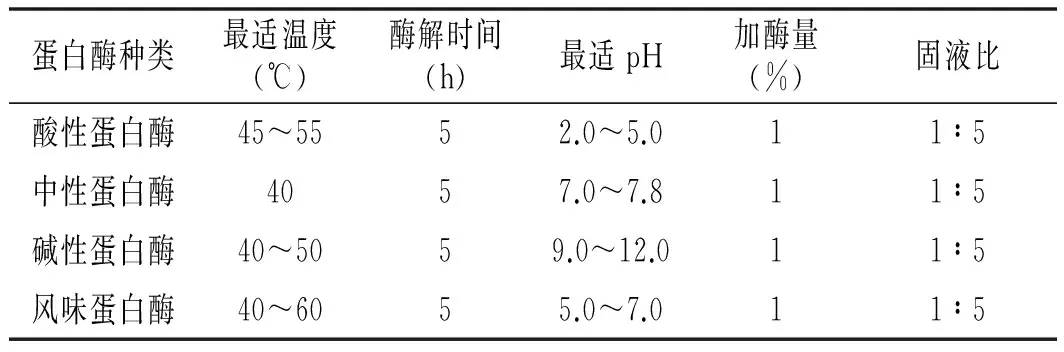
表1 不同蛋白酶的酶解条件Table 1 The enzymatic conditions of different proteases
1.2.4 扇贝酶解液单因素试验
1.2.4.1 酶解时间的确定
选取中性蛋白酶,在固液比1∶5,加酶量1%,酶解温度45 ℃的条件下,选取酶解时间分别为3.5,4,4.5,5.5,6 h。分别测定扇贝酶解液的水解度和DPPH自由基清除率,试验重复3次。
1.2.4.2 酶解温度的确定
选取中性蛋白酶,在固液比1∶5,加酶量1%,酶解时间4 h的条件下,选取酶解温度分别为30,35,40,45,50 ℃。分别测定扇贝酶解液的水解度和DPPH自由基清除率,试验重复3次。
1.2.4.3 加酶量的确定
选取中性蛋白酶,在固液比1∶5,酶解时间4 h,酶解温度45 ℃的条件下,选取加酶量分别为0.5%,1%,2%,3%,4%。分别测定扇贝酶解液的水解度和DPPH自由基清除率,试验重复3次。
1.2.4.4 固液比的确定
选取中性蛋白酶,在酶解时间4 h,酶解温度45 ℃,加酶量1%的条件下,选取固液比分别为1∶3,1∶4,1∶5,1∶6,1∶7。分别测定蛋白酶的水解度和DPPH自由基清除率,试验重复3次。
1.2.5 响应面试验设计
根据单因素试验结果,运用Box-Behnken设计原理采用三因素三水平的响应面分析法,以酶解时间(X1)、 酶解温度(X2)、加酶量(X3)为变量进行试验。因素水平设计见表2。
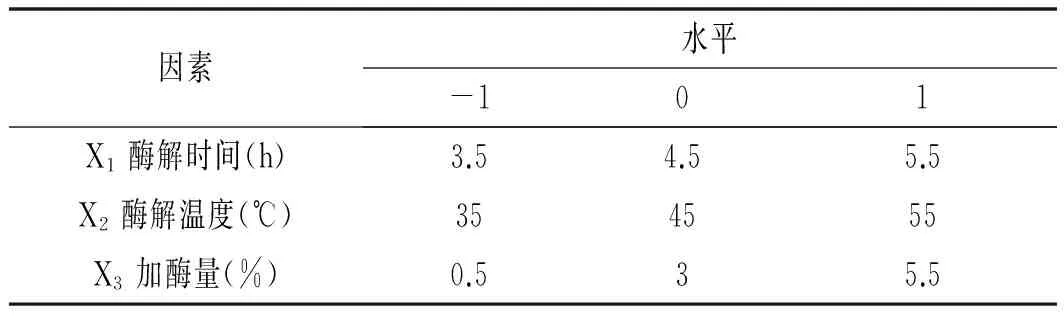
表2 响应面试验因素水平表Table 2 Factors and levels of response surface experiments
1.2.6 水解度的测定
总氮含量测定:采用GB 5009.5-2010中凯式定氮法;氨基酸态氮(AAN)含量测定:采用GB/T 5009.40-2003中甲醛值法;水解度(DH)计算公式[13]:
1.2.7 DPPH自由基清除率的测定
参照Bae Song Hwan和刘媛等[14,15]的方法,并稍做修改。向具塞试管中依次加入1 mL 0.2 mmol/L DPPH乙醇溶液,1 mL蒸馏水,1 mL待测液,振荡混匀,室温下避光反应20 min,在517 nm下测其吸光值As;空白组为1 mL无水乙醇代替DPPH乙醇溶液,测定吸光值Ax;对照组为1 mL蒸馏水代替样品,测定吸光值A0,并以等体积蒸馏水和无水乙醇混合液空白调零,DPPH自由基清除率(R)公式为:
1.2.8 羟自由基清除率的测定
参照田倩等[16]的方法,并稍做修改。向具塞试管中依次加入0.75 mmol/L邻二氮菲溶液1 mL,0.2 mol/L的磷酸盐缓冲溶液(pH 7.4)1 mL,待测样品溶液1 mL及0.75 mmol/L的硫酸亚铁溶液1 mL,混匀后加入体积分数为0.01%的H2O2溶液1 mL摇匀,37 ℃水浴1 h,在536 nm波长下测定吸光度(A样品);用去离子水代替样品溶液测定损伤管吸光度(A损伤);用去离子水代替样品溶液和H2O2测定未损伤管吸光度(A未损伤);参照组为等体积的样品溶液、磷酸盐缓冲溶液和去离子水,测定吸光度(A参);空白组为等体积的去离子水和磷酸盐缓冲溶液,测定其吸光度(A空)。羟自由基清除率的计算公式为:
1.2.9 总抗氧化能力的测定
总抗氧化能力的测定依据试剂盒说明书。以每分钟每毫克的组织蛋白,在37 ℃条件下使得反应体系的吸光度值每变大0.01时,作为1个总抗氧化能力单位,计算公式为:
1.2.10 超氧阴离子自由基清除率的测定
超氧阴离子自由基清除率的测定依据试剂盒说明书。每克组织蛋白在37 ℃条件下,反应40 min,所能抑制的超氧阴离子自由基相当于1 g的维生素C,所能抑制的该自由基的数量变化值,作为1个单位,计算公式为:
1.2.11 数据处理
2 结果与分析
2.1 最佳蛋白酶的选择
不同蛋白酶对扇贝酶解效果的影响见图1。
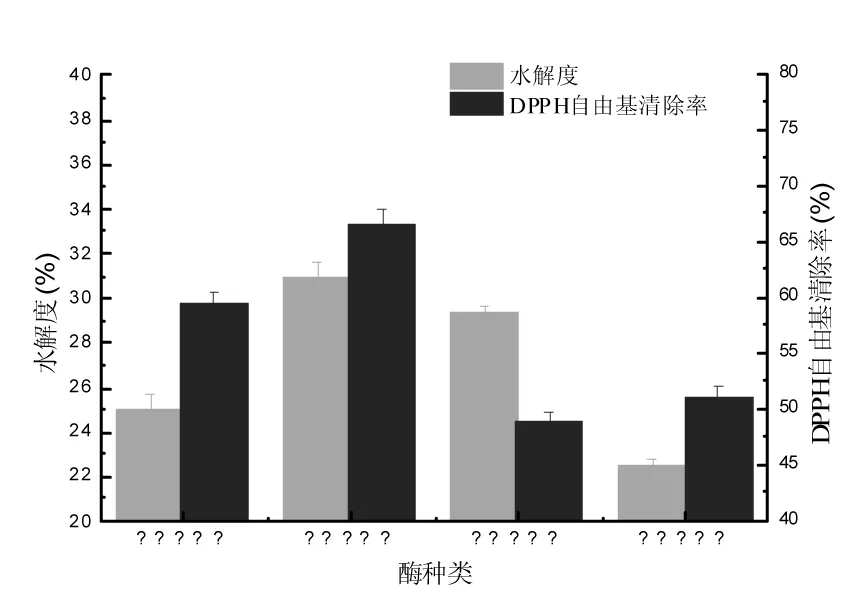
图1 不同蛋白酶对扇贝酶解效果的影响Fig.1 Effect of protease types on hydrolysis efficiency of scallop
由图1可知,不同蛋白酶对扇贝酶解液的效果不同,因为不同的蛋白酶水解蛋白质时,作用的位点不同,水解液的抗氧化活性就不同[17]。根据不同蛋白酶的最适作用条件对扇贝进行酶解,其中中性蛋白酶对扇贝作用的水解度和DPPH自由基清除率分别为(30.88±0.77)%和(66.42±1.41)%。经方差分析,水解度和DPPH自由基清除率都显著高于其他3种酶(p<0.05)。因此,选择中性蛋白酶为本试验水解酶。
2.2 单因素试验结果分析
2.2.1 酶解时间的确定
酶解时间对扇贝酶解液水解度和DPPH自由基清除率的影响见图2。
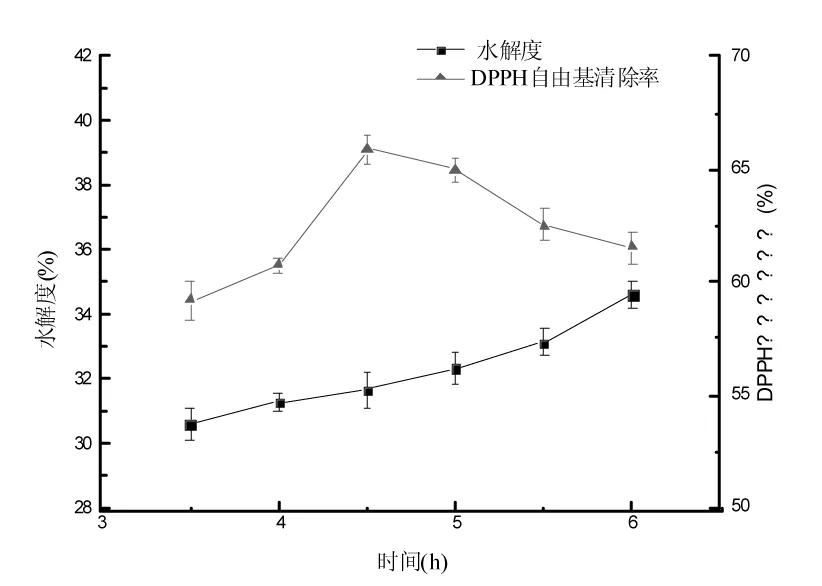
图2 酶解时间对扇贝酶解液水解度和DPPH自由基清除率的影响Fig.2 Effect of hydrolysis time on DH and DPPH clearance rate
由图2可知,随着水解时间的延长,水解度逐渐增大;DPPH自由基清除率先增大后逐渐降低,在酶解时间为4.5 h时,达到最大值(65.87±0.62)%。可能是因为底物浓度的减少或pH改变使酶活力逐渐降低,或水解产物的抑制作用等因素所致,且当酶解时间短时酶解反应不彻底,时间过长有可能出现过度水解,从而影响酶解液的抗氧化活性。经方差分析,不同酶解时间对扇贝酶解液DPPH自由基清除率的影响差异显著(p<0.05),综合考虑,选取适宜的酶解时间为4.5 h。
2.2.2 酶解温度的确定
酶解温度对扇贝酶解液水解度和DPPH自由基清除率的影响见图3。
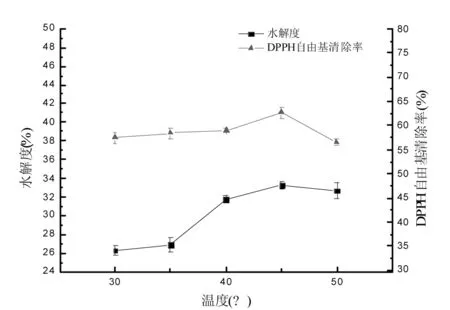
图3 酶解温度对扇贝酶解液水解度和DPPH自由基清除率的影响Fig.3 Effect of hydrolysis temperature on DH and DPPH clearance rate
由图3可知,随着酶解温度的增大,扇贝酶解液的水解度和DPPH自由基清除率都出现先升高后降低的趋势,且在45 ℃时,水解度和DPPH清除率都达到最高值,分别为(33.25±0.45)%和(52.64±1.06)%。这是因为在一定范围内温度升高,反应速度加快,酶解效率提高,当温度过高时,会使蛋白酶变性,酶解效率随之降低[18]。经方差分析,不同酶解温度对水解度和DPPH自由基清除率的影响差异均显著(p<0.05),故选择适宜的酶解温度为45 ℃。
2.2.3 加酶量的确定
加酶量对扇贝酶解液水解度和DPPH自由基清除率的影响见图4。
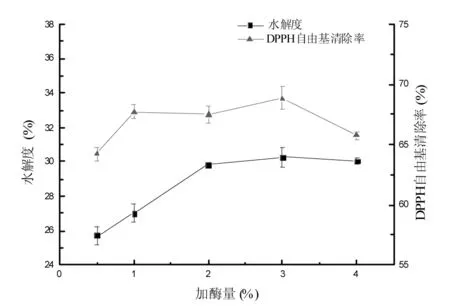
图4 加酶量对扇贝酶解液水解度和 DPPH自由基消除率的影响Fig.4 Effect of enzyme amount on DH and DPPH clearance rate
由图4可知,扇贝酶解液的水解度和DPPH自由基清除率随着加酶量的增加而缓慢升高,当加酶量为3%时,二者都达到最大值,分别为(30.28±0.56)%和(68.86±0.97)%。而随着加酶量继续增加,水解度和DPPH清除能力逐渐降低。这是因为随着加酶量的增加,与底物作用的活性基团增加,加速酶促反应;继续增加酶量,底物达到饱和或水解过度,使抗氧化活性降低[19]。经方差分析,加酶量为2%,3%,4%时,对水解度的影响差异不显著,但在加酶量3%时,DPPH自由基清除率显著高于其他处理(p<0.05),综合考虑选择适宜的加酶量为3%。
2.2.4 固液比的确定
固液比对扇贝酶解液水解度和DPPH自由基清除率的影响见图5。
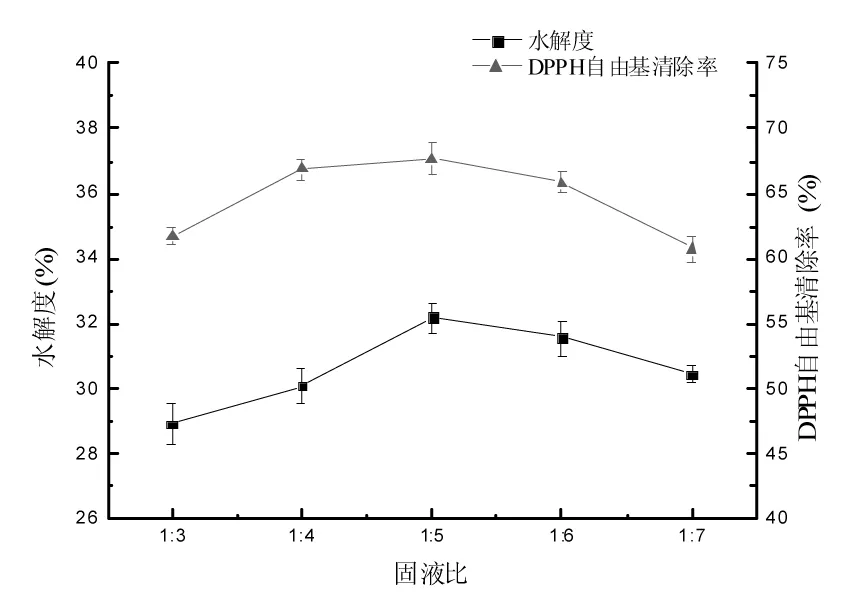
图5 固液比对扇贝酶解液水解度和 DPPH自由基清除率的影响Fig.5 Effect of the ratio of solid-liquid on DH and DPPH clearance rate
由图5可知,水解度和DPPH自由基清除率都随着液体比例的增加先增加后降低,在固液比为1∶5时达到最大值,分别为(32.17±0.46)%和(67.67±1.20)%。这是因为水解程度随底物浓度的增大而增大,但底物浓度太高时不利于酶与底物的充分接触,只有在合适的底物浓度时,蛋白酶才能充分发挥作用[20]。经方差分析,不同固液比对扇贝水解度的影响差异显著(p<0.05),且考虑到成本问题,选择适宜的固液比为1∶5。
2.3 响应面试验分析
在单因素试验的基础上,以酶解时间、酶解温度、加酶量为变量,DPPH自由基清除率为因变量,进行三因素三水平的响应面试验,结果见表3。
利用Design Expert 8.6软件对表3中的试验数据进行分析,得拟合二次多项式方程:Y=-79.34995+32.40125X1+3.03863X2+2.45780X3-0.042250X1X2+0.42000X1X3-0.043000X2X3-3.37375X12-0.030838X22-0.36580X32。
对该模型及系数进行显著性分析,结果见表4。
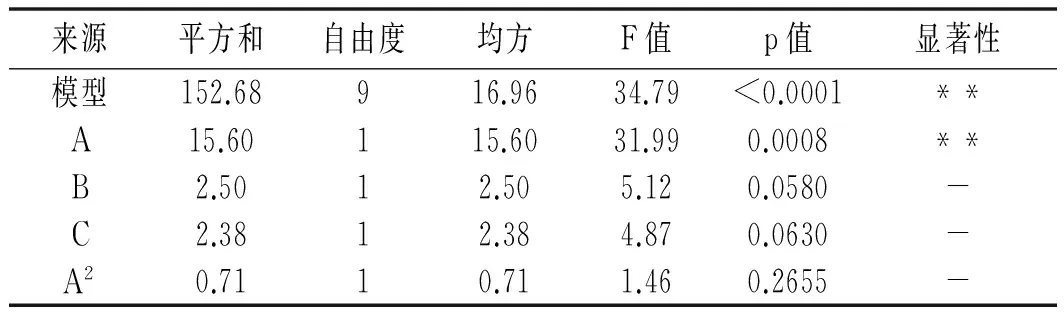
表4 回归模型显著性检验结果Table 4 Regression model significance test results
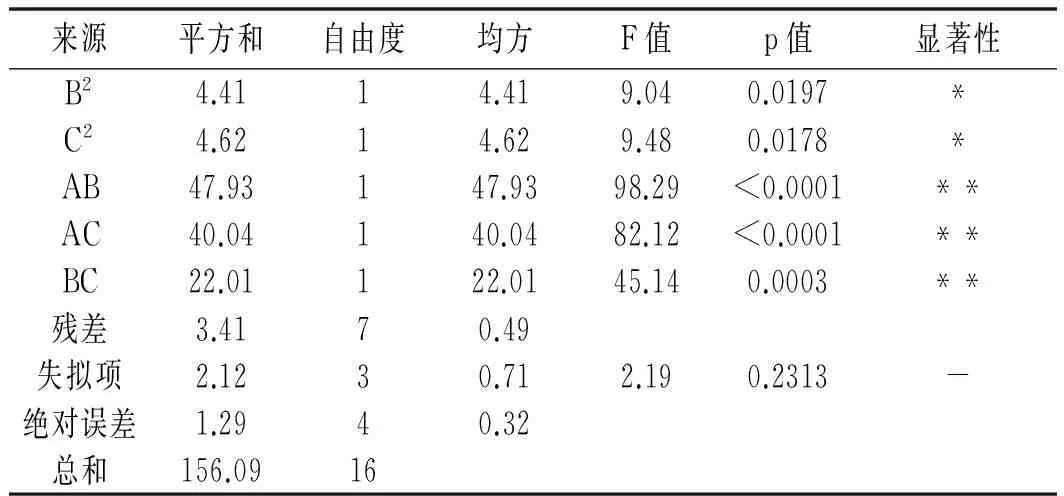
续 表
注:R2=0.9781; RAdj2=0.9500; **表示极显著; *表示显著;-表示不显著。
由表4可知,该二次多项式模型具有高度显著性(p<0.0001)。R2为0.9781,表明该回归方程回归效果比较好,可用模型解释DPPH自由基清除率响应值的变化。失拟项不显著(p=0.2313>0.05),表明实验模型拟合程度良好。分析各模型系数的p值,可知A,B2,C2,AB,AC和BC项的影响显著,说明酶解温度、酶解时间和加酶量之间均存在交互作用。
各因素之间交互作用的响应面图见图6~图8。
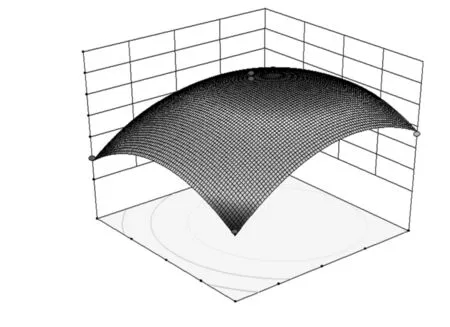
图6 温度与时间对DPPH自由基清除率的影响的响应面图Fig.6 Response surface of temperature and time on the scavenging ratio of DPPH radical
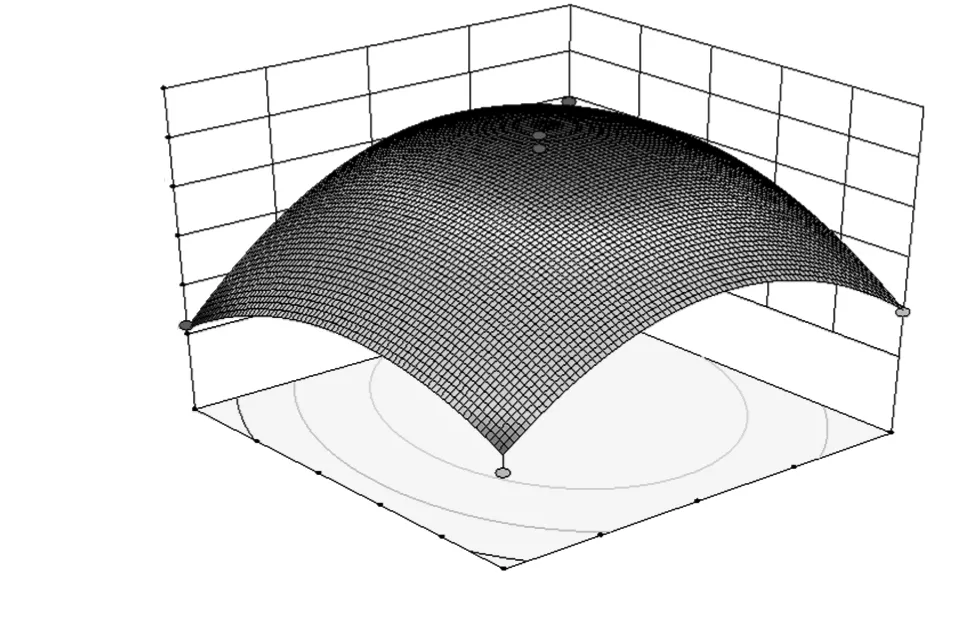
图7 时间与加酶量对DPPH自由基清除率的影响的响应面图Fig.7 Response surface of time and enzyme amount on the scavenging ratio of DPPH radical
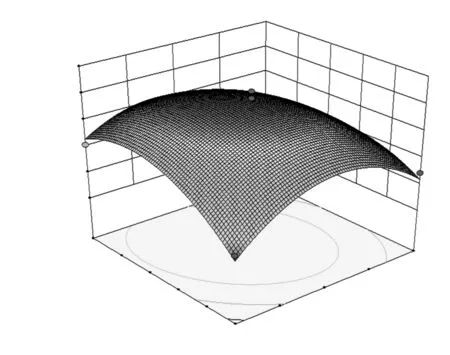
图8 温度与加酶量对DPPH自由基清除率的影响的响应面图Fig.8 Response surface of temperature and enzyme amount on the scavenging ratio of DPPH radical
由图6~图8可知,在所选因素水平范围内,响应值有最大值。通过数学模型预测最优的酶解条件为:酶解时间4.75 h、酶解温度43.56 ℃、加酶量3.53%,此时DPPH自由基清除率最大值为68.09%。
2.4 响应面法优化结果验证
为了检验模型预测的可行性,选取酶解时间4.70 h、酶解温度43 ℃、加酶量3.50%、固液比1∶5进行试验,试验重复3次。测得试验结果的DPPH自由基清除率为68.21%,与理论预测值相比,其相对误差为0.12%,说明通过响应面优化后得出的回归方程具有一定的实践指导意义。
2.5 抗氧化指标测定结果
在最佳酶解工艺条件下制备酶解液,测定扇贝酶解液的抗氧化指标,蛋白浓度为17.97 mg prot/mL的扇贝酶解液的DPPH自由基清除率、羟自由基清除率、总抗氧化能力、抗超氧阴离子活力分别为(68.21±0.63)%,(33.74±0.85)%,(0.086±0.05) U/mg prot,(106.27±3.71) U/g prot。
3 结论
试验确定了采用中性蛋白酶制备抗氧化性扇贝酶解液的条件,在单因素试验的基础上选取试验因素和水平,采用三因素三水平的响应面分析,对酶解温度、酶解时间、加酶量进行进一步优化,建立了酶解温度、酶解时间、加酶量三者与DPPH自由基清除率之间的数学模型,模型的回归效果显著,对试验结果具有良好的预测性。通过响应面优化的酶解条件为:酶解时间4.7 h、酶解温度43 ℃、加酶量3.50%、固液比1∶5。在此条件下,DPPH自由基清除率达到68.21%,羟自由基清除率为33.74%,总抗氧化活力为0.086 U/mg prot,抗超氧阴离子活力为106.27 U/g prot,说明采用中性蛋白酶制备的扇贝酶解液具有良好的抗氧化能力。
[1]李宁,程洁,孙鲁阳,等.中国北方沿海6个栉孔扇贝群体的AFLP分析[J].中国海洋大学学报:自然科学版,2010,40(4):38-42.
[2]楼乔明,王玉明,徐杰,等.栉孔扇贝和海湾扇贝脂质及其脂肪酸组成分析[J].中国食品学报,2012,12(11):198-203.
[3]谢靖,韩彦弢,姜国湖,等.扇贝多肽抑制中波紫外线导致的人皮肤成纤维细胞周期阻滞[J].中国海洋药物,2011(2):53-57.
[4]Aludatt M H,Ereifej K,Abu-zaition A,et al.Anti-oxidant,anti-diabetic,and anti-hypertensive effects of extracted phenolics and hydrolyzed peptides from barley protein fractions[J].International Journal of Food Properties,2012,15(4):781-795.
[5]Martinez-maqueda D,Miralles B,Recio I,et al.Antihypertensive peptides from food proteins: a review[J].Food & Function,2012,3(4):350-61.
[6]朱凤仙,戴志远,张燕平,等.酶解制备水产动物活性肽研究进展[J].食品研究与开发,2008,29(11):159-162.
[7]牛瑞,孙谧,于建生,等.扇贝裙边酶解制备抗氧化肽的实验研究[J].中国水产科学,2011,18(1):214-221.
[8]赵阳,陈海华,刘朝龙,等.双酶同步酶解工艺和自溶工艺制备紫贻贝海鲜风味肽[J].中国食品学报,2014,14(9):56-62.
[9]马赛蕊,胡晓,吴燕燕,等.罗非鱼肉蛋白酶解液的抗氧化活性[J].食品科学,2012(19):52-56.
[10]林娈,黄茂坤,董乐,等.风味蛋白酶水解河蚬蛋白的条件优化[J].食品工业,2014(11):92-95.
[11]李彩,桑亚新,王向红,等.回归正交旋转法优化制备扇贝裙边抗氧化肽[J].中国食品学报,2014,14(4):72-77.
[12]于志鹏,武思佳,赵文竹,等.海洋贝类蛋白源生物活性肽及肽组学的研究进展[J].食品工业科技,2015,36(22):384-388.
[13]张桢,杨贤庆,马海霞.Plackett-Burman法和中心组合法优化罗非鱼下脚料酶解工艺[J].食品科学,2011(18):1-5.
[14]Bae S H,Suh H J.Antioxidant activities of five different mulberry cultivars in Korea[J].Food Science & Technology,2007,40(6):955-962.
[15]刘媛,王健,牟建楼,等.扇贝贝肉抗氧化肽制备及体外抗氧化实验研究[J].食品工业科技,2014,35(8):206-209.
[16]田倩,吴燕燕,李来好,等.合浦珠母贝肉酶解液中抗氧化肽的分离及活性研究[J].食品科学,2011(S1):144-148.
[17]李俊江,潘道东,郭宇星,等.鹅肉蛋白酶解条件优化及酶解产物抗氧化活性研究[J].食品科学,2012(3):126-130.
[18]梁帅峰,梁春辉,王伟,等.牡蛎酶解液酶解工艺优化研究[J].食品工业,2015(3):158-161.
[19]郭兴凤,薛园园,吴欣欣.风味蛋白酶水解制备豌豆蛋白抗氧化酶解产物工艺条件优化[J].粮食与油脂,2011(9):44-47.
[20]桑亚新,王向红,王苏,等.扇贝裙边酶解工艺优化及其氨基酸分析研究[J].中国食品学报,2012,12(8):78-86.
StudyonOptimizationofPreparationConditionsandAntioxidantActivityofEnzymaticHydrolysateofChlamysfarreri
YAN Chao, MU Jian-lou*, CHEN Zhi-zhou, LIU Ya-qiong, ZHAO Huan, QI Xiao-ru
(College of Food Science and Technology, Agricultural University of Hebei, Baoding 071000,China)
WithChlamysfarrerias raw material, degree of hydrolysis and DPPH radical scavenging rate are used as indicators. Based on the single factor test, the Box-Behnken method is used to optimize the enzymatic hydrolysis of scallop hydrolysate with antioxidative polypeptide by response surface test. DPPH free radical scavenging rate, hydroxyl radical scavenging rate, total antioxidant activity and anti-superoxide anion activity are measured. The effects of protease types, enzymolysis time, enzymolysis temperature, enzyme amount and solid-liquid ratio on the antioxidant activity of enzymatic hydrolysate ofChlamysfarreriare studied. The results show that the optimal parameters of enzymolysis are as follows: using neutral protease, the enzymolysis time is 4.7 h, the enzymolysis temperature is 43 ℃, the enzyme amount is 3.5%, the solid-liquid ratio (m/V) is 1∶5. Under the optimum conditions, the scavenging rate of DPPH free radical and hydroxyl radical is 68.21% and 33.74% respectively, the total antioxidant activity is 0.086 U/mg prot, the anti-superoxide anion radical activity is 106.27 U/g prot.
Chlamysfarreri;enzymolysis;degree of hydrolysis;antioxidant activity
TS201.25
A
10.3969/j.issn.1000-9973.2017.12.001
1000-9973(2017)12-0001-06
2017-06-22 *通讯作者
河北省科技计划项目(14273205D)
严超(1992-),女,硕士,研究方向:食品加工与安全。

