紫外线对HaCaT细胞中瞬时受体电位锚蛋白1的影响
刘影 张婷 赵光明 倪静 王宇鹏 刘越坚 宋智琦
116011大连医科大学附属第一医院皮肤科(刘影、张婷、赵光明、倪静、王宇鹏、宋智琦),中心实验室(刘越坚)
紫外线对HaCaT细胞中瞬时受体电位锚蛋白1的影响
刘影 张婷 赵光明 倪静 王宇鹏 刘越坚 宋智琦
116011大连医科大学附属第一医院皮肤科(刘影、张婷、赵光明、倪静、王宇鹏、宋智琦),中心实验室(刘越坚)
目的 探讨HaCaT细胞中瞬时受体电位锚蛋白1(TRPA1)的光控作用及其机制。方法 培养的HaCaT细胞分为225 mJ/cm2UVA刺激组和25 mJ/cm2UVB刺激组,UVA刺激组分为空白对照组(仅有HaCaT细胞)、视黄醛组、UVA组、视黄醛+UVA组(UVA-TRPA1对照组)、视黄醛+UVA+肉桂醛组(UVA-TRPA1激动组)、视黄醛+UVA+樟脑组(UVA-TRPA1抑制组);UVB刺激组分为空白对照组(仅有HaCaT细胞)、视黄醛组、UVB组、视黄醛+UVB组(UVB-TRPA1对照组)、视黄醛+UVB+肉桂醛组(UVB-TRPA1激动组)、视黄醛+UVB+樟脑组(UVB-TRPA1抑制组)。qPCR、Western印迹检测HaCaT细胞中TRPA1的表达。流式细胞仪检测各组HaCaT细胞钙离子内流的变化。结果 qPCR和Western印迹显示,HaCaT细胞中有TRPA1 mRNA及蛋白的表达。UVA作用后空白对照组、视黄醛组、UVA组、视黄醛+UVA组荧光强度分别为155.06±7.62、148.37±18.77、166.92±3.71、331.333±40.563,组间差异有统计学意义(F=44.509,P<0.01)。UVB作用后空白对照组、视黄醛组、UVB组、视黄醛+UVB组荧光强度分别为150.20±1.73、171.66±56.23、147.56±6.60、250.44±9.13,组间差异有统计学意义(F=85.261,P<0.01),视黄醛+UVA/UVB组荧光强度均高于空白对照组(q值分别为18.442、6.052,P<0.01)。TRPA1激动剂和拮抗剂可调节UVA、UVB所引起的钙离子内流的变化(P<0.001),在UVA、UVB作用下,TRPA1激动剂组荧光强度均高于对照组(q值分别为14.934、32.770,P < 0.001),TRPA1抑制剂组荧光强度均低于对照组(q值分别为7.986、14.596,P <0.001)。结论 TRPA1在皮肤HaCaT细胞中有表达,UVA或UVB可通过TRPA1调控HaCaT细胞的钙离子内流。
角蛋白细胞;紫外线;瞬时受体电位通道;锚蛋白类;HaCaT细胞
瞬时受体电位(transient receptor potential,TRP)通道是位于真核细胞膜上的一类重要的非选择性阳离子通道,最早发现于果蝇的视觉系统,突变体果蝇对持续的光刺激产生瞬时而非持续的峰电位[1]。大多数TRP通道为钠离子、钙离子等渗透型通道,其中瞬时受体电位锚蛋白1(transient receptor potential ankyrin 1,TRPA1)为钙离子渗透型通道。Bellono等[2-3]提出TRPA1可能是唯一的眼外光转导通路,表皮黑素细胞受到紫外线辐射时,Gα/q11蛋白-磷脂酶C信号转导途径被激活,随后激活TRPA1通道使大量的钙离子内流,从而导致早期黑素合成增加。为了进一步探讨TRPA1在角质形成细胞中的光控作用,我们研究了在长波紫外线(UVA)、中波紫外线(UVB)作用下,HaCaT细胞中视黄醛依赖性钙离子内流的情况以及TRPA1通道抑制及激活状态下对HaCaT细胞视黄醛依赖性钙离子内流的影响。
材料和方法
一、材料
DMEM培养基(美国Corning公司),胎牛血清(fetal bovine serum,FBS)、1%青霉素-链霉素及含乙二胺四乙酸(EDTA)的0.25%胰蛋白酶(美国Gibco公司),牛血清白蛋白(bovine serum albumin,BSA)、视黄醛、TRPA1通道激动剂-肉桂醛、TRPA1通道拮抗剂-樟脑(美国Sigma公司)。总RNA提取试剂(Trizol)、反转录试剂盒(Prime ScriptTMRT reagent Kit)、荧光定量试剂盒(SYBR®Premix ExTaq™Ⅱ)及qPCR引物设计(大连宝生物工程有限公司)。qPCR引物设计(大连宝生物工程有限公司);兔抗人TRPA1多克隆抗体(中国台湾Abnova公司),兔抗人β肌动蛋白多克隆抗体、辣根过氧化物酶标记山羊抗兔IgG(北京博奥生物集团有限公司);BCA蛋白浓度测定试剂盒、Fluo-3AM钙离子荧光探针(上海碧云天生物技术有限公司);HaCaT细胞株(广州赛库生物技术有限公司)、人胚肾293T细胞(HEK293T细胞株,美国ATCC细胞库)均为本实验室保存细胞株。
二、方法
1.细胞培养:HaCaT细胞用含15%FBS和DMEM培养基于37℃、5%CO2培养箱中培养,每2天更换1次培养基,待细胞长满瓶底后,以0.25%胰蛋白酶溶液消化细胞并传代。HEK293T细胞用含10%FBS和DMEM培养基于37℃、5%CO2的培养箱中培养,2~3 d更换1次培养基,待细胞密度融合至70%~80%时,以0.25%胰蛋白酶溶液消化细胞并传代。选择对数生长期HaCaT细胞、HEK293T细胞进行后续实验。HaCaT细胞为实验组,HEK293T细胞为阳性对照组。
2.细胞分组:视黄醛溶于无水乙醇中,终浓度为12 μmol/L,肉桂醛、樟脑分别溶于DMSO中,终浓度分别为500 μmol/L和1 mmol/L,在实验前混合到细胞外溶液中(最终DMSO浓度<1‰)。实验分为225 mJ/cm2UVA刺激组和25 mJ/cm2UVB刺激组,UVA刺激组分为空白对照组(仅有HaCaT细胞)、视黄醛组、UVA组、视黄醛+UVA组(UVA-TRPA1对照组)、视黄醛+UVA+肉桂醛组(UVA-TRPA1激动组)、视黄醛+UVA+樟脑组(UVA-TRPA1抑制组);UVB刺激组分为空白对照组(仅有HaCaT细胞)、视黄醛组、UVB组、视黄醛+UVB组(UVBTRPA1对照组)、视黄醛+UVB+肉桂醛组(UVBTRPA1激动组)、视黄醛+UVB+樟脑组(UVBTRPA1抑制组)。
3.实时荧光定量PCR(qPCR)检测TRPA1基因表达:采用Trizol试剂提取实验组HaCaT细胞及阳性对照组HEK293T细胞总RNA,紫外/可见光分光光度仪检测总RNA的纯度及浓度,采用反转录试剂盒反转录成cDNA后,采用荧光定量试剂盒进行目的基因及内参基因的扩增。目的基因TRPA1正向引物:5′-TTCCTGGAAAGCTTCATGTTGAAAG-3′,反向引物:5′-TCAAAGTGACATCAGGTGTGTTGG-3′,扩增片段为120 bp;内参基因GAPDH正向引物:5′-GCACCGTCAAGGCTGAGAAC-3′,反向引物:5′-TGGTGAAGACGCCAGTGGA-3′,扩增片段为138 bp。PCR反应体系为20 μl,扩增程序为预变性95℃30 s,PCR反应为95℃5 s,60℃30 s,共40个循环。
4.Western印迹法检测TRPA1蛋白表达:收集HaCaT细胞及HEK293T细胞,适量RIPA裂解液裂解细胞提取总蛋白,采用BCA蛋白浓度测定试剂盒测定蛋白浓度,上样20 μg电泳、转膜及封闭,给予一抗(兔抗人TRPA1多克隆抗体及兔抗人β肌动蛋白多克隆抗体浓度均为1∶1 500)4℃过夜,二抗(山羊抗兔IgG抗体浓度1∶3 000)室温孵育1 h,ECL化学发光显色液显色,凝胶成像系统观察结果,目的蛋白条带TRPA1与β肌动蛋白条带的灰度值比值作为蛋白表达的半定量指标。
5.流式细胞仪检测HaCaT细胞内钙离子:根据UVA、UVB刺激进行细胞分组处理,培养24 h,用0.25%胰蛋白酶消化细胞,磷酸盐缓冲液(PBS)洗涤2次,弃上清。随后,加入500 μl正常生理缓冲液[NPB,为正常生理溶液(NPS,120 mmol/L NaCl、3.3mmol/LKCl、1.2mmol/LKH2PO4、0.8mmol/LMgSO4、24 mmol/L NaHCO3)中加 入1.0 m mol/L CaCl2和 0.1%BSA(重量/体积)]重悬细胞;室温下加入Fluo-3AM(终浓度5 mmol/L)及视黄醛、肉桂醛、樟脑,给予UVA/UVB照射,室温下孵育45 min。然后179×g,离心10min,弃上清,用500 μl NPS洗涤细胞沉淀2次,最后加入500 μl NPS重悬。使用流式细胞仪测定荧光强度(钙离子浓度的相对含量),激发波长488 nm,发射波长530 nm。
6.统计学分析:采用SPSS17.0统计软件,计量资料用±s表示。两组间均数比较用t检验,多组间均数比较用单因素方差分析(one-way ANOVA),采用q检验、LSD法进行组间多重比较。以P<0.05为差异有统计学意义。
结 果
一、TRPA1在HaCaT细胞中的表达
HaCaT细胞及HEK293T细胞中TRPA1 mRNA的表达量分别为0.31±0.09、0.93±0.05,差异有统计学意义(t=10.262,P <0.001)。HaCaT细胞及HEK293T细胞中TRPA1/β肌动蛋白条带的灰度比分别为0.27±0.08、0.49±0.02,差异有统计学意义(t=4.701,P<0.05)。见图1。

图1 Westren印迹法检测HaCaT细胞及HEK293T细胞内源性瞬时受体电位锚蛋白1(TRPA1)的表达 TRPA1 Westren印迹电泳图。1:HaCaT;2:HEK293T
二、紫外线照射对HaCaT细胞视黄醛依赖性钙离子内流的影响
1.UVA照射:UVA增加HaCaT细胞中视黄醛依赖性的钙离子内流,空白对照组、视黄醛组、UVA组、视黄醛+UVA组间荧光强度差异有统计学意义(F=44.509,P<0.01),见表1。与空白对照组相比,视黄醛组、UVA组钙离子内流没有增加(q值分别为0.780、1.382,P > 0.05),视黄醛 +UVA组钙离子内流显著增加(q=18.442,P<0.01)。

表1 UVA、UVB对HaCaT细胞视黄醛依赖性钙离子内流的影响
2.UVB照射:UVB增加HaCaT细胞中视黄醛依赖性的钙离子内流,空白对照组、视黄醛组、UVB组、视黄醛+UVB组间荧光强度差异有统计学意义(F=85.261,P<0.01)。见表1。与空白对照组相比,视黄醛组、UVB组未见钙离子的增加(q值分别为1.295、-0.160,P > 0.05),视黄醛 +UVB组钙离子内流显著增加(q=6.052,P<0.01)。
三、TRPA1的激活与抑制对紫外线照射介导HaCaT细胞视黄醛依赖性钙离子内流的调节
1.UVA照射:TRPA1激活UVA介导的HaCaT细胞视黄醛依赖性的钙离子内流,对照组、视黄醛+UVA+肉桂醛组、视黄醛+UVA+樟脑组间荧光强度差异有统计学意义(F=136.229,P<0.01)。与对照组相比,视黄醛+UVA+肉桂醛组钙离子内流显著增加(q=14.934,P<0.001),视黄醛 +UVA+樟脑组钙离子内流显著减少(q=7.986,P<0.001)。见表2,图2。
表2 TRPA1调节UVA、UVB介导的HaCaT细胞视黄醛依赖性钙离子的内流(荧光强度,±s)
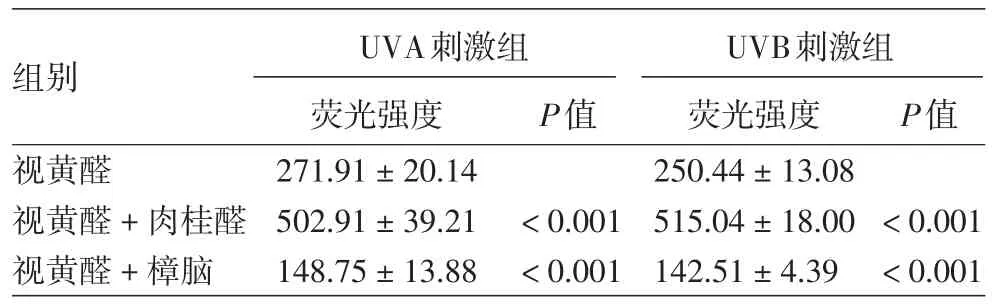
表2 TRPA1调节UVA、UVB介导的HaCaT细胞视黄醛依赖性钙离子的内流(荧光强度,±s)
注:n≥3

图2 TRPA1调节UVA介导的HaCaT细胞视黄醛依赖性钙离子的内流(M1数值为相对荧光强度)
2.UVB照射:TRPA1激活UVB介导的视黄醛依赖性HaCaT细胞的钙离子内流,视黄醛+UVB组、视黄醛+UVB+肉桂醛组、视黄醛+UVB+樟脑组间荧光强度差异有统计学意义(F=639.058,P<0.01)。见表2,图3。与对照组相比,视黄醛+UVB+肉桂醛组钙离子内流显著增加(q=32.770,P<0.001),视黄醛+UVB+樟脑组钙离子内流显著减少(q=14.596,P < 0.001)。

图3 TRPA1调节UVB介导的HaCaT细胞视黄醛依赖性钙离子的内流(M1数值为相对荧光强度)
讨 论
TRPA1最初被认为是机械性刺激的感受器,受到如物理刺激(温度、机械力等)、化学刺激(pH值、信息素等)等不同机制的激活和调控[4]。近期研究发现,TRPA1通路是目前唯一的眼外光转导通路,可被紫外线所激活[2-3]。因此,TRPA1在皮肤光生物学方面可能发挥作用。
钙离子作为胞内第二信使,在细胞生命活动中起着重要的作用,如参与递质和激素的合成与释放[5]、促进表皮角质形成细胞的增殖、分化及细胞间黏附等[6-7]。本研究结果表明,UVA及UVB均可促进HaCaT细胞视黄醛依赖性钙离子内流;进一步的研究发现,激活或者抑制TRPA1通道能够显著增加或减少UVA、UVB介导的HaCaT细胞视黄醛依赖性钙离子内流。视网膜色素上皮细胞特异蛋白65(RPE65)由Hamel等[8]于1993年发现,定位于染色体lp31,是视网膜色素上皮细胞大量特异性表达、高度保守的蛋白序列,后于2005年由Redmond等[9]证实为视黄醇异构酶。RPE65是视网膜内维生素A循环又称视循环的重要结构,被认为是催化全反式视黄酯转变成11-顺-视黄醇的异构酶之一,后者再经过一系列代谢转变成视紫红质,参与视觉系统中光信号的传导过程[10-11]。有研究发现,角质形成细胞中亦有RPE65的表达[12]。由此我们推测在HaCaT细胞中,紫外线所引起钙离子内流显著增加的效应与哺乳动物视网膜中视循环相类似:可能是通过RPE65催化全反式视黄酯向顺式视黄醇的反应,从而参与表皮细胞的光控作用。因此TRPA1的光通道作用机制可能是紫外线照射与视黄醛共孵育的HaCaT细胞后,使TRPA1离子通道开放,细胞内钙离子显著增加,从而激活钙离子触发的级联反应。
综上所述,紫外线激活TRPA1通道导致黑素细胞早期黑素合成增加的效应与引起角质形成细胞内钙离子显著增加的效应均体现表皮细胞中紫外线与TRPA1之间的密切联系,从而我们认为,TRPA1在角质形成细胞中具有光控作用。
[1]Cosens DJ,Manning A.Abnormal electroretinogram from a Drosophila mutant[J].Nature,1969,224(5216):285-287.DOI:10.1038/224285a0.
[2]Bellono NW,Kammel LG,Zimmerman AL,et al.UV light phototransduction activates transient receptor potential A1 ion channels in human melanocytes[J].Proc Natl Acad Sci U S A,2013,110(6):2383-2388.DOI:10.1073/pnas.1215555110.
[3]Bellono NW,Najera JA,Oancea E.UV light activates a Gαq/11-coupled phototransduction pathway in human melanocytes[J].J GenPhysiol,2014,143(2):203-214.DOI:10.1085/jgp.201311094.
[4]García-Añoveros J,Nagata K.TRPA1[J].Handb Exp Pharmacol,2007,(179):347-362.DOI:10.1007/978-3-540-34891-7_21.
[5]司舒杰,刘天龙,刘小雷.电压门控钙离子通道的研究进展[J].北方药学,2012,9(1):33-35.
[6]Bikle DD,Xie Z,Tu CL.Calcium regulation of keratinocyte differentiation[J].Expert Rev Endocrinol Metab,2012,7(4):461-472.DOI:10.1586/eem.12.34.
[7]Bleich M,Shan Q,Himmerkus N.Calcium regulation of tight junction permeability[J].Ann N Y Acad Sci,2012,1258:93-99.DOI:10.1111/j.1749-6632.2012.06539.x.
[8]Hamel CP,Tsilou E,Harris E,et al.A developmentally regulated microsomal protein specific for the pigment epithelium of the vertebrate retina[J].Journal of neuroscience research,1993,34(4):414-425.DOI:10.1002/jnr.490340406.
[9]Redmond TM,Poliakov E,Yu S,et al.Mutation of key residues of RPE65 abolishes its enzymatic role as isomerohydrolase in the visual cycle[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(38):13658-13663.DOI:10.1073/pnas.0504167102.
[10]Alkharashi M,Fulton AB.Available evidence on leber congenital amaurosis and gene therapy[J]Semin Ophthalmol,2017,32(1):14-21.DOI:10.1080/08820 538.2016.1228383.
[11]Yau KW,Hardie RC.Phototransduction motifs and variations[J].Cell,2009,139(2):246-264.DOI:10.1016/j.cell.2009.09.029.
[12]Hinterhuber G,Cauza K,Brugger K,et al.RPE65 of retinal pigment epithelium,a putative receptor molecule for plasma retinol-binding protein,is expressed in human keratinocytes[J].J Invest Dermatol,2004,122(2):406-413.
Effect of ultraviolet radiation on expression of transient receptor potential ankyrin 1 in HaCaT cells
Liu Ying,Zhang Ting,Zhao Guangming,Ni Jing,Wang Yupeng,Liu Yuejian,Song Zhiqi
Department of Dermatology,The First Affiliated Hospital of Dalian Medical University,Dalian 116011,China(Liu Y,Zhang T,Zhao GM,Ni J,Wang YP,Song ZQ);Central Laboratory,The First Affiliated Hospital of Dalian Medical University,Dalian 116011,China(Liu YJ)
Song Zhiqi,Email:szqdalian@163.com
Objective To investigate the photoregulation of transient receptor potential ankyrin 1(TRPA1)in HaCaT cells,and to explore its mechanisms.Methods Cultured HaCaT cells were divided into 225-mJ/cm2UVA radiation groups and 25-mJ/cm2UVB radiation groups.HaCaT cells in the UVA radiation groups were further classified into 6 groups:blank control group 1 receiving no treatment,retinal group 1 treated with 12 μmol/L retinal alone,UVA group treated with 225 mJ/cm2UVA radiation alone,retinal+UVA group(UVA-TRPA1 control group),retinal+UVA+500 μmol/L cinnamaldehyde group(UVA-TRPA1 agonist group)and retinal+UVA+1 mmol/L camphor group(UVA-TRPA1 antagonist group).Additionally,HaCaT cells in the UVB radiation groups were also further classified into 6 groups:blank control group 2 receiving no treatment,retinal group 2 treated with 12 μmol/L retinal alone,UVB group treated with 25-mJ/cm2UVB radiation,retinal+UVB group(UVB-TRPA1 control group),retinal+UVB+500 μmol/L cinnamaldehyde group(UVB-TRPA1 agonist group)and retinal+UVB+1 mmol/L camphor group(UVB-TRPA1 antagonist group).Real-time fluorescence-based quantitative PCR(qPCR)and Western blot analysis were performed to determine the mRNA and protein expression of TRPA1 respectively.Flow cytometry was conducted to investigate changes of calcium influx in HaCaT cells in the above groups.Results qPCR and Western blot analysis showed that TRPA1 mRNA and protein were expressed in HaCaT cells.The fluorescence intensity of calcium influx significantly differed among the blank control group 1,retinal group 1,UVA group and retinal+UVA group(155.06±7.62,148.37±18.77,166.92±3.71 and 331.333±40.563;F=44.509,P<0.01),as well as among the blank control group 2,retinal group 2,UVB group and retinal+UVB group(150.20±1.73,171.66±56.23,147.56±6.60 and 250.44 ± 9.13;F=85.261,P < 0.01).Additionally,retinal+UVA/UVB groups showed significantly higher fluorescence intensity of calcium influx compared with the blank control groups(q=18.442,6.052,P < 0.01).The TRPA1 agonist cinnamaldehyde and its antagonist camphor could regulate the UVA-and UVB-induced calcium influx(P < 0.001).Compared with the blank control group 1 and 2 respectively,the fluorescence intensity of retinal-dependent calcium influx was significantly higher in the UVA/UVB-TRPA1 agonist group(q=14.934,32.770,P < 0.001),and significantly lower in the UVA/UVBTRPA1 antagonist group(q=7.986,14.596,P < 0.001).Conclusion TRPA1 is expressed in HaCaT cells,and UVA or UVB can regulate the calcium influx in HaCaT cells by adjusting the activity of TRPA1.
Keratinocytes;Ultraviolet rays;Transient receptor potential channels;Ankyrins;HaCaT cells
宋智琦,Email:szqdalian@163.com
10.3760/cma.j.issn.0412-4030.2017.10.004
国家自然科学基金(81472865);辽宁省自然科学基金(2014023005)
Fund programs:National Natural Science Foundation of China (81472865);Natural Science Foundation of Liaoning Province of China(2014023005)
2016-12-09)
(本文编辑:朱思维 颜艳)

