三阴性乳腺癌组织中Stathmin、p53蛋白表达变化及意义
李黎洪,陈智伟,陈昱,吴丽婷
(莆田学院附属医院,福建莆田 351100)
三阴性乳腺癌组织中Stathmin、p53蛋白表达变化及意义
李黎洪,陈智伟,陈昱,吴丽婷
(莆田学院附属医院,福建莆田 351100)
目的观察Stathmin和p53蛋白在三阴性乳腺癌组织中的表达变化,并探讨其意义。方法采用免疫组化法分别检测106例三阴性乳腺癌组织(观察组)及42例非三阴性乳腺癌组织(对照组)中Stathmin和p53蛋白表达,Stathmin和p53蛋白表达间的相关性采用Spearman等级相关分析。结果观察组及对照组癌组织中Stathmin蛋白表达阳性率分别为83.02%(88/106)、35.71%(15/42),p53蛋白表达阳性率分别为59.43%(63/106)、11.90%(5/42),两组乳腺癌组织中Stathmin和p53蛋白表达比较,差异均有统计学意义(χ2分别为31.81、23.76,P均lt;0.05)。Stathmin和p53蛋白在肿瘤TNM分期及有无区域淋巴结转移方面均存在统计学差异(P均lt;0.05),而与患者年龄、肿瘤大小及组织学类型均无关(P均gt;0.05);Stathmin与组织学分级无关(χ2=2.97,P=0.23),而p53与组织学分级有关(χ2=9.49,P=0.00);Stathmin与p53蛋白阳性表达呈正相关(r=0.24,P=0.01)。结论Stathmin和p53蛋白在三阴性乳腺癌组织中呈高表达,二者可能在三阴性乳腺癌发生发展及转移中发挥协同作用。
三阴性乳腺癌;Stathmin蛋白;p53蛋白;免疫组化
我国乳腺癌近年发病率为24.86/10万,呈上升趋势及年轻化特点[1]。乳腺癌在形态学与临床治疗反应上具有异质性,可分为管腔型A、管腔型B、正常乳腺样型、人表皮生长因子受体2(Her-2)过表达型和基底样癌型。其中基底样乳腺癌免疫组化法多以雌激素受体(ER)、孕激素受体(PR)和Her-2均阴性表达为特征,因此被称为三阴性乳腺癌[2]。三阴性乳腺癌组织分化程度较低,增殖速度快、浸润性强,早期即可出现他处转移,由于不宜行内分泌治疗却又缺乏有效的针对性靶向治疗措施,故临床预后差[3]。Stathmin在人类多种肿瘤中过表达,与肿瘤细胞高度恶性、增殖快、易侵袭远处器官相关[5]。Stathmin在乳腺癌细胞系中的高表达已有报道,Stathmin低表达与微管稳定性和乳腺癌良好的预后相关[6]。p53是重要的抑癌基因,与乳腺癌的发生发展有关[4]。p53能否作为三阴性乳腺癌预后的独立因素,目前国外文献报道尚有争议,而且联合检测Stathmin及p53蛋白在三阴性乳腺癌中的表达情况尚未见报道。2013年1月~2016年12月,我们应用免疫组化法检测了三阴性乳腺癌组织中Stathmin及p53蛋白表达,并探讨其意义。
1 资料与方法
1.1 临床资料 收集2013年1月~2016年12月于莆田学院附属医院手术切除并经病理诊断为三阴性乳腺癌标本106例份(观察组),患者均为女性,年龄26~73岁,中位年龄46岁,≤45岁者44例,gt;45岁者62例。患者术前均未经放疗、化疗、内分泌及其他任何针对肿瘤的治疗。肿瘤直径1.0~10.0 cm,其中lt;2 cm者31例,2~5 cm者52例,≥5 cm者23例;组织病理学类型:浸润性导管癌79例,浸润性小叶癌22例,黏液癌2例,神经内分泌癌1例,髓样癌1例,大汗腺癌1例;组织学分级:Ⅰ级34例,Ⅱ级52例,Ⅲ级20例;TNM分期:Ⅰ+Ⅱ期43例,Ⅲ+Ⅳ期63例;有腋窝淋巴结转移65例,无腋窝淋巴结转移41例。同时选取经手术切除并经病理诊断为非三阴性乳腺癌组织42例份作为对照组,均为女性,年龄17~69岁,中位年龄44岁。两组性别、年龄具有可比性。
1.2 乳腺癌组织中Stathmin及p53蛋白表达检测 取出两组存档的石蜡组织块,切片、HE染色等常规处理后,采用EnVision免疫组化二步法对两组样本中的Stathmin、p53蛋白表达进行检测,操作步骤按试剂盒说明书进行。Stathmin抗体和p53抗体稀释度均为1∶200。用已知Stathmin、p53阳性组织切片和磷酸盐缓冲液分别代替一抗做阴性对照。由两位主治级别以上的病理医生对切片染色结果采用双盲法分别独立观察并打分。Stathmin蛋白定位于细胞质,以呈现出清晰的棕黄(褐)色颗粒沉积为阳性表达。p53定位于胞核内,以呈现出明显的棕黄(褐)色颗粒沉积为阳性表达。结合染色强度及阳性细胞百分比综合判断。染色结果行半定量分析:在高倍(×400)镜下随机计数10个不重复视野阳性细胞,计数选定区域中染色阳性肿瘤细胞与总体肿瘤细胞的百分比,按染色阳性细胞百分率评分,lt;5%为0分,5%~25%为1分,25%~50%为2分,≥50%为3分;按染色强度计分:细胞无染色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分;将染色计数得分与染色强度得分相加,0分为阴性,1~2分为弱阳性(+),3~4分为中等阳性(++),4分以上为强阳性(+++)。+~+++均代表阳性表达,以上结果由病理科医生盲法独立完成。
1.3 统计学方法 采用SPSS22.0统计软件。对计数资料采用χ2检验或Fisher确切概率法,Stathmin、p53蛋白表达间的相关性采用Spearman等级相关分析。Plt;0.05为差异有统计学意义。
2 结果
2.1 两组乳腺癌组织中Stathmin和p53蛋白表达比较 Stathmin和p53蛋白在两组乳腺癌组织中均有不同程度表达,观察组Stathmin蛋白表达呈+、++、+++各为3、35、50例,p53蛋白表达呈+、++、+++各为11、25、27例;对照组Stathmin蛋白表达呈+、++、+++各为3、10、2例,p53蛋白表达呈+、++、+++各为0、3、2例。观察组及对照组癌组织中Stathmin蛋白表达阳性率分别为83.02%(88/106)、35.71%(15/42),p53蛋白表达阳性率分别为59.43%(63/106)、11.90%(5/42),两组乳腺癌组织中Stathmin和p53蛋白表达比较,差异均有统计学意义(χ2分别为31.81、23.76,P均lt;0.05)。
2.2 Stathmin和p53蛋白表达与三阴性乳腺癌患者临床病理特征的关系 见表1。Stathmin和p53蛋白表达在三阴性乳腺癌TNM分期及区域淋巴结转移方面均存在统计学差异(P均lt;0.05);在患者年龄、肿瘤大小及组织学分型方面均无统计学差异(P均gt;0.05);不同的组织学分级中,Stathmin表达无统计学差异(χ2=2.97,P=0.23),而p53表达却存在统计学差异(χ2=9.49,P=0.00)。
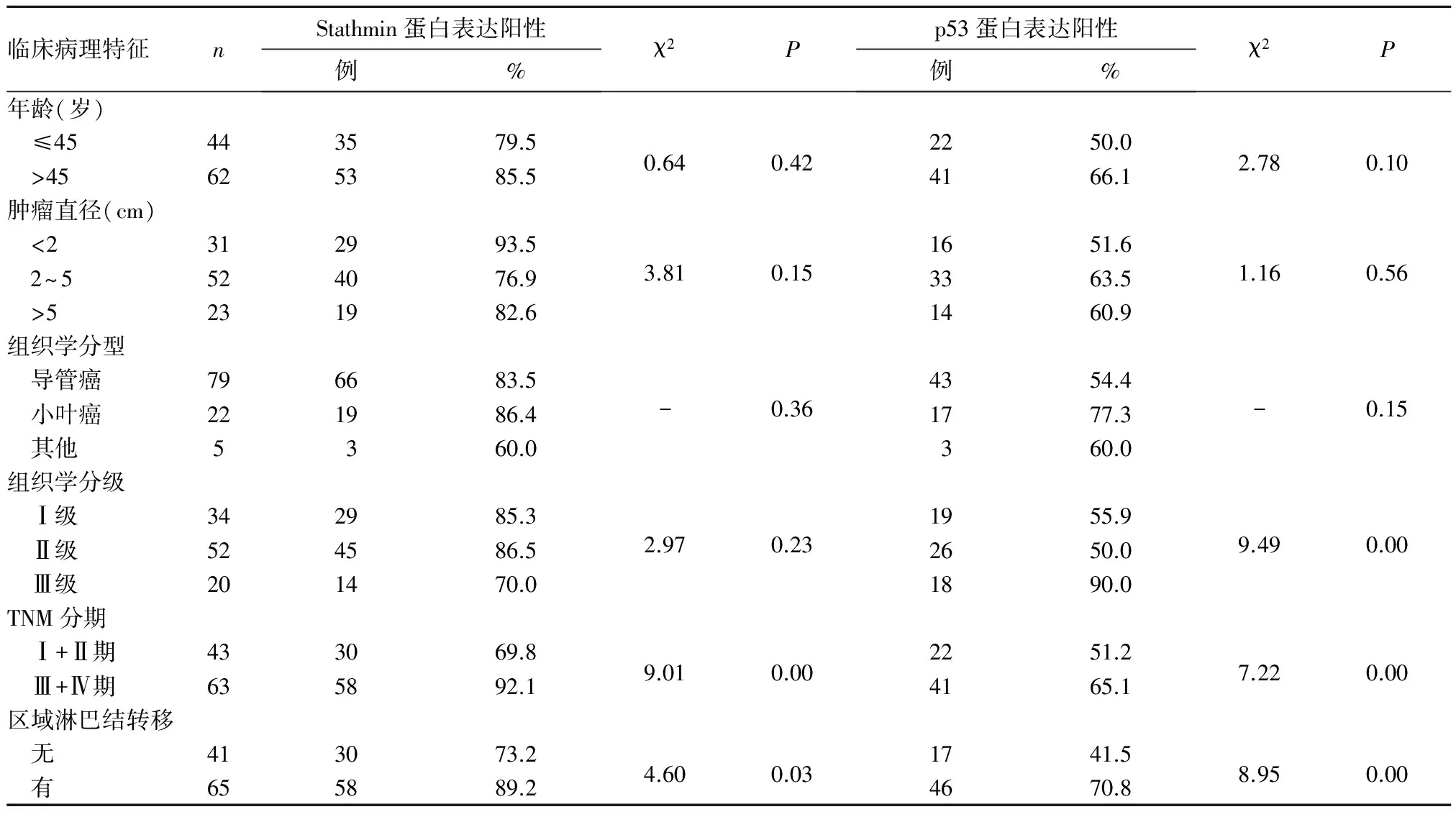
表1 Stathmin和p53蛋白表达与三阴性乳腺癌患者临床病理特征的关系
2.3 三阴性乳腺癌组织中Stathmin与p53蛋白表达的相关性分析 Stathmin蛋白表达阳性88例,其中p53蛋白表达阳性57例;Stathmin蛋白表达阴性18例,其中p53蛋白表达阳性6例;Stathmin与p53蛋白在106例三阴性乳腺癌组织中的表达呈正相关(r=0.24,P=0.01)。
3 讨论
三阴性乳腺癌的发生发展受多种因素的调节,与原癌基因激活及抑癌基因失活密切相关。Stathmin是一种高度保守的细胞质蛋白,通过被蛋白激酶磷酸化影响微管形成及细胞有丝分裂过程,调节细胞周期,从而影响细胞的增殖、分化及功能[7]。阻断Stathmin可使细胞分裂停止于G2/M期,抑制细胞增殖。研究发现,Stathmin在急性淋巴细胞白血病、人成骨肉瘤、喉磷状细胞癌、卵巢癌等多种恶性肿瘤细胞中存在高表达,Stathmin参与多种恶性肿瘤的发生发展过程[6~9]。p53基因位于人染色体17p13.3l,与细胞周期调控、细胞凋亡、DNA修复等相关。正常的p53蛋白能抑制肿瘤细胞增殖、诱导细胞凋亡,正常p53不易被检测到,当p53发生突变后,失去了抑癌功能,并诱导正常细胞向癌细胞转化,同时阻碍其他野生型p53发挥其功能,最终促进肿瘤的发生、演进及转移[5]。p53与癌症患者的不良预后密切相关[10]。
本研究发现,与非三阴性乳腺癌组织相比,三阴性乳腺癌组织中Stathmin及p53蛋白表达增加,差异有统计学意义,表明Stathmin及p53与乳腺癌发生发展有关。该结果与国外类似研究一致[11,12]。进一步分析显示,在TNM分期不同的条件下,与无淋巴结转移者相比,淋巴结转移乳腺癌组织中Stathmin及p53蛋白表达水平更高,且呈递升式演变,差异有统计学意义,此与国外类似研究基本一致[13]。说明Stathmin及p53可能与三阴性乳腺癌的发生、病情进展及转移密切相关,二者有望成为三阴性乳腺癌发生发展、转移过程中的重要标志物。Masciarelli等[14]体外研究发现,在肿瘤细胞株中,p53突变能通过结合启动子,阻碍其转录功能下调miR-223的表达。相关性分析结果显示,Stathmin与p53蛋白表达呈正相关,表明p53对Stathmin蛋白表达具有促进或失去“监控”作用,侧面证实了正常的p53对Stathmin表达可能存在正性调控作用及二者之间的互相关系。此与Masciarelli等[14]的结果基本一致,提示Stathmin可能是体内正常p53作用的靶基因,二者联合检测可作为三阴性乳腺癌进展及转移评估的重要指标。同时,若能通过抑制p53及Stathmin蛋白在肿瘤中的表达,可为三阴性乳腺癌的治疗提供新的靶点。本研究结果还显示,p53与组织学分级呈正相关,三阴性乳腺癌组织学分级越高、分化越差、预后越差,突显了其在乳腺癌演进过程中扮演重要角色。p53高表达率提示三阴性乳腺癌预后不良,检测三阴性乳腺癌中p53表达可作为指导临床诊治及判断预后的重要参考指标。
综上所述,Stathmin和p53蛋白在三阴性乳腺癌组织中呈过表达,二者可能在三阴性乳腺癌发生发展及转移中发挥作用。但本研究为回顾性研究,不足之处在于选取的病理样本为近年来诊断的三阴性乳腺癌病例,不仅病例样本较少且未做进一步的病例随访及生存率分析。
[1] Tong L, Mello-Thoms C, Brennan PC. Descriptive epidemiology of breast cancer in China: incidence, mortality, survival and prevalence[J]. Breast Cancer Research amp; Treatment, 2016,159(3):1-12.
[2] Rubin CI, Atweh GF. The role of stathmin in the regulation of the cell cycle[J]. J Cell Biochem, 2004,93(2):242-250.
[3] Speidel D. The role of DNA damage responses in p53 biology[J]. Arch Toxicol, 2015,89(4):501-517.
[4] Sabapathy K. The Contrived Mutant p53 Oncogene - Beyond Loss of Functions[J]. Front Oncol, 2015,5:276.
[5] Wasylishen AR, Lozano G. Attenuating the p53 Pathway in Human Cancers: Many Means to the Same End[J]. Cold Spring Harb Perspect Med, 2016,6(8):pii: a026211.
[6] Alli E, Yang JM, Ford JM, et al. Reversal of stathmin-mediated resistance to paclitaxel and vinblastine in human breast carcinoma cells[J]. Mol Pharmacol, 2007,71(5):1233-1240.
[7] Belletti B, Baldassarre G. Stathmin: a protein with many tasks. New biomarker and potential target in cancer[J]. Expert Opin Ther Targets, 2011,15(11):1249-1266.
[8] Machado-Neto JA, de Melo CP, Favaro P, et al. Stathmin 1 is involved in the highly proliferative phenotype of high-risk myelodysplastic syndromes and acute leukemia cells[J]. Leuk Res, 2014,38(2):251-257.
[9] Biaoxue R, Xiguang C, Hua L, et al. Stathmin-dependent molecular targeting therapy for malignant tumor: the latest 5 years′ discoveries and developments[J]. J Transl Med, 2016,14(1):279.
[10] Cordani M, Pacchiana R, Butera G, et al. Mutant p53 proteins alter cancer cell secretome and tumour microenvironment: Involvement in cancer invasion and metastasis[J]. Cancer Lett, 2016,376(2):303-309.
[11] Baquero MT, Hanna JA, Neumeister V, et al. Stathmin expression and its relationship to microtubule-associated protein tau and outcome in breast cancer[J]. Cancer, 2012,118(19):4660-4669.
[12] Dookeran KA, Dignam JJ, Ferrer K, et al. p53 as a marker of prognosis in African-American women with breast cancer[J]. Ann Surg Oncol, 2010,17(5):1398-1405.
[13] Carney BK, Cassimeris L. Stathmin/oncoprotein 18, a microtubule regulatory protein, is required for survival of both normal and cancer cell lines lacking the tumor suppressor, p53[J]. Cancer Biol Ther, 2010,9(9):699-709.
[14] Masciarelli S, Fontemaggi G, Di Agostino S, et al. Gain-of-function mutant p53 downregulates miR-223 contributing to chemoresistance of cultured tumor cells[J]. Oncogene, 2014,33(12):1601-1608.
10.3969/j.issn.1002-266X.2017.41.024
R737.9
B
1002-266X(2017)41-0071-03
莆田学院科技项目(2015045)。
2017-07-10)

