血浆循环肿瘤DNA SEPT9基因甲基化与血清CEA及CA19-9在结直肠癌辅助诊断中的价值
刘伟,付波,张安琪,刘义华,卢燕,张姗,唐文强,潘丽
(聊城市人民医院,山东聊城252000)
血浆循环肿瘤DNA SEPT9基因甲基化与血清CEA及CA19-9在结直肠癌辅助诊断中的价值
刘伟,付波,张安琪,刘义华,卢燕,张姗,唐文强,潘丽
(聊城市人民医院,山东聊城252000)
目的比较SEPT9基因甲基化(mSEPT9)与癌胚抗原(CEA)及糖类抗原19-9(CA19-9)在结直肠癌(CRC)辅助诊断中的价值。方法收集CRC 35例(CRC组)、结肠直肠腺瘤65例(腺瘤组)和健康对照人群104例(对照组)的外周血样本,通过Real-time PCR法检测血浆mSEPT9状态,通过化学发光法检测血清CEA和CA19-9。结果CRC组、腺瘤组、对照组血浆mSEPT9阳性率分别为74.29%(26/35)、12.31%(8/65)、1.92%(2/104),组间比较差异有统计学意义(P均lt;0.001)。CRC组、腺瘤组、对照组血清CEA阳性率分别为34.29%(12/35)、3.18%(2/63)、1.92%(2/104),组间比较差异有统计学意义(P均lt;0.001)。CRC组、腺瘤组、对照组血清CA19-9阳性率分别为17.14%(6/35)、0(0/62)、0.96%(1/104),组间比较差异有统计学意义(P均lt;0.001)。在不同TNM分期的CRC患者中mSEPT9阳性率:Ⅰ期60.0%(3/5),Ⅱ期62.5%(5/8),Ⅲ期77.78%(7/9),Ⅳ期84.62%(11/13);CEA阳性率:Ⅰ期0(0/5),Ⅱ期25%(2/8),Ⅲ期22.2%(2/9),Ⅳ期61.54%(8/13);CA19-9阳性率:Ⅰ期0(0/5),Ⅱ期12.5%(1/8),Ⅲ期11.1%(1/9),Ⅳ期30.77%(4/13)。CRC中mSEPT9的灵敏度和特异度分别为74.29%和94.08%,高于CEA及CA19-9单独检测(分别为34.29%和17.14%)或二者联合检测(37.14%)的灵敏度,差异有统计学意义(P均lt;0.01)。mSEPT9在早期(Ⅰ~Ⅱ期)CRC中的阳性率达61.54%,高于CEA及CA19-9的阳性率(分别为15.38%和7.69%),差异有统计学意义(Plt;0.05)。在CRC中mSEPT9与CEA联合的灵敏度为80%,与CA19-9联合的灵敏度为77.14%,三者联合的灵敏度为80%,与mSEPT9单独应用相比均不能显著提高CRC辅助诊断的灵敏度(P均gt;0.05)。结论mSEPT9与CEA和CA19-9相比,在CRC辅助诊断中具有更高的灵敏度,可作为独立的分子标志物,且可用于CRC早期诊断。
结直肠癌;SEPT9基因甲基化;癌胚抗原;糖类抗原19-9
结直肠癌(CRC)是最常见的胃肠道恶性肿瘤之一,其发病率和病死率居恶性肿瘤的第3~4位[1,2],近年发病率呈上升且年轻化趋势。目前国内CRC筛查诊断主要有两种方法:粪便隐血检测(FOBT)和结肠镜检查。FOBT具有简便、无创、经济、耐受性好等优势,但假阳性率较高[3]。全结肠镜检查或乙状结肠镜检查是CRC诊断的金标准,灵敏度及特异度高,但患者依从性差,存在肠道出血及感染风险,左右半肠结果差异明显[4]。肿瘤细胞生物化学的改变可反映其与正常细胞生长、增殖、代谢功能的差异,对肿瘤的诊断、鉴别诊断和预后判断有重要意义。癌胚抗原(CEA)、糖类抗原19-9(CA19-9)等血清学标志物在CRC辅助诊断及预后评估中有重要价值[5]。新近研究发现在CRC发生发展过程中SEPT9基因5′端CpG岛常发生甲基化,导致相应SEPT9基因表达降低,Septin蛋白复合物结构失去稳定,从而扰乱细胞分裂过程,导致细胞朝癌变方向发展[6]。血浆游离DNA中SEPT9基因甲基化(mSEPT9)可作为CRC敏感特异的分子标志物[7]。但mSEPT9与CEA、CA19-9在CRC辅助诊断中的价值比较鲜见报道。2016年8月,我们比较了血浆mSEPT9单独及与血清CEA及CA19-9联合在CRC辅助诊断中的价值。现将结果报告如下。
1 资料与方法
1.1 临床资料 聊城市人民医院2015年8月~2016年7月经组织病理确诊的CRC患者35例(CRC组),男20例、女15例,年龄(64.9±8.83)岁。肿瘤部位:结肠11例,直肠24例。CRC分期:Ⅰ期5例,Ⅱ期8例,Ⅲ期9例,Ⅳ期13例。CRC组织分化程度:低分化腺癌14例,中分化腺癌17例,高分化腺癌4例。结直肠腺瘤65例(腺瘤组),男42例、女23例,年龄(63.7±11.28)岁。肿瘤部位:结肠52例,直肠13例。均为低危腺瘤。健康对照人群104例(对照组),男57例、女47例,年龄(62.4±7.39)岁。排除标准包括既往恶性肿瘤史;既往腹部手术史;接受放疗或化疗患者;妊娠期妇女。三组年龄、性别无统计学差异(P均gt; 0.05)。本研究通过聊城市人民医院伦理委员会批准。
1.2 血浆mSEPT9及血清CEA、CA19-9检测方法 血浆mSEPT9检测:利用Epi proColon 2.0 CE试剂盒,采用磁珠法提取血浆游离DNA(cfDNA),通过Real-time PCR法检测mSEPT9。主要实验步骤:采集10 mL静脉血,(1 350±150)rcf离心12 min。再次离心后转移3.5 mL的血浆至一新的离心管中。加入100 μL磁珠,室温中速旋转混匀45 min。弃上清,转移磁珠至2 mL Eppendorf管。磁珠吸附后,吸弃上清,洗脱DNA。加入150 μL亚硫酸盐溶液80 ℃恒温孵育45 min转化DNA。加入磁珠结合后,洗涤磁珠,干燥后洗脱DNA。PCR反应体系:15 μL PCR预反应液加入15 μL经亚硫酸盐转化的DNA样本,进行三重平行PCR测试。PCR扩增条件:94 ℃预变性20 min;93 ℃变性30 s,62 ℃退火5 s,55.5 ℃延伸35 s,45个循环。PCR结果判读:三个平行测试中,两个及以上mSEPT9 Ct值lt;45结果判定为阳性,反之阴性。血清CEA、CA19-9浓度检测:利用Beckman DXI800全自动化学发光仪测定血清样本中CEA和CA19-9浓度。CEA的截断值为5 mg/L,CA19-9截断值为39 kU/L。
1.3 统计学方法 采用SPSS19.0统计软件。定量资料比较采用t检验或单因素方差分析,率的比较采用χ2检验或Fisher精确检验,基于确切的二项分布计算灵敏度、特异度、阳性预测值和阴性预测值的95%可信区间(95%CI)。Plt;0.05为差异有统计学意义。
2 结果
2.1 三组血浆mSEPT9及血清CEA、CA19-9阳性率比较 CRC组、腺瘤组、对照组血浆mSEPT9阳性率分别为74.29%(26/35)、12.31%(8/65)、1.92%(2/104),组间比较差异有统计学意义(χ2=96.23,P均lt;0.001)。CRC组、腺瘤组、对照组血清CEA水平分别为(56.540±204.723)、(2.209±3.150)、(1.945±1.248)mg/L,组间比较差异有统计学意义(F=5.997,P=0.003)。按照CEA截断值5 mg/L标准,CRC组、腺瘤组、对照组血清CEA阳性率分别为34.29%(12/35)、3.18%(2/63)、1.92%(2/104),组间比较差异有统计学意义(P均lt;0.001)。CRC组、腺瘤组、对照组血清CA19-9水平分别为(128.926±457.903)、(9.094±6.651)、(10.565±7.211)kU/L,组间比较差异有统计学意义(F=5.671,P=0.004)。按照CA19-9截断值39 kU/L标准,CRC组、腺瘤组、对照组血清CA19-9阳性率分别为17.14%(6/35)、0(0/62)、0.96%(1/104),组间比较差异有统计学意义(P均lt;0.001)。在不同分期的CRC患者中mSEPT9阳性率:Ⅰ期60.0%(3/5),Ⅱ期62.5%(5/8),Ⅲ期77.78%(7/9),Ⅳ期84.62%(11/13);CEA阳性率:Ⅰ期0(0/5),Ⅱ期25%(2/8),Ⅲ期22.2%(2/9),Ⅳ期61.54%(8/13);CA19-9阳性率:Ⅰ期0(0/5),Ⅱ期12.5%(1/8),Ⅲ期11.1%(1/9),Ⅳ期30.77%(4/13)。
2.2 血浆mSEPT9、血清CEA和CA19-9单独及联合在CRC辅助诊断中的灵敏度、特异度、阳性预测值和阴性预测值比较 CEA在CRC诊断中的灵敏度低于mSEPT9,差异有统计学意义(χ2=11.283,P=0.002)。CA19-9在CRC诊断中的灵敏度低于mSEPT9,差异有统计学意义(χ2=23.03,Plt;0.001)。在早期(Ⅰ~Ⅱ期)CRC中mSEPT9的灵敏度为61.54%(95%CI:35.52%~82.29%),CEA的灵敏度为15.38%(95%CI:4.33%~42.24%),CA19-9的灵敏度为7.69%(95%CI:1.37%~33.31%),差异有统计学意义(P=0.011)。在晚期(Ⅲ~Ⅳ期)CRC中mSEPT9的灵敏度为81.81%(95%CI:61.48%~92.69%),CEA的灵敏度为45.45%(95%CI:26.92%~65.34%),CA19-9的灵敏度为22.73%(95%CI:10.12%~43.44%),差异有统计学意义(χ2=15.636,Plt;0.001)。CEA和CA19-9联合检测在CRC诊断中的灵敏度为37.14%(95%CI:23.17%~53.66%),低于mSEPT9单独检测的灵敏度,差异有统计学意义(χ2=9.785,P=0.002)。CEA和mSEPT9联合检测在CRC中的灵敏度为80%(95%CI:64.11%~89.96%),与单独mSEPT9检测相比差异无统计学意义(χ2=0.324,P=0.777)。CA19-9和mSEPT9联合检测在CRC中的灵敏度为77.14%(95%CI:60.98%~87.93%),与单独mSEPT9检测差异无统计学意义(χ2=0.078,P=1)。CEA、CA19-9和mSEPT9联合检测在CRC中的灵敏度为80%(95%CI:64.11%~89.96%),与单独mSEPT9检测差异无统计学意义(χ2=0.324,P=0.777)。见表1。
3 讨论
CRC早期症状不典型,早期诊断率仅为5%,60%~70%的CRC患者确诊时已进展为中晚期[8],病死率高,预后差,因此有效的早期筛查、诊断及干预治疗是CRC防治的关键。
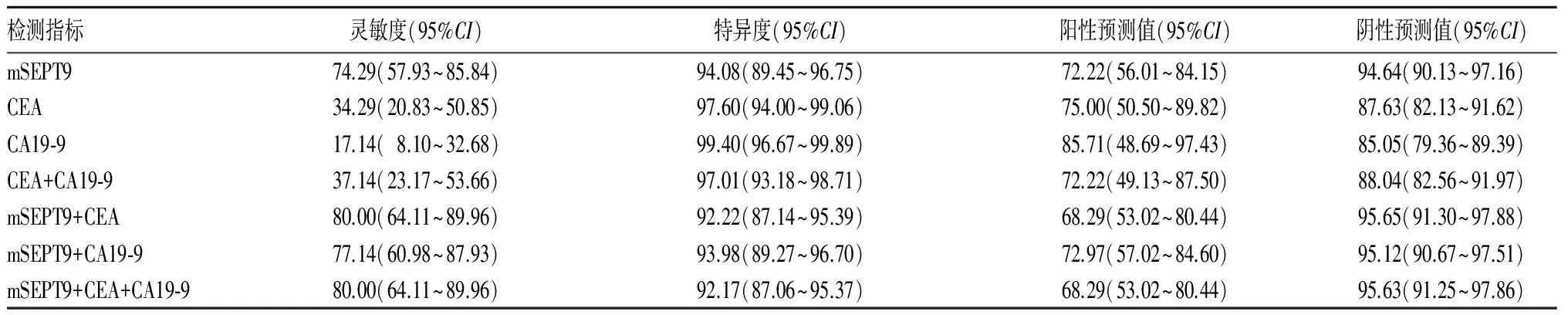
表1 血浆mSEPT9、血清CEA和CA19-9单独及联合检测在CRC辅助诊断中的灵敏度、特异度、阳性预测值和阴性预测值比较(%)
现有研究报道证实,血浆mSEPT9在CRC辅助诊断中具有良好的灵敏度(56.1%~79.3%)和特异度(89.6%~99.1%)[7,9,10]。本研究中血浆mSEPT9用于CRC诊断灵敏度和特异度分别为74.29%和94.08%,与文献报道一致。胃肠道血清学肿瘤标志物如CEA、CA19-9等已用于CRC的筛查、辅助诊断、肿瘤分级等,但这些指标在CRC诊断中敏感性较低[11]。CEA在CRC诊断中的灵敏度为40.9%~51.8%,特异度为85.2%~95%[12,13]。CA19-9在CRC辅助诊断中的灵敏度较CEA低[11]。CA19-9作为CEA的补充,约7.3%患者CA19-9升高而CEA水平不升高[14]。本研究中CEA和CA19-9在CRC中的灵敏度分别为34.29%和17.14%,均显著低于mSEPT9。在61.53%CRC患者中mSEPT9检测阳性而CEA不升高,在80.77%的患者中mSEPT9检测阳性而CA19-9不升高。以上结果说明mSEPT9与CEA及CA19-9血清学肿瘤标志物相比在CRC辅助诊断中具有更高的灵敏度。本研究结果显示,mSEPT9在CRC中的灵敏度为74.29%,显著高于CEA(34.29%)、CA19-9(17.14%)单独或联合检测(37.14%)。在早期(Ⅰ~Ⅱ期)CRC中mSEPT9的灵敏度61.54%,高于CEA(15.38%)及CA19-9(7.69%),差异有统计学意义,说明mSEPT9用于早期CRC的辅助诊断优于CEA和CA19-9,具有更高的敏感性,有望成为CRC早期辅助诊断的指标。
mSEPT9与CEA和(或)CA19-9联合应用均不能提高CRC辅助诊断的灵敏度,差异无统计学意义,说明mSEPT9可以独立作为CRC辅助诊断的分子标记物。但本研究CRC患者样本较少,需要继续扩大样本量进行更大规模的研究来进一步验证mSEPT9与CEA、CA19-9联合检测的价值。
综上所述,mSEPT9与CEA、CA19-9相比在CRC辅助诊断中具有更高的灵敏度,可作为独立的分子标记物用于CRC早期诊断。
[1] 赵慧霞,李秋文,董伟伟,等.粪便SEPT9基因甲基化检测在结直肠癌早期诊断中的应用研究[J].中华临床医师杂志(电子版),2012,6(10):42-45.
[2] 吴东,杨红,李玥,等.外周血甲基化Septin9基因联合粪便免疫化学试验对专科门诊患者结直肠癌和腺瘤的筛查[J].中华消化杂志,2016,36(2):107-112.
[3] 邓尚新,蔡全才,李兆申.大肠癌筛查方法的研究进展[J].胃肠病学和肝病学杂志,2010,19(2):99-102.
[4] 赵晓敏,李云涛,季国忠.结直肠癌筛查现状与进展[J].中国临床研究,2016,29(6):838-841.
[5] Duffy MJ, Lamerz R, Haglund C, et al. Tumor markers in colorectal cancer, gastric cancer and gastrointestinal stromal cancers: European group on tumor markers 2014 guidelines update[J]. Int J Cancer, 2014,134(11):2513-2522.
[6] 贺娜,吴开春.血浆甲基化septin9基因与结直肠癌相关性的研究进展[J].中华消化杂志,2015,35(5):358-360.
[7] Warren JD, Xiong W, Bunker AM, et al. Septin 9 methylated DNA is a sensitive and specific blood test for colorectal cancer[J]. BMC Med, 2011,9(1):133.
[8] 褚文慧,吴开春.外周血SEPT9 DNA甲基化检测在结直肠癌筛查中的应用[J].胃肠病学,2015,20(10):622-624.
[9] Song L, Li Y. SEPT9: A Specific Circulating Biomarker for Colorectal Cancer[J]. Adv Clin Chem, 2015,72(1):171-204.
[10] Payne SR. From discovery to the clinic: the novel DNA methylation biomarker (m)SEPT9 for the detection of colorectal cancer in blood[J]. Epigenomics, 2010,2(4):575-585.
[11] Zhang SY, Lin M, Zhang HB. Diagnostic value of carcinoembryonic antigen and carcinoma antigen 19-9 for colorectal carcinoma[J]. Int J Clin Exp Pathol, 2015,8(8):9404-9409.
[12] Toth K, Sipos F, Kalmar A, et al. Detection of methylated SEPT9 in plasma is a reliable screening method for both left- and right-sided colon cancers[J]. PLoS One, 2012,7(9):e46000.
[13] Wild N, Andres H, Rollinger W, et al. A combination of serum markers for the early detection of colorectal cancer[J]. Clin Cancer Res, 2010,16(24):6111-6121.
[14] Stiksma J, Grootendorst DC, van der Linden PW. CA 19-9 as a marker in addition to CEA to monitor colorectal cancer[J]. Clin Colorectal Cancer, 2014,13(4):239-244.
10.3969/j.issn.1002-266X.2017.41.023
R735.3
B
1002-266X(2017)41-0068-03
付波(E-mail:fubo.22@163.com)
2017-06-02)

