镍铝合金催化油酸甲酯加氢饱和的热力学和动力学分析
孙培永,刘 森,周玉鹏,戚 琪,张胜红,姚志龙(北京石油化工学院 化学工程学院,恩泽生物质精细化工北京市重点实验室,北京 102617)
油脂化工
镍铝合金催化油酸甲酯加氢饱和的热力学和动力学分析
孙培永,刘 森,周玉鹏,戚 琪,张胜红,姚志龙
(北京石油化工学院 化学工程学院,恩泽生物质精细化工北京市重点实验室,北京 102617)
油酸甲酯;硬脂酸甲酯;催化加氢;基团贡献法;热力学分析;反应动力学

Ni基金属催化剂由于具有较高的加氢活性和低廉的制备成本,被广泛应用于植物油脂和不饱和FAME的加氢反应中[7-12]。在油脂及其衍生物加氢饱和的动力学和反应机理方面,Bern等[13-14]采用经验模型法详细地研究了Ni基催化剂催化菜籽油的加氢过程,并给出了相应的幂函数动力学方程。Jonker等[15]基于两种不同类型吸附位点的反应机制推导出油酸甲酯 (C18∶1FAME) 加氢饱和的速率方程,能够和实验测得的油酸甲酯加氢反应动力学数据较好地吻合。Cabrera等[16-17]在Ni/Al2O3催化油酸甲酯加氢反应中进一步发现反应物在催化剂表面竞争或半竞争的吸附模型,在此基础上拟合出了更为合理的反应速率方程。

1 材料与方法
1.1 实验材料
FAME工业品(其中油酸甲酯、棕榈油酸甲酯 (C16∶1FAME) 和其他饱和脂肪酸甲酯的含量分别为65.2%、1.6%和33.2%),江西旭峰化工实业有限公司;Ni-Al合金细粉催化剂 (粒径小于75 μm),江苏泰利达科技有限公司;氢气 (纯度99.999%),北京氦普北分气体工业有限公司。
Parr 5500系列不锈钢高压反应釜 (0.6 L,Φ70 mm×160 mm),美国Parr公司;Shimadzu GC2010气相色谱仪,日本岛津制作所。
1.2 实验方法
1.2.1 油酸甲酯的加氢实验
油酸甲酯的加氢实验在Parr 5500系列不锈钢高压反应釜内进行。首先在反应釜内加入250 g FAME原料和0.5%的Ni-Al合金细粉催化剂,以氮气置换反应釜内空气3次并以10 K/min的速率在氮气氛围中升至反应温度。到达目标温度后以氢气置换氮气3次并增压至反应压力 (1.0~2.5 MPa),同时开启搅拌 (1 000 r/min) 并记为反应的开始时间,即t=0。为简单计算,忽略少量C16∶1FAME加氢饱和的影响,只考虑油酸甲酯的加氢饱和,其初始浓度c0为1.62 mol/L。
1.2.2 分析方法
Ni-Al合金催化油酸甲酯加氢反应过程中原料和产物硬脂酸甲酯的浓度采用配有HP-5 ms毛细管色谱柱(30 m×0.25 mm×0.25 μm)的Shimadzu GC2010气相色谱仪进行分析。
分析条件:进样口温度和检测器温度573 K;柱前压28.2 kPa;分流比50∶1;柱温373 K,恒温5 min,5 K/min的速率升温至473 K,然后以10 K/min的速率升温至553 K并恒温15 min。
反应产物中各组分的含量采用面积归一化法进行计算。反应的转化率表示为转化的油酸甲酯质量与原料中油酸甲酯质量的比值,而反应的选择性在实验条件下始终为100%,即产物中除硬脂酸甲酯 (C18∶0FAME) 外未见其他副产物。
2 结果与讨论
2.1 反应热力学分析
在433~463 K温度范围内,油酸甲酯在Ni-Al合金催化下加氢饱和制备硬脂酸甲酯为典型的气、液、固三相催化反应,反应中氢气的热力学基础数据可以直接查表[18]得到,但油酸甲酯和硬脂酸甲酯的热力学基础数据尚未有系统的报道。因此,本文首先采用基团贡献法估算反应物和产物的热力学基础数据并据此进一步分析反应的热力学。
2.1.1 气态条件下热力学数据的估算
(1)
(2)
(3)

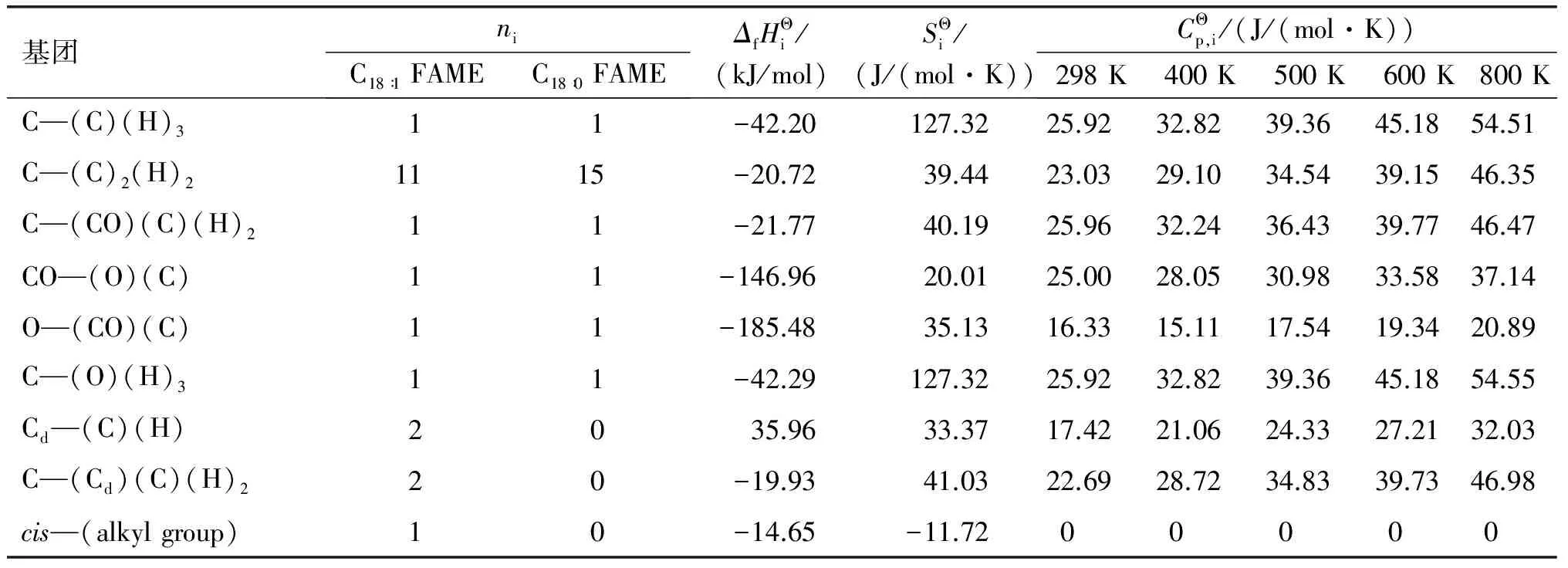
表1 油酸甲酯和硬脂酸甲酯的热力学基团贡献值 (Benson法)

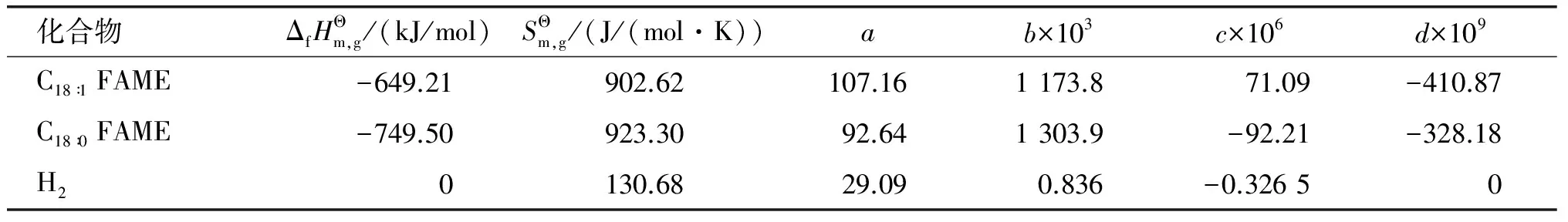
表2 氢气、油酸甲酯和硬脂酸甲酯的热力学数据
2.1.2 沸点及临界参数的估算

Tb=204.359ln(∑niΔTbi+∑njΔTbj)
(4)
Tc=181.728ln(∑niΔTci+∑njΔTcj)
(5)
pc=1.370 5+(0.100 220+∑niΔpci+∑njΔpcj)-2
(6)
(7)

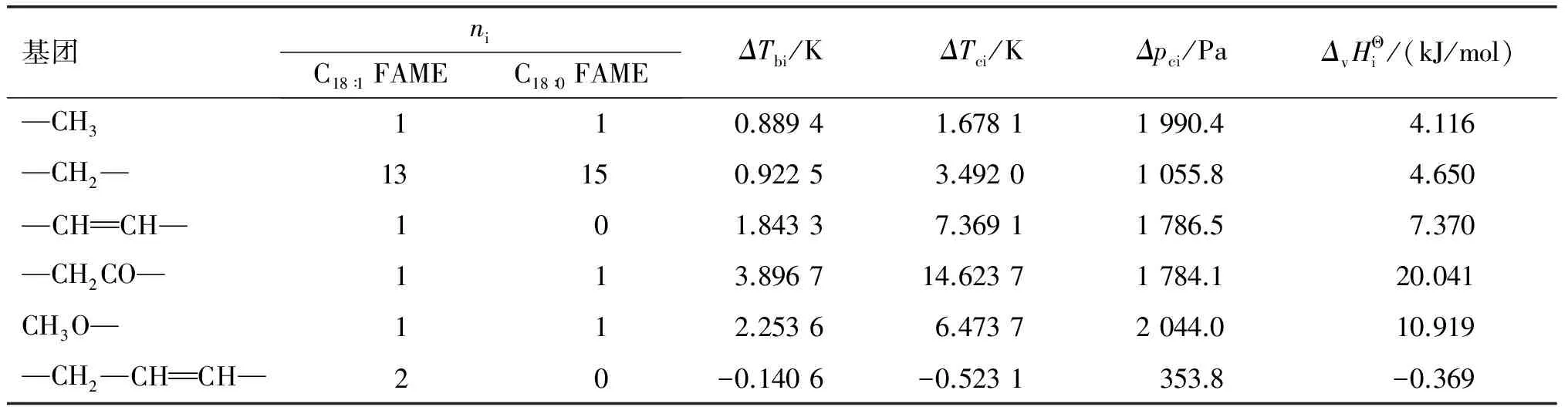
表3 油酸甲酯和硬脂酸甲酯的热力学基团贡献值(C-G法)
由C-G法估算得到的油酸甲酯和硬脂酸甲酯的沸点分别为618.19 K和620.98 K,这与Krop等[24]通过实验法测得的结果吻合。二者的Tc(783.38、784.98 K)和pc(1.110、1.134 MPa)数值也和Nikitin等[25]得到的实验数据接近,进一步表明C-G法估算得到的油酸甲酯和硬脂酸甲酯的热力学数据是可信的,可以用于反应热力学的分析。
2.1.3 液相条件下热力学数据的估算
(8)
(9)

(10)
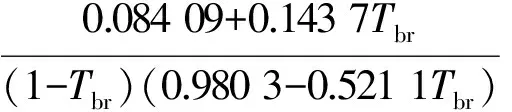
(11)
式中:Tr和pr分别为对比温度和对比压力,在数值上分别等于T/Tc和pΘ/pc;ω为偏心因子,无量纲;Tbr在数值上等于Tb/Tc。

表4 油酸甲酯和硬脂酸甲酯的热力学数据
2.1.4 反应的热力学分析
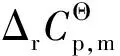
(12)
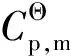
(13)
(14)
(15)
(16)
(17)
(18)
(19)
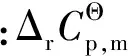
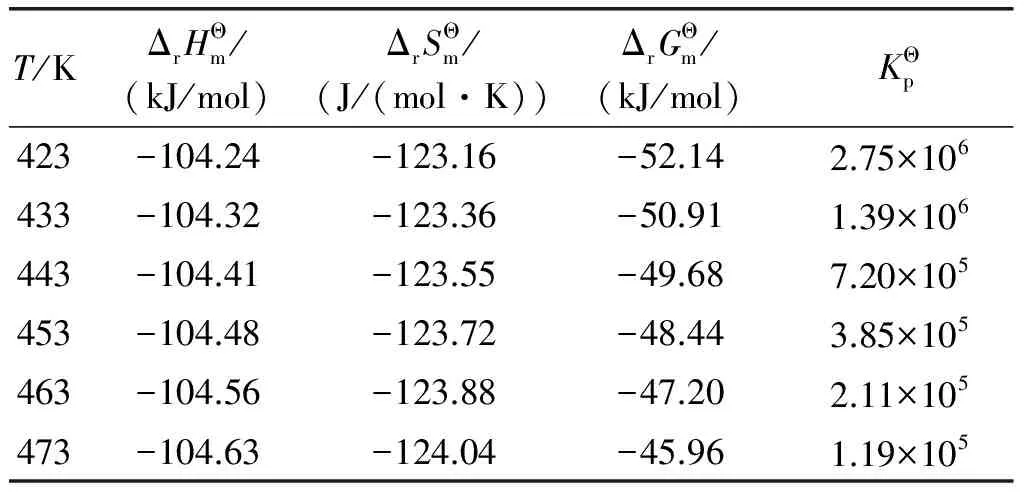
表5 油酸甲酯加氢反应的热力学数据
由表5可知,随反应温度从423 K升高到473 K,反应的标准摩尔反应焓从-104.24 kJ/mol缓慢降低到-104.63 kJ/mol,表明油酸甲酯加氢饱和制备硬脂酸甲酯为典型的放热反应且反应热对温度不敏感;同时,反应的Gibbs自由能变随反应温度升高则从-52.14 kJ/mol增大到-45.96 kJ/mol,标准平衡常数也随2.75×106降低到1.19×105,意味着升高反应温度不利于反应平衡向产物方向移动。但即使在473 K反应的标准平衡常数仍大于105,表明油酸甲酯加氢反应进行较为彻底,逆反应对化学平衡的影响可以忽略不计。
2.2 动力学反应数据
Ni-Al合金催化不饱和脂肪酸甲酯加氢饱和为典型的气、液、固三相催化反应,反应动力学数据的采集和分析首先需要排除传质的影响。图1为不同搅拌速率下油酸甲酯的转化率曲线。
从图1可以看出,当搅拌速率大于1 000 r/min时,油酸甲酯的转化率曲线与1 000 r/min的基本重合,表明搅拌速率超过1 000 r/min时外扩散的影响可以消除。文献[27]研究结果也证实,当催化剂粒度小于100 μm 时,内扩散的影响基本可以忽略。因此,在Ni-Al合金催化剂粒度小于 75 μm 且反应釜搅拌速率超过1 000 r/min的实际反应条件下,传质对油酸甲酯转化速率的影响可以忽略。

图1 搅拌速率对C18∶1 FAME转化率的影响
在消除传质影响的反应条件下,固定1.62 mol/L的油酸甲酯初始浓度和0.5%的催化剂用量,考察了氢气压力对油酸甲酯转化率的影响,结果如图2所示。

图2 氢气压力对C18∶1 FAME转化率的影响
从图2可以看出,当反应温度为453 K时,反应30 min后油酸甲酯转化率随氢气压力从1.0 MPa增加到2.5 MPa相应从14.08% 提高到34.79%;在反应压力为2.0 MPa时,反应30 min后油酸甲酯的转化率随反应温度从433 K提升到463 K而相应从20.13% 提高到36.04%。这表明反应温度和氢气压力的增加都有利于提高油酸甲酯转化率。
为获得准确的反应速率,反应物浓度c与反应时间t的关系采用三次多项式方程对离散的实验数据点进行拟合,所得拟合方程(R2gt;0.99)进一步微分即可得到相应的反应速率r,如表6所示。

表6 油酸甲酯浓度和反应速率随反应时间的变化关系
续表6

氢气压力/MPa反应时间/min浓度/(mol/L)433K443K453K463K反应速率r/(mol/(L·min))433K443K453K463K1.030-1.45801.38671.3189-0.37080.61040.63461.040-1.42071.33011.2589-0.37670.51490.56921.050-1.38261.28541.2041-0.38480.36990.53341.060-1.30351.25771.1513-0.40760.17560.52741.5101.50021.49371.4395-0.59600.94040.9204-1.5201.44321.40721.3513-0.54410.78820.8447-1.5301.39151.33631.2702-0.49110.62900.7803-1.5401.34501.28161.1949-0.43700.46260.7275-1.5501.26871.24401.1243-0.32550.28920.6861-1.5601.21511.22401.0573-0.20960.10870.6562-2.0101.45991.43391.41621.31440.89581.02121.62431.62142.0201.37401.33481.26771.15760.82410.95951.35451.50982.0301.29491.24231.14361.01350.75740.88831.13641.36672.0401.22231.15741.03870.88530.69580.80750.97001.19192.0501.15561.08110.94790.77620.63930.71720.85520.98552.0601.09431.01430.86590.68920.58790.61720.79220.74752.5101.43591.40921.30761.18201.11261.32371.50831.31302.5201.33711.29181.16861.04740.88401.04441.28211.36172.5301.25521.19611.04920.91290.77240.89071.11761.31252.5401.17871.10950.94300.78820.77780.86251.01491.16532.5501.09581.01940.84410.68310.90010.95990.97390.92012.5600.99480.91330.74620.60741.13941.18280.99460.5769
2.2.1 动力学模型的建立
图2和表6中的数据表明油酸甲酯转化率和反应速率受反应温度、原料浓度和氢气压力的影响。实验过程中氢气压力控制在1.0~2.5 MPa,此压力范围内氢气在脂肪酸甲酯中的溶解度近似遵从亨利定律[27],即脂肪酸甲酯中溶解的氢气的浓度近似与氢气压力成正比。因此,反应条件下油酸甲酯加氢饱和的速率方程可以采用经验模型法近似表示为反应温度、油酸甲酯浓度和氢气压力的函数,即式(20):
(20)
式中:A为指前因子;p为氢气压力,MPa;α和β分别为对应反应物的级数;Ea为表观活化能,kJ/mol。
对此方程两边取对数得式 (21):

(21)
式(21)可以进一步简化为三元一次线性方程:
y=b0+b1x1+b2x2+b3x3
(22)
式中:变量x1、x2和x3分别代表1/T、lnc和lnp;斜率b1、b2和b3分别代表-Ea/R、α和β;截距b0为指前因子A的函数lnA。
2.2.2 动力学参数回归与模型检验
依据最小二乘法原理,利用Excel对表6中的数据进行多元线性回归可得到式 (22) 中各参数的值,结果见表7。

表7 多元线性回归结果
由表7可知,参数b0、b1、b2和b3的回归结果依次为-7.595 3、-5 235.8、1.14和1.31,进而可以计算出式 (20) 中的指前因子A的数值为5.03×10-4,表观活化能Ea为43.53 kJ/mol,油酸甲酯浓度和氢气压力的反应级数分别为1.14和1.31。采用最小二乘法拟合得到的表观活化能与文献报道的Pt/C催化油酸甲酯加氢饱和表观活化能(45.1 kJ/mol)[28]吻合。此外,α的拟合数值为1.14,表明该反应对不饱和FAME近似为一级反应;β的数值为1.31,说明在1.0~2.5 MPa氢气压力条件下反应速率受氢气压力的影响更为明显。相应地,在433~463 K温度区间内油酸甲酯加氢反应的速率方程可以写为:
(23)
拟合方程式 (23) 对整体实验数据的表达能力需要进行模型显著性检验。式 (23) 中各参数是实验数据在95%的置信度条件下多元线性回归分析所得,对应多元线性回归的复决定系数R2的数值为0.854 5,表明因变量 (lnr) 变异的85.45%可由自变量 (1/T、α和β) 进行解释;F显著性统计量的P值为9.99×10-32,远远低于显著性水平0.05。这表明速率方程模型整体上是高度显著且可信的,能够很好地描述反应的动力学特征。自变量x1、x2和x3的回归系数t统计量的P值依次为3.55×10-21、1.29×10-14和2.63×10-31(见表7),均远远低于显著性水平0.05,进一步表明各自变量和因变量之间存在相关性且回归系数显著。
将表6中的反应温度、油酸甲酯浓度和氢气压力数据带入拟合方程式 (23),计算各反应条件下的理论转化速率并与实验值 (实测转化率数据点的拟合曲线的微分结果) 相比较,结果如图3所示。
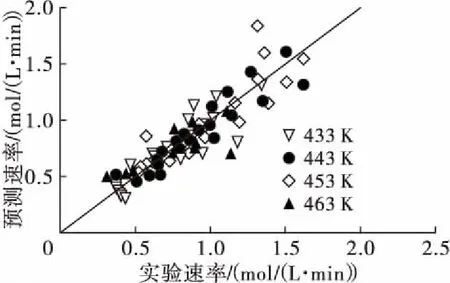
图3 反应速率实验值和理论值的比较
从图3可以看出,反应速率实验值和预测值线性相关性良好,线性回归的复决定系数R2为0.845 7,标准误差为0.125 0,回归系数t统计量的P值为5.49×10-33,表明理论值和实验值具有较高的吻合度,进一步验证了动力学模型的可靠性。
3 结 论
在缺少热力学基础数据的情况下,本文首先采用Benson基团贡献法、C-G基团贡献法、对应状态法等方法对油酸甲酯和硬脂酸甲酯的物性数据进行估算,在此基础上计算油酸甲酯加氢饱和的热力学数据并进行分析。同时,采用实验方法测定油酸甲酯浓度、氢气压力、反应温度对油酸甲酯加氢反应速率的影响,拟合出反应的动力学方程并计算反应的表观活化能。通过对Ni-Al合金催化油酸甲酯加氢饱和制备硬脂酸甲酯反应热力学和动力学的分析,得到以下结论:
(1)油酸甲酯加氢饱和制备硬脂酸甲酯为放热反应,在433~463 K温度区间反应的标准摩尔反应焓约为-104.5 kJ/mol,且反应完全,平衡常数大于105。

[1] YAAKOB Z, MOHAMMAD M, ALHERBAWI M, et al. Overview of the production of biodiesel from waste cooking oil[J]. Renew Sustain Energy Rev, 2013, 18: 184-193.
[2] MOHAMMAD M, HARI T K, YAAKOB Z, et al. Overview on the production of paraffin based-biofuels via catalytic hydrodeoxygenation[J]. Renew Sustain Energy Rev, 2013, 22: 121-132.
[3] 张家仁, 邓甜音, 刘海超. 油脂和木质纤维素催化转化制备生物液体燃料[J]. 化学进展, 2013, 25(2/3):192-208.
[4] 马冰, 张晶晶, 崔慧梅, 等. 油脂催化转化为绿色燃料的技术进展[J]. 中国科学: 化学, 2015, 45(4): 350-360.
[5] 任阳阳, 宋运晶, 段艳, 等. 高水热稳定性加氢脱氧Ni-Mo 复合氧化物催化剂的制备[J]. 高校化学工程学报, 2015, 29(3): 621-627.

[7] 陈凌霞, 刘寿长. 不饱和油脂加氢制硬化油催化剂的研究(I)——制备条件对催化剂活性的影响[J]. 中国油脂, 2002, 27(3): 43-46.
[8] 陈凌霞, 刘寿长, 霍胜娟. 新型油脂加氢催化剂Ni-B/SiO2非晶态合金的研究[J]. 中国油脂, 2003, 28(8): 66-68.
[9] 蒋惠亮, 王相明, 毛孙房, 等. 高活性油脂加氢催化剂的制备[J]. 中国油脂, 2013, 38(7): 69-72.
[10] 赵焕利, 蒋惠亮, 赵起, 等. 油脂加氢镍基纳米催化剂的研究[J]. 中国油脂, 2015, 40(8): 54-58.
[11] 刘伟, 于海斌, 陈永生, 等. 载体对镍基催化剂不饱和油脂加氢性能的影响[J]. 无机盐工业, 2015, 47(3): 76-78.
[12] 刘伟, 于海斌, 陈永生, 等. Ni/γ-Al2O3油脂加氢催化剂的制备研究[J]. 中国油脂, 2014, 39(3): 54-57.
[13] BERN L, HELL M, SCHOON N H. Kinetics of hydrogenation of rapeseed oil: I. Influence of transport steps in kinetic study[J]. J Am Oil Chem Soc, 1975, 52(6): 182-187.
[14] BERN L, HELL M, SCHOON N H. Kinetics of hydrogenation of rapeseed oil: II. Rate equations of chemical reactions[J]. J Am Oil Chem Soc, 1975, 52(10): 391-394.
[15] JONKER G H, VELDSINK J W, BEENACKERS A A C M. Intrinsic kinetics of 9-monoenic fatty acid methyl ester hydrogenation over nickel-based catalysts[J]. Ind Eng Chem Res, 1997, 36(5): 1567-1579.
[16] CABRERA M I, GRAU R J. Liquid-phase hydrogenation of methyl oleate on a Ni/α-Al2O3catalyst: a study based on kinetic models describing extreme and intermediate adsorption regimes[J]. J Mol Catal A: Chem, 2006, 260(1/2): 269-279.
[17] CABRERA M I, GRAU R J. Methyl oleate isomerization and hydrogenation over Ni/α-Al2O3: a kinetic study recognizing differences in the molecular size of hydrogen and organic species[J]. J Mol Catal A: Chem, 2008, 287(1/2): 24-32.
[18] LIDE D R. CRC handbook of chemistry and physics[M]. 84th ed. Boca Raton: CRC Press, 2003.
[19] POLING B E, PRAUSNITZ J M, O’CONNEL J P. The properties of gases and liquids[M]. 5th ed. USA: McGraw-Hill Education, 2005.
[20] 马沛生. 化工数据[M]. 北京: 中国石化出版社, 2003.
[21] 王琳琳, 陈建云, 梁杰珍, 等. 枞酸与甲醇酯化反应的基团贡献法热力学分析[J]. 化工学报, 2013, 64(6): 1900-1906.
[22] 马沛生, 夏淑倩, 夏清. 化工物性数据简明手册[M]. 北京: 化学工业出版社, 2013.
[23] MARRERO J, GANI R. Group-contribution based estimation of pure component properties[J]. Fluid Phase Equilib, 2001, 183-184: 183-208.
[24] KROP H B, VELZEN M J M, PARSONS J R, et al. Determination of environmentally relevant physical-chemical properties of some fatty acid esters[J]. J Am Oil Chem Soc, 1997, 74(3): 309-315.
[25] NIKITIN E D, POPOV A P. Vapor-liquid critical point measurements of fifteen compounds by the pulse-heating method[J]. Fluid Phase Equilib, 2014, 380: 11-17.
[26] 董新法, 方利国, 陈砺. 物性估算原理及计算机计算[M]. 北京: 化学工业出版社, 2006.
[27] KONKOL M, WROBEL W, BICKI R, et al. The influence of the hydrogen pressure on kinetics of the canola oil hydrogenation on industrial nickel catalyst[J]. Catalysts, 2016, 6(4): 55-68.
[28] DELIY I V, SIMAKOVA I L, RAVASIO N, et al. Catalytic behaviour of carbon supported platinum group metals in the hydrogenation and isomerization of methyl oleate[J]. Appl Catal A: Gen, 2009, 357(2): 170-177.
ThermodynamicandkineticsanalysisofcatalytichydrogenationofmethyloleateoverNi-Alalloy
SUN Peiyong,LIU Sen,ZHOU Yupeng, QI Qi,ZHANG Shenghong,YAO Zhilong
(Beijing Key Laboratory of Enze Biomass Fine Chemicals, College of Chemical Engineering,Beijing Institute of Petrochemical Technology,Beijing 102617,China)

methyl oleate; methyl stearate; catalytic hydrogenation; group-contribution method; thermodynamic analysis; reaction kinetics
2017-01-25;
2017-06-28
北京市属高等学校高层次人才引进与培养计划项目资助(长城学者:CITamp;TCD 20150316)
孙培永(1979),男,讲师,博士,研究方向为油脂化学(E-mail)sunpeiyong@bipt.edu.cn。
张胜红,副教授(E-mail)zshong@bipt.edu.cn。
O643.12;TQ644.5
A
1003-7969(2017)10-0093-08

