鼻咽癌肿瘤组织中IgM的表达及其临床意义*
许胜恩,徐伟,赵飞鹏,杨金亮,梁传余,覃纲
[1.西南医科大学附属医院 耳鼻咽喉头颈外科,四川 泸州 646000;2.四川大学华西医院生物治疗国家重点实验室(肿瘤生物治疗研究室),四川 成都 610041;3.四川大学华西医院 耳鼻咽喉头颈外科,四川 成都 610041]
临床研究·论著
鼻咽癌肿瘤组织中IgM的表达及其临床意义*
许胜恩1,徐伟1,赵飞鹏1,杨金亮2,梁传余3,覃纲1
[1.西南医科大学附属医院 耳鼻咽喉头颈外科,四川 泸州 646000;2.四川大学华西医院生物治疗国家重点实验室(肿瘤生物治疗研究室),四川 成都 610041;3.四川大学华西医院 耳鼻咽喉头颈外科,四川 成都 610041]
目的检测鼻咽癌(NPC)组织中免疫球蛋白M(IgM)的表达,结合患者临床病理特征及生存预后,探讨其相互关系。方法采用免疫组织化学SABC法检测92例NPC组织中IgM的表达,选取同期50例病理诊断为鼻咽部炎症组织作为对照,结合NPC患者临床病理资料和预后情况进行分析。结果NPC组织中IgM阳性表达率为68.48%,高于鼻咽部炎症组织的24.00%(P<0.05)。NPC组织中IgM表达多位于细胞浆,鼻咽部炎症组织则主要在细胞膜,且胞浆表达者多为低分化鳞癌,细胞膜表达者多为高、中分化磷癌。IgM表达与NPC患者T分期、临床分期有关(P<0.05),与鼻咽部或颈部复发及全身转移无关(P>0.05)。IgM表达阳性组的NPC患者总体生存率(57.14%)高于IgM表达阴性组(27.59%)(P<0.05),但两者无瘤生存率比较,差异无统计学意义(P>0.05)。结论IgM高表达于人NPC组织;IgM高表达可能参与NPC早期发病过程,其是否表达可作为患者生存预后的指标。
鼻咽癌;免疫球蛋白M;免疫组织化学法
作为头颈部肿瘤家族的重要成员,鼻咽癌(nasopharyngeal carcinoma,NPC)全球发病率呈显著的地域特征,中国南方及东南亚地区是全球高发地带[1]。过去的十几年由于放、化疗技术的进步,NPC的局部控制率得到很大的提高,然而多数患者就诊时已达疾病中、晚期,加之患者对放、化疗耐受,放、化疗后局部复发仍然是NPC高死亡率的主要原因[2],故致力于寻找更加敏感的早期诊断指标和有效的治疗靶点成为NPC研究的热门方向。近10年来,随着研究人员不断在非B淋巴细胞来源肿瘤中发现免疫球蛋白(Immunoglobulin,Ig)的表达,传统免疫学关于Ig只产生于成熟B淋巴细胞这一经典理论受到越来越多的挑战。在已发现异位表达的Ig中,主要是以IgG、IgA为主,有关IgM的报道还很少见。本研究着眼于IgM在人NPC组织中的表达,结合患者临床病理特征及生存预后,分析其相互关系,初步探讨异位表达IgM在NPC发病中的作用,旨在为NPC的临床诊断和治疗提供理论参考,以寻求更加有效的诊断和治疗方法。
1 资料与方法
1.1 研究对象
研究标本选取西南医科大学附属医院(原泸州医学院附属医院)1998年1月-2000年12月就诊的有完整随访资料的NPC患者,患者诊断前未经任何治疗。纳入患者92例,其中,男性69例,女性23例;发病年龄18~78岁,中位发病年龄51.50岁。依据1997年国际抗癌联盟制定的NPC TNM分期标准,T122例,T233例,T324例,T413例;N030例,N142例,N211例,N39例;临床分期Ⅰ期1例,Ⅱ期32例,Ⅲ期35例,Ⅳ期24例;病理组织学分类依据世界卫生组织NPC病理分类标准第2版,鳞癌89例,非角化癌(包括未分化癌)3例;鳞癌包括高分化鳞癌3例,中分化鳞癌19例,低分化鳞癌67例。入组患者初诊时均无明确远处转移,确诊后在本院接受根治性放疗,并以患者规范化治疗结束后的出院时间作为随访起始时间,随访截止时间为2005年10月,全组患者随访时间4~94个月,中位随访时间63.50个月。选取同期50例鼻咽部炎性组织作为对照,其病理诊断多为黏膜鳞状上皮慢性炎症或伴淋巴组织增生(49例),1例为鳞状上皮轻度不典型增生。
1.2 主要试剂
SABC、生物素化山羊抗兔Ig及生物素封闭系统购自丹麦DAKO公司,兔抗人IgM多克隆抗体购自美国LAB VISION公司,APES防脱片胶购自北京中杉金桥生物技术有限公司,DAB购自美国Sigma公司。
1.3 方法
1.3.1 组织、切片预处理 组织标本经10%甲醛固定,石蜡包埋,4μm连续切片。将盖玻片和载玻片于清水中浸泡,清洗干净并烘干,用现配的APES和丙酮溶液进行预处理。
1.3.2 免疫组织化学SABC法 石蜡切片依次经二甲苯、酒精、蒸馏水浸泡脱蜡、脱水,再用过氧化氢封闭内源性过氧化物酶,高温水煮进行抗原修复。依次加入以PBS 1∶400稀释的兔抗人IgM一抗、生物素化山羊抗兔二抗及SABC复合物溶液后进行DAB显色。选用扁桃体组织切片作为阳性对照,PBS替代一抗作为阴性对照。
1.4 免疫组织化学法结果判定
显微镜下观察组织染色情况,视细胞浆和/或细胞膜呈棕黄色染色计为阳性细胞。由2位实验人员在完全双盲情况下随机选取10个良好视野,计算肿瘤细胞或上皮细胞中阳性染色细胞的百分率,借鉴汪泱[3]和XIANG等[4]的标准,并做修改:无阳性细胞或阳性细胞比例<10%为阴性(-),10%~25%阳性细胞为弱阳性(+),25%~50%阳性细胞为阳性(++),≥50%阳性细胞计为强阳性(+++),以10%阳性细胞为界,≥10%为IgM阳性表达,否则为阴性。判定过程中,如果研究人员意见不一致,可经讨论后达成一致,必要时可申请第3者参与判定。
1.5 统计学方法
数据分析采用SPSS 12.0统计软件,计数资料以率表示,组间比较用χ2检验;采用Kaplan-Meier法计算生存率,并进行生存分析;Log-rank法进行差异性检验,运用COX回归模型进行多因素生存预后分析,检验水准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 IgM在NPC组织中的表达
2.1.1 IgM阳性表达率比较 NPC组与对照组的IgM阳性表达率比较,差异有统计学意义(χ2=25.716,P=0.000),NPC组织中IgM存在优势表达。见表1。2.1.2 IgM表达部位及特点 NPC组织中IgM阳性表达部位主要位于细胞浆,少数位于细胞膜;NPC组织中IgM细胞浆表达的多为低分化鳞癌,而IgM细胞膜表达的多为高、中分化磷癌。鼻咽部炎症组织中IgM表达大多数位于细胞膜,仅少数位于细胞浆(P<0.05)。见表 2、3 和图 1。
2.2 NPC组织中IgM表达与患者临床病理特征的关系
NPC组织中IgM表达与NPC患者的临床分期、T分期有关(P<0.05);与患者病程、性别、发病年龄、组织分化程度、颈淋巴结转移、病理分型无关(P>0.05)。见表 4。
2.3 NPC组织中IgM表达与预后的关系
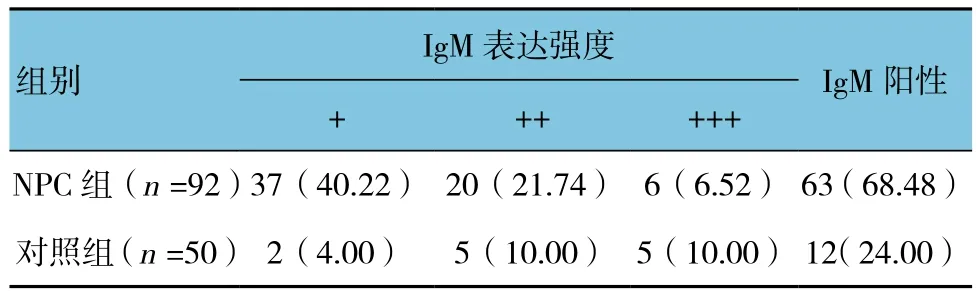
表1 两组患者IgM阳性表达的比较 例(%)
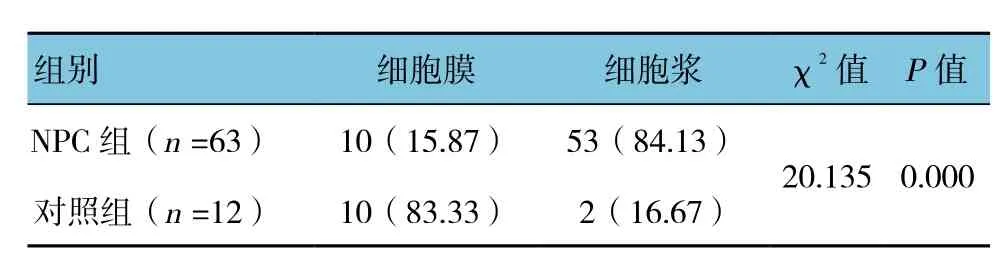
表2 两组患者的IgM阳性表达部位 例(%)

表3 IgM分化程度与表达部位的关系 例(%)

图1 两组患者IgM的表达 (SABC×400)
2.3.1 随访结果 随访截止后,纳入患者的随访时间为4~94个月,随访率为94.85%,中位随访时间63.50个月;随访期内复发率为21.74%(20/92),其中鼻咽部复发14例,颈部复发4例,鼻咽部和颈部同时复发2例;全身转移率为41.30%(38/92),其中单一肺转移16例,单一肝转移9例,单一骨转移5例,多器官转移8例;随访期内92例患者总体生存率为47.83%,无转移生存率为37.00%,无复发生存率为45.65%,其1、3和5年总体生存率分别为93.48%、71.74%和58.66%,而1、3和5年无瘤生存率分别为84.78%、65.15%和46.38%。

表4 NPC患者临床病理特征与IgM表达的关系
2.3.2 IgM表达与NPC患者复发、转移的关系 随访期内IgM阳性表达患者复发率为19.05%(12/63),IgM阴性表达患者为27.59%(8/29),经χ2检验,差异无统计学意义(χ2=0.851,P=0.356);随访期内IgM阳性表达患者远处转移率为39.68%(25/63),IgM阴性表达患者为41.38%(12/29),经χ2检验,差异无统计学意义(χ2=0.024,P=0.877)。
2.3.3 NPC组织中IgM表达对生存率的影响 IgM阳性表达组的总生存率为57.14%,IgM阴性表达组为27.59%,经χ2检验,差异有统计学意义(χ2=6.745,P=0.009),IgM阳性表达组的总生存率高于IgM阴性表达组;但无瘤生存率两组比较,差异无统计学意义(χ2=1.928,P=0.165)。见图 2、3。
2.3.4 IgM表达强度对NPC患者生存率的影响 将IgM阳性表达的NPC患者分为高表达组和低表达组,低表达组IgM表达强度为(+),高表达组IgM表达强度为(++)和(+++)。两组的无瘤生存率、总体生存率比较,经χ2检验,差异有统计学意义(χ2=0.168和 0.710,P=0.682 和 0.400)。
2.3.5 NPC患者预后影响因素的多因素分析 本实验构建COX风险回归模型,模型中Y为NPC患者生存函数,X为NPC患者临床病理参数,采用逐步法COX回归分析,去除无统计学意义变量。统计学分析结果表明,复发和转移是患者不良预后因素(P<0.05),而IgM表达不是独立的预后影响因素(P>0.05)。见表5。

图2 NPC组织中IgM表达对患者总生存率的影响
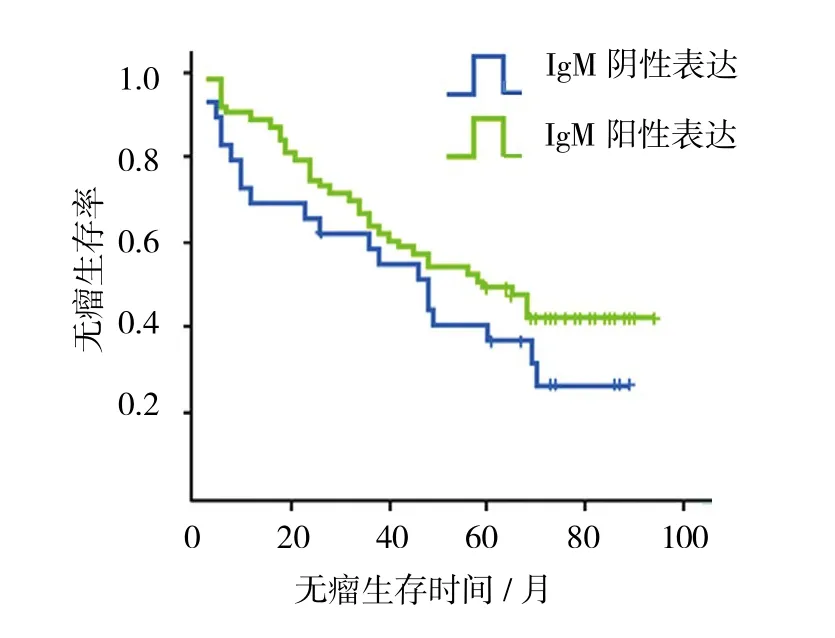
图3 NPC组织中IgM表达对患者无瘤生存率的影响
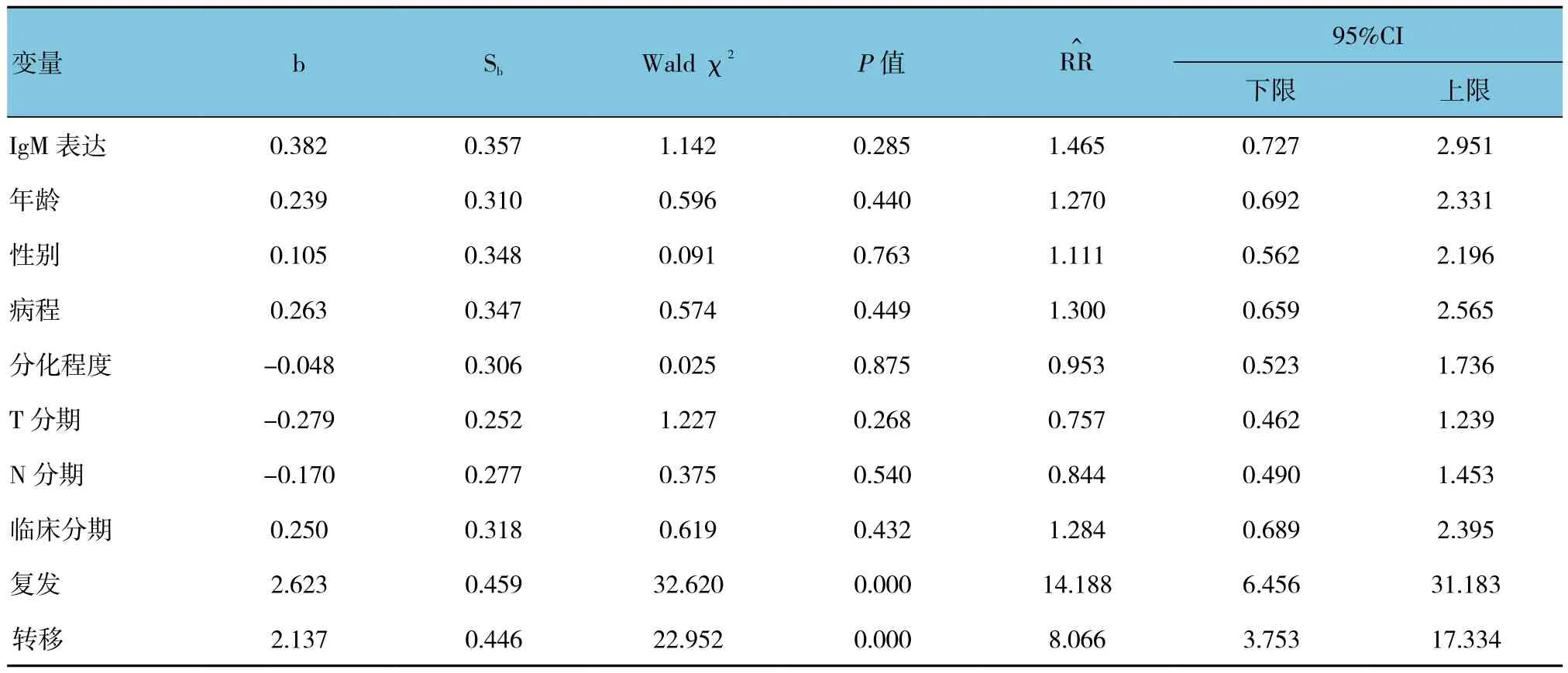
表5 影响患者预后的临床病理参数多因素分析
3 讨论
邱晓彦等[5]在多种上皮恶性肿瘤细胞和部分癌变倾向细胞中发现IgG样物质后,多个研究小组对这一新发现进行了相关研究。HU等[6]通过免疫荧光技术在肿瘤细胞高尔基复合体中检测到Ig的存在,间接说明该异位表达的Ig可能在肿瘤细胞中进行组装和修饰。随后相继有学者在包括乳腺、结肠、肺脏、胰腺、肾脏及皮肤等肿瘤中检测到Ig轻链的表达[7-8]。又有多位学者发现,在这些肿瘤中还存在IgG、IgA、Ig重链可变区表达,且表达部位多位于细胞浆和细胞膜[9-11]。有关非B细胞异位表达Ig的报道不断涌现,这也引起广大学者极大的关注。以往肿瘤细胞相关研究中意外发现的Ig阳性染色往往被忽视,究其原因往往误认为是背景反应或肿瘤组织从周围环境中吸收所致。为进一步证实该异位表达Ig的来源,JIANG[9]等采用激光分类技术和相关肿瘤细胞标记排除了淋巴细胞和浆细胞可能造成的污染,表明肺癌细胞中检测到的IgG确实是由肿瘤细胞合成,并非从血清或周围组织中吸收而来。已知的有关肿瘤细胞中异位表达的Ig多为IgG和IgA,有关IgM在肿瘤细胞中异位表达的报道目前还很少见。本研究运用免疫组织化学法技术对NPC组织和鼻咽部炎性组织中IgM表达进行检测,发现IgM在NPC组织中的表达高于鼻咽部炎性组织,且表达部位主要位于细胞浆,少量位于细胞膜,与ZHANG等[12]在食管癌细胞中得到的结果相似。本实验还发现IgM表达的部位与NPC组织病理分型有关,IgM细胞浆表达的多为低分化磷癌,IgM细胞膜表达的多为高、中分化磷癌。进而提示NPC异位表达的IgM可能是NPC发生过程中的产物,其在肿瘤发生、发展过程中可能扮演重要功能,但该表达部位上的差异是否与IgM的功能状态有关,还需深入研究加以明确。HU等[13]研究发现,上皮肿瘤细胞来源的IgM具有天然IgM属性,包括自身抗体活性及识别自身抗原功能。NPC细胞中异位表达的IgM是否同样具有天然IgM相似的功能,在向细胞膜迁移的过程中不断修饰并具有抗体活性,进而中和机体自身免疫应答产生的抗体来使肿瘤避免自身免疫攻击,从而促进肿瘤细胞的生长及增殖,这还需要后续实验进一步证实。
目前研究表明,除上皮肿瘤组织能表达Ig外,一些正常组织、肉瘤组织中也存在Ig样物质的表达[14]。传统观点认为,正常成年老鼠大脑由于免疫赦免使得其能够逃逸巡视的免疫细胞和抗体。HUANG等[15]运用原位杂交和Western blot检测正常成年老鼠大脑神经元,证实在这些免疫特赦部位同样有IgG、IgM的表达。随后HUANG等[16]在机体另一个免疫特赦位点小鼠睾丸和附睾中也发现了IgG及重组Igλ链和κ链转录本。本实验结果显示,对照组鼻咽部炎症组织中IgM阳性表达率仍有24%,但其表达是否与鼻黏膜上皮的癌变有关还不明确。笔者推测可能机体的所有细胞都拥有表达Ig的潜力,只是在非B细胞中这种潜力受到某些因素的限制,在细胞自身或周围微环境发生变化时,这种制约被打破,最终导致Ig的异位表达,因此对该异位表达的Ig进行深入研究可能对某些疾病尤其是肿瘤的早期诊断及治疗提供有效的帮助。目前有关异位表达Ig与肿瘤病理分级和临床分期的研究还很少。CHEN等[14]通过免疫组织化学法在肉瘤和软组织的良性损害区发现Igκ轻链不同程度的表达,与1、2级肉瘤相比,3级肉瘤Igκ表达更高,与ZHANG等[12]对食管癌研究得出的结论相吻合。本实验结果表明,NPC组织中IgM的表达与临床分期、T分期呈负相关,即临床Ⅰ、Ⅱ期NPC患者中IgM的表达高于Ⅲ、Ⅳ期患者,Tl、T2期患者IgM阳性表达率也高于T3、T4期患者。而YANG等[10]研究发现,乳腺癌中IgG表达与乳腺癌的病理分型和临床分期呈正相关,出现这种情况的原因可能与不同的Ig功能差异有关。
为初步探讨异位表达Ig样物质的功能,HU等[13]运用RT-PCR和Western blot检测证实,上皮肿瘤来源的IgM能与B细胞特异分子CD79A和CD79B结合形成BCR,IgM可刺激BCR下游信号通路活化,进而导致上皮肿瘤细胞生长。WANG[17]等对Hela宫颈癌细胞系进行研究,发现下调肿瘤异常表达的IgG可通过增强细胞抗氧化能力来降低细胞内活性氧簇的水平,从而表明肿瘤来源IgG可基于维持较低的细胞内活性氧簇水平,来增强肿瘤细胞的生长及增殖。更深入的研究发现,通过LPS的刺激,宫颈癌来源的IgG与Toll样受体结合并增强其表达,进而使LPS诱导的NF-κB、MARK信号通路活化,增强促炎症反应细胞因子TNF-α、IL-6等的表达,促进肿瘤细胞增殖[18]。JIANG[9]等运用siRNA技术抑制肺癌细胞中IgG表达,发现随着IgG合成的减少,肿瘤细胞转移过程中如细胞迁移、黏附及创伤愈合能力明显抑制,从而表明肿瘤来源的IgG可能影响肺癌细胞的转移能力,而相同的实验在正常的肺细胞中并未得到相似的结果,进一步证实肿瘤来源的IgG参与肿瘤细胞的转移。有关肿瘤组织中异位表达的IgM与患者生存预后的关系还鲜有报道。本实验结果表明,IgM阳性表达组总生存率高于IgM阴性表达组,但无瘤生存率无差异,且IgM的表达与局部复发、远处转移无关,IgM表达的强度对患者生存率也无影响。CHEN[7]等对乳腺癌的相关研究同样表明,乳腺癌中异位表达的Igκ轻链与患者无病生存率和总生存率相关,高表达组高于低表达组。笔者推测异位表达的Ig虽然具有促进肿瘤细胞生长、增殖及转移的功能,但影响患者生存预后是多个因素共同作用的结果,其具体机制还有待进一步研究。
本实验结果表明,IgM在人类NPC组织中呈优势表达,其表达部位与肿瘤细胞分化类型有关,IgM细胞浆表达的多为低分化磷癌,IgM细胞膜表达的多为高、中分化磷癌,且IgM的表达与患者T分期、临床分期有关,提示IgM表达可能参与NPC早期癌变过程,并可能作为NPC患者预后良好的指标,但NPC组织中异位表达的IgM的生物学活性及可能的致癌机制尚待进一步研究。
[1]TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics,2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108.
[2]SUÁREZ C, RODRIGO J P, RINALDO A, et al. Current treatment options for recurrent nasopharyngeal cancer[J]. Eur Arch Otorhinolaryngol, 2010, 267(12): 1811-1824.
[3]汪泱, 张叔人, 何祖根, 等. 免疫球蛋白样物质在上皮来源的恶性肿瘤中的表达[J]. 中国肿瘤临床, 2001, 28(3): 169-171.
[4]XIANG Y Q, YAO H R, WANG S S, et al. Prognostic value of survivin and livin in nasopharyngeal carcinoma[J]. Laryngoscope,2006, 116(1): 126-130.
[5]邱晓彦, 杨贵贞. 恶性肿瘤细胞内存在免疫球蛋白样物质[J].白求恩医科大学学报, 1996, 22(6): 572-575.
[6]HU D S, DUAN Z, LI M, et al. Heterogeneity of aberrant immunoglobulin expression in cancer cells[J]. Cell Mol Immunol,2011, 8(6): 479-485.
[7]CHEN Z L, GERHOLD-AY A, GEBHARD S, et al.Immunoglobulin kappa C predicts overall survival in nodenegative breast cancer[J]. PLoS One, 2012, 7(9): DOI: 10.1371/journal.pone.0044741.
[8]KORMELINK T G, POWE D G, KUIJPERS S A, et al.Immunoglobulin free light chains are biomarkers of poor prognosis in basal-like breast cancer and are potential targets in tumor-associated inflammation[J]. Oncotarget, 2014, 5(10): 3159-3167.
[9]JIANG C F, HUANG T, WANG Y, et al. Immunoglobulin G expression in lung cancer and its effects on metastasis[J]. PLoS One, 2014, 9(5): DOI: 10.1371/journal.pone.0097359.
[10]YANG, B K, MA C C, CHEN Z S, et al. Correlation of immunoglobulin G expression and histological subtype and stage in breast cancer[J]. PLoS One, 2013, 8(3): DOI: 10.1371/journal.pone.0058706.
[11]WELINDER C, BALDETORP B, BLIXT O, et al. Primary breast cancer tumours contain high amounts of IgA1 immunoglobulin:an immunohistochemical analysis of a possible carrier of the tumour-associated Tn antigen[J]. PLoS One, 2013, 8(4): DOI:org/10.1371/journal.pone.0061749.
[12]ZHANG L Y, HU S P, KORTEWEG C, et al. Expression of immunoglobulin G in esophageal squamous cell carcinomas and its association with tumor grade and Ki67[J]. Hum Pathol, 2012,43(3): 423-434.
[13]HU F L, ZHANG L, ZHENG J, et al. Spontaneous production of immunoglobulin M in human epithelial cancer cells[J]. PLoS One, 2012, 7(12): DOI: 10.1371/journal.pone.0051423.
[14]CHEN Z S, HUANG X R, YE J X, et al. Immunoglobulin G is present in wide variety of soft tissue tumors and correlates well with proliferation markers and tumor grades[J]. Cancer, 2010,116(8): 1953-1963.
[15]HUANG J, SUN X, MAO Y T, et al. Expression of immunoglobulin gene with classical V-(D)-J rearrangement in mouse brain neurons[J]. Int J Biochem Cell Biol, 2008, 40(8):1604-1615.
[16]HUANG J, ZHANG L, MA T, et al. Expression of immunoglobulin gene with classical V-(D)-J rearrangement in mouse testis and epididymis[J]. J Histochem Cytochem, 2009,57(4): 339-349.
[17]WANG J, LIN D, PENG H, et al. Cancer-derived immunoglobulin G promotes tumor cell growth and proliferation through inducing production of reactive oxygen species[J]. Cell Death Dis, 2013,4(12): DOI: 10.1038/cddils.e945.
[18]WANG J P, LIN D Y, PENG H, et al. Cancer-derived immunoglobulin G promotes LPS-induced proinflammatory cytokine production via binding to TLR4 in cervical cancer cells[J]. Oncotarget, 2014, 5(20): 9727-9743.
(童颖丹 编辑)
Expression of IgM and its significance in human nasopharyngeal carcinoma tissues*
Sheng-en Xu1, Wei Xu1, Fei-peng Zhao1, Jin-liang Yang2, Chuan-yu Liang3, Gang Qin1
[1. Department of Otolaryngology and Head and Neck Surgery, the Affiliated Hospital of Southwest Medical University, Luzhou, Sichuan 646000, China; 2. State Key Laboratory of Biotherapy (Division of Cancer Biotherapy), 3. Department of Otolaryngology and Head and Neck Surgery, West China Hospital,Sichuan University, Chengdu, Sichuan 610041, China]
ObjectiveTo detect the expression of IgM in nasopharyngeal carcinoma (NPC) tissues, and to explore its relationships with the clinicopathological characteristics and prognosis of NPC patients.MethodsImmunohistochemical streptavidin-biotin-peroxidase complex (SABC) method was used to detect the expression of IgM in the NPC tissues of 92 patients, the pathologically-diagnosed nasopharyngeal inflammatory tissues of 50 cases were taken as controls. The results were analyzed in combination with clinical and pathological data and prognosis of the NPC patients.ResultsThe positive expression rate of IgM in the NPC tissues was 68.48%, which was significantly higher than 24.00% of the nasopharyngeal in flammatory tissues (P< 0.05). The expression of IgM was mainly located in the cytoplasm in the NPC tissues, but in the cell membrane of the nasopharyngeal in flammatory tissues; and the cytoplasm expression mostly appeared in poorly-differentiated squamous cell carcinoma, and the cell membrane expression was mainly observed in the moderately- and well-differentiated NPC and the nasopharyngeal inflammatory tissues. The expression of IgM in the NPC tissues was negatively correlated with T stage and clinical stage (P< 0.05) in the patients with NPC and had nothing to do with local or cervical recurrence or distant metastasis (P> 0.05). The overall survival rate of the NPC patients with positive IgM expression was significantly higher than that of the NPC patients with negative IgM expression (57.14% vs. 27.59%,P< 0.05), but the disease-free survival rate was not significantly different between the positive IgM expression group and the negative group(P> 0.05).ConclusionsIgM is highly expressed in NPC. It is necessary to further study whether the different expression sites of IgM in NPC and different degree of differentiation are related to the function of the protein. The high expression of IgM may be involved in the early pathogenesis of NPC and can be used as an useful indicator for prognosis prediction of NPC patients.
nasopharyngeal carcinoma; immunoglobulin M; immunohistochemistry
R739.63
A
10.3969/j.issn.1005-8982.2017.29.006
1005-8982(2017)29-0025-07
2016-07-20
四川省泸州市人民政府-四川医科大学科技战略合作项目[No:2015LZCYD-S02(4/11)]
覃纲,E-mail:qin-lzm@163.com

