水分胁迫下接种不同ERM菌株对桃叶杜鹃幼苗生理特性的影响
陈荣建,欧 静,王丽娟,龙海燕,熊贤荣
(贵州大学 林学院,贵州 贵阳 550025)
水分胁迫下接种不同ERM菌株对桃叶杜鹃幼苗生理特性的影响
陈荣建,欧 静,王丽娟,龙海燕,熊贤荣
(贵州大学 林学院,贵州 贵阳 550025)
比较研究了水分胁迫下接种4种ERM真菌对桃叶杜鹃幼苗生理特性的影响。结果表明:水分胁迫下,ERM真菌均能显著促进桃叶杜鹃幼苗的生长,提高桃叶杜鹃在水分胁迫下的苗高和地径生长量,对照不接菌处理表现出较好的抗旱能力;随着水分胁迫的加强,接菌组比对照(CK)能合成更多的可溶性糖、游离脯氨酸等渗透调节物质来维持桃叶杜鹃细胞的渗透压平衡;接菌组较CK有效提高水分胁迫下桃叶杜鹃SOD、POD、CAT保护酶活性;接菌组显著降低水分胁迫下MDA含量生成,接菌与不接菌处理差异显著;ERM真菌能有效增强桃叶杜鹃的抗旱能力,以TY29和TY35处理在轻度水分胁迫下表现最好。
桃叶杜鹃;ERM;水分胁迫;生理响应
干旱胁迫是植物经常遭受环境胁迫的因子之一。长期的严重干旱不仅限制了植物的生长、发育,甚至会导致植物死亡[1-2]。随着城市绿地面积的增加和水资源的时空分布不均,干旱已成为城市绿化建设主要的限制因子[3],严重影响园林植物的应用范围及在城市绿化中的生态效应[4],提高植物本身的抗旱能力及选育优良的抗旱品种已成为城市绿化建设的重要内容。
桃叶杜鹃Rhododendron annae为杜鹃花科杜鹃花属常绿灌木,冠形优美,花色丰富,花期集中于 5、6 月木本少花季节,主要分布于贵州的高山地区,花色艳丽,观赏价值极高[5],但桃叶杜鹃为浅根系树种,耐旱性较差,严重阻碍其引种栽培及在园林中的应用。研究表明,杜鹃花类菌根(Ericoid mycorrhizas,ERM)具有促进和改善宿主植物营养元素的吸收、促进宿主植物生长、增强宿主植物对逆境环境适应性等作用[6-7],是杜鹃花科植物全球广泛分布的重要原因。ERM真菌可以促进杜鹃花在营养贫瘠的生境中获取氮源[8],促进笃斯越橘在不同含氮立地条件下的正常生长[9]。张春英等人[10]接种ERM菌株对云锦杜鹃接种苗有明显的促生效应,接菌苗显著高于对照,且不同菌株接种苗生长量差异明显。在高温胁迫下,ERM真菌可通过提高杜鹃叶片的抗氧化酶活性减轻膜脂过氧化作用的产物积累影响,在一定程度上提高杜鹃“淡妆”的抗热性[11];在干旱胁迫下,接种内生真菌可促进毛棉杜鹃幼苗对干旱胁迫的适应性[12]。现已证实接种ERM真菌可以提高桃叶杜鹃种子萌发率、移植成活率[13-14],显著提高桃叶杜鹃幼苗苗高、地径及生物量,有明显的促生效应[15];在干旱胁迫下ERM真菌可以提高桃叶杜鹃的光合效应[16],但ERM真菌对桃叶杜鹃抗旱生理研究还鲜见报道。本实验以接种4种ERM真菌对桃叶杜鹃进行水分胁迫试验,研究在水分胁迫下不同ERM真菌对桃叶杜鹃生理生化指标的影响,旨在筛选抗旱能力强的ERM菌株,为促进桃叶杜鹃及高山常绿杜鹃的引种栽培、园林应用提供理论依据。
1 材料与方法
1.1 试验材料
4个供试菌株TY02(AJ279484:Ascmycetesp.)、TY21(AB369417:Cryptosporiopsis ericae)、TY29(AB158314:Trametes ochracea)、TY35(AB378554:Pochonia bulbillosa)(括号中前者为国际GenBank中的登录号,后者为与试验菌株亲缘关系最近种)均是培育桃叶杜鹃菌根苗优良备选菌株[15],对照为不接菌(CK)。采用PDA固体培养基将4个供试菌株(TY02、TY21、TY29、TY35)进行平板培养,接种后置于25 ℃培养箱中黑暗培养2周,待菌丝长满基质后作为菌剂使用。
试验苗为桃叶杜鹃,育苗所用种子采自贵州省百里杜鹃风景区方家坪。育苗基质采自百里杜鹃风景区桃叶杜鹃林下腐殖质土。供试土壤理化性质为:pH值4.77,有机质44.15 g/kg,全氮1.56 g/kg,全磷0.161 g/kg,有效磷7.04 mg/kg,碱解氮268.55 mg/kg,速效钾205.91 mg/kg。
1.2 实验设计
1.2.1 播种及接菌处理
育苗基质用腐殖土和珍珠岩按照3∶1配制,在121℃条件下高温高压蒸汽灭菌2 h,自然冷却后80℃烘干2 h。桃叶杜鹃种子细小,千粒重为0.206±0.001 g。将籽粒饱满的桃叶杜鹃种子及播种花盆(上口径×底径×高度 210×150×185 mm)在0.5%KMnO4溶液中消毒15 min,用蒸馏水冲洗至无色,晾干。在消毒后的花盆中装入2/3高度的灭菌基质,均匀地铺上长满菌丝的PDA培养基,在菌丝上覆盖少量基质并将消毒后的种子均匀播撒其上,播种完毕用剪细灭菌后的松针进行均匀覆盖放,然后入人工气候箱内恒温培养(温度25℃、湿度85%、湿度90%、光照24 h)。
1.2.2 桃叶杜鹃菌根苗培育
待幼苗出土生长90 d后,将各接种处理移出可控温光照培养箱,移栽到用0.5%KMnO4浸泡10 min消毒清洗后的塑料花盆中(上口径×底径×高度 110 mm×87 mm×99 mm),每盆1株,放置贵州大学林学院苗圃大棚内进行菌根苗培育、管理。
1.2.3 试验设计
接种×水分胁迫:随机区组设计(5×4),5个菌根处理和4个水分胁迫处理(菌根处理:CK、TY02、TY21、TY29、TY35;水分胁迫:正常供水、轻度干旱、中度干旱、重度干旱)。采用称重法控制土壤含水量,每天下午17:00—18:00按照田间最大持水量的比例进行称重补水,正常供水,80%~90%;轻度干旱,65%~75%;中度干旱,50%~60%;重度干旱,35%~45%。各处理选取生长一致的1年生桃叶杜鹃菌根苗进行水分胁迫处理,每个处理10盆,每盆1株,各处理重复3次,共600株苗,30 d后进行指标测定。
1.3 测定方法和数据分析
菌根侵染率采用 Phillips等[17]的改进法统计。苗高、地径采用卷尺和游标卡尺随机抽取进行定点测量(苗高精确到0.1 cm、地径精确到0.01 mm)。可溶性糖含量采用蒽酮比色法测定,游离脯氨酸采用酸性茚三酮显色法测定,MDA含量采用硫代巴比妥酸法测定,SOD活性采用氮蓝四唑光还原法测定,CAT活性采用紫外吸收法测定,POD活性采用愈创木酚显色法测定[18-19]。
1.4 数据处理
采用Execl 2010记录数据及绘图,使用SPSS18.0软件采用最小差异显著差数法检验数据间的差异性。
2 结果与分析
2.1 水分胁迫下接种不同ERM菌株对桃叶杜鹃幼苗生长的影响
不同ERM菌株对桃叶杜鹃根系亲和力的差异性反映出宿主对不同菌株的依赖性程度不同。从图1可见,不同ERM菌株对桃叶杜鹃菌根侵染率和菌根依赖性呈极显著差异(p<0.01),桃叶杜鹃ERM菌株的有效侵染率达到36.8%~57.6%,菌根依赖性均大于100%,以接种TY35号的侵染率和依赖性最高,分别达到57.6%和212.3%。
由图2可见,不同ERM菌株及不同水分梯度对桃叶杜鹃幼苗苗高和地径均产生了显著影响,处理间差异极显著(p<0.01)。在相同水分条件下,接种ERM菌株桃叶杜鹃的苗高和地径的生长量均高于CK苗。随着水分胁迫的加剧,接种TY02和TY35的桃叶杜鹃苗高、地径的生长量呈先升高后降低趋势,在轻度胁迫时达到最大值;接种TY21和TY29及CK的苗高、地径的生长量均呈下降趋势。表明在水分胁迫下,接种ERM菌株能提高桃叶杜鹃幼苗的生长及抗旱能力,不同的菌株呈现出不同的抗旱能力,以TY35在轻度水分胁迫时促生效应最好。
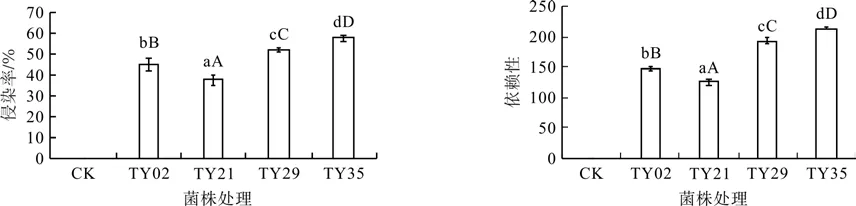
图1 不同ERM菌株对桃叶杜鹃幼苗的菌根侵染率与菌根依赖性Fig.1 Mycorrhizal colonization and dependency graph in R. annae inoculated with different ERM strains

图2 水分胁迫下接种不同ERM菌株对桃叶杜鹃苗高和地径的影响Fig.2 Effects of different ERM strains on height and diameter of R. annae under water stress
2.2 水分胁迫下接种不同ERM菌株对桃叶杜鹃苗渗透调节物质的影响
渗透调节是植物适应水分胁迫的一种重要机制,可溶性糖、脯氨酸等作为渗透调节物质,可以提高渗透压,增强保水力,提高植物抗旱性。由图3可见,同一水分条件下,接种ERM菌株桃叶杜鹃菌苗可溶性糖含量均高于CK苗,差异显著(p<0.05)。随着干旱胁迫的加剧,CK苗可溶性糖含量逐渐降低并在重度胁迫下达到最低值,比正常水分降低79.57%;接种TY02的桃叶杜鹃可溶性糖含量呈先降低后升高的变化;接种TY21、TY29和TY35的桃叶杜鹃可溶性糖含量均呈先升高后降低再升高的变化趋势,各菌株处理间显著差异(p<0.05)。在轻度、中度及重度干旱胁迫下,以接种TY21的苗木可溶性糖含量最高,比CK分别提高了142.4%、265.7%、668.3%,与CK间差异极显著(p<0.01)。在重度胁迫时,各菌株处理的苗木可溶性糖含量达到最大值。重度水分胁迫下CK苗可溶性糖含量急剧下降,说明受到的干旱损伤已经不可逆转,接种ERM菌株的桃叶杜鹃能在其受到严重干旱胁迫时产生更多的可溶性糖来维持细胞渗透势,缓解由干旱胁迫造成的生理代谢不平衡,提高其抗旱能力。
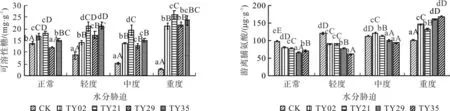
图3 水分胁迫下接种不同ERM菌株对桃叶杜鹃苗渗透调节物质的影响Fig.3 Osmolytes in R. annae inoculated with different ERM strains under water stress
在正常和轻度水分胁迫条件下,接种ERM菌株桃叶杜鹃苗游离脯氨酸含量低于CK苗,呈显著性差异(p<0.05),表明接种ERM菌株桃叶杜鹃苗在轻度水分胁迫下并没有受到干旱的危害,无需合成更多的游离脯氨酸来维持细胞的渗透压平衡。随着干旱胁迫程度的加剧,苗木游离脯氨酸含量逐渐升高,在重度胁迫条件下,接种TY29和TY35苗木的游离脯氨酸量呈急剧上升趋势,表明桃叶杜鹃幼苗遭受严重的干旱威胁,ERM菌株能迅速增加苗木叶片中的游离脯氨酸含量,用来维持桃叶杜鹃叶片细胞的渗透压平衡,减少水分胁迫带来的伤害,提高其抗旱能力。
2.3 水分胁迫下接种不同ERM菌株对桃叶杜鹃苗保护酶系统的影响
植物在遭受干旱等逆境时,植物体内活性氧增加,对细胞产生氧化伤害。植物通过调节抗氧化酶活性来降低活性氧,从而维持体内活性氧代谢的平衡。由图4可见,在正常水分条件下,接种ERM菌株与不接菌的桃叶杜鹃苗SOD活性差别不大,在水分胁迫下接种ERM菌株桃叶杜鹃苗SOD活性均显著高于CK(p<0.05)。在轻度、中度及重度干旱胁迫下,以接种TY29和TY35菌株的苗木SOD活性较高,两者差异不明显。随着胁迫的加剧,CK对照苗呈逐渐降低趋势,接种ERM菌株桃叶杜鹃苗SOD活性呈上升—降低的变化趋势,但始终高于CK对照苗,以接种TY29和TY35效果最好。
在不同水分条件下,接种ERM菌株桃叶杜鹃苗POD活性均高于CK苗(p<0.05),随着水分胁迫的加剧,CK苗POD活性呈逐渐降低的趋势,接种ERM菌株桃叶杜鹃苗呈上升—降低的变化,以接种TY29和TY35的苗在中度时达到最大,分别比CK增加了154.9%和167.5%。
随着水分胁迫的加剧,CK苗CAT活性呈逐渐下降变化,接种ERM菌株桃叶杜鹃菌苗CAT活性呈上升—降低的变化,且CAT活性均始终高于CK,差异显著(p<0.05)。在轻度水分条件下,接种ERM菌株桃叶杜鹃菌苗CAT活性达到最大值,以TY35最高,比正常水分条件下增加了26.45%;在中度和重度干旱胁迫下,接种TY35的桃叶杜鹃苗CAT活性均能维持接近正常水分条件下的含量。
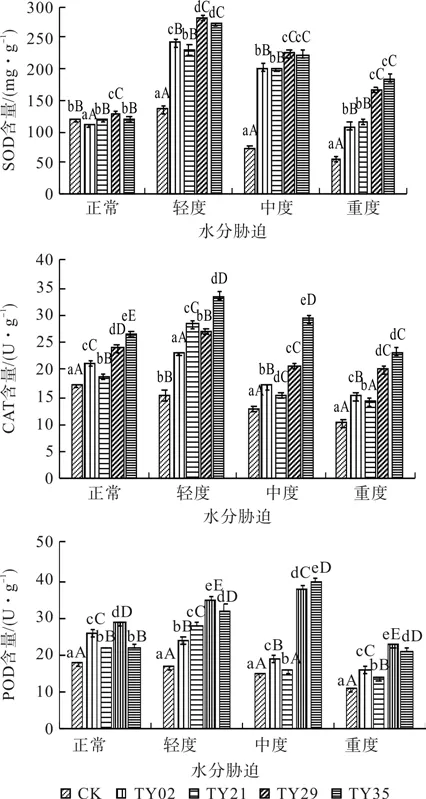
图4 水分胁迫下接种不同ERM菌株对桃叶杜鹃苗保护酶系统的影响Fig.4 Protective enzyme system of R. annae inoculated with different ERM strains under water stress
2.4 水分胁迫下接种不同ERM菌株对桃叶杜鹃苗MDA含量的影响
MDA是膜脂过氧化产物之一,其含量的高低可作为植物细胞受胁迫程度的依据。由图5可见,在水分胁迫条件下,接种ERM菌株桃叶杜鹃苗MDA含量均低于CK苗,且呈显著性差异。随着干旱胁迫的加剧,苗木MDA含量呈逐渐增加趋势,以CK苗对水分胁迫表现最为敏感、剧烈,在轻度胁迫时MDA含量急剧上升,在重度胁迫时达到最大值;接种ERM菌株桃叶杜鹃苗MDA含量在轻度、中度水分胁迫下较正常水分条件下变化不大,在重度水分胁迫时含量急剧上升但低于CK苗。说明接种ERM菌株能有效减轻水分胁迫带来的伤害,降低桃叶杜鹃苗MDA含量,增强桃叶杜鹃的抗旱能力。
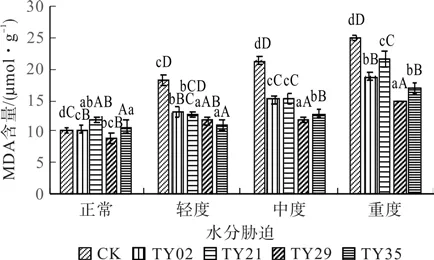
图5 水分胁迫下接种不同ERM菌株对桃叶杜鹃苗的MDA含量的影响Fig.5 MDA content in R. Annae inoculated with different ERM strains under water stress
3 结论与讨论
在水分胁迫条件下,ERM菌株可通过调节桃叶杜鹃的渗透调节物质、抗氧化酶活性、MDA含量等生理变化来改善水分胁迫的影响,显著促进桃叶杜鹃幼苗生长,表现出较强的抗旱能力。不同ERM菌株在水分胁迫下对桃叶杜鹃的影响差异明显,ERM菌株的侵染率与水分胁迫下的抗旱能力表现呈正相关,可能跟ERM菌株与桃叶杜鹃的亲和力有关。
脯氨酸和可溶性糖是重要及有效的有机渗透调节物质。水分胁迫下,植物体内多种生理反应被诱导和加速,植物细胞通过脯氨酸和可溶性糖的积累进行渗透调节,从而阻止细胞膜解离,增强细胞保水能力,稳定细胞结构,防止细胞脱水[20]。试验结果表明,干旱胁迫下桃叶杜鹃增强渗透调节物质游离脯氨酸和可溶性糖含量应对干旱胁迫带来的伤害,与梁文斌等[21]、黄威龙等[22]、李冬琴等[23]的研究结果相似。接种ERM菌株能增加桃叶杜鹃叶片可溶性糖含量,同时体内游离脯氨酸含量显著降低,与赵金莉等[24]的研究结果相一致。在轻度及中度水分胁迫下,ERM菌株能快速增加桃叶杜鹃叶片可溶性糖含量来维持细胞渗透势,缓解水分胁迫造成的生理代谢不平衡,减缓体内游离脯氨酸的生成;在重度水分胁迫下ERM菌株则通过合成大量可溶性糖及游离脯氨酸来共同调节细胞渗透势,以降低桃叶杜鹃受胁迫的程度。说明在应对外界胁迫时,ERM菌株有不同的渗透调节机制。
植物在逆境下保护酶活性下降,细胞内自由基平衡被打破,自由基累积增加造成膜脂过氧化,产生较多有毒产物MDA,使膜结构受损程度加重,导致植物受害甚至死亡[25]。试验结果表明,水分胁迫下,ERM菌株能提高桃叶杜鹃的SOD、POD、CAT酶活性,降低MDA含量,与秦子娴等[26]、马海宾等[27]、王艺等[28]在菌根方面的研究结果相似。随着水分胁迫的加剧,桃叶杜鹃保护酶活性显著提高,接种ERM菌株桃叶杜鹃保护酶活性均显著高于对照苗,MDA含量也较对照苗更低,进一步说明ERM菌株通过提高桃叶杜鹃在水分胁迫下的保护酶活性来有效减轻膜脂过氧化程度,降低细胞膜损伤,增强桃叶杜鹃抗旱性。
综上结果:水分胁迫条件下,ERM菌株能够通过提高桃叶杜鹃体内可溶性糖、游离脯氨酸含量来进行渗透调节维持正常生理活动,提高SOD、POD、CAT酶活性以降低MDA所带来的伤害,促进桃叶杜鹃在水分胁迫下的生长,证实ERM菌株能有效增强桃叶杜鹃的抗旱性,以TY29和TY35在轻度水分胁迫下表现最好。本研究仅对接种不同ERM菌株对桃叶杜鹃在水分胁迫下的生理特性方面进行了研究,但ERM菌株是以何种方式进行生理调控还不清楚,接下来将从内源激素与生理变化的相关性方面展开研究,从激素与生理的角度探明ERM调控桃叶杜鹃抗旱生理机制。
[1]Ibrahim L,Pore M F,Cameron A D.Interactive effects of nitrogen and water availabilities on gas exchange and whole-plant carbon allocation in poplar[J]. Tree Physiology, 1998(18): 481-487.
[2]吴玲利,雷小林,龚 春,等.干旱胁迫对白木通光合生理特性的影响[J].中南林业科技大学学报,2015,35(11): 68-73.
[3]王玉涛,李吉跃,刘 平.水分胁迫对四种园林花灌木耗水特性及观赏性的影响[J].北方园艺,2012,35(3):63-66.
[4]陈立明,尹艳豹.干旱区园林植物抗旱机制研究进展[J].安徽农业科学,2015,43(4): 73-76.
[5]陈 训,巫华美.中国贵州杜鹃花[M].贵阳:贵州科技出版社,2003.
[6]Jansa J, Vosatka M. In vitro and post vitro inoculation of micropropagated rhododendrons with ericoid mycorrhizal fungi[J]. Applied Soil Ecology, 2000, 15(2): 125-136.
[7]Strandberg M, Johannsson M. Uptake of nutrients inCalluna wlgarisseed plants growth with and without mycorrhiza[J]. For.Ecol. Mgmt., 1999, 114: 129-135.
[8]Cairney J W G,Meharg A A.Ericoid mycorrhiza: Apartnership that exploits harsh edaphic conditions[J]. European Journal of Soil Science, 2003, 54: 735-740.
[9]王 冲,侯智霞,宫中志,等.大兴安岭地区立地条件对笃斯越橘生长的影响[J].经济林研究,2015,33(3):81-85,107.
[10]张春英,陈 真,于 芳,等.云锦杜鹃ERM真菌接种效应研究及优良菌株筛选[J].上海农业学报,2010,26(2):38-41.
[11]罗 倩,何 颖,宋卓达,等.接种ERM的杜鹃在高温胁迫下生理指标变化[J].林业与环境科学,2016,32(1):41-46.
[12]洪文君,王 盼,刘 强,等.毛棉杜鹃接菌苗对干旱胁迫的生理响应研究[J].西南农业学报,2016,29(4):805-809.
[13]欧 静,刘仁阳,陈 训.桃叶杜鹃菌根显微结构及侵染情况[J].中南林业科技大学学报,2012,32(11):28-33.
[14]欧 静,刘仁阳,陈 训,等.菌根真菌对桃叶杜鹃种子萌发及幼苗移植的影响[J].南方农业学报,2013(2):293-298.
[15]欧 静,韦小丽,何跃军,等.接种ERM真菌对桃叶杜鹃幼苗的促生效应及生理生化影响[J].林业科学,2013,49(7):48-56.
[16]谌端玉,欧 静,王丽娟,等.干旱胁迫对接种ERM真菌桃叶杜鹃幼苗叶绿素含量及荧光参数的影响[J].南方农业学报,2016, 47(7):1164-1170.
[17]Phillips J M,Hayrnan D S. Improved procedures for clearing roots and staining parasitic and vesicular arbus-cular mycorrhizal fungi for rapid assessment of infection [J].Transac Br Mycol.Soc., 1970, 55(1): 158-161.
[18]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:164-169,258-261.
[19]张立军,樊金娟.植物生理学实验教程[M].北京:中国农业大学出版社,2007:94-103.
[20]吴强盛,夏仁学,张琼华.果树对水分胁迫反应研究进展[J].亚热带植物科学,2003,32(2):72-76.
[21]梁文斌,聂东伶,吴思政,等.水分胁迫对短梗大参生理生化特征的影响[J].经济林研究,2016,34(3):99-104,186.
[22]黄威龙,李 洁,薛 立,等.4 种绿化幼苗对干旱胁迫的生理响应[J].中南林业科技大学学报,2016, 36(7):36-40.
[23]李冬琴,曾鹏程,陈桂葵,等.干旱胁迫对3种豆科灌木生物量分配和生理特性的影[J].中南林业科技大学学报,2016,36(1): 33-39.
[24]赵金莉,贺学礼.AM真菌对油蒿生长和抗旱性的影响[J].华北农学报,2007,22(5):184-188.
[25]肖姣娣.不同强度干旱胁迫对刺槐幼苗生理生化特性的影响[J].中南林业科技大学学报, 2015, 35(8):23-26.
[26]秦子娴,朱 敏,郭 涛.干旱胁迫下丛枝菌根真菌对玉米生理生化特性的影响[J].植物营养与肥料学报,2013,19(2):510-516.
[27]马海宾,康丽华,江业根,等.接种根瘤菌对厚荚相思水分胁迫的响应[J].中南林业科技大学学报,2009,29(4):74-78.
[28]王 艺,丁贵杰.干旱胁迫下外生菌根真菌对马尾松幼苗生长和微量元素吸收的影响[J].浙江农林大学学报, 2012, 29(6):822-828.
[本文编校:谢荣秀]
Effects of inoculated differentEricoid mycorrhizasstrains on physiological characteristics ofRhododendron annaeunder water stress
CHEN Rongjian, OU Jing, WANG Lijuan, LONG Haiyan, XIONG Xianrong
(College of Forestry, Guizhou University, Guiyang 550025, Guizhou, China)
Effects of four different inoculated ERM strains on physiological characteristics ofRhododendron annaeunder water stress were compared. The results showed that ERM strains could significantly promote the growth ofR. annae, and increase height and ground diameter growth ofR. annae, showing good drought resistance in the control. With the strengthening of stress, inoculation group could synthesize more soluble sugar, free proline, osmotic adjustment to maintain osmotic balance Peach azalea cells than in the CK;inoculated group could effectively improve the enzymatic activity ofR. annae’s SOD, POD, CAT with control check group under water stress; inoculated group could decreased significantly MDA content, inoculated and non-inoculated treatments was significant. ERM strains effectively enhanceR. annae’s ability of drought resistance, while the strains of TY29 and TY35 under mild water stress showed the best performance.
Rhododendron annae; ERM; water stress; physiological responses
S718.45
A
1673-923X(2017)09-0043-06
10.14067/j.cnki.1673-923x.2017.09.008
2016-07-10
国家自然科学基金“ERM调控桃叶杜鹃抗旱机理研究”(31560223);贵州大学引进人才科研项目“桃叶杜鹃菌根苗抗旱性研究”(贵大人基合字[2013]07号);贵州大学研究生创新基金“干旱胁迫下桃叶杜鹃菌根苗内源激素的响应”(研农2016014)
陈荣建,硕士研究生
欧 静,教授;E-mail:coloroj@126.com
陈荣建,欧 静,王丽娟,等.水分胁迫下接种不同ERM菌株对桃叶杜鹃幼苗生理特性的影响[J].中南林业科技大学学报,2017, 37(9): 43-48.

