运动通过调节内源性大麻素系统抑制帕金森病模型大鼠纹状体谷氨酸兴奋性毒作用的实验研究
林湘明,刘晓莉,时凯旋,张凌韬,张文津
运动通过调节内源性大麻素系统抑制帕金森病模型大鼠纹状体谷氨酸兴奋性毒作用的实验研究
林湘明1,刘晓莉1,时凯旋1,张凌韬1,张文津2
目的:试图从内源性大麻素系统(eCBs)对纹状体突触Glu兴奋性毒性的调节作用入手,进一步阐释运动调控PD模型大鼠行为功能紊乱的神经生物学机制。方法:选用清洁级雄性SD大鼠,随机分为假手术组、假手术运动组、PD组、PD运动组,每组18只,共72只。6-OHDA于右内侧前脑束注射制备单侧PD大鼠模型,假手术组于相同位点注射等量生理盐水作为对照。术后恢复1周对大鼠进行强度11 m/min,时间30 min/d,每周5天,为期4周运动干预。在建模后7天于颈部皮下注射阿扑吗啡(APO)诱导旋转实验评价PD模型可靠性,并结合平衡木试验评价大鼠运动整合能力和平衡能力。采用微透析-高效液相色谱(HPLC)技术,检测纹状体神经细胞外Glu浓度;采用免疫组化和免疫印记技术检测纹状体CB1受体及RGS4蛋白表达。结果:运动干预第3、4周,与PD组相比,PD运动组大鼠穿越平衡木的潜伏期和总时间显著性减少(P<0.05),纹状体神经细胞外Glu含量显著降低(P<0.05),纹状体CB1受体、RGS4蛋白表达水平也显著降低(P<0.05)。结论:运动通过调节纹状体RGS4、CB1表达,降低纹状体胞外Glu增高的趋势,并改善了PD模型大鼠运动整合能力和平衡能力。eCBs参与运动对皮层-纹状体Glu突触兴奋性毒作用的调节过程,其机制可能与运动重塑皮层-纹状体Glu能突触eCBs介导的长时程抑制(eCB-LTD)有关。
帕金森病;大鼠;运动干预;谷氨酸;内源性大麻素系统
帕金森病(Parkinson,s Disease,PD)是由于黑质-纹状体通路多巴胺(dopamine,DA)能神经元变性、缺失,导致纹状体DA含量显著减少而引发的一种中枢神经系统退行性疾病[1]。新近研究[2-3]表明,随着病程的发展,PD患者或模型动物纹状体内谷氨酸(glutamine,Glu)含量也出现显著性增高的现象。Glu作为脑内重要的兴奋性神经递质,参与突触可塑性和神经环路功能的调节[4],但神经元胞外Glu浓度剧增又会对突触后神经元产生兴奋性毒性损伤,导致神经元功能紊乱、甚致坏死或凋亡[5]。PD病理状态下,皮层-纹状体Glu通路被过度激活,使纹状体神经元胞外Glu浓度显著升高与大鼠行为功能紊乱有关[6]。内源性大麻素系统(endocannabinoid system,eCBs)在脑内作为一种重要的神经调质系统,通过其配体与受体抑制性地调节突触前Glu释放,并降低Glu对突触后神经元的兴奋性毒作用[7],目前已被作为非DA能药物治疗PD的新靶点[8]。本实验室前期研究[9]发现,4周跑台运动干预能有效降低PD模型大鼠皮层-纹状体Glu通路活性,减少纹状体胞外Glu浓度,纠正基底神经节功能紊乱导致的大鼠行为功能异常,推测其机制可能与eCBs介导有关,但目前还尚未见相关文献报道。为此,本研究拟采用高效液相色谱-荧光法(HPLC-FLD)动态检测大鼠纹状体神经元胞外Glu浓度,采用免疫组织化学和免疫印记法检测大鼠纹状体内源性大麻素受体CB1(cannabinoid receptor 1,CB1)和配体调节因子G-蛋白信号转导调节子4(regulator of G-protein signaling 4,RGS4)表达水平,进一步揭示eCBs在运动干预改善PD大鼠行为功能障碍中的作用机制。
1 材料与方法
1.1 实验主要仪器与试剂
主要仪器:动物跑台(杭州段式DSPT-202型)、数显大鼠脑立体定位仪(深圳瑞沃德)、微透析探针(BAS-MD-2200,美国)、微量注射泵(BAS-MD-0250,美国)、大鼠清醒活动装置(深圳瑞沃德)、冷冻收集器(MAB-85,瑞典)、高效液相色谱仪组件(日本岛津)、荧光检测器(RF-20A,日本岛津)、色谱分析柱(ODSSP,4.6 mm×150 mm,5 μm)。
主要试剂:水合氯醛(sigma)、阿扑吗啡(APO,sigma)、6-羟基多巴胺(6-OHDA,sigma)、邻苯二甲醛(OPA,sigma)、β-巯基乙醇(β-MCE,sigma)、Glu标准品(sigma)、甲醇色谱纯(MeOH,Baker)、CB1和RGS4抗体均购于abcam公司,其他常规试剂均购于国产分析纯。
1.2 实验对象及分组
选用清洁级雄性SD大鼠,体重(230±10)g,由北京华阜康生物科技股份有限公司提供,生产许可证号:SCXK(京)2014-0004。所有实验大鼠分笼饲养(3~4只/笼),自由饮食、饮水,动物房温度20~25℃,相对湿度控制在45%~50%,12 h昼夜循环光照。实验大鼠进入实验室后适应性饲养7天,并进行适应性跑台训练,训练后剔除无法完成预设跑台训练方案的大鼠。随后将大鼠随机分为4组:假手术安静组(Control,n=18),假手术运动组(Control+Ex,n=18),PD安静组(PD,n=18),PD运动组(PD+Ex,n=18)
1.3 PD模型大鼠的制备与可靠性验证
采用10%水合氯醛溶液腹腔麻醉大鼠(3.5 mL/kg),将其固定在脑立体定位仪上,剔除大鼠颅部毛发,手术暴露出前囟和后囟,调节门齿夹刻度,确定前、后囟在同一水平面。以前囟为原点,根据G.PAXINOS等[10]大鼠脑立体定位图谱确定右侧内侧前脑束(MFB)坐标(AP:-4.3 mm,R:1.5 mm,V:7.6-7.8 mm),采用颅骨钻钻孔,用微量进样器抽取4 μL 6-OHDA,以1 mm/min的速度缓慢下针至MFB,并以1 μL/min速度注射;注射完毕后留针5 min,再以1 mm/min速度缓慢退针。对照组用上述方法于相同位置注射等剂量含0.02%抗坏血酸的生理盐水。注药结束后对伤口进行消毒、缝合,单笼饲养。在手术造模后第7天于大鼠背部皮下注射APO(2.5 mL/100 g)检测大鼠旋转行为,以30 min内大鼠向健侧旋转净圈数大于100转视为PD成功模型标准[11]。
1.4 运动干预方案
Control+Ex与PD+Ex组大鼠在建模1周后开始进行跑台运动干预。运动方案参照N.TAJIRI等[12]的强迫跑台训练方案,训练共持续4周,每周5天(周一至周五训练,周末休息),每天30 min,速度为11 m/min。
1.5 大鼠运动整合能力和平衡能力评价
采用平衡木实验(balance beam test)评价大鼠的运动整合能力和平衡能力。实验时将大鼠置于平衡木一端长20 cm的“start”区,采用高速摄像机记录大鼠穿过平衡木过程中后肢完全越过“start”区的时间(潜伏期)和穿过平衡木的总时间,大鼠放入“start”区后,1 min内四肢没有完全离开“start”区,潜伏期按照1 min计算;出现掉落现象或2 min内未能穿过平衡木,穿过平衡木总时间按2 min计算,每只大鼠重复测试5次,计算平均值[13]。
1.6 纹状体微透析样品液采集与Glu浓度测定
1.6.1 微透析套管植入手术与样品采集 在6-OHDA或生理盐水注射完毕退针后,将微透析探针套管尖端埋藏至右侧纹状体(AP:0.2 mm,R:3.5 mm,V:3.5 mm),并用不锈钢小螺丝拧于大鼠颅骨表面,牙科水泥覆盖固定,放置鼠笼中单独饲养。微透析样品采集前,连接探针与人工脑脊液灌流端与样品收集端的管路,开启微透析灌流泵检测系统是否漏液。拔出大鼠头部套管内芯,将微透析探针缓慢、充分插入套管并固定,置大鼠于清醒活动装置当中。调节灌流泵流速至2 μL/min,灌流平衡30 min后,打开冷冻收集器收集透析液,采样频率为15 min/管,1次/周,连续4周,收集完毕后将透析液置于-80℃冰箱保存待测。
1.6.2 大鼠脑组织学定位 微透析样品液采集完毕后,用10%水合氯醛麻醉大鼠(3.5 mg/kg),剪开胸腔,暴露心脏,用4%多聚甲醛溶液进行常规灌注固定,剥离脑组织置于30%蔗糖的多聚甲醛溶液中过夜。对纹状体组织行连续冠状冰冻切片(40 μm),用尼氏染色验证微透析套管所在位置(见图1),与脑立体定位图谱进行对比(见图2),以剔除套管埋藏位置不在纹状体的微透析样品液。

图1 微透析探针定位脑片Figure1 The Location of The Microdialysis Probe on Brain Slices

图2 纹状体脑立体定位图谱Figure2 The Brain Stereotaxic Atlas of Striatum
1.6.3 高效液相-荧光法检测Glu浓度 色谱条件:流动相A:0.1 mol·L-1磷酸二氢钾溶液,调节PH至6.6(室温25 ℃);流动相B:纯甲醇(40%恒流洗脱),使用前经0.22 μm有机膜过滤,超声波震荡脱气,流速为1 mL/min,柱温箱温度为25℃,荧光检测器的激发波长为357nm,发射波长为455nm。OPA柱前衍生:精确量取20 μL的微透析样品液或标准液,加入10 μL衍生试剂和10 μL0.05 mol·L-1的Na2CO3缓冲液,充分混匀后静置30 s,抽取20 μL进样。
衍生试剂:称取135 mg邻苯二甲醛,溶于2.5 mL纯甲醇中,再将此混合液与另配制好的25 mL浓度为0.4 mol·L-1的硼酸液混合均匀(PH=9.5),最后滴加100 μL的β-巯基乙醇,4℃避光保存。
Glu浓度测定:精确称取Glu标准品,采用人工脑脊液分别配制成10、1、0.1、0.01、0.001 μmol·L-1的标准溶液。根据5个浓度标准液所对应的峰面积在LC-Solution软件中绘制浓度-峰面积标准曲线图;以峰面积作为纵坐标Y,标准品液浓度作为横坐标X,得到Glu标准曲线:Y=1 179 939.70X-19 522.40(r2=0.999 5)。依据Glu标准品液相色谱图确定Glu保留时间(见图3-5),根据Glu标准曲线计算微透析样品液中Glu浓度。
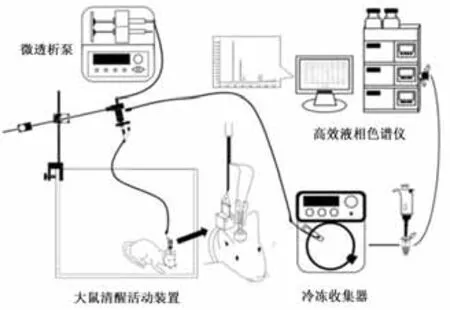
图3 清醒状态下大鼠纹状体微透析样品液的采集与高效液相检测模式图Figure3 Collection of Microdialysis Sample in Striatum of Rats with Conscious State and HPLC Detection
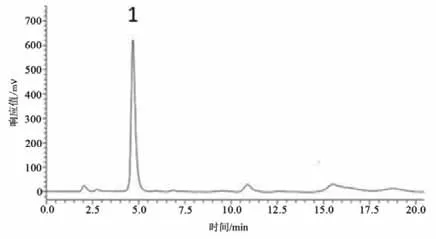
图4 Glu标准品的高效液相色谱图Figure4 The HPLC Diagram of Glutamate Standard
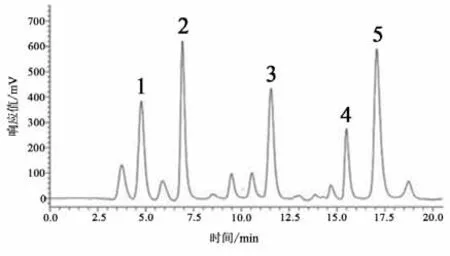
图5 大鼠纹状体微透析样品液高效液相色谱图Figure5 The HPLC Diagram of Microdialysis Sample
1.7 纹状体CB1受体与RGS4蛋白表达水平检测
1.7.1 免疫组织化学 最后1次运动干预24 h后,大鼠腹腔注射10%水合氯醛进行麻醉,剪开胸腔,暴露心脏,用37℃生理盐水(200 mL)和4℃的4%多聚甲醛(200 mL)经左心室-升主动脉插管灌流并迅速取出脑组织置于4%多聚甲醛溶液中固定保存24 h;将脑组织块依次置于不同浓度的乙醇进行脱水、透明、浸蜡、包埋修块、冠状切片(5 μm),将脑片贴附在涂有多聚赖氨酸的载玻片上,62℃恒温烤箱中烘烤60 min,进行染色、梯度脱水、透明、封片。应用Olympus-DP72型显微镜对脑片进行拍照。采用Image-pro plus 6.0图像分析软件对CB1受体、RGS4阳性细胞数量和平均光密度进行统计分析。
1.7.2 免疫印记(Western Blotting) 大鼠麻醉后断头取脑,于冰上迅速剥离右侧纹状体,加入适量裂解液提取各组脑组织总蛋白,采用BCA法测定蛋白浓度后加入5倍SDS缓冲液,沸水煮5 min,冷却后于-80℃冰箱保存待测。取30 μg蛋白样本进行SDS-PAGE电泳分离,转移蛋白至PVDF膜上置入保鲜膜中,加入封闭液,室温条件下缓慢摇动90 min。将膜置于用TBST溶解的5%脱脂奶粉中封闭,加入一抗4℃孵育过夜。PBS洗膜,加入二抗,置于摇床上,室温下孵育90 min后,洗膜。室温反应1 h加入ECL化学发光液于膜上,X射线曝光显影,以β-actin为内参照,采用图像分析软件对图片进行分析,以每个条带的积分光密度(IOD)值与其相对应的β-actin的IOD值之比表示蛋白相对表达水平。
1.8 数据处理
所有实验数据均用SPSS 21.0数据统计软件进行处理,结果以平均数±标准差表示。采用单因素方差分析(One-Way ANOVA)所得数据,选择LSD对组间均值差异进行比较,以P<0.05表示差异具有显著性,P<0.01表示差异具有非常显著性。
2 研究结果
2.1 6-OHDA诱导PD大鼠模型可靠性评价
APO诱导旋转实验结果显示,6-OHDA组大鼠APO诱导旋转圈数(198.5±25.5)显著增加(P<0.01),且均大于100转/30 min,Control组大鼠无明显旋转行为发生(见图6);免疫组化结果显示,Control组大鼠双侧纹状体TH阳性细胞表达均匀、密集、对称(见图7);APO诱导旋转行为符合PD模型标准的大鼠损毁侧(右侧)纹状体TH阳性细胞出现严重丢失,双侧出现明显不对称性(见图8)。与PD组正常侧相比,PD组大鼠损毁侧纹状体TH表达显著降低(P<0.01);与Control组大鼠损毁侧相比,PD组大鼠损毁侧纹状体TH表达显著降低(P<0.01)(见图9)。
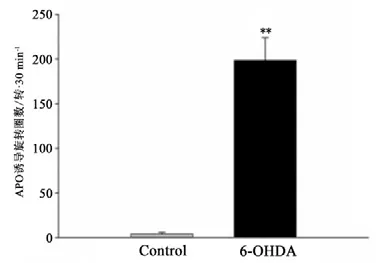
图6 各组大鼠APO诱导旋转圈数Figure6 The Number of Apomorphine Induce Rotation

图7 Control组大鼠纹状体TH表达Figure7 The Expression of Striatal TH in Control Group

图8 PD组大鼠纹状体TH表达Figure8 The Expression of Striatal TH in PD Group
2.2 运动干预后PD大鼠行为功能的变化
平衡木实验(见图10)结果显示,与Control组相比,PD与PD+Ex组大鼠穿越平衡木的潜伏期、总时间显著增加,且差异均具有显著性(P<0.01);PD+Ex组穿越平衡木的潜伏期、总时间在运动干预的第3、4周较PD组显著降低(P<0.05)(见图11-12)。

图9 各组大鼠纹状体TH阳性细胞表达比较Figure9 Comparison of Striatal TH Positive Cells Expression with Rats in Each Group
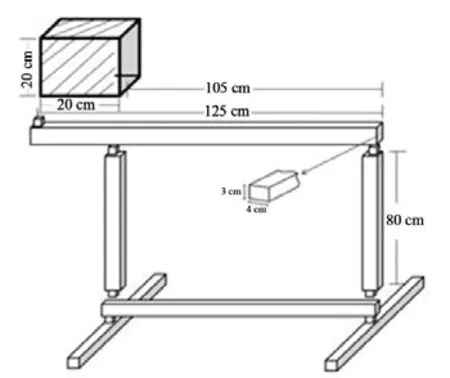
图10 平衡木测试模式图Figure10 The Diagrammatic Sketch of Balance Beam Test
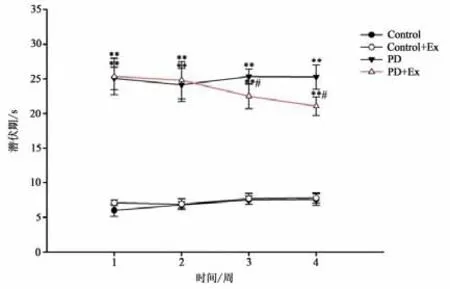
图11 各组大鼠穿越平衡木潜伏期比较Figure11 Comparison of Latency with Rats in Each Group
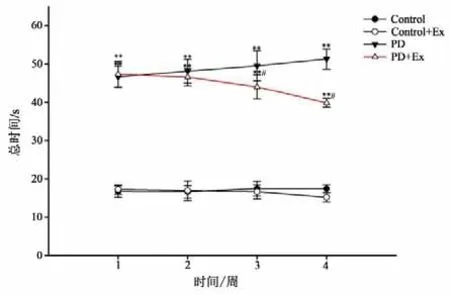
图12 各组大鼠穿越平衡木总时间比较Figure12 Comparison of Total Time with Rats in Each Group
2.3 运动干预后大鼠纹状体Glu浓度变化
高效液相色谱-荧光法检测结果显示,与Control组相比,运动干预前PD、PD+Ex组大鼠纹状体Glu浓度显著增高(P<0.01)(见图13);实施运动干预后PD、PD+Ex大鼠纹状体Glu浓度仍呈持续性增高的趋势,但与PD组比较,运动干预第3、4周PD+Ex组大鼠纹状体Glu浓度显著降低(P<0.05)(见图14)。
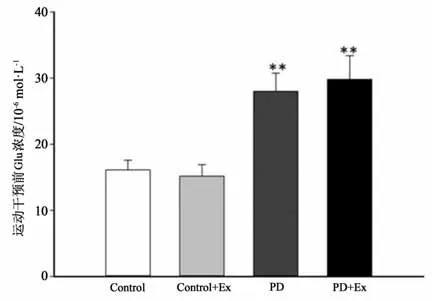
图13 运动干预前纹状体胞外Glu浓度比较Figure13 Comparison of extracellular Glu concentration in striatum before exercise intervention

图14 纹状体Glu浓度比较Figure14 Comparison of extracellular Glu concentration in striatum
2.4 运动干预后纹状体CB1受体表达水平变化
免疫组化结果显示(见图15-17),与Control相比,PD与PD+Ex组大鼠纹状体CB1受体表达上调,差异具有显著性(P<0.01),与PD组比较,PD+Ex组大鼠纹状体CB1受体表达显著性下调(P<0.05);Westrn Blotting结果显示(见图18),各组大鼠纹状体CB1受体表达变化趋势与免疫组化结果一致。

图15 各组大鼠纹状体CB1受体阳性细胞表达(n=6,400×)Figure15 The Expression of CB1 Receptors Positive Cells in Each Group(n=6,400×)

图16 各组大鼠纹状体CB1受体平均光密度值比较Figure16 Comparison of Mean Optical Density of CB1 Receptors in Striatum of Rats in Each Group

图17 各组大鼠纹状体CB1受体阳性细胞表达数比较Figure17 Comparison of the Number of CB1 Receptor Positive Cells in Striatum of Rats in Each Group
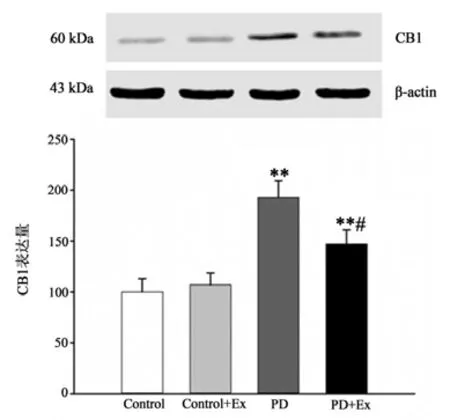
图18 各组大鼠纹状体CB1受体表达水平比较(n=6)Figure18 Comparison of Expression Levels of CB1 Receptor in Striatum of Rats in Each Group(n=6)
2.5 运动干预后PD大鼠纹状体RGS4表达水平的变化
免疫组化结果显示(见图19-21),与Control相比,PD与PD+Ex组大鼠纹状体RGS4表达显著增加(P<0.01),与PD组比较,PD+Ex组大鼠纹状体RGS4表达量显著性降低(P<0.05)。Westrn Blotting结果显示(见图22),各组大鼠纹状体RGS4表达变化趋势与免疫组化结果一致。
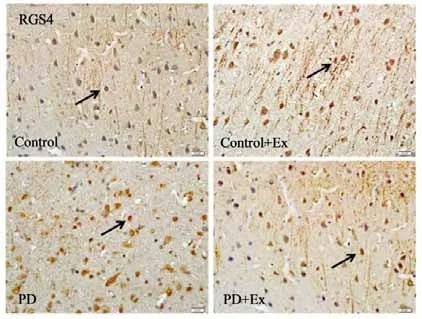
图19 各组大鼠纹状体RGS4阳性细胞表达(n=6,400×)Figure19 The Expression of RGS4 Positive Cells in Each Group(n=6,400×)
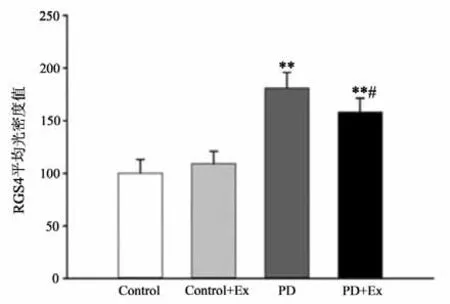
图20 各组大鼠纹状体RGS4平均光密度值比较Figure20 Comparison of Mean Optical Density of RGS4 in Striatum of Rats in Each Group

图21 各组大鼠纹状体RGS4阳性细胞表达数比较Figure21 Comparison of the Number of RGS4 Positive Cells in Striatum of Rats in Each Group
2.6 大鼠纹状体Glu浓度与RGS4表达及行为功能的相关性检验
本研究将运动干预4周后PD+Ex组大鼠纹状体Glu浓度与RGS4蛋白表达水平及行为功能进行事件相关性检验,结果显示,纹状体Glu浓度与RGS4蛋白表达水平成显著正相关(P<0.05,r=0.884)(见图23);与大鼠穿越平衡木的潜伏期和总时间也均成显著正相关(P<0.05,r=0.912;P<0.05,r=0.829)(见图24-25)。

图22 各组大鼠纹状体RGS4表达水平比较(n=6,400×)Figure22 Comparison of Expression of RGS4 Protein in Striatum of Rats in Each Group(n=6,400×)
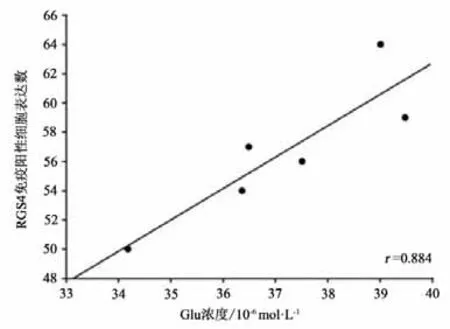
图23 大鼠纹状体Glu浓度与RGS4蛋白表达水平的相关性检验Figure23 Correlation Between Striatal Glu Concentration and RGS4 Protein Expression
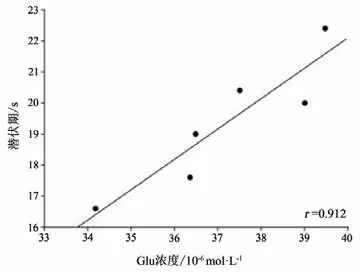
图24 大鼠纹状体Glu浓度与大鼠穿越平衡木潜伏期相关性检验Figure24 Correlation between striatal Glu concentration and latency of rat through balance beam
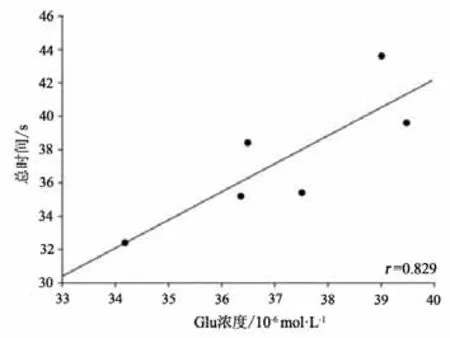
图25 大鼠纹状体Glu浓度与大鼠穿越平衡木总时间相关性检验Figure25 Correlation Between Striatal Glu Concentration and the Total time of Rats Crossing the Balance Beam
3 讨论
基底神经节是位于端脑腹侧深部,靠近中脑和间脑的一组灰质核团,主要包括纹状体、黑质、苍白球、丘脑底核等[14]。纹状体是接受皮层向基底神经节信息输入的主要核团,其细胞构筑95%为中等多棘神经元(medium spiny neurons,MSNs),根据表达受体种类不同将其分为2类:即高度表达多巴胺Ⅰ型受体(D1DR)的MSNs(D1-MSNs)和高度表达多巴胺Ⅱ型受体(D2DR)的MSNs(D2-MSNs)[15]。生理状态下,由皮层锥体细胞发出的轴突与纹状体γ-氨基丁酸(γ-amino butyric acid,GABA)能神经元的树突棘顶部构成突触联系,形成皮层-纹状体Glu能神经通路;而来自中脑黑质致密区的DA能神经投射则作用于MSNs树突棘的颈部,形成黑质-纹状体DA能神经通路,这是DA和Glu共同参与纹状体神经元的兴奋性调节解剖基础[16]。
动物模型及尸检均发现,当PD运动障碍症状开始出现时,纹状体内DA含量减少80%以上[17],且运动障碍症状的严重程度与DA含量减少成显著正相关[15]。除黑质-纹状体DA能系统异常外,皮层-纹状体Glu能通路活动异常也参与PD的发病。陈巍等[9]采用透射电子显微镜观察突触超微结构发现,PD模型大鼠Glu能突触活性增强。S.BOULET等[2]对绒猴注射MPTP后,用在体微透析技术观察纹状体神经递质水平发现,除DA含量降低外,纹状体还出现Glu浓度显著增高现象。本研究采用微透析-高效液相色谱联用法检测6-OHDA大鼠纹状体胞外Glu含量得到相同的结果。D.V.RAJU等[18]认为,PD状态下,纹状体Glu浓度的增加主要与皮层的兴奋性投射增多有关,与丘脑并无关系。Glu作为脑内一种重要的兴奋性氨基酸,过量释放将导致突触后膜上的相应受体(AMPA/NMDA)敏感性增强,激活Ca2+通道,引起大量Ca2+内流及胞内Ca2+超载,导致神经元变性、坏死或凋亡[19]。因此,黑质致密区DA能神经元渐进性衰亡是引发PD发病的起始事件,继发引起皮层-纹状体Glu能通路过度激活是该病发生发展的重要因素,Glu的兴奋性毒作用可能也是导致PD行为功能障碍的病理机制之一。
eCBs是由内源性大麻素受体、配体及其合成代谢有关的酶组合而成的一种内源性神经调质系统[20]。在脑内,大麻素受体主要有CB1,配体则有花生四烯酸乙醇胺(Anandamide,AEA)和2-花生四烯酸甘油(2-Arachidonoylglycerol,2-AG)两种[21]。与经典神经递质释放机制不同的是,内源性大麻素配体由突触后细胞产生,通过eCB特有的膜转运体(endocannabinoid membrane transporter,EMT)转运至突触间隙,作用于突触前膜CB1受体,抑制性地调控突触前神经递质释放[22]。纹状体突触可塑性主要包括长时程增强(long-term potentiation,LTP)和长时程抑制(long-term depression,LTD)效应。皮层-纹状体LTD产生与eCBs所介导的逆行信使功能有关,又称eCB-LTD[23]。G.L.GERDEMAN等[24]研究表明,eCB-LTD特异性地发生于纹状体D2-MSNs,且受D2DR调控。具体机制为D2DR被DA激活后,与其耦连的Gi蛋白抑制了环磷酸腺苷(cAMP)/蛋白激酶A(PKA)活性,降低其下游蛋白RGS4磷酸化水平。RGS4作为一种GTP酶激活蛋白,可减弱与代谢型谷氨酸受体1/5(mGluR1/5)耦联的Gq蛋白α亚基上的GTP转为GDP的能力,增加α亚基作用的时间和强度,促进eCB生成,后者经EMT运输到突触间隙与突触前膜上的CB1受体结合,产生去极化诱导脱兴奋现象,而后诱发eCB-LTD,最终抑制性地调节突触前Glu释放[25]。本实验室前期研究结果表明,PD状态下,DA合成受损使纹状体D2DR表达下调[9]。A.C.KREITZER等[26]利用膜片钳技术研究发现,PD小鼠纹状体脑片D2-MSNs上LTD诱导失败,但在脑片浴液中加入D2DR激动后LTD被成功诱发。T.N.LERNER等[27]研究还发现,D2DR下游信号调节因子RGS4水平降低或CB1受体活性增强均对重塑皮层-纹状体D2-MSNs上LTD有益。本研究结果显示,6-OHDA注射4周后,纹状体RGS4蛋白表达显著升高;提示黑质DA能通路传递效能降低也会引起信号通路调节因子RGS4功能异常,从而抑制eCB配体合成,最终使eCB-LTD现象减弱或消失。注射6-OHDA 4周后,纹状体CB1受体蛋白表达含量增加,可能只是eCB配体合成不足所导致的一种代偿反应。
PD患者的主要临床症状以行为功能障碍为主,包括静止性震颤、肌强直、动作迟缓和姿势平衡障碍等[17]。J.L.TILLERSON等[28]发现,用石膏固定PD大鼠健侧肢体,强迫患侧肢体进行为期28天垂直和水平方向运动,结果发现患侧肢体运动能力增强,肢体不对称障碍减轻。K.POTHAKOS等[29]发现10周跑台训练后小鼠肢体平衡能力明显改善。本研究结果显示,4周跑台运动干预后PD模型大鼠穿越平衡木的潜伏期和总时间显著降低,肢体运动整合能力及平衡能力改善,且行为恢复程度与运动干预持续时间以及纹状体Glu浓度降低水平呈显著相关。运动改善了PD行为功能障碍的机制可能是通过抗细胞氧化应激、抗细胞炎性因子表达、神经再生等神经保护作用,减轻6-OHDA神经毒素对黑质DA能神经元的损伤。近期G.M.PETZINGER等[30]提出皮层-纹状体Glu能突触可塑性重塑是运动改善PD行为功能的关键因素,运动的神经营养作用上调纹状体脑源性神经营养因子(BDNF)和胶质细胞源性神经营养因子(GDNF)表达[12],抑制皮层-纹状体Glu能突触传递,降低由于Glu兴奋性毒作用导致的纹状体MSNs树突棘脱落,重塑突触结构可塑性[31]。另有研究发现,黑质-纹状体DA能传导增强时RGS4蛋白表达降低[25];给RGS4基因敲除小鼠注射6-OHDA后并未出现PD典型的行为功能障碍表现[27],提示RGS4在行为功能调控中具有一定作用。本研究发现,4周跑台运动干预上调PD模型大鼠纹状体RGS4水平,且纹状体RGS4表达水平与Glu浓度呈正相关,与大鼠肢体运动整合能力及平衡能力改善程度呈负相关。RGS4下调势必加强mGluR1/5 G蛋白耦连强度,提高eCB配体(AEA/2-AG)的合成,恢复皮层-纹状体突触eCBLTD功能可塑性,降低突触前神经元Glu释放。此外,4周跑台运动干预显著下调PD模型大鼠纹状体CB1受体表达,J.ROMERO等[32]的研究也获得类似结果;由此说明eCBs也参与了运动对皮层-纹状体Glu突触兴奋性毒性作用的调节过程。
4 结 论
4周跑台运动通过调节纹状体RGS4、CB1受体表达,缓解了纹状体胞外Glu增高的趋势,并改善了PD模型大鼠运动整合能力和平衡能力;PD模型大鼠行为功能恢复程度与运动干预持续时间有关,也与纹状体胞外Glu水平具有显著相关性。本研究结果证实,eCBs参与运动对皮层-纹状体Glu突触兴奋性毒作用的调节过程,其机制可能与运动重塑皮层-纹状体Glu能突触eCB-LTD有关。
[1]时凯旋,刘晓莉,乔德才,等.跑台运动对PD模型大鼠运动皮层异常β振荡的调节作用[J].西安体育学院学报,2017,34(5):590-298.
[2]BOULT S,MOUNAYAR S,POUPARD A,et al.Behavioral recovery in MPTP-treated monkeys:neurochemical mechanisms studied by intra⁃striatalmicrodialysis[J].J Neurosci,2008,28(38):9575-9584.
[3]MENG T,YUAN S,ZHENG Z,et al.Effects of endogenous melatonin on glutamate and GABA rhythms in the striatum of unilateral 6-hydroxydo⁃pamine-lesioned rats[J].Neuroscience,2015,286:308-315.
[4]VILLALBA R M,MATHAI A,SMITH Y.Morphological changes of glu⁃tamatergic synapses in animal models of Parkinson's disease[J].Front Neuroanat,2014,9:117-117.
[5]VAN LAAR V S,ROY N,LIU A,et al.Glutamate excitotoxicity in neu⁃rons triggers mitochondrial and endoplasmic reticulum accumulation of Parkin,and,in the presence of N-acetyl cysteine,mitophagy[J].Neurobi⁃ol Dis,2015,74:180-193.
[6]SUN Z,JIA J,GONG X,et al.Inhibition of glutamate and acetylcholine release in behavioral improvement induced by electroacupuncture in parkinsonian rats[J].Neurosci Lett,2012,520(1):32-37.
[7]FERNANDEZ‐RUIZ J.The endocannabinoid system as a target for the treatment of motor dysfunction[J].Br J Pharmacol,2009,156(7):1029-1040.
[8]FAGAN S G,CAMPBELL V A.The influence of cannabinoids on gener⁃ic traits of neurodegeneration[J].Br J Pharmacol,2014,171(6):1347-1360.
[9]陈巍,魏翔,刘晓莉,等.运动对PD模型大鼠皮层-纹状体Glu能神经传递的影响[J].北京体育大学学报,2015(2):61-66.
[10]PAXIONS G,WASTON C.The rat brain in stereotaxic coordinates[M].Elsevier Academic Press,2007,17-18.
[11]DEUMENS R,BLOKLAND A,PRICKAERTS J.Modeling Parkinson's disease in rats:an evaluation of 6-OHDA lesions of the nigrostriatal⁃pathway[J].Exp Neurol,2002,175(2):303-317.
[12]TAJIRI N,YASUHARA T,SHINGO T,et al.Exercise exerts neuropro⁃tective effects on Parkinson's disease model of rats[J].Brain Res,2010,1310:200-207.
[13]ALLBUTT H N,HENDERSON J M.Use of the narrow beam test in the rat,6-hydroxydopamine model of Parkinson's disease[J].J Neurosci Methods,2007,159(2):195-202.
[14]侯莉娟,林然,刘晓莉,等.一次性力竭运动对大鼠苍白球外侧部神经元自发放电活动的影响[J].西安体育学院学报,2015,32(2):196-2 00.
[15]LANG A E,OBESO J A.Challenges in Parkinson's disease:restoration of the nigrostriatal dopamine system is not enough[J].Lancet Neurol,2004,3(5):309-316.
[16]FLORIO T,DILORETO S,CERRITO F,et al.Influence of prelimbic and sensorimotor cortices on striatal neurons in the rat:electrophysio⁃logical evidence for converging inputs and the effects of 6-OHDA-in⁃duced degeneration of the substantia nigra[J].Brain Res,1993,619(1):180-188.
[17]BEZARD E,DOVERO S,PRUNIER C,et al.Relationship between the appearance of symptoms and the level of nigrostriatal degeneration in a progressive 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine-le⁃sioned macaque model of Parkinson's disease[J].J Neurosci,2001,21(17):6853-6861.
[18]RAJU D V,AHERN T H,SHAH D J,et al.Differential synaptic plas⁃ticity of the corticostriatal and thalamostriatal systems in an MPTP⁃treated monkey model of parkinsonism[J].Eur J Neurosci,2008,27(7):1647-1658.
[19]LEWERENZ J,MAHER P.Chronic glutamate toxicity in neurodegener⁃ative diseases-what is the evidence?[J].Front Neurosci,2015,9.
[20]CASTILLO P E,YOUNTS T J,CHAVEZ A E,et al.Endocannabinoid signaling and synaptic function[J].Neuron,2012,76(1):70-81.
[21]MORES V,CHOI D K.Promising cannabinoid-based therapies for Par⁃kinson’s disease:motor symptoms to neuroprotection[J].Mol Neurode⁃gener,2015,10(1):17.
[22]HASHIMOTODANI Y,OHNO-SHOSAKU T,KANO M.Endocannabi⁃noids and synaptic function in the CNS[J].Neuroscientist,2007,13(2):127-137.
[23]MATHUR B N,LOVINGER D M.Endocannabinoid–dopamine inter⁃actions in striatal synaptic plasticity[J].Front Pharmacol,2012,3:66.
[24]GERDEMAN G L,RONESI J,LOVINGER D M.Postsynaptic endocan⁃nabinoid release is critical to long-term depression in the striatum[J].Nat Neurosci,2002,5(5):446-451.
[25]CEROVIC M,D’ISA R,TONINI R,et al.Molecular and cellular mech⁃anisms of dopamine-mediated behavioral plasticity in the striatum[J].Neurobiol Learn Mem,2013,105:63-80.
[26]KREITZER A C,MALENKA R C.Endocannabinoid-mediated rescue of striatal LTD and motor deficits in Parkinson's disease models[J].Na⁃ture,2007,445(7128):643-647.
[27]LERNER T N,KREITZER A C.RGS4 is required for dopaminergic control of striatal LTD and susceptibility to parkinsonian motor deficits[J].Neuron,2012,73(2):347-359.
[28]TILLERSON J L,COHEN A D,PHILHOWER J,et al.Forced limbuse effects on the behavioral and neurochemical effects of 6-hydroxy⁃dopamine[J].J Neurosci,2001,21(12):4427-4435.
[29]POTHAKOS K,KURZ M J,LAU Y S.Restorative effect of endurance exercise on behavioral deficits in the chronic mouse model of Parkin⁃son's disease with severe neurodegeneration[J].BMC Neurosci,2009,10(1):6.
[30]PETZINGER G M,FISHER B E,MCEWEN S,et al.Exercise-en⁃hanced neuroplasticity targeting motor and cognitive circuitry in Par⁃kinson’s disease[J].Lancet Neurol,2013,12(7):716-726.
[31]TOY W A,PETZINGER G M,LEYSHON B J,et al.Treadmill exercise reverses dendritic spine loss in direct and indirect striatal medium spiny neurons in the 1-methyl-4-phenyl-1,2,3,6-tetrahydropyri⁃dine(MPTP)mouse model of Parkinson's disease[J].Neurobiol Dis,2014,63:201-209.
[32]ROMERO J,BERRENdERO F,Perez-Rosado A,et al.Unilateral 6-hy⁃droxydopamine lesions of nigrostriatal dopaminergic neurons increased CB1 receptor mRNA levels in the caudate-putamen[J].Life Sci,2000,66(6):485-494.
Experimental Study that Treadmill Exercise Inhibit Striatal Glutamate Excitotoxicity by Regulating Endocan⁃nabinoid System in a Rat Model of Unilateral Parkinsonism
LIN Xiangming1,LIU Xiaoli1,SHI Kaixuan1,ZHANG Lingtao1,ZHANG Wenjin2
(1.School of PE and Sports,Beijing Normal University,Beijing 100875,China;2.The International Department of Beijing No.35 High School,Beijing 100082,China)
Objective:To further explain the biological mechanism of behavioral deficits in rats with PD model,we investigated the effects of endocannabinoid system(eCBs)on regulation of striatal Glu excitotoxicity.Methods:Seventy-two adult male SD rats were randomly divided into 4 groups:Control(Control),Control with exercise(Control+Ex),PD(PD),PD with exercise(PD+Ex),with 18 rats in each group.6-OHDA was injected into the right medial forebrain bundle of rats to establish a unilateral PD rat model.The sham group was injected with the same amount of normal saline as the control group.One week after surgery,exercise group rats participated in 4 weeks exercise,exercise program was 11m/min,30min/day,and 5 days/week.At 7 days after surgery,subcutane⁃ous injection of Apomorphine induced rotation test performed to evaluate the reliability of PD model,and the balance beam test was used to examine the abili⁃ty of motor integration and balance.The extracellular Glu concentration was measured by microdialysis and high performance liquid chromatography(HPLC).The expression of CB1 receptor and RGS4 protein was observed by immunohistochemical staining and western blotting.Results:After 3 and 4 weeks of exer⁃cise intervention,compared with PD group,PD exercise group rats through the balance beam latency and total time were significantly lower(P<0.05),the con⁃centration of Glu in striatum was significantly decreased(P< 0.05).the expression of striatal CB1 receptor and RGS4 protein levels were significantly decreased(P<0.05,P<0.05).Conclusions:Exercise regulates the expression of RGS4 and CB1,reduced the trend of increased extracellular Glu in striatum,and im⁃proved the motor integration ability and balance ability of PD rats.eCBs participates the regulation of excitotoxicity in corticostriatal Glu synapses.It is specu⁃lated that the mechanism of exercise remodel corticostriatal synaptic plasticity was related to recovery of the endocannabinoid-dependent LTD(eCB-LTD).
Parkinson,s disease;rat;exercise intervention;glutamate;endocannabinoid system
G 804.2
A
1005-0000(2017)03-261-08
2017-02-25;
2017-04-28;录用日期:2017-04-29
国家自然科学基金项目(项目编号:31571221)
林湘明(1991-),男,福建厦门人,在读硕士研究生,研究方向为体育保健与运动康复;通信作者:刘晓莉(1958-),女,山西晋中人,教授,博士,博士生导师,研究方向为体育保健与康复。
北京师范大学体育与运动学院,北京100875;2.北京市第三十五中学国际部,北京100082。
10.13297/j.cnki.issn1005-0000.2017.03.014

