江洪鱼露发酵过程中微生物多样性分析
齐宁利,饶梦微,李 涛,龚 霄,魏晓奕,王晓芳
(1.中国热带农业科学院农产品加工研究所,农业部农产品加工质量安全风险评估实验室(湛江),广东湛江 524001;2.广东海洋大学食品科技学院,广东湛江 524048;3.中国热带农业科学院农产品加工研究所,广东湛江 524001)
江洪鱼露发酵过程中微生物多样性分析
齐宁利1,饶梦微2,李 涛1,*龚 霄3,魏晓奕3,王晓芳3
(1.中国热带农业科学院农产品加工研究所,农业部农产品加工质量安全风险评估实验室(湛江),广东湛江 524001;2.广东海洋大学食品科技学院,广东湛江 524048;3.中国热带农业科学院农产品加工研究所,广东湛江 524001)
江洪鱼露以我国北部湾青鳞鱼为原料,经传统工艺腌制、深埋、自然发酵而成。分析了发酵过程中微生物多样性差异,并测定了pH值、氨基酸态氮、挥发性盐基氮、游离氨基酸等理化特性的变化。结果表明,乳酸菌和酵母菌是江洪鱼露发酵过程中的优势菌,其菌相变化与各项理化指标密切相关,为江洪鱼露生产过程中的品质控制和快速发酵技术研发提供理论基础。
江洪鱼露;微生物多样性;理化特性
0 引言
鱼露是一种以低值鱼虾或水产加工废弃物为原料,利用自身酶或微生物发酵而成的海鲜调味品,风味独特、营养丰富,并因兼有赋咸、起鲜、增香、调色等作用而深受消费者欢迎。鱼露原产于我国广东潮汕和福建等地,在东南亚国家(如日本、越南、泰国等)得到发展,目前在欧洲和非洲地区逐渐盛行。其中,江洪鱼露又称“鱼鲐”,是以广东江洪镇北部湾水域的生猛青鳞鱼为原料,在卤化后的瓷瓶中经海盐搓腌、密封发酵、深埋、变温处理[1]等工艺制作而成,含有蛋白质、脂肪、氨基酸,以及铁、钙、碘等矿物质,营养丰富且易被人体吸收,当地人形容其为“血滴滴”。
江洪鱼露经过多种微生物的共同作用酿造而成,生产周期一般在1~3年,作为一种特殊的地理标志产品,目前品质形成机理尚不清楚。黄紫燕等人[2]采用选择性培养的方法对汕头鱼露传统制作过程中微生物多样性进行了分析,发现乳酸菌和酵母菌是优势菌。但是,可培养的细菌只占很少一部分,而剩余的大多数细菌是不可培养或难以培养的,这些不可培养或难以培养的细菌也参与了鱼露香气物质的形成[3]。所以,通过一种新方法研究不可培养或较难培养细菌多样性[4],极具研究价值。
试验对江洪鱼露整个生产过程进行跟踪采样,利用高通量测序技术分析发酵各阶段的微生物组成及其多样性,对pH值、总酸、TSN和TVB-N,以及游离氨基酸等理化指标进行了测定,初步探讨其品质形成机理,为快速发酵工艺[5]升级和鱼露品质控制提供理论支持。
1 材料与方法
1.1 材料
鱼露样品,广东省遂溪平顺水产公司提供。以青鳞鱼(Harengula zunasi bleeker) 为原料,加20%海盐搓匀、装坛(2/3容积)、自然发酵,在不同阶段进行取样分析。取样时,将鱼露发酵液混匀,取适量混合液,部分用于微生物检测,部分用滤纸(新星,102#定性滤纸12.5 cm) 过滤,滤液沸水浴10 min后用于理化指标分析。
1.2 试验方法
通过传统工艺发酵江洪鱼露,利用分子生物学方法——16S rDNA序列分析对洪江鱼露中的微生物进行分离、培养和鉴定。研究发酵过程中微生物多样性差异,分析pH值、总可溶性氮(TSN)、挥发性盐基氮(TVB-N)和游离氨基酸组成。
1.3 样品16S rDNA V4~V5可变区的扩增和高通量测序
按照参考文献[6]的方法对样品基因组DNA进行提取与纯化,采用引物barcode 338F(5'-ACT CCT ACG GGA GGC AGC A-3')和806R(5'-GGA CTA CHV GGG TWT CTA AT-3'),对样品16S rDNA的可变区V3~V4的进行扩增。反应体系:Taq Mix 10 μL,模版 1 μL,正反引物各 0.5 μL和 dd H2O补足 20 μL。反应条件:94℃变性5 min;94℃45 s,50℃60 s,72℃ 60 s,25次循环,72℃延伸10 min;扩增产物纯化回收;基因组测序由上海美吉生物医药科技有限公司通过Miseq Illumina平台完成。
1.4 群落组成分析[7]
基于Miseq Illumina平台的测序得到不同发酵阶段鱼露样品文库,按照97%相似性对非重复序列(不含单序列)进行OTU聚类分析,利用Silva(Release123 http://www.arb-silva.de) 进行分类学研究,利用Shannon指数等方法完成多样性分析指数分析,探索鱼露发酵样品中细菌丰度与发酵时间的相关性。
1.5 理化指标的测定
总可溶性氮(TSN),采用凯氏定氮法[8]测定;挥发性盐基氮(TVB-N),采用康维皿法(微量扩散法) 测定[9];pH值,按照GB/T 10786—1989方法,用数字式pH计测定;总酸,按照GB/T 12456—1990方法;总酯,按照GB/T 10345.5—1989测定挥发性风味物质中乙醇含量的测定,采用气相色谱-质谱联用(GCMS)进行定性定量分析[10]。
1.6 游离氨基酸组成的测定
游离氨基酸的测定,采用L-8900型日立氨基酸自动分析仪和日立专用离子交换树脂色谱柱(4.6 mm I.D.×60 mm×3 μm),温度范围20~85℃(步进1℃),检测波长570 nm,标准氨基酸溶液为Sigma产品。
2 结果与讨论
2.1 鱼露发酵过程微生物菌系的消长变化分析
按照97%相似性对非重复序列(不含单序列)进行OTU聚类,利用稀释曲线,分析了测序质量。通过Silva数据库(Release123 http://www.arb-silva.de) 比对鉴定,可以发现江洪鱼露发酵过程中的细菌主要属于6个菌门(Phylum),即变形菌门(Proteobacteria)、厚壁菌门 (Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria) 和蓝藻门(Cyanobacteria)。发酵前期,检测出真菌(Aspergillus) 分泌丰富的蛋白酶,使蛋白质水解成多肽、氨基酸等,为其他微生物的生长提供条件。其中,乳酸杆菌、乳酸乳球菌、芽孢杆菌在江洪鱼露发酵过程中最为丰富,发酵前10个月,优势菌互相交替变化。这些细菌大部分为耐盐菌,这和青鳞鱼生存的海水环境及鱼露制作工艺(添加20%~30%海盐)有直接关系。发酵12个月为江洪鱼露发酵主要活动期,经细菌多样性分析,共发现13个门、20个属(其中有3个Unclassified),这是由于随着海盐渗入鱼体,鱼汁渗出,肠道内的海洋杆菌、假单胞菌和变形菌等开始生长。除此之外,也发现肠球菌、链球菌等少量腐败菌。随着乳酸菌发酵产生乳酸使pH值下降,一定程度上抑制了其他微生物的生长,使菌群组成保持相对稳定。
2.2 鱼露发酵过程pH值、总酸含量的变化
酸度可以反映出鱼露发酵的优劣程度,pH值可以影响微生物的生长繁殖。通过对江洪鱼露的pH值测定可以发现,江洪鱼露的优势菌是酵母菌和乳酸菌。通过试验可以得知,发酵前4个月,pH值不断增高到5.8,酵母菌生长加快,氨基酸发生生化反应,转变为挥发性盐基氮;发酵4个月后,乳酸菌抑制杂菌生长,发酵液中游离的氨基酸转变为有机酸,pH值开始下降。总酸的变化趋势则和乳酸菌相反,江洪鱼露中主要风味物质是挥发性脂肪酸,产生挥发性脂肪酸的主要途径是通过微生物发酵。江洪鱼露中含有大量的有机酸,在发酵4个月后,转变为乙酸、丁酸等,总酸数值变大,是江洪鱼露特殊风味的重要组成部分。
2.3 江洪鱼露发酵过程TSN和TVB-N含量的变化
江洪鱼露发酵过程中TSN和TVB-N的含量见表1。
利用凯氏定氮法和测定挥发性盐基氮得到的TSN,TVB-N数值,可以反映出江洪鱼露中微生物的发酵及品质状况。TSN总数值呈不断增长的状态,前6个月快速增长,乳酸菌及酵母菌等优势菌共同作用,分泌水解蛋白质;后6个月缓慢增加,证明蛋白质水解达到完全。利用TVB-N来测量洪江鱼露的腐败变质情况,蛋白质水解成氨基酸后,进一步发生生化反应,产生新的物质。前4个月TVB-N数值快速增长,缓冲液里杂菌较多,随后优势菌抑制杂菌,TVB-N数值增长变缓。
2.4 江洪鱼露发酵过程主要香气成分含量的变化
鱼露发酵液通过测定乙醇的含量,确定微生物发酵进程。在江洪鱼露的香气物质中,可以测定乙醇是快速增长的物质,发酵初始阶段,由于微生物的繁殖,众多微生物互相作用,乙醇含量不断增多,发酵8个月达到最大值(占挥发性风味物质总量的25.46%),随后开始减少,逐渐转化为其他挥发性风味物质。江洪鱼露的总脂含量随着发酵时间的延长也在不断增多,与发酵8个月后乙醇含量不断减少相互作用(与参考文献[2]试验结果一致),形成江洪鱼露的独特滋味。
2.5 鱼露发酵过程中游离氨基酸组成与含量的变化
鱼露发酵过程中游离氨基酸的组成与含量见表2。
由表2可以看出,江洪鱼露在发酵过程的各个阶段中,游离氨基酸总量不断增加,谷氨酸的含量随发酵时间的延长,增加的含量比其他氨基酸要多,提升了江洪鱼露的鲜味。经过12个月的发酵,最终江洪鱼露的游离氨基酸总量为4.054 mg/100 g,然而在发酵8个月的时候,江洪鱼露的游离氨基酸总量已经达到4.405 mg/100 g,前8个月的发酵中游离氨基酸总量不断增加,在发酵过程中,优势菌种处于活跃状态,乳酸菌分泌出的蛋白酶使青鳞鱼的蛋白质水解,酵母菌的存在也使江洪鱼露的发酵更加完全。而从发酵10个月开始,环境发生变化,使得游离氨基酸总量减少。
3 结论
江洪鱼露经12个月发酵完全,发酵前10个月,优势菌互相交替变化,发酵前4个月酵母菌是优势菌,4个月后乳酸菌共同作用促进江洪鱼露发酵。乳酸菌发酵产生乳酸使pH值下降,一定程度上抑制了其他杂菌的生长,乳酸菌分泌出的蛋白酶使青鳞鱼的蛋白质水解,酵母菌的存在也使江洪鱼露的发酵更加完全、风味更加协调、营养更加丰富。

表1 江洪鱼露发酵过程中TSN和TVB-N的含量
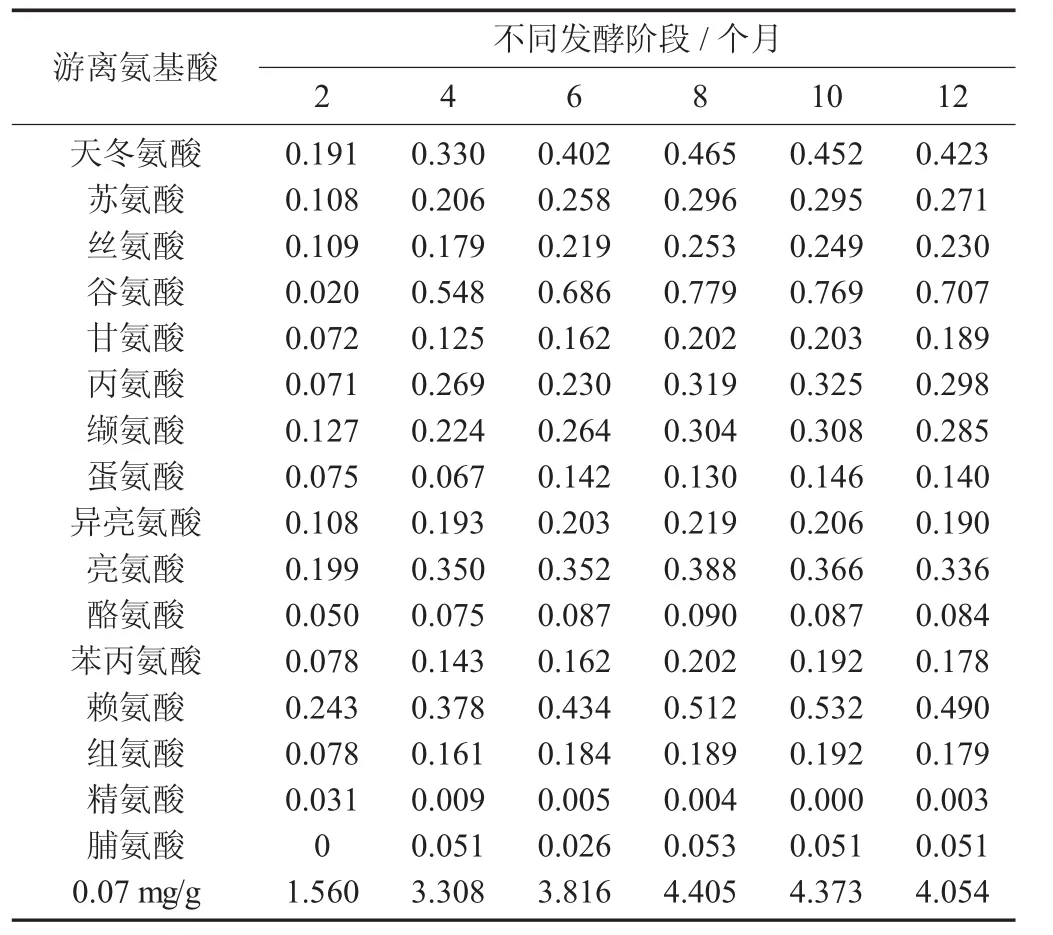
表2 鱼露发酵过程中游离氨基酸的组成与含量/mg·(100 g)-1
[1]翁武银,陈书霖,刘光明,等.温度对加曲速酿低盐鱼露性质的影响 [J].食品工业科技,2012,33(23):183-191.
[2]黄紫燕,朱志伟,曾庆孝,等.传统鱼露发酵的微生物动态分析 [J].食品与发酵工业,2010,36(7):18-22.
[3]Rissana R P,Mitsuya S,Yutaka O.Further identification of volatile compounds in fish sauce[J].J Agric Food Chem,1996 (4):3 606-3 610.
[4]燕平梅,马雁飞,倪玲.发酵食品中微生物多样性研究方法进展 [J].中国酿造,2011(2):12-14.
[5]黄紫燕,晁岱秀,朱志伟,等.鱼露快速发酵工艺的研究 [J].现代食品科技,2010,26(11):1 207-1 211,1 288.
[6]LisaO,ChristinZ,StefanL,etal.Theignoreddiversity:complex bacterial communities in intensive care units revealed by 16Spyrosequencing[J].SciRep-UK,2013,3(3):4 422-4 427.
[7]Quast C,Pruesse E,Yilmaz P,et al.The SILVA ribosomal RNA gene database project:improved data processing and web-based tools[J].Nucl Acids Res,2013,41 (D1):590-596.
[8]Conway E J,Byrne A.An absorption apparatus for the micro-determination of certain volatile substances:The microdetermination of ammonia[J].Biochem J, 1935 (27):419-429.
[9]Jiang J J, Zeng Q X, Zhu Z W.Analysis of volatile compounds in traditional Chinese fish sauce(Yulu) [J].Food Bioprocess Technol,2011,4 (2):266-271.
[10]门胁清.酱醪中微生物间的相互作用 [J].中国调味品,1988 (5):12-14.◇
Analysis of Microbial Diversity in the Fermentation of Jianghong Yulu
QI Ningli1,RAO Mengwei2,LI Tao1,*GONG Xiao3,WEI Xiaoyi3,WANG Xiaofang3
(1.Laboratory of Quality&Risk Assessment on Agro-product Processing(Zhanjiang),Ministry of Agricuture,Agricultural Products Processing Research Institute,Chinese Academy of Tropical Agricultural Sciences,Zhanjiang,Guangdong 524001,China;2.College of Food Science and Technolgy,Guangdong Ocean University,Zhanjiang,Guangdong 524048,China;3.Agricultural Products Processing Research Institute,Chinese Academy of Tropical Agricultural Sciences,Zhanjiang,Guangdong 524001,China)
Jianghong Yulu is made from Harengula nymphaea(Richardson) obtained from Beibu Gulf in China,and processed by traditional pickled,submerged,and natural fermentation.The changes of microbial diversity during fermentation were analyzed,and the changes of pH value,amino acid nitrogen,volatile base nitrogen and free amino acid were determined.The results showed that lactic acid bacteria and yeasts were the dominant bacteria in the process of Jianghong Yulu.The change of microbial community was closely related to the physichemical properties,which will provided theoretical basis for quality control and rapid fermentation technology in the production Jianghong Yulu.
Jianghong Yulu;microbial diversity;physichemical properties
S816
A
10.16693/j.cnki.1671-9646(X).2017.11.017
1671-9646(2017) 11a-0056-03
2017-08-28
中国热带农业科学院基本科研业务费专项资金(1630122017T23)。
齐宁利(1982— ),女,硕士,助理研究员,研究方向为食品质量安全。
*通讯作者:龚 霄(1984— ),男,博士,副研究员,研究方向为食品发酵与代谢组学。

