不同血管通路对老年维持性血液透析患者心功能、透析相关指标和实验室指标的影响
焦荣红 于明月 牛慧敏 冯珍
·论著·
不同血管通路对老年维持性血液透析患者心功能、透析相关指标和实验室指标的影响
焦荣红 于明月 牛慧敏 冯珍
目的探讨动静脉瘘、深静脉导管长期留置对维持性血液透析患者的心功能、透析相关指标和实验室指标的影响。方法维持性血液透析患者120例,由于血管条件异常,不能耐受内瘘手术或内瘘失败36例行深静脉导管留置(深静脉导管组),余84患者行动静脉内瘘(动静脉内瘘组)。观察2组患者超声心动图心脏结构[左心室舒张末期内径(LVDd)、室间隔舒张末期厚度(IVSTd)、左心室后壁舒张末期厚度(PWTH)、射血分数(EF)、舒张早期和舒张晚期左心房室瓣口最大血流速度之比(E/A)]、心功能评价(左心室肥厚、左心室收缩功能障碍发病率)、透析相关指标[尿素清除率(Kt/V)、尿素下降率、血管通路血流量]、实验室观察指标(血清肌酐、血钙、血磷、清蛋白、全段甲状旁腺激素、血红蛋白)。结果动静脉内瘘组通路建立后LVDd、IVSTd、LVPWTd水平明显高于通路建立前(Plt;0.05),而EF、E/A水平比较,差异无统计学意义(Pgt;0.05)。深静脉导管组通路建立后上述指标水平与通路建立前比较,差异无统计学意义(Pgt;0.05)。深静脉导管组通路建立后LVDd、IVSTd、LVPWTd水平明显低于动静脉内瘘组(Plt;0.05)。深静脉导管组血管通路建立1年后左心室肥厚、左心室收缩功能障碍发病率显著低于动静脉内瘘组(Plt;0.05)。深静脉导管组Kt/V、尿素下降率、血管通路血流量均低于动静脉内瘘组(Plt;0.05)。动静脉内瘘组通路建立后前肌酐、血磷、全段甲状旁腺激素均低于通路建立前,血钙、清蛋白、血红蛋白水平均高于通路建立前(Plt;0.05)。深静脉导管组通路建立前肌酐、血磷均低于通路建立前,血钙、清蛋白、血红蛋白水平均高于通路建立前,差异有统计学意义(Plt;0.05),全段甲状旁腺激素低于通路建立前,但差异无统计学意义(Pgt;0.05)。治疗后2组上述指标差异均无统计学意义(Pgt;0.05)。深静脉导管组栓塞、感染及不良反应总发生率均高于动静脉内瘘组(Plt;0.05),出血不畅发生率高于动静脉内瘘组,但差异无统计学意义(Pgt;0.05)。结论动静脉内瘘对维持性血液透析患者的心脏结构和心功能有一定影响,深静脉导管虽然出现栓塞、感染的发生率较高,但对心功能影响较小,超声评价对血液透析患者临床效果和不良反应监测有重要意义。
动静脉瘘;深静脉导管;血液透析;超声,彩色多普勒;心功能;不良反应
过去二十年来,终末期肾病综合征(ESRD)的发病率几乎翻了一番。尽管ESRD人口总入院率下降,但感染相关住院率却稳步上升[1]。动静脉瘘,动静脉移植物和静脉血液透析导管是临床常用的血液透析血管通路。临床实践指南建议将动静脉瘘作为首选的血液渗透血液渗透,但血管紧张症与各种临床结果之间的定量关联仍有争议[2]。一项荟萃分析显示,尽管最初确定动静脉瘘具有长期通畅和较少的并发症等优点,但对2000至2012年100项前瞻性研究发现,动静脉瘘初次失败率高,初次和次要通畅率降至中等[3]。动静脉移植物是皮下静脉床耗尽或不适合创建动静脉瘘时采用的手段,但其静脉吻合口狭窄、感染、血栓形成制约了其临床应用[4]。部分患者存在心脏功能不佳、血管条件异常或不能耐受内瘘手术等原因,深静脉导管长期留置是其良好选择。本研究通过对维持性血液透析患者采用动静脉瘘、深静脉导管长期留置患者的心功能、透析相关指标和实验室检查进行分析。
1 资料与方法
1.1 一般资料 选取2015至2017年在我院进行维持性血液透析的患者120例,其中男56例,女64例;年龄25~80岁,平均年龄(51.2±12.1)岁;维持透析时间10 d~9年,平均(31.3±13.6)个月;体重45.3~76.4 kg,平均(49.6±14.6)kg;收缩压89~142 mm Hg,平均(131.6±44.8)mm Hg;舒张压60~91 mm Hg,平均(80.5±7.3)mm Hg;其中慢性肾小球肾炎56例,糖尿病肾病50例,良性肾小球动脉硬化7例,慢性间质性肾炎4例,梗阻性肾病3例。由于血管条件异常,不能耐受内瘘手术或内瘘失败36例行深静脉导管留置(深静脉导管组),余84患者行动静脉内瘘(动静脉内瘘组)。动静脉内瘘组男39例,女45例;年龄26~79岁,平均年龄(51.7±13.5)岁;维持透析时间14 d至9年,平均(32.0±12.5)个月;体重45.7~76.0 kg,平均(50.1±13.7)kg;收缩压90~142 mm Hg,平均(130.4±45.4)mm Hg;舒张压61~90 mm Hg,平均(80.7±7.2)mm Hg;其中慢性肾小球肾炎39例,糖尿病肾病35例,良性肾小球动脉硬化5例,慢性间质性肾炎3例,梗阻性肾病2例。深静脉导管组男17例,女19例;年龄25~80岁,平均年龄(50.6±14.6)岁;维持透析时间10 d至9年,平均(31.0±13.1)个月;体重45.3~76.4 kg,平均(49.3±14.5)kg;收缩压89~140 mm Hg,平均(132.3±45.2)mm Hg;舒张压60~91 mm Hg,平均(80.2±7.1)mm Hg;其中慢性肾小球肾炎17例,糖尿病肾病15例,良性肾小球动脉硬化2例,慢性间质性肾炎1例,梗阻性肾病1例。2组性别比、平均年龄、维持透析时间、体重、收缩压、舒张压、原发疾病等比较,差异无统计学意义(Pgt;0.05)。
1.2 纳入与排除标准
1.2.1 纳入标准:①患者符合“中国血液透析用血管通路专家共识(第1版)”[5]的血管通路建立时机;②患者年龄≥18岁;③患者和(或)家属知情同意,并签署知情同意书。
1.2.2 排除标准:①患者有冠状动脉支架植入或旁路移植术者,安装心脏起搏器者;②近半年有严重的心血管事件发生,如心肌梗死;③患者基础情况不良,如严重感染、重度营养不良、肝功能损伤、慢性阻塞性肺疾病等;④患者合并肿瘤、严重凝血功能障碍;⑤患者有精神障碍,不能配合诊疗;⑥患者预期寿命lt;3个月。
1.3 方法
1.3.1 动静脉内瘘组:采用头静脉-桡动脉端侧吻合。首先进行ALLEN试验,检查患者手部血液供应情况,然后对选择的患者动静脉、重要脏器功能、血液动力学指标进行评估。患者取仰卧位或坐位,手术侧上肢外旋外展,平放于手术操作台上,用手术画线笔标记动静脉血管走行,常规碘伏消毒、铺巾。1%利多卡因局部浸润麻醉。在桡动脉和头静脉之间纵行切开皮肤3~4 cm,切口选择应尽量能充分暴露桡动脉及头静脉,便于分离血管。血管钳分离皮下组织,寻找并游离头静脉,结扎并切断近心端分支。头静脉游离长度为2~3 cm,以能搭到桡动脉处为宜,远端穿1-0或0-0丝线备用。术者食指触及桡动脉搏动,游离皮下组织,血管钳分离腕掌侧韧带,用弯血管钳前端挑出动脉鞘,穿一根专用皮筋牵拉,打开动脉鞘,小心分离与之伴行的静脉,游离桡动脉1.0~1.5 cm并结扎分支,再穿一根专用皮筋备用。动脉近心端夹血管夹,远心端结扎,于远心端切断动脉,若动脉管径较细,可剪一斜面。肝素0.9%氯化钠溶液冲洗管腔,采用7-0尼龙线先作两定点吻合,并作牵引用,然后作动静脉前壁和后壁连续或间断吻合,针距间隔大约1 mm,吻合口大小6~8 mm为宜。吻合完毕后,打开动脉血管夹。用手触摸到吻合口血管震颤,说明内瘘通畅。检查无渗血后,可给与庆大霉素5 ml冲洗切口,缝合皮肤(注意缝合皮肤不易过紧,以免压迫瘘口影响瘘的血流量)。
1.3.2 深静脉导管组:术前对患者进行评估:中心静脉、外周静脉插管史;上肢、胸部、颈部手术或外伤史;是否有抗凝治疗或凝血功能异常;水肿评估和侧支静脉检查;其他影像学和实验室检查。选择右侧颈内静脉进行穿刺,患者去枕仰卧,取Tredlengberg’s位,肩部垫高、外展,头部后仰20°~30°,脸转向对侧。头低位可保持静脉充盈,减少空气栓塞的危险。消毒铺巾,采用利多卡因进行局部麻醉,超声引导下,在胸锁乳突肌汇合处的顶点,穿刺针与皮肤呈30°~45°,针对同侧乳头或胸锁乳突肌锁骨头内侧端,进针约3 cm。做皮下隧道将长期双腔导管从隧道引出,沿导引钢丝依次进细、粗扩张管扩张皮下,拔除引导钢丝和扩张管,在撕脱鞘引导下置入导管,调整长期导管位置,使导管动静脉端血流通畅。肝素盐水封导管,缝合切口,固定导管,包扎。
1.4 观察指标
1.4.1 超声心动图心脏结构检测:检测患者左心室舒张末期内径(LVDd)、室间隔舒张末期厚度(IVSTd)、左心室后壁舒张末期厚度(PWTH)、射血分数(EF)、舒张早期和舒张晚期左心房室瓣口最大血流速度比(E/A)。
1.4.2 心功能评价:根据0.8×[1.04×(LVDd+PWTH)3-LVDd3]+0.6计算左心室心肌重量(LVM)。根据LVM/(0.0061×身高+0.0128×体重-0.15)计算左心室重量指数(LVMI)。左心室肥厚:男LVMIgt;125 g/m2,女gt;120 g/m2。左心室收缩功能障碍:EFlt;50%。左心室舒张功能障碍:E/Flt;1.0。
1.4.3 透析相关指标:根据-In(R-0.008t)+(4-3.5R)UF/W计算尿素清除率(Kt/V),其中R=透析后尿素氮值/透析前尿素氮值,t为透析时间,UF为透析超滤量,W为透析后干体重。尿素下降率=1-透析后尿素氮值/透析前尿素氮值,观察血管通路血流量。
1.4.4 实验室观察指标:血清肌酐、血钙、血磷、清蛋白、全段甲状旁腺激素、血红蛋白水平。
1.4.5 不良反应:观察2组患者不良反应发生情况。
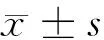
2 结果
2.1 2组血管通路建立前和建立后1年心脏结构改变比较 2组通路建立前LVDd、IVSTd、LVPWTd、EF、E/A水平比较,差异无统计学意义(Pgt;0.05)。动静脉内瘘组通路建立后LVDd、IVSTd、LVPWTd水平明显高于通路建立前,差异均有统计学意义(Plt;0.05),而EF、E/A水平比较,差异无统计学意义(Pgt;0.05)。深静脉导管组通路建立后LVDd、IVSTd、LVPWTd、EF、E/A水平与通路建立前比较,差异无统计学意义(Pgt;0.05)。深静脉导管组通路建立后LVDd、IVSTd、LVPWTd水平明显低于动静脉内瘘组,差异有统计学意义(Plt;0.05)。见表1。
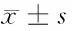
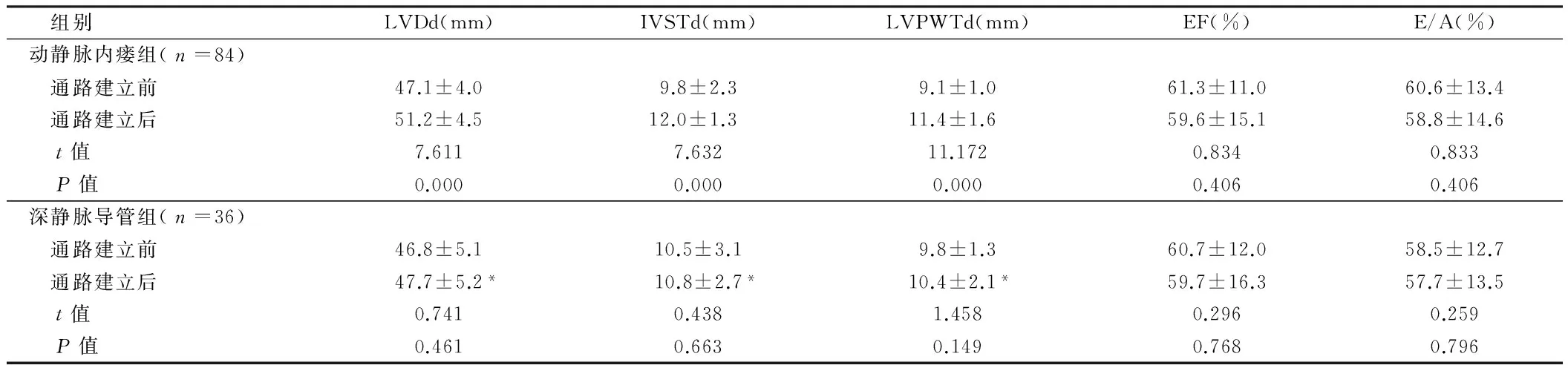
组别LVDd(mm)IVSTd(mm)LVPWTd(mm)EF(%)E/A(%)动静脉内瘘组(n=84) 通路建立前47.1±4.09.8±2.39.1±1.061.3±11.060.6±13.4 通路建立后51.2±4.512.0±1.311.4±1.659.6±15.158.8±14.6 t值7.6117.63211.1720.8340.833 P值0.0000.0000.0000.4060.406深静脉导管组(n=36) 通路建立前46.8±5.110.5±3.19.8±1.360.7±12.058.5±12.7 通路建立后47.7±5.2*10.8±2.7*10.4±2.1*59.7±16.357.7±13.5 t值0.7410.4381.4580.2960.259 P值0.4610.6630.1490.7680.796
注:与动静脉内瘘组比较,*Plt;0.05
2.2 2组血管通路建立1年后心功能评价 深静脉导管组血管通路建立1年后左心室肥厚、左心室收缩功能障碍发病率显著低于动静脉内瘘组,差异有统计学意义(Plt;0.05),左心室舒张功能障碍发病率低于动静脉内瘘组,但差异无统计学意义(Pgt;0.05)。见表2。

表2 2组血管通路建立1年后心功能评价 例(%)
注:*为Pearson未校正法
2.3 2组透析相关指标比较 深静脉导管组Kt/V、尿素下降率、血管通路血流量均低于动静脉内瘘组,差异有统计学意义(Plt;0.05)。见表3。
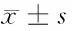

组别Kt/V尿素下降率(%)血管通路血流量(ml/min)动静脉内瘘组(n=84)1.59±0.2068.9±10.4237.5±30.6深静脉导管组(n=36)1.38±0.0963.8±9.0201.5±15.3t值6.0332.5596.698P值0.0000.0120.000
2.4 2组血管通路建立前和建立后1年实验室观察指标比较 动静脉内瘘组通路建立后肌酐、血磷、全段甲状旁腺激素均低于通路建立前,血钙、清蛋白、血红蛋白水平均高于通路建立前,差异均有统计学意义(Plt;0.05)。深静脉导管组通路建立后肌酐、血磷均低于通路建立前,血钙、清蛋白、血红蛋白水平均高于通路建立前,差异有统计学意义(Plt;0.05),全段甲状旁腺激素低于通路建立前,但差异无统计学意义(Pgt;0.05)。深静脉导管组治疗后肌酐、血钙、血磷、清蛋白、全段甲状旁腺激素、血红蛋白水平与动静脉内瘘组比较,差异均无统计学意义(Pgt;0.05)。见表4。
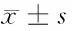

指标动静脉内瘘组(n=84)通路建立前通路建立后t值P值深静脉导管组(n=36)通路建立前通路建立后t值P值肌酐(μmmol/L)1120.7±277.4955.7±290.53.7650.0001105.2±215.0906.2±194.44.1190.000血钙(mmol/L)2.11±0.152.29±0.285.1940.0002.09±0.152.25±0.085.6470.000血磷(mmol/L)1.82±0.731.33±0.225.8900.0001.76±0.661.38±0.193.3200.001清蛋白(g/L)36.7±4.539.7±2.25.4890.00037.0±3.839.0±2.32.7020.009全段甲状旁腺激素(pg/L)265.2±134.2206.3±127.42.9170.004238.4±116.1194.6±107.21.6630.101血红蛋白(g/L)90.2±2.498.2±5.612.0340.00091.4±3.097.6±5.26.1970.000
注:与动静脉内瘘组比较,*Plt;0.05
2.5 2组不良反应发生率比较 深静脉导管组栓塞、感染及不良反应总发生率均高于动静脉内瘘组,差异有统计学意义(Plt;0.05),出血不畅发生率高于动静脉内瘘组,但差异无统计学意义(Pgt;0.05)。见表5。
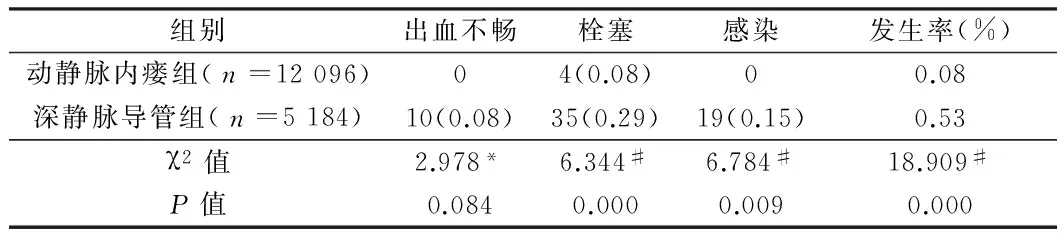
表5 2组不良反应发生率比较 例(%)
注:*为Yates校正法;#为Pearson未校正法
3 讨论
肾脏替代治疗的基本形式是血液透析,其治疗的持续时间和效果取决于良好的血管通路[6]。国内指南中明确指出,动静脉内瘘是血液透析的首选方案[5]。一项大型调查发现,2013年20个国家动静脉内瘘使用率为49%~92%,而深静脉导管使用率为1%~45%,美国2010至2013年动静脉内瘘使用率由63%增加至68%,而深静脉导管使用率由19%下降至15%[7]。但Pushevski等[8]指出,尽管动静脉内瘘是血液透析患者永久血管通路中的最佳方法,但60%的内瘘不成熟。本研究通过对维持性血液透析患者采用动静脉瘘、深静脉导管长期留置患者的心功能、透析相关指标和实验室检查进行分析,探讨二者临床应用价值。
3.1 动静脉内瘘 动静脉内瘘具有长期使用、并发症少,血流量充分和感染率低的特点。Ravani等[2]对62项血液透析血管通路方法的随机对照研究进行荟萃分析发现,与动静脉内瘘相比,使用导管的患者具有更高的全因死亡风险、致命感染、心血管事件。同样,使用导管的患者的死亡率、致命感染和心血管事件相比也有较高的风险,说明动静脉内瘘患者的风险最低。Mandolfo等[9]对2006至2010年美国国家数据系统中≥18岁的血液透析患者进行分析发现,动静脉内瘘患者总体死亡风险最低,且在不同年龄段中仍保持低死亡风险的优势。Pushevski等[8]研究发现,尽管动静脉内瘘具有绝对的临床应用优势,但动静脉内瘘狭窄是血液透析失败的主要原因,这可能与患者的年龄、性别、原发性肾病、小血管的直径、手术技巧、遗传学等有关,组织学研究发现,动静脉内瘘狭窄与局部炎症,氧化应激,导致成纤维细胞、内皮细胞增生、迁移有关。
3.2 永久深静脉导管 永久深静脉导管具有使用便捷,无需静脉穿刺,适用于不适合动静脉内瘘或人造血管的患者。永久深静脉导管可伴有导管相关血栓和细菌性栓塞,但随着科技发展,血液透析管及附件的表面和内腔均全部覆盖肝素涂层可以降低血小板黏附形成血栓的可能性。Mandolfo等[9]对141例血液透析患者进行前瞻性研究,发现导管替换15例,导管功能障碍是替换的主要原因,共发现53例血流相关感染事件(每1 000天0.82次),其中最常见的是革兰氏阳性病原体,累积生存期为1年91%,2年88%,4年85%。本研究发现,深静脉导管组通路建立后LVDd、IVSTd、LVPWTd、EF、E/A水平与通路建立前比较,差异无统计学意义(Pgt;0.05)。深静脉导管组通路建立后LVDd、IVSTd、LVPWTd水平明显低于动静脉内瘘组(Plt;0.05)。深静脉导管组血管通路建立1年后左心室肥厚、左心室收缩功能障碍发病率显著低于动静脉内瘘组(Plt;0.05)。深静脉导管组Kt/V、尿素下降率、血管通路血流量均低于动静脉内瘘组(Plt;0.05)。深静脉导管组通路建立前肌酐、血磷均低于通路建立前,血钙、清蛋白、血红蛋白水平均高于通路建立前(Plt;0.05)。深静脉导管组治疗后肌酐、血钙、血磷、清蛋白、全段甲状旁腺激素、血红蛋白水平与动静脉内瘘组比较,差异均无统计学意义(Pgt;0.05)。深静脉导管组栓塞、感染及不良反应总发生率均高于动静脉内瘘组(Plt;0.05),出血不畅发生率高于动静脉内瘘组,但差异无统计学意义(Pgt;0.05)。说明深静脉导管组对心脏结构影响较小,患者心功能改变和不良反应发生率低。
3.3 超声监测 永久性血液透析血管通路建立不断增加,在血管通路建立后会发生栓塞和感染,通过影像学监测透析导管功能、导管插入位置及血栓形成,可以减少并发症的发生率[10]。Almeida[11]研究发现,超声检查提高了患者血管穿刺的成功率,减少了并发症的发生。Ishii等[12]对2 557例维持性血液透析患者进行超声评估发现,超声评估是预测血栓形成和瘘功能障碍风险的一种简单方法。有利于对患者植入导管的功能进行评价。Burleva等[13]评估了动静脉瘘(AVF)的血流动力学变化,创建动静脉内瘘后12个月内肾功能不全患者表现出左心室尺寸增加。因此超声在前期评价、后期血管通路功能评估和心脏功能监测方面有重要意义。
综上所述,动静脉内瘘对维持性血液透析患者的心脏结构和心功能有一定影响,深静脉导管虽然出现栓塞、感染的发生率较高,但对心功能影响较小,超声评价对血液透析的临床效果和不良反应有重要意义。
1 Gupta V,Yassin MH.Infection andhemodialysisaccess:an updated review.Infect Disord Drug Targets,2013,13:196-205.
2 Ravani P,Palmer SC,Oliver MJ,et al.Associations betweenhemodialysisaccesstype and clinical outcomes:a systematic review.J Am Soc Nephrol,2013,24:465-473.
3 Al-Jaishi AA,Oliver MJ,Thomas SM,et al.Patency rates of thearteriovenous fistulaforhemodialysis:a systematic review and meta-analysis.Am J Kidney Dis,2014,63:464-478.
4 Bachleda P,Utikal P,Kocher M,et al.Arteriovenous graft for hemodialysis,graft venous anastomosis closure-current state of knowledge.Minireview.Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub,2015,159:27-30.
5 中国医院协会血液净化中心管理分会血液净化通路学组.中国血液透析用血管通路专家共识.第1版.中国血液净化,2014,13:549-558.
6 Les J,Wańkowicz Z.Methods of central vascular access for haemodialysis.Anaesthesiol Intensive Ther,2013,45:171-176.
7 Pisoni RL,Zepel L,Port FK,et al.Trends in US vascular access use,patient preferences,and related practices:an update from the US DOPPS practice monitor with international comparisons.Am J Kidney Dis,2015,65:905-915.
8 Pushevski V,Dejanov P,Gerasimovska V,et al.Severe endothelial damage in chronic kidney disease patients prior to haemodialysis vascularaccess surgery.Pril (Makedon Akad Nauk Umet Odd Med Nauki),2015,36:43-49.
9 Mandolfo S,Acconcia P,Bucci R,et al.Hemodialysistunneled central venous catheters:five-year outcome analysis.J VascAccess,2014,15:461-465.
10 Premui V,Tomasevi B,Erzen G,et al.Temporary and permanent central venous catheters forhemodialysis.Acta Med Croatica,2014,68:167-174.
11 Almeida CE.Vascularaccess:the impact of ultrasonography.Einstein (Sao Paulo),2016,14:561-566.
12 Ishii T,Suzuki Y,Nakayama T,et al.Duplex ultrasound for the prediction ofvascularevents associated with arteriovenous fistulas in hemodialysis patients.J VascAccess,2016,17:499-505.
13 Burleva EP,Nazarov AV,Popov AN,et al.Evolution ofultrasonicindices of theheartand arteriovenous fistulas in patients on chronic haemodialysis.Angiol Sosud Khir,2013,19:11-17.
10.3969/j.issn.1002-7386.2017.23.011
050051 石家庄市,河北省人民医院超声科(焦荣红、于明月、牛慧敏),肾内科(冯珍)
R 459.5
A
1002-7386(2017)23-3565-05
2017-08-24)

