超声内镜是否足以精准诊断上消化道黏膜下肿物?
张志宏, 刘晓岗, 李良平
四川省人民医院消化内科,四川 成都 610072
其他论著
超声内镜是否足以精准诊断上消化道黏膜下肿物?
张志宏, 刘晓岗, 李良平
四川省人民医院消化内科,四川 成都 610072
目的评估超声内镜(endoscopic ultrasonography,EUS)诊断上消化道黏膜下隆起病变的准确率。方法收集四川省人民医院2014年1月至2016年6月经胃镜检查提示上消化道黏膜下隆起者共108例,顺序以EUS拟诊、内镜下切除术(ESD/STER等)、病理结果评估EUS诊断的准确率。以病理结果为金标准,计算EUS的真阳性率及假阳性率。结果EUS真阳性率为72.2%(78/108),假阳性率为27.8%(30/108)。来源于黏膜肌层及固有肌层隆起病变的假阳性率为23.6%(21/89)。食管及贲门隆起病变多为平滑肌瘤;除贲门外其他上消化道黏膜下隆起病变则以间质瘤为主,真阳性率高达80.3%。来源于固有肌层的钙化性纤维瘤,EUS下极易被误诊为间质瘤。来源于黏膜下层的低回声病灶,如神经内分泌肿瘤、深在性囊性胃炎、神经鞘瘤、脉管瘤等,EUS的假阳性率则高达47.3%(9/19)。结论EUS对于上消化道黏膜下隆起病变的诊断有较高的临床价值,但对于黏膜下层低回声病灶的精准诊断,EUS仍存在较多困难。因此,对照术后病理结果复习EUS图像,对于提高EUS诊断、鉴别诊断的能力,把握内镜切除指征具有重要的临床意义。
黏膜下隆起病变;超声内镜;ESD/STER;平滑肌瘤;间质瘤
随着超声内镜(endoscopic ultrasonography,EUS)技术和设备的发展,EUS对于上消化道黏膜下隆起病变的诊断价值基本得以公认。既往研究[1-2]提示,EUS可根据黏膜下肿物的部位、起源层次、大小、回声强度、均匀程度、边界、与周围脏器关系等因素做出诊断,其特异性为80%~88%。但是,单纯采用EUS这一影像学技术是否足以做出精准诊断,有待证实本文收集四川省人民医院2014年1月至2016年6月上消化道黏膜下隆起病变者108例,所有纳入病例均顺序予以胃镜及EUS拟诊、内镜下切除术(ESD/STER等),最后以病理结果为金标准评估EUS诊断的准确率,以期明确EUS的正确诊断率。
1 资料与方法
1.1一般资料收集四川省人民医院2014年1月至2016年6月上消化道黏膜下隆起病变者共108例,男45例,女63例,年龄25~84岁,平均年龄52.6岁。纳入标准:经胃镜检查提示上消化道黏膜下隆起,EUS对黏膜下隆起病变予以拟诊,所有患者均于签署知情同意后行内镜下切除术。排除标准:心、肺、肝、肾等重要脏器功能衰竭、凝血功能障碍等不能耐受内镜手术者;拟诊为囊肿、血管瘤、脂肪瘤等良性病变,无需内镜下治疗者;拒绝接受内镜或其他治疗者。
1.2EUS检查所有患者予以微型超声探头(Olympus Endo Echo EU-M2000,探头频率20 MHz),采用脱气水充盈法,明确病变起源层次、回声强度、回声均匀度、边界及与周围脏器的关系等。如病变较大,观察病灶全貌困难者予以Olympus ME-1环扫EUS明确。
1.3内镜切除术所有病灶根据其所在层次及病变的性质选择相应的内镜切除术式(ESD、STER、EFR等),收集整块标本送检。手术病灶大小为0.5~3.5 cm。仅1例于术中出现大出血,在尝试各种方法予以止血困难后转外科手术切除。
1.4手术后标本病理分析所有病变标本均予以固定、染色等病理标本制作流程,然后根据需要予以免疫组化如CD117、CD34、DOG-1、SMA、Desmin、S-100、CK、Ki-67等指标加以分析。
1.5统计学分析以病理结果为金标准,分别计算EUS阳性检出结果中的真阳性率,真阳性率(%)=EUS与病理同为阳性的病例数/EUS检出阳性的总例数×100%;EUS检出阳性结果中假阳性率,假阳性率(%)=EUS阳性而病理阴性的病例数/EUS检出阳性的总例数×100%。
2 结果
2.1评估采用EUS对于隆起病变的正确检出率尽管EUS可根据病灶的来源及回声高低等大致判断病变的性质,但对比病理金标准后仍然有一定的假阳性率。在本研究所纳入的108例患者中,经EUS检查,各病灶检出正确率,即真阳性率为72.2%(78/108),而假阳性率为27.8%(30/108)。
2.2评估来源于黏膜肌层及固有肌层隆起病变的正确检出率如表1所示,本研究中来源于黏膜肌层及固有肌层隆起病变总假阳性率为23.6%(21/89)。

表1 来源于黏膜肌层及固有肌层的隆起病变EUS及病理结果对比
注:△:副脾;*:钙化性纤维瘤。
本研究中,隆起病变来源于黏膜肌层及固有肌层的比例最大。根据病灶来源于食管及胃部的具体部位不同,病灶的性质也有差异。其中,食管及贲门大多为平滑肌瘤,而其他部位则以间质瘤为主。但是,若仅根据病灶部位判断隆起病变的性质可能导致一定比例的误诊。本研究中3例来源于固有肌层的食管隆起,EUS经验判断为间质瘤,最后仅1例经病理免疫组化证实,EUS诊断的真阳性率为33.3%(1/3)。来源于贲门固有肌层的间质瘤的真阳性率为45.5%(5/11),而平滑肌瘤在贲门肿物中仍占较大比例(54.5%,6/11)。胃底固有肌层作为间质瘤的好发部位,其真阳性率为87.5%(35/40),但病理结果提示,4例平滑肌瘤被误诊为间质瘤,该结果提示10%假阳性率。1例胃底隆起因术中出血难止,改外科手术,术后证实为副脾。胃窦及十二指肠来源于固有肌层及黏膜肌层的病变较上述部位较少,均为间质瘤,未见平滑肌瘤。由此,胃部肿物除贲门以平滑肌瘤为主外,其他部位以间质瘤为主,真阳性率高达80.3%(53/66)。此外,本研究中间质瘤病灶的直径为0.5~3.5 cm,所有病灶的Ki67均为1%~2%,无1例>5%,提示<3.5 cm的恶性间质瘤罕见。此外,4例来源于胃体、胃窦固有肌层的钙化性纤维瘤EUS经验性诊断时均被误诊为间质瘤,误诊率较高。
2.3评估黏膜下层隆起病变的假阳性检出率来源于黏膜下层低回声病灶,EUS的假阳性率高达47.3%(9/19),相较其他病灶来说,其准确性最低,尤其是低回声病灶诊断更为困难(见表2)。
黏膜下层的病灶可分为中-高回声及无-低回声两类病变。高回声病灶以脂肪瘤、纤维瘤多见;无回声多见于囊肿、血管;中-高混合性回声多见于异位胰腺;低回声病灶种类较多,多见于神经内分泌肿瘤、深在性囊性胃炎、神经鞘瘤、脉管瘤等,假阳性率非常高,本研究中此类病变的假阳性率高达47.3%(9/19),部位则以胃体胃窦多见,食管及胃底较少见,而贲门罕见。本研究中,低回声病灶以神经内分泌肿瘤较为常见,真阳性率为66.7%(6/9),其次为深在性囊性胃炎,而脉管瘤、神经鞘瘤仅仅依靠EUS鉴别则非常困难,常需行免疫组化检查后,方可确诊,单纯采用EUS则极易被误诊。
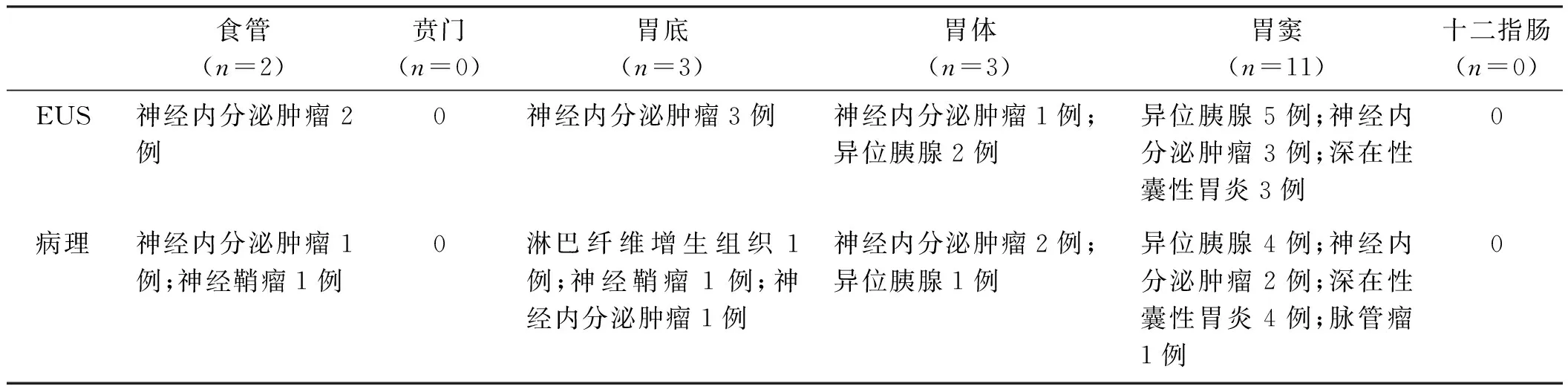
表2 黏膜下层低回声病变的EUS及病理结果对比
2.4典型病例EUS的表现特点如图1~7所示,EUS可根据病灶大小、部位及起源的层次等特点以鉴别间质瘤及平滑肌瘤,但仍有一定误判率,最后诊断仍然需要病理的免疫组化。
来源于固有肌层的钙化性纤维瘤在EUS中表现为起源于固有浅层,病灶为高回声,其后常伴声影,部分病例显示即使其病灶直径不大,EUS中的病灶后壁却显示欠佳,此特点可用以鉴别间质瘤,但是部分钙化性纤维瘤该特点表现缺乏,导致诊断仍然比较困难。
黏膜下层中高混合回声病变以异位胰腺多见,病灶中央可见无-低回声管状结构,多见于胃体、胃窦、十二指肠球部。黏膜下层低回声病变可能为深在性囊性胃炎、神经内分泌肿瘤、神经鞘瘤、淋巴瘤、脉管瘤等,鉴别相对困难,但部分典型病例仍有一定特点。如图所示,神经内分泌肿瘤来源于黏膜下层,以均匀低回声多见;而深在性囊性胃炎多呈无-低回声,多呈囊性结构,部分病灶可见分隔,且回声欠均匀,但少数深在性囊性胃炎呈中-高回声,难与异位胰腺区别。神经鞘瘤来源于黏膜下层或固有肌层浅层,中-低回声,需依靠EUS-FNA或切除后病理鉴别。淋巴纤维组织增生EUS呈中等回声,较前述病灶回声稍高。
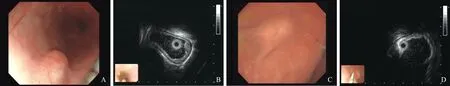
图1 食管隆起 A:食管神经内鞘瘤;B:食管神经鞘瘤,起源黏膜下层,中低回声;C:胃神经鞘瘤;D:胃神经鞘瘤起源于黏膜下层,低回声Fig 1 Esophageal neoplasm A: esophagus schwannoma; B: esophagus schwannoma, origin from submucosa, pypoech; C: gastric schwannoma; D: gastric schwannoma: origin from submucosa, pypoech

图2 胃体隆起 A:胃体纤维钙化瘤;B:欠均匀回声中见高回声,后伴声影;C:起源于固有肌层
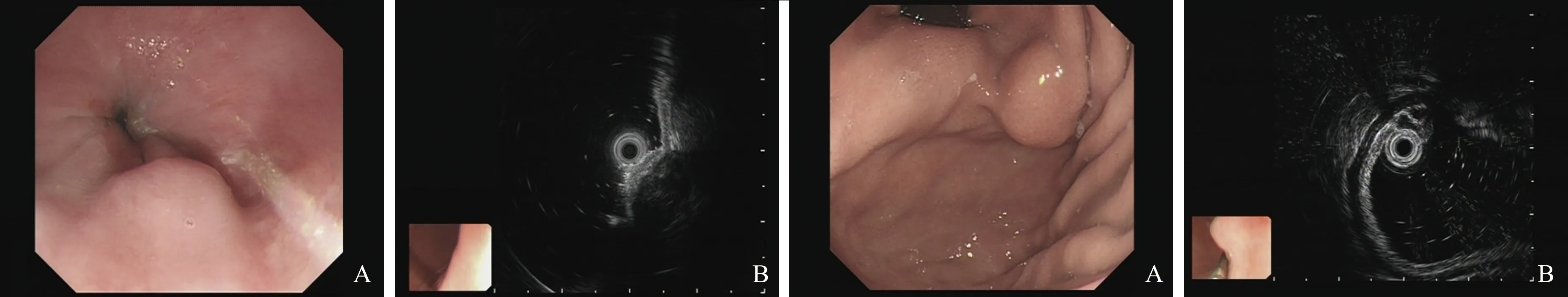
图3 食管隆起 A:食管平滑肌瘤;B:起源于固有肌层;图4 胃底隆起 A:胃底GIST;B:GIST起源于固有肌层,低回声
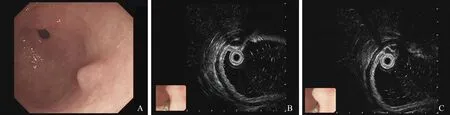
图5 胃窦隆起 A:胃窦深在性囊性胃炎;B:起源于黏膜下层;C:低回声伴分隔的深在性囊性胃炎Fig 5 Gastric antral neoplasm A:deep cystic gastritis in gastric antrum; B:deep cystic gastritis origin from submucos; C:EUS presented hypoechoic and separation

图6 胃窦隆起 A:息肉样隆起的深在性囊性胃炎;B:不均匀或低回声的囊性胃炎伴分隔图7 胃体隆起 A:胃神经内分泌肿瘤;B:EUS呈低回声Fig 6 Gastric antral neoplasm A:deep cystic gastritis in gastric antrum; B:uneven echoic or anechoic cystic with separationFig 7 Gastric neoplasm A:neuroendocrine tumors; B:EUS showed hypoechioc
3 讨论
随着EUS设备和技术水平的发展,EUS在上消化道黏膜下隆起病变的诊断价值已基本得到公认。但是,单纯采用EUS是否足以精确诊断上消化道黏膜下肿物有待证实。本研究将上消化道黏膜下隆起病变顺序予以EUS检查拟诊、内镜切除、对比病理结果,以评估EUS诊断的准确率。
本研究提示,EUS诊断来源于黏膜肌层及固有肌层病变的准确率较高(72.2%),与既往研究[3]基本一致(75%~85%),但病灶的具体性质仍需依赖免疫组化,甚至是基因检测方可明确。其中,食管病灶中,无论来源于黏膜肌层或固有肌层,均以平滑肌瘤为主,仅少数固有肌层来源的病灶为间质瘤,比例低至9.1%(1/11),与既往报道[4]中食管间质瘤的比例不足7%基本一致,其他来源于食管黏膜下层的恶性或潜在恶性者如食管的颗粒细胞瘤等非常少见,不足1%[5]。来源于固有肌层的胃底病灶以间质瘤为主(87.5%,35/40),仅少数为平滑肌瘤,与既往研究[6]的间质瘤多发生于50岁以上近端胃的结论一致,但平滑肌瘤仍可见于胃体(18.2%)及贲门(54.5%),也与既往研究[7]结论相一致。上述结果提示,做出EUS诊断时根据病变部位顺序排列“间质瘤?或平滑肌瘤?”可能更为客观。既往有研究[8]提出,EUS-FNA对于直径<1 cm间质瘤的诊断准确性为40%~50%,1~3 cm准确性为60%~70%,提示EUS-FNA技术因病灶直径的大小而导致获取的标本量受限,诊断仍然存在一定难度,提示本研究中采用的内镜下完整切除术对于精确诊断仍有一定的临床意义。此外,尽管有报道[9]认为,间质瘤在<2 cm时的恶性比例高达11%,但本研究在<3.5 cm的间质瘤中未见1例Ki67>5%,故认为<1 cm的恶性间质瘤极为罕见,该结论与既往报道[10]的结论一致。
另外,起源于固有肌层浅层的钙化性纤维瘤,于EUS检查中表现为固有肌层的近侧病灶呈高回声影,其后常伴声影,即使隆起病变的直径不大,但由于声影的存在,固有肌层深层的外侧常难以窥视边界,此特点可作为鉴别间质瘤的特点。但仍有部分钙化性纤维瘤病灶的特点并不突出,导致EUS做出诊断时非常困难。有报道[11-12]认为,EUS的上述表现可能是胃壁本身钙化所致,但本研究中的数例病灶均予以病理及免疫组化检查,结果提示,EUS出现上述表现特点时诊断钙化性纤维瘤的可能性更大。
与起源于肌层的病灶比较,黏膜下层病灶的假阳性率较高,本研究高达47.3%(9/19)。分析原因如下:(1)大部分起源于黏膜下层的胃窦、胃体中-高回声病灶以异位胰腺常见,而十二指肠黏膜下高回声则多见于脂肪瘤或纤维瘤;(2)部分低-无回声多为囊肿或血管瘤。上述两类病灶者,除少数强烈要求治疗者外,因无须内镜下处理,均未被纳入研究,导致该类病灶获得的病理资料较少,影响了真阳性率的统计结果,也是造成本研究偏倚较大的重要原因;(3)被纳入本研究并处理的黏膜下层病灶多为低回声、具有潜在恶性者,尽管部分病变EUS下表现有一定的特点,但明确诊断基本需要依赖病理及免疫组化,也是造成本研究误诊率较高的重要原因。
黏膜下层低回声病变常见于深在性囊性胃炎、神经内分泌肿瘤、神经鞘瘤、淋巴瘤、脉管瘤等,其中以深在性囊性胃炎、神经内分泌肿瘤等多见。部分典型病例的EUS表现具有一定的特点。
其中,神经内分泌肿瘤多见于胃窦(22.8%),也可见于阑尾、小肠、直肠,EUS以黏膜下层低回声表现为主,回声均匀,直径一般较小,无分隔及无囊性改变[13]。
深在性囊性胃炎则表现为厚壁病灶,病变内见无-低回声囊性结构,多为分隔或排列为管腔样结构,少数以中-高回声表现者难与异位胰腺鉴别,与其他报道[14]描述一致。本研究中1例深在性囊性胃炎病灶在随访中突然由1 cm迅速增大至3 cm,由于不能完全排除神经内分泌肿瘤等病变,立即予以行ESD切除治疗,术后证实为深在性囊性胃炎。有研究[15]报道,80周的深在性囊性胃炎动物模型中,76.2%的深在性囊性胃炎可进展为腺癌。其他一些研究[16]也认为,深在性囊性胃炎有癌变的可能,提示消化科医师应该予其以足够的重视。
神经鞘瘤多见于老年女性,以胃体为主[17],来源于黏膜下层或固有肌层浅层。本研究中食管神经鞘瘤在EUS多表现为低-中等回声,回声均匀;而胃体神经鞘瘤则多呈不均匀的低回声,边界尚清楚,与其他相关报道中所示的神经鞘瘤EUS多表现为较肌层更低或低回声中可见点片状中高回声影等特点类似,但本研究中所有病灶均未见囊性变或钙化等表现,此类肿瘤与神经内分泌肿瘤有时鉴别极为困难,误诊率也较高。
淋巴纤维组织增生呈中等回声表现,多数需要取得病理方可明确。脉管瘤多表现为多发的囊性病变,部分病例予以环扫超声内镜检查时,可显示血流信号以鉴别,但少数病灶表现为单发、低回声、实性变、且无伴明显血流者则诊断困难,需要切除病理明确[18]。
综上,EUS在诊断上消化道黏膜下隆起病灶时具有较高的临床价值,但是对于黏膜下层低回声病灶的精准诊断仍存在较多困难。由于低回声病灶较中-高回声病灶的潜在恶性度更大,辅助EUS-FNA或内镜下切除等方式加以明确可能更为需要。因此,即使患者不愿意接受内镜下的治疗,也应告知需密切随访;一旦病灶大小或程度出现变化,即予以积极治疗。由此,本研究还提示,反复研习EUS图像及术后的病理结果,对于掌握和提高EUS诊断、鉴别诊断能力,更准确把握内镜切除的指针等,具有非常重要的临床意义。
[1] Rösch T, Kapfer B, Will U, et al. Accuracy of endoscopic ultrasonography in upper gastrointestinal submucosal lesions: a prospective multicenter study [J]. Scand J Gastroenterol, 2002, 37(7): 856-862.
[2] Will U, Fueldner F, Mueller AK, et al. A prospective study on endoscopic ultrasonography criteria to guide management in upper GI submucosal tumors [J]. Pol Przegl Chir, 2011, 83(2): 63-69.
[3] Seo SW, Hong SJ, Han JP, et al. Accuracy of a scoring system for the differential diagnosis of common gastric subepithelial tumors based on endoscopic ultrasonography [J]. J Dig Dis, 2013, 14(12): 647-653.
[4] Franco MC, Schulz RT, Maluf-Filho F. Opinion: how to manage subepithelial lesions of the upper gastrointestinal tract? [J]. World J Gastrointest Endosc, 2015, 7(18): 1262-1267.
[5] Polkowski M. Endoscopic ultrasound and endoscopic ultrasound-guided fine-needle biopsy for the diagnosis of malignant submucosal tumors [J]. Endoscopy, 2005, 37(7): 635-645.
[6] Nishida T, Blay JY, Hirota S, et al. The standard diagnosis, treatment, and follow-up of gastrointestinal stromal tumors based on guidelines [J]. Gastric Cancer, 2016, 19(1): 3-14.
[7] He Z, Sun C, Wang J, et al. Efficacy and safety of endoscopic submucosal dissection in treating gastric subepithelial tumors originating in the muscularis propria layer: a single-center study of 144 cases [J]. Scand J Gastroenterol, 2013, 48(12): 1466-1473.
[8] Hoda KM, Rodriguez SA, Faigel DO. EUS-guided sampling of suspected GI stromal tumors [J]. Gastrointest Endosc, 2009, 69(7): 1218-1223.
[9] Coe TM, Fero KE, Fanta PT, et al. Population-based epidemiology and mortality of small malignant gastrointestinal stromal tumors in the USA [J]. J Gastrointest Surg, 2016, 20(6): 1132-1140.
[10] Zeng QH, Wan J, Du HT, et al. A retrospective study of 22 years endoscopic follow-up in elderly patients with gastrointestinal submucosal tumors [J]. Zhonghua Yi Xue Za Zhi, 2013, 93(6): 452-454.
[11] Zhou C, Wang S, Tang W, et al. A rare case of spherical calcifications presenting as a submucosal lesion on the stomach wall: an EUS analysis [J]. Endosc Ultrasound, 2016, 5(2): 137-139.
[12] Izawa N, Sawada T, Abiko R, et al. Gastrointestinal stromal tumor presenting with prominent calcification [J]. World J Gastroenterol, 2012, 18(39): 5645-5648.
[13] Li QL, Zhang YQ, Chen WF, et al. Endoscopic submucosal dissection for foregut neuroendocrine tumors: an initial study [J]. World J Gastroenterol, 2012, 18(40): 5799-5806.
[14] Yu XF, Guo LW, Chen ST, et al. Gastritis cystica profunda in a previously unoperated stomach: a case report [J]. World J Gastroenterol, 2015, 21(12): 3759-3762.
[15] Mukaisho K, Miwa K, Kumagai H, et al. Gastric carcinogenesis by duodenal reflux through gut regenerative cell lineage [J]. Dig Dis Sci, 2003, 48(11): 2153-2158.
[16] Choi MG, Jeong JY, Kim KM, et al. Clinical significance of gastritis cystica profunda and its association with Epstein-Barr virus in gastric cancer [J]. Cancer, 2012, 118(21): 5227-5233.
[17] Voltaggio L, Murray R, Lasota J, et al. Gastric schwannoma: a clinicopathologic study of 51 cases and critical review of the literature [J]. Hum Pathol, 2012, 43(5): 650-659.
[18] Yoo S. GI-associated hemangiomas and vascular malformations [J]. Clin Colon Rectal Surg, 2011, 24(3): 193-200.
(责任编辑:马 军)
Thevalueofendoscopicultrasonographyindiagnosisofuppergastrointestinalsubmucosallesions
ZHANG Zhihong, LIU Xiaogang, LI Liangping
Department of Gastroenterology, Sichuan Provincal People’s Hospital, Chengdu 610072, China
ObjectiveTo evaluate the diagnosis accuracy rate of endoscopic ultrasonography (EUS) for upper gastrointestinal submucosal lesions .MethodsOne hundred and eight cases were collected from Jan. 2014 to Jun. 2016. All submucosal protuberant lesions were recognized by gastroendoscopy firstly. Then these lesions were sequentially given examination by EUS and endoscopic resection (ESD/STER, etc.). The diagnosis accuracy rate of EUS was assessed with pathological results as the golden standard.ResultsThe overall true positive probability of EUS was 72.2% (78/108), while the false positive probability was 27.8% (30/108). The protuberant lesions from mucosal muscularis or muscularis propria layers showed the false positive probability was 23.6% (21/89). Most lesions from esophagus and cardia were leiomyoma, but others were stromal tumors. The true positive probability arrived to 80.3%. Calcified fibrous tumors derived from the propria muscle layer were easily misdiagnosed as stromal tumors just through EUS. The hypo-echo lesions from the submucosa layer showed the high false positive probability of 47.3% (9/19), mostly were identified as the neuroendocrine tumors, deep cystic gastritis, schwannomas and hemangioma, etc.ConclusionFor the upper gastrointestial submucosal lesions, EUS has much high clinical diagnosis value. However, it is still difficult for the hypoechoic lesions origin from the submucosa layer. And it is very important to improve the diagnosis rate, differential diagnosis lever and assure endoscopic resection indications by repeatedly reviewing EUS images with the pathological results.
Submucosal protuberant lesions; Endoscopic ultrasonography; ESD/STER; Leiomyoma; Stromal tumor
四川省卫计委科研项目支持(150209)
张志宏,硕士,副主任医师,研究方向:超声内镜的应用及消化道肿瘤的诊治。E-mail: 750725308@qq.com
10.3969/j.issn.1006-5709.2017.11.019
R57
A
1006-5709(2017)11-1273-05
2016-12-19

