耐盐植物虎尾草内生解烃细菌的筛选及其降解特性
吴 涛 ,许 杰 ,谢文军 ,姚志刚 ,刘俊华 ,杨红军 ,孙春龙 ,王书平
耐盐植物虎尾草内生解烃细菌的筛选及其降解特性
吴 涛1,2,许 杰3,谢文军1,2,姚志刚1,刘俊华2,杨红军2,孙春龙1,2,王书平1
(1.滨州学院生物工程学院,山东省黄河三角洲野生植物资源开发利用工程技术研究中心,山东 滨州 256600;2.滨州学院,山东省黄河三角洲生态环境重点实验室,山东 滨州 256600;3.滨州职业学院生物工程学院,山东 滨州 256603)
从耐盐植物中分离具有石油烃降解功能内生细菌并研究其降解特性,为内生细菌协同宿主植物修复石油污染盐渍化土壤提供基础。以黄河三角洲长期受石油污染重盐碱地生长的耐盐植物虎尾草为材料,分离出能以柴油为唯一碳源生长的内生细菌24株。通过柴油降解试验,筛选得到1株高效石油烃降解内生细菌BF04。经生理生化特性及16S rDNA同源序列分析,确定BF04为短小芽孢杆菌(Bacillus pumilus)。通过液体培养试验研究了BF04对不同烃的利用能力和对柴油的降解动力学特征。结果表明:BF04能够利用直链烷烃、支链烷烃和单环芳烃,不能利用多环芳烃和苯酚。BF04能降解柴油中大部分烷烃,其中对短链烷烃(nC11~nC23)降解率高于长链烷烃(nC24~nC27)。BF04对柴油降解可以用一级反应动力学模型表示。在含有3%NaCl的液体培养基中,BF04具有较强的降解柴油能力,在修复石油污染高盐环境中具有一定的应用潜力。
石油污染;盐渍化土壤;内生细菌;短小芽孢杆菌;耐盐植物;解烃
土壤盐渍化导致石油烃类污染物持久性增加,环境风险加大[1-2]。对石油污染盐渍化土壤治理,是目前面临的一项重要任务。植物修复是一种经济、有效、环境友好的污染土壤治理技术。研究证明,耐盐植物能加快盐渍化土壤中石油污染物降解,引入耐盐植物是加快石油污染盐渍化土壤修复进程的重要途径[3]。植物内生细菌(Endophytic bacteria)是指生活在健康植物内部组织和器官中,并未使植物的表型特征和功能发生改变的细菌[4]。植物内生细菌能提高宿主对环境污染物的耐受性,促进植物生长,并且能在植物组织中降解有机污染物,减少有毒污染物对食草动物的影响和向大气中挥发[5-6]。此外,与根际微生物相比,内生细菌生存竞争压力小,具有稳定的生境,在植物修复的实践中更具有优势[7]。对于内生细菌在耐盐植物修复石油污染土壤方面的研究几乎无人涉足。虎尾草作为一种耐盐碱草本植物,能在含盐量0.53%、pH 10.51的土壤环境中正常生长[8],对石油污染物耐性强,在植物修复石油污染盐渍化土壤中具有较大的应用潜力[3]。本研究从黄河三角洲石油污染重盐碱地土壤上生长的耐盐植物虎尾草(Chloris virgata SW.)中筛选出1株高效解烃内生细菌,通过形态观察、生理生化特征和16S rDNA序列比对对其进行鉴定,同时初步研究了该菌降解石油烃特性,以期为内生细菌协同植物修复石油污染盐渍化土壤提供依据。
1 材料与方法
1.1 实验材料
供试植物虎尾草采自黄河三角洲石油污染重盐碱地区(37°51′58.6″N,118°48′56.0″E)。采集的完整植株,放入冷藏式采样样品保存箱,带回实验室立即进行菌株的分离筛选。
实验用柴油为0#,购自山东省滨州市滨城区中石化第三加油站。
1.2 培养基
LB固体培养基:酵母粉5.0 g,胰蛋白胨10.0 g,NaCl 10.0 g,琼脂15.0 g,溶于1000 mL蒸馏水,pH 7.4。
无机盐液体培养基(MSM):KH2PO41.5 g,Na2HPO41.5 g,MgSO40.2 g,(NH4)2SO41.0 g,微量元素混合液 1 mL,蒸馏水定容至1000 mL,pH 7.4。其中微量元素混合 液 :CoCl2·6H2O 4.0 g,H3BO30.5 g,ZnCl22.0 g,NaMoO4·2H2O 2.0 g,CuCl2·2H2O 1.0 g,CaCl240.0 g,FeCl3·7H2O 40.0 g,MnCl2·4H2O 8.0 g,AlCl3·6H2O 1.0 g,溶于1000 mL蒸馏水。
无机盐固体培养基:在无机盐液体培养基中按15 g·L-1的量加入琼脂。
Oil-Ms-agar固体培养基:在无机盐固体培养基上滴加柴油,使培养基表面形成薄层油膜。
1.3 植物内生解烃菌的分离、筛选与降解能力
自来水冲洗整株植物30 min,再用蒸馏水冲洗3次,每次3 min。吸干植物表面水分,将植株分为根、茎、叶三部分,各部分用70%乙醇溶液浸泡2 min,无菌水洗3次,再放入1.2%次氯酸钠溶液中振荡30 min,无菌水冲洗3次,每次2 min。取最后一次冲洗无菌水100 μL,涂布于LB固体培养基培养24 h,检验植株表面消毒是否完全。在表面消毒的植物组织中加入10倍体积的磷酸盐缓冲液,研磨后静置5 min,将悬液涂布于Oil-Ms-agar固体培养基,30℃恒温培养4 d,挑取不同形态的单菌落,经纯化后保存于LB固体培养基斜面[9]。
制备细胞数约为1×108CFU·mL-1的菌悬液,按5%接种量接入以柴油为唯一碳源的无机盐液体培养基。其中,柴油通过0.22 μm有机滤膜除菌后按3 g·L-1的量加入,以不加菌加柴油培养基作为对照,设置3个重复。调pH值为7.4,于30℃摇床200 r·min-1培养7 d,柴油残留量采用红外测油仪(华夏科创,OIL480)测定。柴油降解率按照式(1)计算:
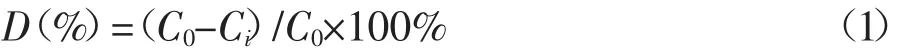
式中:D为培养基中柴油降解率,%;C0为未加菌降解后培养基中柴油浓度,g·L-1;Ci为加菌降解后培养基中柴油浓度,g·L-1。
1.4 菌株鉴定
菌株生理生化实验参照文献[10]进行,16S rDNA克隆参照文献[11]进行。正向引物:5′-AGAGTTTGATYMTGGCTCAG-3′;反向引物:5′-CGGTTACCTTGTTACGACTT-3′。16S rDNA序列由生工生物工程(上海)股份有限公司测定。将测定的序列在GenBank中用Blast软件与已知序列进行同源性分析,采用Mega 5.0软件进行多序列匹配排列,以邻接法(Neighbor-Joining Method)构建16S rDNA系统发育树。
1.5 菌株利用不同烃类物质的定性分析
取适量菲、萘和苯酚的氯仿溶液,通过0.22 μm有机滤膜除菌后加入灭菌三角瓶中,待氯仿挥发完加入无机盐液体培养基,正己烷、环己烷、正辛烷、异辛烷、正十六烷、甲苯、二甲苯通过0.22 μm有机滤膜除菌后直接加入无机盐液体培养基,终浓度为500 mg·L-1。制备细胞数约为 1×108CFU·mL-1的菌悬液,按5%接种量分别接入以各种烃类为唯一碳源的无机盐液体培养基。以不加菌加烃培养基处理作为对照,每个处理设置3个重复。调pH值为7.4,于30℃恒温摇床200 r·min-1培养5 d,于600 nm处测定吸光度。通过600 nm处吸光度大小反映菌株在各烃类物质为唯一碳源无机盐液体培养基中的生长情况。
1.6 菌株对柴油中烷烃组分的降解实验
按照1.3方法进行菌株柴油降解实验。培养7 d后,培养液中石油烃组分利用正己烷萃取,无水硫酸钠脱水,萃取液过硅酸镁吸附柱,用GC-FID(Agilent,7890A)进行分析。用正构烷烃混合标准液(nC8~nC40,AccuStandard)进行校正,利用外标法建立线性5点校正曲线,计算正构烷烃含量。烷烃降解率(R)按照式(2)计算:

式中:Ri为i碳数正构烷烃的降解率,%;Pci为对照中i碳数正构烷烃含量,mg·L-1;Pi为加菌降解后 i碳数正构烷烃含量,mg·L-1。
色谱分析条件:色谱柱为Agilent HP-5 MS,30 m×0.25 mm×0.25 μm;检测器为 FID 氢火焰离子检测器;载气为氦气(99.999%);进样口温度为290℃;检测器温度为300℃;升温程序为50℃保持2 min,以每分钟6℃的速度升到300℃,并在300℃保持16 min,进样量为1 μL,以不分流方式进样,柱流量为1 mL·min-1。
1.7 菌株降解柴油动力学试验
按5%接种量接入以柴油为唯一碳源的无机盐液体培养基(柴油含量为3 g·L-1)。其中,培养基中NaCl浓度分别设置为 1%、3%、5%,第 0、1、3、6、10、15 d 取样,测定培养液中柴油残留量。培养条件和测定柴油残留量同1.3所述。
1.8 数据分析
实验数据均以3次重复的平均值±标准偏差来表示,采用Microsoft Excel 2007和Origin 8.0进行数据分析与绘图,使用SPSS 19.0进行差异性分析。
2 结果与分析
2.1 虎尾草内生解烃细菌的分离与筛选
从虎尾草根、茎和叶中分离得到以柴油为唯一碳源的内生细菌24株,其中根中11株(编号BF01~BF11),茎中 8株(编号 BF12~BF19),叶中 5株(编号BF20~BF24)。菌株在无机盐液体培养基中培养7 d后的柴油降解率如图1。由图可知,各菌株对柴油的降解率在11.3%~69.6%之间,其中根、茎和叶中分离菌株平均降解率分别为38.1%、31.1%和40.7%。差异显著性分析表明,根和叶中分离的菌株平均降解率显著高于茎中各菌株平均降解率(P<0.05),根与叶中分离的菌株平均降解率差异不显著(P>0.05)。BF03、BF04、BF06、BF10、BF20 和 BF22 6 株菌对柴油的降解率高于50%,其中BF04对柴油的降解率极显著高于BF03、BF06、BF10、BF20 和 BF22(P<0.01),培养 7 d 降解率达到69.6%。因此,选择菌株BF04作进一步研究。
2.2 菌株鉴定
菌株BF04在LB固体培养基上培养24 h,菌落呈圆形,乳白色,不透明,干燥,中心褶皱。镜检菌株为杆状,大小(0.7~0.9)μm×(1.7~2.5)μm,有运动性。产芽孢,革兰氏染色呈阳性。生理生化结果见表1。BF04与Bacillus pumilus的模式种在生理生化指标上具有相同的特征。
菌株BF04的PCR扩增产物经测序获得片段长度为 1507 bp,GenBank登录号为 MF073272。在GenBank数据库中比对,菌株BF04与已报道的短小芽孢杆菌(Bacillus pumilus)序列相似性为99%。根据形态观察、生理生化特征和16S rDNA序列比对,推断BF04为短小芽孢杆菌。应用MEGA5.0软件、采用NJ法构建系统发育树,确定其进化地位,结果如图2所示。

图1 菌株在无机盐液体培养基中的柴油降解率Figure 1 Degradation of isolated strains for diesel-oil in the mineral salts(liquid)medium
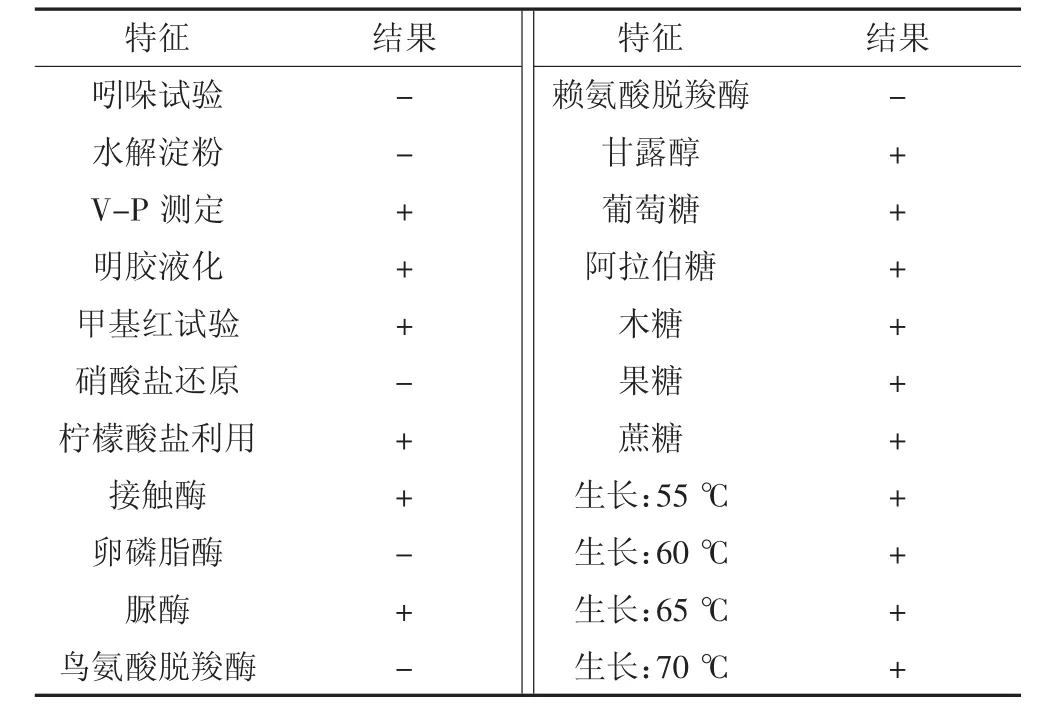
表1 菌株BF04生理生化特征Table 1 Physiological and biochemical characteristics of strain BF04
2.3 菌株利用不同烃类物质的定性分析
分别选取代表直链烷烃、支链烷烃、低分子量芳香烃、多环芳烃、环烷烃等不同石油烃组分物质为唯一碳源进行培养,定性考察菌株BF04对石油烃各组分的利用能力。菌株BF04对不同烃类物质的利用情况见表2。由表可知,在底物浓度为500 mg·L-1的无机盐液体培养基中,菌株BF04以正辛烷、正十六烷为唯一碳源生长最好,以正己烷、异辛烷为碳源生长较好,能以环己烷、甲苯、二甲苯为碳源生长,以苯酚、萘和菲为唯一碳源不能生长。表明菌株BF04对直链烷烃具有较强的代谢能力,其次是支链烷烃,能代谢环烷烃和单环芳烃,不能代谢底物浓度为500 mg·L-1的苯酚和多环芳烃菲、萘。
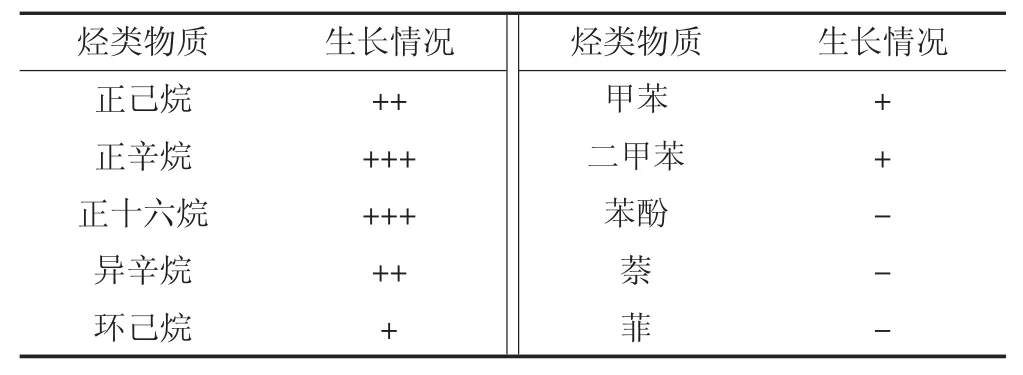
表2 菌株BF04对不同烃类物质的利用Table 2 Growth substrate utilization profile of strain BF04 on selected hydrocarbons
2.4 菌株对柴油中烷烃组分降解的定量分析
为弄清BF04对不同碳数烷烃的降解情况,采用GC-FID对柴油降解后的烷烃组分进行分析,其气相色谱如图3所示。可以看出,培养7 d后,柴油中不同碳数正构烷烃都有不同程度的降解。利用外标法建立线性5点校正曲线,计算正构烷烃降解率,结果见表3。由表可知,柴油中 nC12、nC13、nC14、nC15、nC16、nC17、nC19、nC20、nC21、nC22、nC23、nC24 和nC25 正构烷烃降解率较高,都达到90%以上。nC11和nC27降解率相对较低,分别为63.9%、74.5%。短链烷烃nC11~nC23降解率达到93.2%,长链烷烃nC24~nC27降解率达到86.9%。差异显著性分析表明,BF04对短链烷烃(nC11~nC23)降解率极显著高于长链烷烃(nC24~nC27)(P<0.01)。
2.5 菌株对柴油降解的动力学特征

图2 基于16S rDNA基因序列的菌株BF04系统发育树Figure 2 Phylogenetic analysis based on the 16S rDNA gene sequences of strain BF04
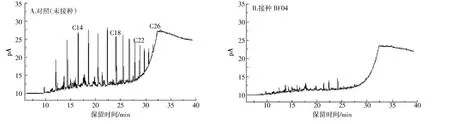
图3 降解7 d后培养液中残留柴油的气相色谱图Figure 3 GC-FID chromatograms of diesel oil extracted from the aqueous phase of the medium after 7 days of incubation with 3 g·L-1 diesel with and without inoculation with strain BF04

表3 菌株BF04对柴油中正构烷烃的降解Table 3 Degradation of diesel-oil n-alkanes by strain BF04 in the mineral salts(liquid)medium after 7 days at 30 ℃ and 200 r·min-1
菌株BF04在不同NaCl含量培养基中对柴油的降解情况如图4所示。可以看出,培养15 d后,NaCl含量为5%的培养基中柴油的残留量极显著高于NaCl含量为1%和3%的培养基(P<0.01),NaCl含量为1%与3%的培养基中柴油的残留量差异不显著(P>0.05),表明3%NaCl浓度没有抑制BF04对柴油的降解,5%NaCl浓度明显抑制BF04对柴油的降解。不同NaCl含量对BF04降解柴油速率影响不同。在NaCl含量为1%的培养基中,柴油降解最快速率出现在培养1~3 d;在NaCl含量为3%的培养基中,柴油降解最快速率出现在培养3~6 d;在NaCl含量为5%的培养基中,柴油降解最快速率出现在培养6~10 d。表明随着盐度的增加,BF04对柴油最大降解速率逐渐拖后。
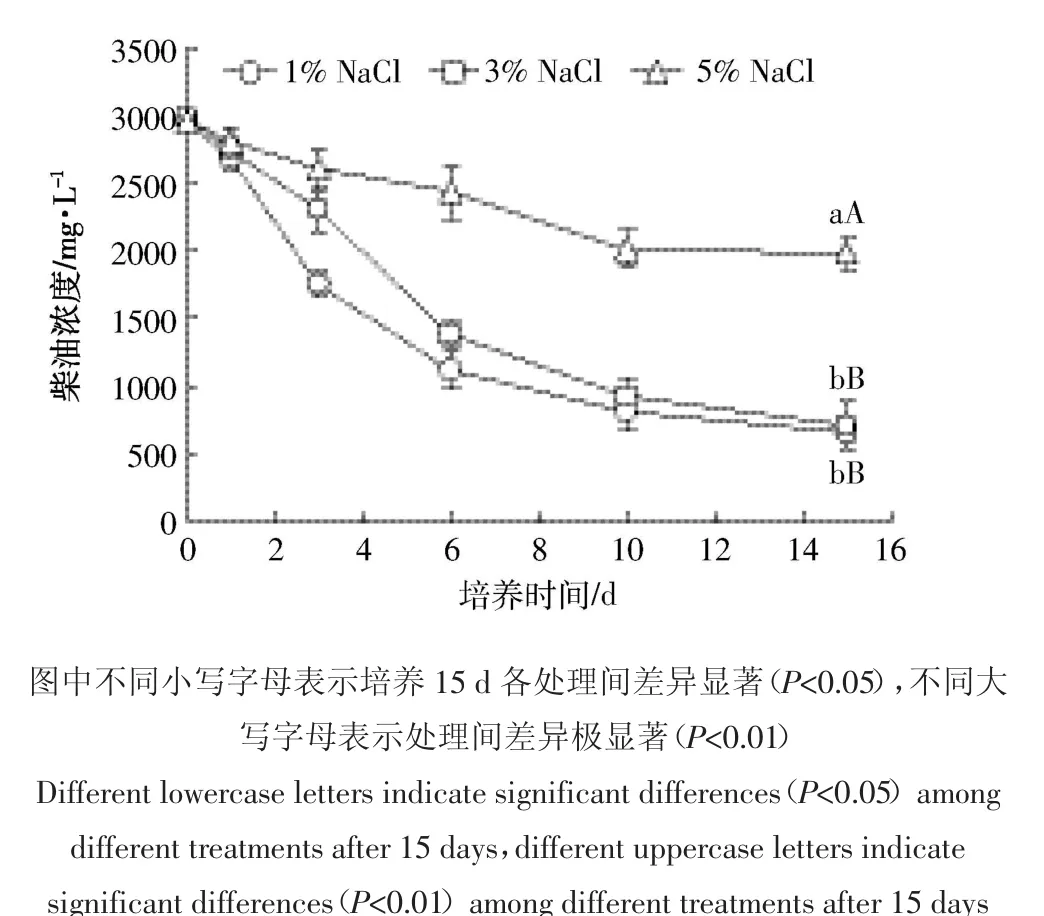
图4 菌株BF04在不同NaCl含量培养基中对柴油的降解曲线Figure 4 Degradation curves of diesel oil by strain BF04 in different NaCl concentration cultures
为定量描述BF04降解柴油过程的速率,对柴油的生物降解反应进行简化,建立数学模型。石油烃降解过程是一个酶催化反应,其反应速率可用米氏方程表示。根据底物浓度和米氏常数大小关系可以将反应过程分为零级反应和一级反应,进而推导底物浓度与时间的关系式[12]。一级反应和零级反应关系式为:

式中:c为底物浓度;k为降解速率常数。
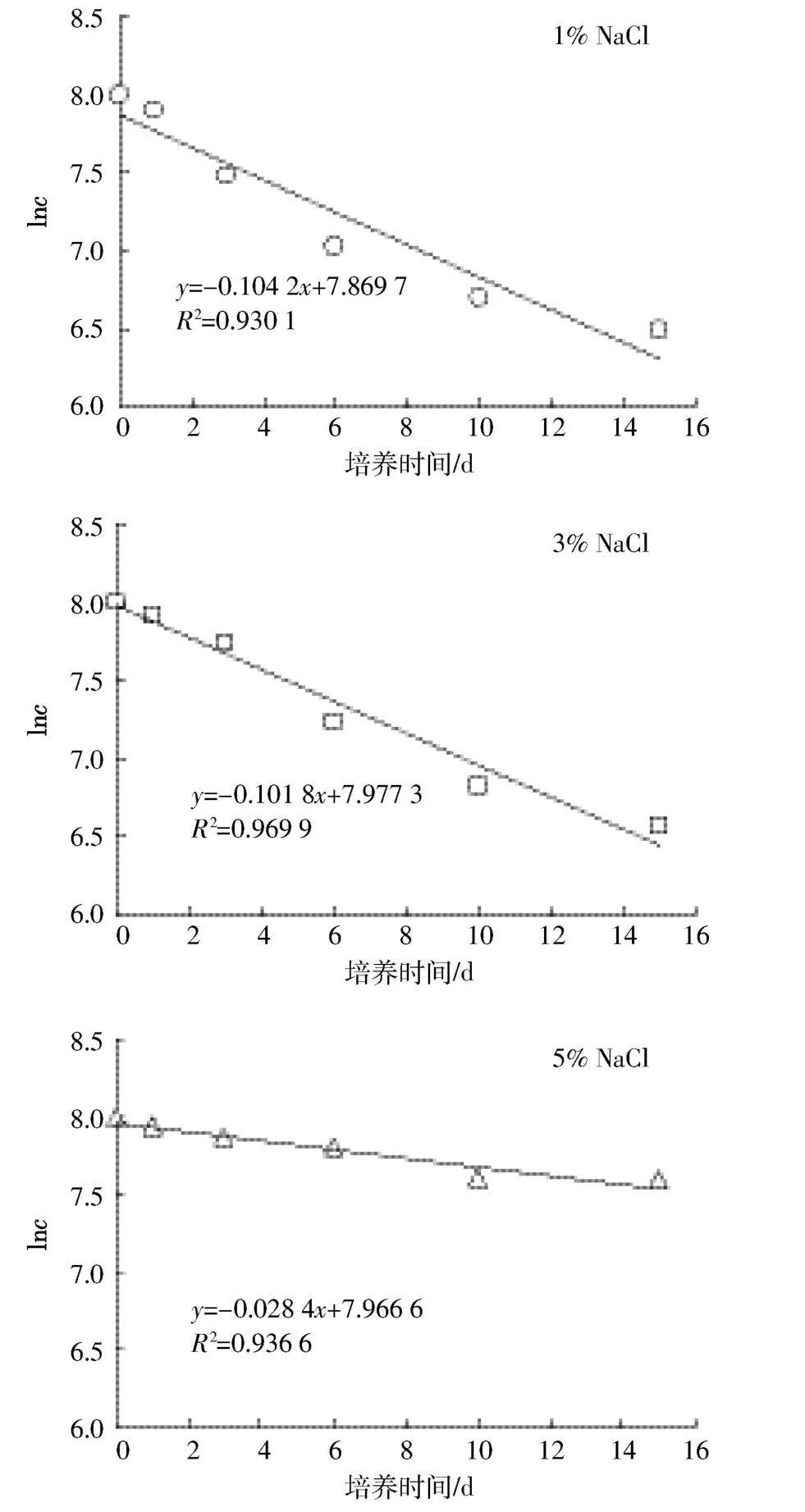
图5 菌株BF04降解柴油动力学拟合曲线Figure 5 Degradation kinetics curves of diesel oil by strain BF04
对图4的数据分别按一级反应和零级反应方程拟合,结果表明,在不同NaCl含量培养基中BF04对柴油降解曲线符合一级反应(图5)。由图5可知,在含1%、3%、5%NaCl的培养基中,BF04降解柴油的降解速率常数分别为0.104 2、0.101 8、0.028 4 d-1。以得到的动力学方程预测,如果培养液中柴油完全降解,BF04在含1%NaCl的培养基中需要76 d,在含3%NaCl的培养基中需要78 d,而在含5%NaCl的培养基中需要284 d。
3 讨论
植物修复有机污染土壤效率主要取决于协同功能微生物的数量和活性,其中细菌是发挥最主要作用的微生物类群[13]。从植物中分离、筛选内生解烃细菌并研究其特性,对于揭示植物修复石油污染环境过程中微生物所扮演的生态角色具有重要意义。本研究从黄河三角洲石油污染重盐碱土上生长的虎尾草中分离得到能降解柴油的内生细菌24株,其中根中最多,茎次之,叶中最少,这与Pawlik等[14]和Fatima等[15]从植物各部位分离降解石油烃内生细菌数量趋势一致。一般认为土壤微生物是植物内生细菌的主要来源,在植物体中随着与根尖等微生物进入口距离的增加,内生细菌的种群密度逐渐减少[16]。
不同植物其协同的优势内生细菌种类不同。研究者从黑麦草、野黑麦和冰草中分离出可培养的优势内生细菌分别为Pseudomonasfulgida,Pseudomonasfluorescens和Pseudomonas poae[17],从夏栎、大豆、花生、向日葵分离出可培养的优势内生细菌主要为Actinobacteria sp.,Bacillus sp.和 Pantoea sp.[18-20]。虎尾草作为一种耐盐碱、耐石油烃污染的草本植物,还未见其内生细菌的相关报道。目前发现能降解石油烃类污染物的细菌主要有 Pseudomonas sp.,Sphingomonas sp.,Acinetobacter sp.,Alcaligenessp.,Micrococcussp.,Bacillussp.,Flavobacteriumsp.,Arthrobactersp.,Alcanivoraxsp.,Mycobacteriumsp.,Rhodococcus sp.和 Actinobacter sp.[21]。菌株BF04通过形态特征、生理生化特征和16S rDNA序列分析,鉴定为Bacillus pumilus。关于Bacillus pumilus降解石油烃已有很多报道[22-24],这些能降解石油烃污染物的Bacillus pumilus主要分离自土壤和水环境,从植物体内部分离得到降解石油烃的Bacillus pumilus较少。Fatima等[25]从多年生黑麦草(Lolium perenne)中分离出一株内生细菌Bacillus pumilus LOSI68,该菌能利用原油和萘为唯一碳源正常生长,但不能利用正辛烷、正癸烷、正十二烷和正十六烷。Ho等[26]从芦苇和水蕹菜中分离出内生细菌Bacillus pumilus C3和Bacillus pumilus E10,菌C3和E10都能利用苯酚、甲苯、二甲苯、乙苯等为唯一碳源生长。BF04能利用正己烷、正辛烷、正十六烷、异辛烷、环己烷、甲苯、二甲苯为碳源生长,不能利用苯酚、菲和萘,这与菌LOSI68代谢石油烃种类不同,与菌C3和菌E10代谢石油烃种类部分相同。同类微生物代谢石油烃活性受宿主植物代谢特性、石油烃类污染物组成和土壤理化性质影响[15],BF04 与 LOSI68、C3、E10 生存环境不同,可能是导致这些同种降解菌代谢石油烃种类不同的原因。
柴油主要由中长链饱和烃(C10~C29)组成[27],BF04能降解大部分这类烷烃,其中对nC12~nC17和nC19~nC25正构烷烃降解率达到90%以上,对nC11和nC27降解率较低,分别为63.9%和74.5%。柴油中各组分的生物降解与其分子结构密切相关,链烷烃由于分子结构较其他烃类组分简单而更容易被微生物降解[28-29]。短链烷烃生物可利用性低以及可溶解细菌细胞膜而使其不能被完全降解,长链烷烃由于降解过程中产生的中间物质的毒性也限制细菌对其完全降解[30]。BF04 对短链烷烃(nC11~nC23)降解率高于长链烷烃(nC24~nC27),这与 Nkem 等[31]从石油污染海滩中分离出的菌GS和WR1降解柴油各烷烃组分特性一致。一般柴油中简单的烷烃组分首先被石油烃降解菌降解,这些烃类组分的降解促进降解菌不断生长繁殖,产生更多的水解酶,进而促进更复杂烷烃组分的降解,复杂烷烃在降解过程中产生有毒中间体使降解过程减慢,导致长链烷烃(nC24~nC27)降解率降低[31-32]。
高盐、石油污染物是限制石油污染盐渍化地区植物生长发育的主要因子,但这种生态条件同时会赋予植物及其内生菌较强的抗逆性。通常随着盐度的增加微生物降解石油烃类物质能力降低,当盐度>3%时,一般微生物的代谢会受到抑制,降解石油烃效率明显降低[33]。3%NaCl浓度没有抑制BF04降解柴油的降解活性,可能是其在长期高盐、石油污染环境胁迫下,经过双重选择,逐渐适应生态环境的结果。通常海洋环境盐度含量为3%~3.5%[27],BF04在含有3%NaCl液体培养基中具有较强的降解柴油能力,在修复石油污染海洋环境中具有一定的应用潜力。盐浓度影响菌株生长率,随着浓度的增加,菌株生长曲线的适应期变长,对数增长期滞后[34],进而影响菌株对柴油的降解速率,这可能是导致BF04随着培养基中盐度的增加,对柴油最大降解速率拖后的原因。微生物代谢石油烃是一个复杂的生物化学过程,石油烃组成复杂,又难溶于水,生物降解过程的生化反应体系具有多相、多组分及非线性的特点。在不同NaCl含量培养基中,BF04对柴油降解曲线符合一级反应,这与吴涛[3]从石油污染盐渍化土壤中分离出的耐盐菌BM38以及张秀霞等[12]从石油污染土壤中分离出的HJ-1降解石油烃动力学特性一致。
4 结论
(1)本研究从黄河三角洲石油污染重盐碱地生长的虎尾草中分离出24株内生解烃细菌,经液体培养柴油降解试验,确定了一株高效降解石油烃植物内生细菌BF04。经鉴定BF04为短小芽孢杆菌(Bacillus pumilus)。
(2)菌株BF04能够利用正辛烷、异辛烷、正十六烷、正己烷、环己烷等链烷烃和甲苯、二甲苯等单环芳烃,不能利用萘、菲等多环芳烃和苯酚。BF04能降解柴油中大部分烷烃,其中对nC12~nC17和nC19~nC25正构烷烃降解率较高,对nC11和nC27正构烷烃降解率相对较低。BF04对短链烷烃(nC11~nC23)降解率高于长链烷烃(nC24~nC27)。
(3)随着培养基中盐度的增加,BF04对柴油最大降解速率拖后。BF04对柴油降解可以用一级反应动力学模型表示,在含盐量为1%、3%和5%条件下对柴油降解动力学方程分别为:y=-0.104 2x+7.869 7,y=-0.101 8x+7.977 3和y=-0.028 4x+7.966 6。在含有3%NaCl液体培养基中BF04仍具有较强的降解柴油能力,在修复石油污染高盐环境中具有一定的应用潜力。
[1]Li H L,Boufadel M C.Long-term persistence of oil from the Exxon Valdez spill in two-layer beaches[J].Nature Geoscience,2010,3(2):96-99.
[2]Qin X,Tang J C,Li D S,et al.Effect of salinity on the bioremediation of petroleum hydrocarbons in a saline-alkaline soil[J].Letters in Applied Microbiology,2012,55(3):210-217.
[3]吴 涛.盐渍化石油污染土壤的生物修复研究[D].沈阳:沈阳农业大学,2013.
WU Tao.Bioremediation of saline soil contaminated with petroleum[D].Shenyang:Shenyang Agricultural University,2013.
[4]Calheiros C S C,Pereira S I A,Brix H,et al.Assessment of culturable bacterial endophytic communities colonizing Canna flaccida inhabiting a wastewater treatment constructed wetland[J].Ecological Engineering,2017,98:418-426.
[5]Afzal M,Khan Q M,Sessitsch A.Endophytic bacteria:Prospects and applications for the phytoremediation of organic pollutants[J].Chemosphere,2014,117(1):232-242.
[6]Gandolfi I,Canedoli C,Imperato V,et al.Diversity and hydrocarbondegrading potential of epiphytic microbial communities on Platanus x acerifolia leaves in an urban area[J].Environmental Pollution,2017,220(Part A):650-658.
[7]Weyens N,Truyens S,Dupae J,et al.Potential of the TCE-degrading endophyte Pseudomonas putida W619-TCE to improve plant growth and reduce TCE phytotoxicity and evapotranspiration in poplar cuttings[J].Environmental Pollution,2010,158(9):2915-2919.
[8]殷立娟,石德成,薛 萍.松嫩平原草原5种耐盐牧草体内K+,Na+的分布与积累的研究[J].植物生态学报,1994,18(1):34-40.
YIN Li-juan,SHI De-cheng,XUE Ping.The distribution and accumulation of K+and Na+in five salt-tolerant forage plants in a Song-Nei plain steppe[J].Acta Phytoecologica Sinica,1994,18(1):34-40.
[9]Hallmann J,Quadt-Hallmann A,Mahaffee W,et al.Bacterial endo-phytes in agricultural crops[J].Canadian Journal of Microbiology,1997,43(10):895-914.
[10]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:67-105,128-191.
DONG Xiu-zhu,CAI Miao-ying.Manual of systematic and determinative bacteriology[M].Beijing:Science Press,2001:67-105,128-191.
[11]Sambrook J,Russell D W.Molecular cloning:A laboratory manual[M].3rd Edition.Beijing:Science Press,2002:597-627.
[12]张秀霞,单宝来,张剑杰,等.降解菌HJ-1降解石油动力学[J].中国石油大学学报(自然科学版),2009,33(5):140-143.
ZHANG Xiu-xia,SHAN Bao-lai,ZHANG Jian-jie,et al.Kinetics on strain HJ-1 degrading petroleum[J].Journal of China University of Petroleum(Edition of Natural Sciences),2009,33(5):140-143.
[13]Afzal M,Yousaf S,Reichenauer T G,et al.Soil type affects plant colonization,activity and catabolic gene expression of inoculated bacterial strains during phytoremediation of diesel[J].Journal of Hazardous Materials,2011,186(2/3):1568-1575.
[14]Pawlik M,Piotrowska-Seget Z.Endophytic bacteria associated with Hieracium piloselloides:Their potential for hydrocarbon-utilizing and plantgrowth-promotion[J].Journalof Toxicology&EnvironmentalHealth,Part A,2015,78(13/14):860-870.
[15]Fatima K,Afzal M,Imran A,et al.Bacterial rhizosphere and endosphere populations associated with grasses and trees to be used for phytoremediation of crude oil contaminated soil[J].Bulletin of Environmental Contamination&Toxicology,2015,94(3):314-320.
[16]Khan S,Afzal M,Iqbal S,et al.Plant-bacteria partnerships for the remediation of hydrocarbon contaminated soils[J].Chemosphere,2013,90(4):1317-1332.
[17]Phillips L A,Germida J J,Farrell R E,et al.Hydrocarbon degradation potential and activity of endophytic bacteria associated with prairie plants[J].Soil Biology&Biochemistry,2008,12(40):3054-3064.
[18]Forchetti G,Masciarelli O,Alemano S,et al.Endophytic bacteria in sunflower(Helianthus annuus L.):Isolation,characterization,and production of jasmonates and abscisic acid in culture medium[J].Applied Microbiology&Biotechnology,2007,76(5):1145-1152.
[19]Ikeda S,Okubo T,Anda M,et al.Community and genome-based views of plant-associated bacteria:Plant-bacterial interactions in soybean and rice[J].Plant&Cell Physiology,2010,51(9):1398-1410.
[20]Gagne-Bourgue F,Aliferis K A,Seguin P,et al.Isolation and characterization of indigenous endophytic bacteria associated with leaves of switchgrass(Panicum virgatum L.)cultivars[J].Journal of Applied Microbiology,2013,114(3):836-853.
[21]Oluwafemi S O,Matthew O I,Sunday A,et al.Degradation of hydrocarbons and biosurfactant production by Pseudomonas sp.strain LP1[J].World Journal of Microbiology&Biotechnology,2009,25(9):1615-1623.
[22]Varma S S,Lakshmi M B,Rajagopal P,et al.Degradation of total petroleum hydrocarbon(TPH) in contaminated soil using Bacillus pumilus MVSV3[J].Biocontrol Science,2017,22(1):17-23.
[23]Calvo C,Toledo F L,González-López J.Surfactant activity of a naphthalene degrading Bacillus pumilus strain isolated from oil sludge[J].Journal of Biotechnology,2004,109(3):255-262.
[24]De Vasconcellos S P,Crespim E,Da Cruz G F,et al.Isolation,biodegradation ability and molecular detection of hydrocarbon degrading bacteria in petroleum samples from a Brazilian offshore basin[J].Organic Geochemistry,2009,40(5):574-588.
[25]Fatima K,Imran A,Amin I,et al.Plant species affect colonization patterns and metabolic activity of associated endophytes during phytoremediation of crude oil-contaminated soil[J].Environmental Science&Pollution Research,2016,23(7):6188-6196.
[26]Ho Y N,Mathew D C,Hsiao S C,et al.Selection and application of endophytic bacterium Achromobacter xylosoxidans strain F3B for improving phytoremediation of phenolic pollutants[J].Journal of Hazardous Materials,2012,219/220(12):43-49.
[27]Mukherji S,Jagadevan S,Mohapatra G,et al.Biodegradation of diesel oil by an Arabian Sea sediment culture isolated from the vicinity of an oil field[J].Bioresource Technology,2004,95(3):281-286.
[28]Horowitz A,Gutnick D,Rosenberg E.Sequential growth of bacteria on crude oil[J].Applied Microbiology,1975,30(1):10-19.
[29]Verma S,Bhargava R,Pruthi V.Oily sludge degradation by bacteria from Ankleshwar,India[J].International Biodeterioration&Biodegradation,2006,57(4):207-213.
[30]Deng M C,Li J,Liang F R,et al.Isolation and characterization of a novel hydrocarbon-degrading bacterium Achromobacter sp.HZ01 from the crude oil-contaminated seawater at the Daya Bay,Southern China[J].Marine Pollution Bulletin,2014,83(1):79-86.
[31]Nkem B M,Halimoon N,Yusoff F M,et al.Isolation,identification and diesel-oil biodegradation capacities of indigenous hydrocarbon-degrading strains of Cellulosimicrobium cellulans and Acinetobacter baumannii from tarball at Terengganu Beach,Malaysia[J].Marine Pollution Bulletin,2016,107(1):261-268.
[32]Ghanem K M,Al-Garni S M,Al-Zahrani M A.Bioremediation of diesel fuel by fungal consortium using statistical experimental designs[J].Polish Journal of Environmental Studies,2016,25(1):97-106.
[33]Margesin R,Schinner F.Biodegradation and bioremediation of hydrocarbons in extreme environments[J].Applied Microbiology&Biotechnology,2001,56(5/6):650-663.
[34]吴 涛,谢文军,依艳丽,等.耐盐石油烃降解菌的筛选鉴定及其特性研究[J].环境科学,2012,33(11):3949-3955.
WU Tao,XIE Wen-jun,YI Yan-li,et al.Isolation,identification and characterization of halotolerant petroleum-degrading bacteria[J].Environmental Science,2012,33(11):3949-3955.
Isolation and degradation characteristics of hydrocarbon-degrading endophytic bacteria from the salt-tolerant plant Chloris virgata
WU Tao1,2,XU Jie3,XIE Wen-jun1,2,YAO Zhi-gang1,LIU Jun-hua2,YANG Hong-jun2,SUN Chun-long1,2,WANG Shu-ping1
(1.Shandong Provincial Engineering and Technology Research Center for Wild Plant Resources Development and Application of Yellow River Delta,School of Bioengineering,Binzhou University,Binzhou 256600,China;2.Shandong Provincial Key Laboratory of Eco-Environmental Science for Yellow River Delta,Binzhou University,Binzhou 256600,China;3.Department of Bioengineering,Binzhou Vocational College,Binzhou 256603,China)
The degradation characteristics of hydrocarbon-degrading endophytic bacteria isolated from salt-tolerant plants may provide the foundation for phytoremediation of petroleum-polluted saline soils using endophytic bacteria.Twenty-four strains of endophytic petroleumdegrading bacteria were isolated from the salt-tolerant plant Chloris virgata,which grows in a heavily saline-alkaline,crude oil-contaminated environment in the Yellow River Delta,China.All 24 strains were able to utilize diesel oil as their sole carbon and energy source.Their abilities to degrade diesel oil were compared to screen one highly effective petroleum-degrading bacterium named BF04.The strain BF04 was identified as Bacillus pumilus based on physiological and biochemical characteristics,and 16S ribosomal DNA analysis.In addition,we studied the kinetic characteristics of diesel oil degradation and the capability of the strain to utilize different hydrocarbons.The results showed that strain BF04 could utilize straight-chain paraffin,branched paraffin,and mononuclear aromatics,but could not utilize phenol or polycyclic aromatic hydrocarbons.The degradation rate of diesel-oil short-chain n-alkanes(nC11~nC23)was relatively higher than that of long-chain n-alkanes(nC24~nC27)in the mineral salts(liquid)medium.The degradation of petroleum may be expressed using a first-order kinetic model.Moreover,the strain BF04 degraded diesel-oil effectively in the presence of 3%NaCl,indicating that strain BF04 has potential application in the bioremediation of petroleum-contaminated saline-alkaline soils.
petroleum contamination;saline soil;endophytic bacteria;Bacillus pumilus;salt-tolerant plant;petroleum degradation
X172
A
1672-2043(2017)11-2267-08
10.11654/jaes.2017-0771
吴 涛,许 杰,谢文军,等.耐盐植物虎尾草内生解烃细菌的筛选及其降解特性[J].农业环境科学学报,2017,36(11):2267-2274.
WU Tao,XU Jie,XIE Wen-jun,et al.Isolation and degradation characteristics of hydrocarbon-degrading endophytic bacteria from the salt-tolerant plant Chloris virgata[J].Journal of Agro-Environment Science,2017,36(11):2267-2274.
2017-05-31 录用日期:2017-08-23
吴 涛(1980—),男,山东平阴人,博士,副教授,从事污染土壤的生物修复研究。E-mail:wtsdbz@hotmail.com
国家自然科学基金青年科学基金项目(41401359);山东省高等学校科技计划项目(J14LE05);山东省自然科学基金项目(ZR2013DM001)
Project supported:The Young Scientists Fund of the National Natural Science Foundation of China(41401359);The Project of Shandong Province Higher Educational Science and Technology Program(J14LE05);Natural Science Foundation of Shandong Province(ZR2013DM001)

