柠檬酸对纳米氧化铁诱导水稻根表铁膜形成及对水稻铁吸收转运的影响
胡 露,陈 奇,李云霞,闫达方,鲍艳宇*
柠檬酸对纳米氧化铁诱导水稻根表铁膜形成及对水稻铁吸收转运的影响
胡 露1,2,陈 奇1,2,李云霞1,2,闫达方1,2,鲍艳宇1,2*
(1.南开大学环境科学与工程学院,教育部环境污染过程与基准重点实验室,天津 300350;2.天津市城市生态环境修复与污染防治重点实验室,天津 300350)
本研究利用水培模拟实验探讨了柠檬酸对纳米氧化铁(NPs,γFe2O3)诱导水稻根表铁膜的影响,同时研究了其对铁(Fe)在植株体内吸收转运的影响。结果表明,低浓度柠檬酸包被和未包被处理NPs能够显著增加水稻根生物量,但对水稻地上部生物量影响不显著。NPs能够诱导根表铁膜形成,然而铁膜量随着柠檬酸浓度增加而下降,可能是由于柠檬酸降低NPs的Fe2+释放量造成的;但是2.10 mg·L-1柠檬酸包被NPs能显著提高根表铁膜量。根表铁膜主要以无定型为主(除柠檬酸包被处理外),晶格态仅占铁膜总量的24.88%~48.12%;其中,由于根表铁膜的晶格构造与NPs类似,可能晶格态铁膜主要来源于NPs的直接吸附沉淀。柠檬酸的加入显著降低Fe在根表和根中累积,但是增加了Fe在地上部的累积;然而,柠檬酸包被NPs处理能够增加Fe在根表和植株地上部的累积,但降低Fe在根系中的累积。2.10 mg·L-1柠檬酸(包被和未包被NPs处理)能够减弱Fe从根表向根内的转移,但是增强了Fe从根向地上部的转移。不同NPs处理条件下,Fe在水稻植株不同部位均存在富集现象,根表和地上部的富集系数显著高于根内。
纳米氧化铁;水稻;根表铁膜;吸收;转运
纳米材料由于其独特的电学、热力学、光学以及催化性质被广泛地应用于工业和日常生活之中。市场上有超过300种纳米材料产品被生产和销售[1],纳米产品的应用增加将导致这些纳米产品暴露在环境中,其中,土壤是纳米材料重要的沉积场所,尤其是对于一些将污泥农用作为一项标准流程的城市来说[2]。目前,纳米磁赤铁矿(γFe2O3nanoparticle,NPs)已被广泛应用于磁性材料、颜料、精细陶瓷以及塑料制品的制备和催化剂工业中,在声学、电子学、光学、热学,尤其是医学和生物工程如生物医疗图像等方面也有广泛的应用价值和前景[3-4]。作为金属纳米氧化物的一种,它会在生产、使用、处理过程中不可避免地进入到环境中,最终通过各种方式进入到土壤中,对土壤生态系统中的农作物造成一定的影响。另一方面,铁(Fe)是植物所必需营养元素,在农作物叶绿素的合成上起着至关重要的作用,伴随着NPs的Fe离子释放,它可能作为养分元素被农作物吸收利用。
根际是污染物进入植物体内的第一道屏障,根系分泌物如低分子量有机酸等[5]可能影响纳米粒子在根际溶液中的性质,如通过吸附在纳米粒子表面产生单个纳米粒子间相斥的双电层,影响纳米粒子的稳定性,从而影响植物对纳米粒子的吸收、迁移和转化。而且,纳米金属氧化物与根系分泌物在植物根表构成的根际微界面是其离子释放、还原转化的必要条件[6-7]。有研究发现乙酸能够增加La2O3纳米粒子的溶解[8];当CeO2纳米粒子包被柠檬酸后,植株中累积的铈含量减少[9];纳米铁包被柠檬酸后,显著地提高了光合作用参数[10]。通常条件下,纳米金属氧化物可能通过两种方式进入植物体内,一方面,通过离子释放,然后以离子形态进入植物体内,另一方面,直接通过细胞壁的孔隙也可以直接进入植物根内组织中。但是目前关于NPs如何被水稻吸收的研究还鲜见报道。然而,到目前为止,根系分泌的典型低分子量有机酸——柠檬酸如何影响纳米氧化铁的植物吸收累积尚不清楚。
湿地植物(如水稻)能够在植株根表形成铁氧化物胶膜(简称“铁膜”),这是由于植物为了适应淹水条件,根系会生成大量通气组织,将大气中的氧气通过叶片输送到根系,在根际形成氧化环境,如果淹水环境有大量的Fe存在,根系氧化作用会导致根表形成明显的铁膜[11],已有研究显示根表铁膜会对水稻吸收累积As等重金属污染物产生影响[12-13]。NPs暴露是否诱导形成根表铁膜,进而对Fe的水稻吸收累积及转运产生影响,至今为止还未见报道和研究。
水稻作为重要的粮食作物,占粮食总产量的一半以上。纳米材料在环境中的排放,最终不可避免地进入农田环境中,因此可能对食品安全和人体健康造成威胁。因此,本研究选取了水稻作为研究对象,开展了γFe2O3NPs暴露条件下根表铁膜的形成以及水稻吸收累积Fe的效应研究,并以柠檬酸为典型根系分泌物,探讨了其对根表铁膜形成的影响以及水稻吸收累积Fe效应的影响,将为如何降低此类污染物在农作物水稻体内吸收积累的界面调控提供借鉴,对促进农产品向安全、健康的方向发展有重要的意义。
1 材料与方法
1.1 供试材料
供试γFe2O3NPs:固体粉末,呈球形,粒径为20 nm,比表面积为45.6 m2·g-1,购于长春三邦医药科技有限公司。
供试柠檬酸(CA):纯度≥99.0%,分子式为C6H8O7·H2O,分子量 210.14。
供试水稻:品种为津原E28,由天津市农作物研究所提供。选择大小一致、颗粒饱满的种子,用30%H2O2消毒30 min后,用去离子水清洗3~4遍,蒸馏水浸泡24 h后,播于润湿的单层纱布上,水稻出苗10 d后,挑选出生长一致的幼苗移栽到100 mL的三角瓶中,每瓶10株幼苗,每个盆中供应1/4强度的国际水稻所水稻营养液,营养液pH值调至5.0,每3 d更换一次进行预培养。
1.2 实验设计
从第三次营养液开始,加入25 mg·L-1NPs(加入前超声1 h,使其尽量分散)设置以下5个处理组:CK为未加入NPs处理,为了保证水稻的正常生长,仅加入 1.128 mg·L-1EDTA-Fe(Ⅱ);NPs为 25 mg·L-1NPs;NPs+CA1 为 25 mg·L-1NPs+2.10 mg·L-1柠檬酸[未包被];NPs+CA2 为 25 mg·L-1NPs+8.41 mg·L-1柠檬酸[未包被];NPs+CA 为 25 mg·L-1NPs+2.10 mg·L-1柠檬酸[包被]。每个处理组设置三个重复,每盆中种植6株水稻。其中,为探明NPs被柠檬酸包被与不包被添加情况下水稻吸收、累积、转运Fe的差异,选取其中一个浓度组即2.10 mg·L-1柠檬酸来进行研究。柠檬酸设置包被和未包被的添加方式,未包被是指NPs超声溶解后配制25 mg·L-1,在培养前加入柠檬酸使其浓度为2.10 mg·L-1,从而避免包被可能产生的影响;而柠檬酸包被采用的是Kotsmar[14]提出的方法,此方法的包被稳定性可长达2个月。具体为,加入柠檬酸后使其溶液浓度为2.10 mg·L-1,调节pH值为5,加入25 mg·L-1的 NPs,超声分散后在 90°下搅拌 90 min,促进柠檬酸在NPs表面的包被,然后在摇床中以1200 r·h-1转速振动24 h,即为包被溶液。其中70%以上的柠檬酸被吸附在纳米颗粒表面,同时为了保证与未包被处理中柠檬酸浓度一致,因此未对包被纳米材料进行水洗去除多余柠檬酸的处理。将上述所有培养液的pH值均调为5,25℃培养箱中进行10 d的水培实验,培养过程中为了避免可能产生的影响,未对营养液进行更换,培养结束后将水稻从营养液中取出,每个处理取三株用去离子水冲洗3次,然后从茎基部将水稻根和地上部分开,分别对根表晶格态和无定型铁膜数量、根及地上部Fe含量进行测定。
1.3 测定指标与方法
1.3.1 水稻根表铁膜测定
水稻植株根表铁膜包括无定型态和晶格态,首先,采用草酸铵-草酸溶液对根表无定型态进行提取,然后用 DCB(Dithionite-Citrate-Bicarbonate method)溶液对晶格态组分进行提取[15-16]。具体步骤:将用去离子水洗干净后的水稻根系放入150 mL三角瓶中,加入 pH=4 的草酸铵(0.175 mol·L-1)-草酸(0.10 mol·L-1)溶液50 mL提取无定型态铁膜,振荡3 h,浸提液用火焰法原子吸收测定其中的Fe含量,即为无定型铁膜量。然后,将上述水稻根系继续用DCB溶液提取,即放入150 mL三角瓶中,加入40 mL 0.3 mol·L-1的Na3C6H5O7·2H2O,5 mL 1 mol·L-1的 NaHCO3,3 g Na2S2O4,振荡3 h,浸提液用火焰法原子吸收测定其中的Fe含量即为根表晶格态铁膜量。
1.3.2 水稻根及地上部Fe含量测定
将水稻地上部和浸提后的水稻根分别用纯净水清洗3次,用吸水纸将水分吸干后,80℃恒温下烘干至恒重,冷却后放入干燥器中,分别称量后加入5 mL的HNO3和3 mL的H2O2,盖上短颈小漏斗浸泡过夜后移至电热板上缓慢加热,消解至溶液清亮并继续加热至近干,用2%的HNO3定容到10 mL,用火焰原子吸收法测定其中的Fe含量。
1.3.3 水稻根系分泌物中总Fe离子和二价Fe离子的测定
水稻育苗并更换两次培养液后用自来水和蒸馏水各冲洗五次,然后放在蒸馏水的容器中培养24 h,则该容器中即为含有水稻根际分泌物的溶液。将这些根际分泌物分别装在150 mL的三角瓶中,每瓶装入140 mL,共设置 3 个对照组:NPs为 25 mg·L-1NPs;NPs+CA1 为 25 mg·L-1NPs+2.10 mg·L-1柠檬酸[未包被],NPs+CA 为 25 mg·L-1NPs+2.10 mg·L-1柠檬酸[包被]。分别在 0、3、24、72 h和 120 h测定溶液中的总 Fe和二价Fe离子的含量。
以邻二氮菲为显色剂测定二价和三价Fe。具体步骤:取样品50 mL于150 mL锥形瓶中,用盐酸调节使水呈酸性,pH<3,刚果红试纸显蓝色。加热煮沸10分钟,冷却后移入50 mL比色管中,加10%盐酸羟胺溶液1 mL(测二价Fe时不加),摇匀,1min后再加0.15%邻菲罗琳溶液2 mL,及5 mL HAc-NaAc缓冲溶液后用水稀释至刻度。10 min后于510 nm处,以试剂空白作参比,测其吸光度,其测定值分别为二价Fe和总Fe含量,通过总Fe与二价Fe差值计算得到三价Fe含量。
1.3.4 X射线衍射仪(XRD)分析
选取 NPs、NPs+CA1、NPs+CA 3 组处理的水稻根,用蒸馏水清洗后,冷冻干燥,将部分根粉碎后在XRD下测定不同处理情况下根表铁膜形态。XRD衍射仪(X′Pert PRO,Almelo,荷兰)采用铜发射源,扫描速率为 0.06 °·s-1,衍射角为 10°至 80°。
1.3.5 电动电势以及水合粒径大小的测定
利用激光束为632 nm的马尔文测定仪测定悬浮样品的电动电势和粒径,样品处理组分别为NPs、NPs+CA1和NPs+CA。
1.3.6数据分析
水稻根表铁膜向根内,以及根内向地上部转移Fe的能力用转运系数(TF)表示。

式中:TF根表-根内表示铁膜向根转移 Fe的系数;TF根-地上部表示根向地上部转移 Fe的系数;C铁膜、C根、C地上分别表示铁膜、根、地上部Fe的含量。
水稻对Fe的富集能力用富集系数(BAF)表示。

式中:BAFn分别表示根表铁膜、根、地上部Fe的富集系数,Cn分别代表根表铁膜、根、地上部Fe的含量,Csolution表示培养液中Fe的含量。
采用统计软件Origin 8.5进行绘图,差异显著性和相关性分析采用 IBM SPSS Statistics 20(Duncan法)进行检验,统计显著性设为P<0.05。
2 结果与讨论
2.1 NPs处理条件下的水稻生物量
柠檬酸既是根际分泌物又常作为一种生物相容性材料覆盖于纳米材料上,改变纳米材料的稳定性,为了探究柠檬酸对NPs在水稻体内吸收累积的影响,本研究设置了不同浓度以及不同加入方式的柠檬酸的影响效应。结果发现,与对照CK相比,2.10 mg·L-1柠檬酸包被和未包被NPs能够显著(P<0.05)增加根生物量(干质量,下同)(P<0.05),而 NPs的不同处理加入均能显著增加地上部生物量;与NPs处理相比,2.10 mg·L-1柠檬酸包被和未包被NPs均能显著增加水稻根部生物量(P<0.05),而高浓度(8.41 mg·L-1)柠檬酸未包被NPs不能影响根部生物量(P>0.05)(图1)。然而,与单一NPs相比,柠檬酸的加入对水稻地上部生物量影响不显著(P>0.05)。可见,仅低浓度柠檬酸包被和未包被处理NPs能够显著增加水稻根生物量。
2.2 柠檬酸对NPs诱导形成水稻根表铁膜的影响
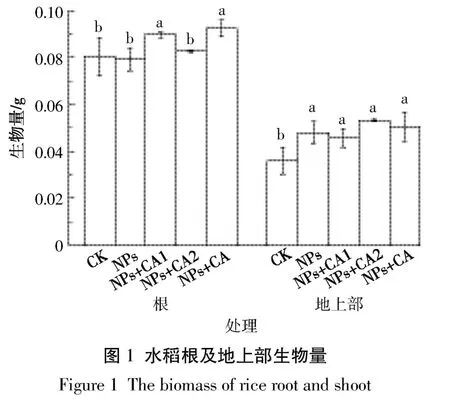
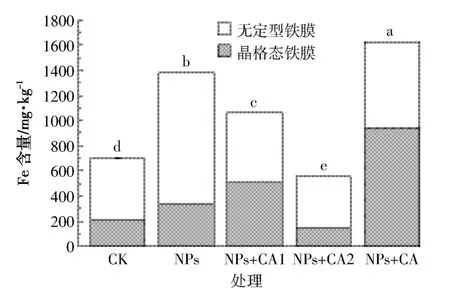
图2 水稻根表铁膜分布Figure 2 The distribution of iron plaque on rice root surface
水稻为了适应淹水条件,根系生成大量通气组织,将大气中的氧气通过叶片输送到根系,使根系具有氧化能力,在根际范围内形成氧化环境。因此,当大量Fe2+存在时根际氧化条件能够诱导水稻在其根表形成铁膜。由图2可知,CK条件下根表也能够形成700.0 mg·kg-1铁膜量,这是由于营养液中添加了1.128 mg·L-1Fe2+的缘故。与CK相比,除了NPs+高浓度柠檬酸处理显著降低根表铁膜量外(P<0.05),其他NPs处理均能显著增加根表铁膜量(P<0.05),尤其是对晶格态铁膜数量增加效果更为显著(P<0.05)。结果表明,NPs存在条件下能够诱导根表铁膜的形成。而且,与单独NPs处理相比,柠檬酸添加(未包被)能够显著降低铁膜含量(P<0.05),随着柠檬酸浓度由2.10增加到 8.41 mg·L-1,铁膜量显著下降。然而 2.10 mg·L-1柠檬酸包被NPs能够显著提高根表铁膜含量(P<0.05)。对于所有处理而言,除了柠檬酸包被处理中晶格态胶膜占总胶膜量的58.28%外,其他处理的晶格态仅占铁膜总量的24.88%~48.12%。
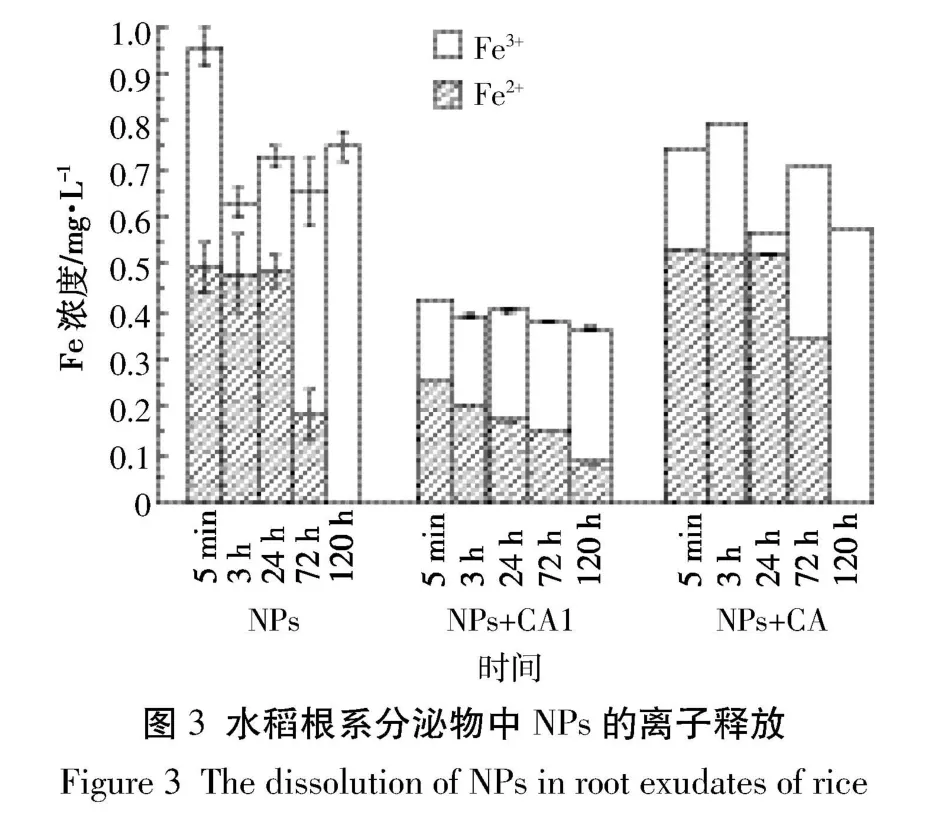
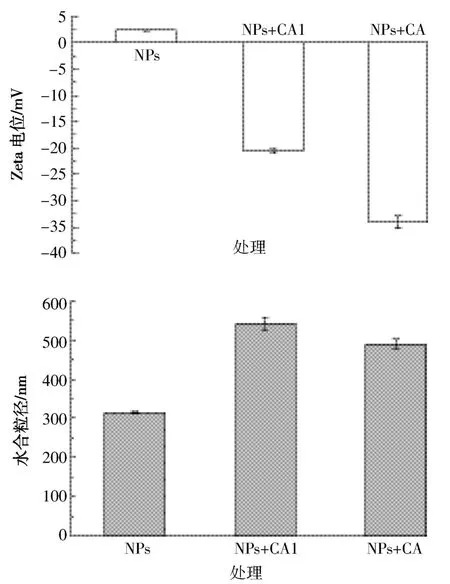
图4 NPs的Zeta电位和水合粒径Figure 4 Zeta potential and hydrodynamic diameter of NPs
由于根表铁膜的形成与根际溶液中Fe2+有直接关系[16],而NPs能够进行离子释放,而且在还原性物质存在条件下产生还原释放,即释放的三价Fe被还原为二价Fe,因此二者之间可能存在关联。水稻根系分泌物中含有有机酸等还原性物质,因此,根系分泌物是否对NPs的离子释放,尤其是还原释放过程产生影响,值得考虑。因此,本研究对NPs在根系分泌物中短时间内(120 h)的Fe离子释放进行了测定(图3),结果发现,Fe离子的释放量与铁膜的形成量具有较好的一致性,尤其是与Fe2+释放量相关性更明显,相关性分析显示Fe2+释放量与根表铁膜总量在5 min和3、24、72 h 的相关性系数分别为 0.950(P<0.05)、0.942(P<0.10)、0.935(P<0.10)、0.900(P<0.10),结果表明,柠檬酸降低根表铁膜量可能主要是由于其降低了NPs在根系分泌物中的Fe2+释放量。同时,对NPs的Zeta电位和水合粒径分析(图4)显示,柠檬酸的加入使得NPs的Zeta电位由正值变为负值,而且水合粒径显著增加(P<0.01)。已有研究报道,由于植物细胞壁的电负性,带正电荷的NPs更容易被吸附固定在根表[17],因此,本研究中随着柠檬酸的加入Zeta电位变为负值进而可能降低NPs在根表的沉淀作用,进而降低其根表铁膜生成量。柠檬酸的加入和NPs水合粒径的增加,提高了聚合沉淀的可能性进而减弱了其向根表迁移的能力,因此有助于降低根表铁膜生成量。然而,随着柠檬酸对NPs的包被,其Zeta电位转为负值以及水合粒径增加却反而促进了根表铁膜的生成量,且柠檬酸包被导致NPs的Zeta电位及水合粒径的变化可能也是导致其离子释放与未包被相比产生差异的主要原因,其具体机理还需进一步深入探讨。根据图3的结果,3~72 h内柠檬酸包被NPs处理条件下Fe2+释放量显著高于未加柠檬酸的NPs处理,且在72 h时达到极显著增加水平(图3),这导致了相应形成的铁膜量增加;除此之外,根据图2的结果,方差分析显示柠檬酸包被NPs极显著地增加了晶格态铁膜含量,但是显著降低了无定型铁膜含量,因此对根表铁膜的XRD进行分析,结果(图5)显示,根表铁膜XRD图谱中的三个处理的主峰与原始的NPs(γFe2O3)一致,表明铁膜的晶格构造与NPs相类似。已有研究[7,18-20]显示,纳米金属氧化物能够直接强烈地吸附在植物根表,因此,推测水稻根表增加的晶格态铁膜可能主要来源于NPs的直接吸附沉淀作用,NPs参与了根表膜的形成,最终成为根表铁膜的一部分。特别是NPs包被处理,可能是由于更多的NPs直接参与诱导形成铁膜中晶格态组分,因而此处理条件下形成了更高量的铁膜。
2.3 柠檬酸对NPs处理条件下水稻植株吸收累积的Fe影响

图5 水稻根表铁膜XRD分析Figure 5 XRD analysis of iron plaque on root surface of rice
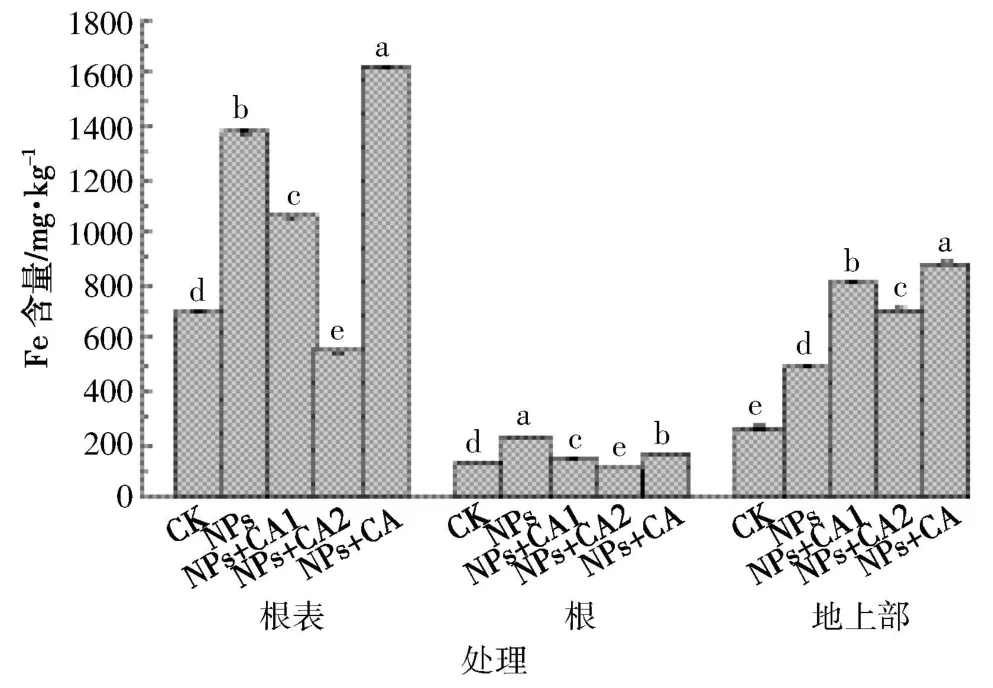
图6 Fe在水稻植株中的含量Figure 6 Fe contents in rice
根据图6可知,与CK相比,除了高浓度柠檬酸显著降低了Fe在根表以及根内的累积,其他NPs处理均能显著增加Fe在水稻根表、根内以及地上部的累积。对于不同的NPs处理而言,除高浓度柠檬酸处理外,Fe主要累积在水稻根表(1059~1623 mg·kg-1),其次为地上部(492.3~880.1 mg·kg-1),在根内的累积量最小(145.5~226.6 mg·kg-1);对于 8.41 mg·kg-1柠檬酸处理,Fe主要累积在地上部(708.6 mg·kg-1),其次为根表(553.4 mg·kg-1),在根内累积量最小(110.4 mg·kg-1)。
柠檬酸对根系中Fe累积的影响类似于根表,其加入显著降低了Fe在根内累积量,且随着柠檬酸浓度增加(从 2.10 到 8.41 mg·L-1),Fe在根中的累积量下降(图6)。其原因,一方面可能与柠檬酸降低了NPs的Fe离子释放有关(图3),无论是二价还是三价Fe离子,均能够被水稻根系吸收累积;另一方面,与柠檬酸增加了NPs水合粒径,并使其Zeta电位由正值变为负值(图4),进而降低了NPs向根表以及根内的迁移有关。然而,与未包被相比,柠檬酸包被NPs能够显著缓解根系Fe累积量的下降(图6)。与之相反,柠檬酸的加入显著增加了Fe在水稻地上部的累积,但是随着柠檬酸浓度的增加,这种增加作用减缓;与未包被相比,柠檬酸包被NPs更能够促进Fe在地上部的累积。上述结果显示,柠檬酸的加入能够显著降低Fe在根表和根中的累积,但是增加了Fe在地上部的累积。然而,柠檬酸包被NPs处理条件下能够增加Fe在根表和植株地上部的累积,但降低Fe在根系中的累积。
2.4 柠檬酸对NPs处理条件下Fe在水稻植株中转移和富集的影响
表1显示,不同NPs处理条件下,Fe从根到地上部的转移系数(2.173~6.418)远高于Fe从根表到根内的迁移系数(0.102~0.200)。与单一NPs相比,低浓度柠檬酸的包被与未包被NPs处理均能显著(P<0.05)降低Fe从根表到根内的转运系数,然而高浓度柠檬酸能够显著(P<0.05)增加Fe从根表到根内的转运系数。对于从根到地上部的转移系数,柠檬酸的加入均显著增加(P<0.05)了Fe从根到地上部的转移,其顺序为NPs+CA2>NPs+CA1>NPs+CA>NPs,结果显示,随着柠檬酸浓度的增加,Fe从根到地上部的转移系数显著增加;且柠檬酸未包被处理对Fe转移的影响显著高于柠檬酸包被处理。总之,低浓度柠檬酸(包被和未包被NPs处理)能够减弱Fe从根表向根内的转移,但是增强了Fe从根向地上部的转移。
不同NPs处理条件下Fe在水稻根表、根内和地上部的富集系数(表1)均高于4,显示了Fe在水稻植株不同部位均存在富集现象,除高浓度柠檬酸处理外,富集系数大小顺序为 BAF根表>BAF地上部>BAF根内,与Fe在水稻植株不同部位的累积量一致。
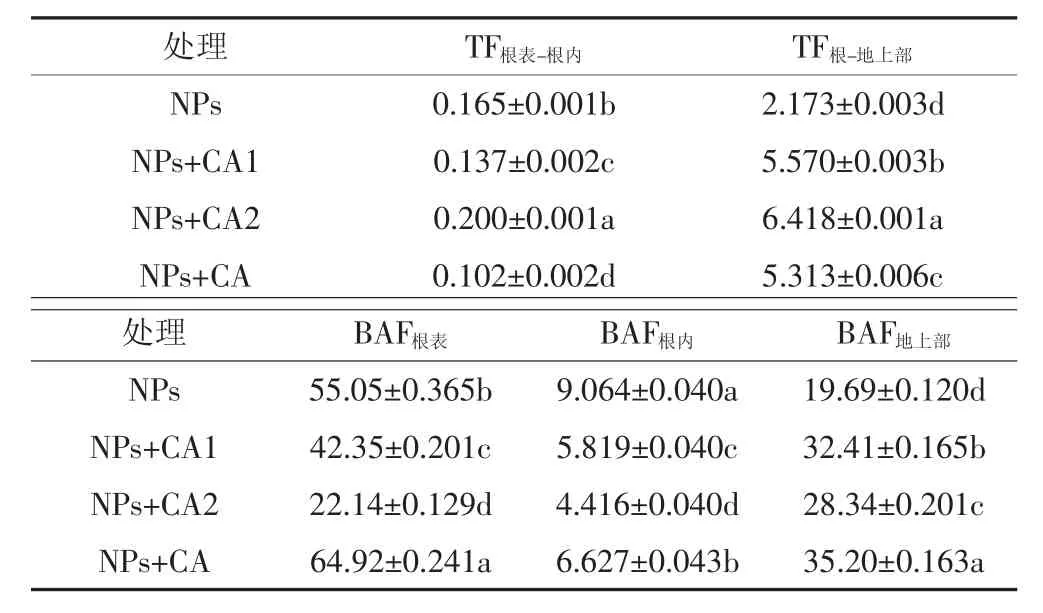
表1 NPs处理条件下Fe在水稻中的转运系数(TF)和富集系数(BAF)Table 1 The translocation factors and bio-accumulation factors of Fe in rice after NPs exposure
3 结论
(1)NPs能够诱导水稻根表铁膜形成。但是柠檬酸的加入降低了铁膜形成量,随着柠檬酸浓度增加,铁膜量下降,其主要原因是柠檬酸通过降低NPs的Fe2+释放量来减少根表铁膜生成。然而,与未包被NPs相比,2.10 mg·L-1柠檬酸包被NPs能够显著提高根表铁膜形成量,这是由于包被处理一方面促进了NPs的Fe2+释放量,另一方面使NPs直接吸附在根表参与铁膜形成。
(2)除柠檬酸包被NPs处理外,根表铁膜均以无定型为主,晶格态仅占铁膜总量的24.88%~48.12%。铁膜中的晶格态组分构造与NPs类似,可能主要来源于NPs的直接吸附沉淀进而成为根表铁膜的一部分。
(3)柠檬酸的加入显著降低Fe在根表和根内累积,但是增加了Fe在地上部的累积。然而,柠檬酸包被NPs处理能够增加Fe在根表和植株地上部的累积,但降低Fe在根内的累积。
(4)2.10 mg·L-1柠檬酸(包被和未包被NPs处理)能够减弱Fe从根表向根内的转移,但是增强Fe从根向地上部的转移。不同NPs处理条件下,Fe在水稻植株不同部位均存在富集现象,根表和地上部的富集系数显著高于根内。
[1]Maynard A,Michelson E.The nanotechnology consumer products inventory[M].Washington DC:Woodrow Wilson International Center for Scholars,2006.
[2]Mueller N C,Nowack B.Exposure modeling of engineered nanoparticles in the environment[J].Environmental Science&Technology,2008,42(12):4447-4453.
[3]Bee A,Massart R,Neveu S.Synthesis of very fine maghemite particles[J].Journal of Magnetism&Magnetic Materials,1995,149(1/2):6-9.
[4]Gupta A K,Gupta M.Synthesis and surface engineering of iron oxide nanoparticlesforbiomedicalapplications[J].Biomaterials,2005,26(18):3995-4201.
[5]Bais H P,Weir T L,Perry L G,et al.The role of root exudates in rhizosphere interactions with plants and other organisms[J].Annu Rev Plant Biol,2006,57(1):233-266.
[6]Ma C,White J C,Dhankher O P,et al.Metal-based nanotoxicity and detoxification pathways in higher plants[J].Environmental Science&Technology,2015,49(12):7109-7122.
[7]Zhang P,Ma Y H,Zhang Z Y,et al.Biotransformation of ceria nanoparticles in cucumber plants[J].ACS Nano,2012,6(11):9943-9950.
[8]Ma Y H,He X,Zhang P,et al.Phytoxicity and biotransformation of La2O3nanoparticles in a terrestrial plant cucumber(Cucumis sativus)[J].Nanotoxicology,2011,5(4):743-753.
[9]Barrios A C,Rico C M,Trujillo-Reyes J,et al.Effects of uncoated and citric acid coated cerium oxide nanoparticles,bulk cerium oxide,cerium acetate,and citric acid on tomato plants[J].Science of the Total Environment,2016,563/564:956-964.
[10]Akihiro D,Isoda A.Effect of γFe2O3nanoparticles on photosynthetic characteristic of soybean(Glycine max(L.)Merr.):Foliar spray versus soil amendment[J].Acta Physiol Plant,2013,35(12):3365-3375.
[11]Armstrong W.Oxygen diffusion from the roots of some British bog plants[J].Nature,1964,204(4960):801-802.
[12]Park J H,Han Y S,Seong H J,et al.Arsenic uptake and speciation in Arabidopsis thaliana under hydroponic conditions[J].Chemosphere,2016,154:283-288.
[13]Zhou H,Zeng M,Zhou X,et al.Heavy metal translocation and accumulation in iron plaques and plant tissues for 32 hybrid rice(Oryza sativa L.)cultivars[J].Plant Soil,2015,386(1/2):317-329.
[14]Kotsmar C,Yoon K Y,Yu H,et al.Stable citrate-coated iron oxide superparamagnetic nanoclusters at high salinity[J].Industrial&Engineering Chemistry Research,2010,49(24):12435-12443.
[15]Yan D F,Ma W,Song X J,et al.The effect of iron plaque on uptake and translocation of norfloxacin in rice seedlings grown in paddy soil[J].Environmental Science and Pollution Research,2017,24(8):7544-7554.
[16]马 微,鲍艳宇.根表铁氧化物胶膜对水稻吸收诺氟沙星的影响[J].环境科学,2015,36(6):2259-2265.
MA Wei,BAO Yan-yu.Effect of root iron plaque on norfloxacin uptake by rice[J].Environmental Science,2015,36(6):2259-2265.
[17]Zhu Z J,Wang H H,Yan B,et al.Effect of surface charge on the uptake and distribution of gold nanoparticles in four plant species[J].Environmental Science&Technology,2012,46(22):12391-12398.
[18]Ma Y H,Zhang P,Zhang Z Y,et al.Where does the transformation of precipitated ceria nanoparticles in hydroponic plants take place?[J].Environmental Science&Technology,2015,49(17):10667-10674.
[19]Zhang P,Ma Y H,Zhang Z Y,et al.Comparative toxicity of nanoparticulate/bulk Yb2O3and YbCl3to cucumber(Cucumis sativus)[J].Environmental Science&Technology,2011,46(3):1834-1841.
[20]Geisler-Lee J,Wang Q,Yao Y,et al.Phytotoxicity,accumulation and transport of silver nanoparticles by Arabidopsis thaliana[J].Nanotoxicology,2013,7(3):323-337.
The effect of citric acid on iron plaque formation on root surface and iron uptake/translocation in rice after γFe2O3NPs exposure
HU Lu1,2,CHEN Qi1,2,LI Yun-xia1,2,YAN Da-fang1,2,BAO Yan-yu1,2*
(1.Key Laboratory of Pollution Processes and Environmental Criteria at Ministry of Education,College of Environmental Science and Engineering,Nankai University,Tianjin 300350,China;2.Tianjin Key Laboratory of Remediation&Pollution Control for Urban Ecological Environment,Tianjin 300350,China)
The aim of this study was to identify the effect of citric acid on iron plaque formation on the root surface of rice,and iron uptake and translocation after exposure to γFe2O3nanoparticles(NPs)in a hydroponic culture experiment.The results showed that the addition of citric acid(low concentration or uncoated NPs)greatly increased the biomass of roots,but not to that of aboveground rice,compared with the single Fe2O3NPs treatment.Fe2O3NPs exposure induced iron plaque formation on root surfaces of rice.However,the presence of citric acid decreased the amount of iron plaque,which could have been caused by low Fe2+dissolution from Fe2O3NPs in the presence of citric acid.Also,citric acid(2.10 mg·L-1)coated NPs promoted iron plaque formation.Iron plaque was mainly comprised of amorphous fractions,except in the citric acid-coated treatment.The crystal fraction was only 24.88%~48.12%of the total amount of iron plaque.As the crystalfraction was consistent with that of NPs from the XRD analysis,it was speculated that the crystal fraction could come mainly from the direct adsorption precipitation of NPs,and then as iron plaque components.The addition of citric acid significantly decreased iron accumulation on the root surface and in the root,but significantly increased the accumulation in the aboveground parts.However,the citric acid-coated NPs treatment increased the accumulation of iron on the root surface and in the shoot,and decreased the accumulation in the root.Low concentration of citric acid(2.10 mg·L-1,coated and uncoated NPs)decreased iron translocation from the root surface to the root,and increased the translocation from the root to aboveground parts.Iron enrichment was found in all NPs treatments,and the enrichment factors on the root surface and in aboveground parts were significantly higher than in the root.
Fe2O3NPs;rice;iron plaque;uptake;translocation
S511
A
1672-2043(2017)11-2185-08
10.11654/jaes.2017-0118
胡 露,陈 奇,李云霞,等.柠檬酸对纳米氧化铁诱导水稻根表铁膜形成及对水稻铁吸收转运的影响[J].农业环境科学学报,2017,36(11):2185-2192.
HU Lu,CHEN Qi,LI Yun-xia,et al.The effect of citric acid on iron plaque formation on root surface and iron uptake/translocation in rice after γFe2O3NPs exposure[J].Journal of Agro-Environment Science,2017,36(11):2185-2192.
2017-01-21 录用日期:2017-08-23
胡 露(1991—),女,湖南娄底人,硕士研究生,主要研究方向为新型污染物根际微界面传输。E-mail:954267105@qq.com
*通信作者:鲍艳宇 E-mail:baoyanyu@nankai.edu.cn
天津市自然基金重点项目(16JCZDJC39200);中央高校基本科研业务费专项资金项目
Project supported:The Natural Foundation of Tianjin,China(16JCZDJC39200);The Fundamental Research Funds for the Central Universities

