六溴环十二烷对斑马鱼的甲状腺激素干扰效应研究
刘小燕 ,刘 珊 ,张丽娟 ,韩 倩 ,陈棉彪 ,黄楚珊 ,魏东洋 ,胡国成 *
六溴环十二烷对斑马鱼的甲状腺激素干扰效应研究
刘小燕1,2,3,刘 珊1,张丽娟2,3,韩 倩4,陈棉彪2,3,黄楚珊2,3,魏东洋2,3,胡国成2,3*
(1.长安大学旱区地下水文与生态效应教育部重点实验室,西安 710064;2.环境保护部华南环境科学研究所,广州 510535;3.国家环境保护环境污染健康风险评价重点实验室,广州 510535;4.深圳市环境科学研究院,广东 深圳 518001)
作为添加型阻燃剂,六溴环十二烷(HBCDs)广泛存在于环境介质及生物体内。为研究HBCDs饲料长期暴露对斑马鱼的甲状腺激素干扰效应,设计HBCDs饲料暴露剂量为0、10、100、400 ng·g-1,对斑马鱼成鱼进行为期56 d的长期暴露,以其肝脏组织中三碘甲腺原氨酸(T3)、四碘甲腺原氨酸(T4)、游离三碘甲腺原氨酸(FT3)和游离四碘甲腺原氨酸(FT4)含量及T3/T4比值作为生物标志物,评价HBCDs饲料长期暴露对斑马鱼肝脏组织甲状腺功能的影响。结果表明,HBCDs对斑马鱼体内T3和T4具有明显抑制作用(P<0.05),随着HBCDs暴露浓度的增加,T3和T4的含量水平呈现下降趋势;在中浓度组(100 ng·g-1)和高浓度组(400 ng·g-1),HBCDs对FT3和FT4具有显著性抑制作用(P<0.05);随着HBCDs暴露浓度增加,T3/T4的比值呈现升高的趋势,表明HBCDs可诱导T4转化为T3。研究表明,HBCDs对鱼类具有甲状腺激素干扰效应,从而影响鱼类的生长发育。
六溴环十二烷;斑马鱼;甲状腺激素;干扰效应
目前,六溴环十二烷(HBCDs)广泛应用于建筑材料、塑料橡胶产品以及电子设备中[1]。工业品HBCDs主要含有3种手性异构体:α-HBCD、β-HBCD和γ-HBCD,其比例分别为10%~13%、1%~12%和75%~89%,其中γ-HBCD是工业品中最主要的异构体[2]。研究资料显示,HBCDs是除多溴联苯醚(PBDEs)和四溴双酚A(TBBPA)之外的全球第三大溴代阻燃剂。至2010年,HBCDs的全球年产量已达到28 000 t,其中约64%的产量集中于中国山东省、江苏省等HBCDs的生产地区[3-5]。随着HBCDs生产量和使用量的增加,HBCDs在不同环境介质(水、土壤、沉积物及空气等)和生物体内(银鸥、鲫鱼、田螺、斑马贻贝和欧鲤等)均有不同程度的检出[6-13],且在水生物体内可随着食物链富集放大。He等[6]研究发现珠江流域水体中HBCDs的平均浓度为0.04 ng·L-1;Xian等[14]首次研究了中国环境中HBCDs的含量,发现长江流域鱼体中HBCDs的含量范围为12~330 ng·g-1,高于意大利高山湖泊斑马贻贝和欧鲤体内HBCDs的平均浓度(分别为72.4、31 ng·g-1)[15],而低于欧洲工业区鱼类体内 HBCDs含量水平(9.1~1113 ng·g-1)[13]。
目前,关于HBCDs毒性研究的资料相对较少。HBCDs对大鼠的口服最小致死剂量大于20 g·kg-1,吸入最小致死剂量大于200 mg·L-1;HBCDs对兔子的经皮肤接触暴露的最小致死剂量大于20 g·kg-1[15]。2008年,欧洲联盟委员会对HBCDs的全面评估显示:HBCDs可能会造成生殖毒性和慢性毒性。工业品HBCDs在等于或低于溶解度的条件下不会导致急性毒性,但该类化合物具有较高的生物浓缩系数。这表明HBCDs的急性毒性并不显著,但其慢性毒性及亚致死毒性效应不容忽视[16]。研究资料表明HBCDs具有生殖发育、神经毒性及内分泌干扰等毒性[15-19]。由于HBCDs与多溴联苯醚(PBDEs)结构相似,由此推测,HBCDs具有较为显著的甲状腺激素干扰效应[20]。目前,HBCDs的甲状腺毒性效应研究主要集中于大鼠及鱼类的血清,如Van-Der-Ven等[21]研究发现HBCDs会使大鼠脑垂体和甲状腺重量增加,促甲状腺激素水平增加,但此现象只出现在雌鼠体内,其影响机制还需进一步研究。HBCDs对鱼类组织中甲状腺激素水平的研究却鲜有报道,因此研究HBCDs对鱼类甲状腺激素水平的影响具有重要意义。本研究以斑马鱼为受试生物,研究了不同剂量HBCDs饲料暴露对斑马鱼甲状腺激素水平的影响,选取T3、T4、FT3、FT4以及T3/T4的比值为甲状腺激素的水平指标,进一步揭示HBCDs的甲状腺激素干扰效应,为筛选和甄别环境内分泌干扰物提供基础资料,为生态环境安全及人体健康风险评估提供理论支撑和技术支持。
1 材料与方法
1.1 仪器与试剂
全自动荧光及化学发光酶标仪(Synergy HT,宝特仪器有限公司);匀浆机(FS-2,德国IKA公司);-80℃超低温冰箱(Revco Value Series,赛默飞世尔科技公司);低温冷冻离心机(Sorvall Stratos,赛默飞世尔科技公司);超高效液相色谱/三重四极杆串联质谱(Agilent 1260 LC/AB SCIEX 4000trap MS,美国安捷伦科技有限公司(液相色谱)/SCIEX)。
六溴环十二烷(hexabromocyclododecane,HBCD),纯度97%(百灵威公司);丙酮、正己烷、甲醇(HPLC级,CNW)购自上海安谱实验科技股份有限公司;斑马鱼成鱼专用饲料(250~450 Microns,Zeigler,USA)购自上海海圣生物实验设备有限公司;PBS缓冲液、鱼三碘甲状腺原氨酸(T3)、鱼游离三碘甲状腺原氨酸(FT3)、鱼四碘甲状腺原氨酸(T4)、鱼游离四碘甲状腺原氨酸(FT4)酶联免疫检测试剂盒均购自南京建成生物工程研究所。
1.2 实验动物
斑马鱼成鱼,体长3.10~3.60 cm,体重0.55~0.80 g,购自广州芳村花鸟鱼虫市场。实验前将斑马鱼在实验室条件下驯养至少14 d以上,实验鱼应无明显的疾病和肉眼可见的畸形。实验用水为曝气24 h的自来水,空调控制水温为25℃左右。随机选取健康活泼的斑马鱼用于暴露实验,放入50 L的玻璃鱼缸中。实验中包括3个暴露组和1个对照组,每个浓度组设置3个平行,每个养殖缸中放养斑马鱼65尾。每日9:30和16∶30投喂自制饵料(含不同浓度HBCD)2次,投饲量为体重2%。实验过程中每日换1次水,并尽量清除食物残渣及排泄物,换水前后测水温及溶解氧含量,每周清洗鱼缸1次。整个实验期间,用外挂式过滤器持续微量曝气,光暗比为14 h∶10 h,溶解氧、温度、pH值等水质参数符合斑马鱼生长需要,水温为25℃左右,pH 值为 7.34±0.18,电导率为 182.08±2.46 μS·cm-1,溶解氧为 7.65±0.94 mg·L-1,每日观察斑马鱼有无行为异常、疾病或死亡情况。
1.3 实验方法
1.3.1 饲料制备与测定
1.3.1.1 饲料制备
本研究暴露剂量的设计以反映实际环境中HBCDs的暴露水平为原则,根据Du等[22]和Law等[23]实验中设置饲料浓度(5、50 ng·g-1)基本接近环境浓度的暴露剂量,本实验设置两个较为接近环境浓度的暴露剂量:低浓度组(10ng·g-1)和中浓度组(100ng·g-1)。同时综合考虑HBCDs的毒性资料,设置高浓度组(400 ng·g-1),与低浓度组和中浓度组进行比较,观察HBCDs对斑马鱼的甲状腺激素干扰及氧化应激效应。首先,将HBCDs工业品溶于丙酮,配制1 g·L-1的HBCDs丙酮溶液,并根据需要稀释至不同梯度。暴露实验中所用饲料选取美国Zeigler公司生产的斑马鱼成鱼专用饲料,将鱼饲料置于圆底烧瓶中,然后加入不同浓度的HBCDs丙酮溶液,使饲料中HBCD的剂量分别为 10、100、400 ng·g-1,振荡 1 h 使 HBCDs充分混匀于饲料中,混合物过夜风干,使溶剂蒸发。对照组饲料用未添加HBCDs的丙酮作同样处理。将饲料置于棕色瓶中,并存放于4℃冰箱中保存,以免光解。为考察投喂饲料后水中HBCDs的含量水平,保证饲料在斑马鱼摄食前未释放到水中,将制备好的3组饲料(10、100、400 ng·g-1)均取 1 g分别投入至 1 L 超纯水中,黑暗中静置1 h后测定超纯水中HBCDs的含量水平。
1.3.1.2 饲料中HBCDs的测定
饲料配制完成后,经索氏抽提、旋转蒸发、凝胶渗透色谱柱除脂肪以及氧化铝硅胶柱净化等前处理过程,利用超高效液相色谱质谱联用(LC-MS/MS)测定饲料中HBCDs的含量。饲料静置后的超纯水样品经过HLB柱富集萃取、浓缩净化等过程后,同样利用LC-MS/MS测定HBCDs的含量。每分析一批样品同时分析质量保证/质量控制(QA/QC)样品,包括方法空白、空白加标、基质加标和样品平行样。甲醇空白样品用来检查实验过程中有无来自溶剂或玻璃器皿的干扰或污染,其中均没有HBCDs检出或低于检测限。空白加标中 α-HBCD、β-HBCD、γ-HBCD 的回收率分别为98%~118%、105%~116%、109~113%;基质加标中目标物 α-HBCD、β-HBCD、γ-HBCD 的回收率分别为87%~96%、86%~94%、83%~93%。
检测可知,对照组、低浓度组、中浓度组和高浓度组饲料中HBCDs的实际含量水平分别为5.23、15.03、98.29、388.30 ng·g-1,与设定的浓度剂量基本接近。对照组中检出HBCDs可能与饲料成分的背景值有关。对照组饲料中α-HBCD、β-HBCD和γ-HBCD的含量分别为 0.80、0.64、3.78 ng·g-1。因为 α-HBCD为生物体内主要的异构体形式,且毒性较高,故本实验对照组饲料中HBCDs对斑马鱼的影响基本可以忽略。饲料溶解实验的监测结果表明:水中γ-HBCD未检出,α-HBCD和β-HBCD有检出,且浓度水平均较低(ND~0.023 ng·L-1和 ND~0.011 ng·L-1),基本可以忽略水体溶解的HBCDs对斑马鱼的影响。
1.3.2 斑马鱼样品前处理
斑马鱼暴露56 d后,每缸鱼中随机选取6尾,解剖取肝脏,每3尾鱼混合为一个样品,准确称取肝脏组织重量,按照重量(g)∶体积(mL)=1∶9 的比例,加入9倍体积预冷的PBS缓冲溶液,冰水浴条件下机械匀浆,制成10%的组织匀浆液,以2500 r·min-1,离心10 min,取上清液待测。
1.3.3 测定指标及方法
1.3.3.1 测定指标及原理
利用生物素双抗体夹心酶联免疫吸附法(ELISA)检测斑马鱼肝脏中三碘甲状腺原氨酸(T3)、游离三碘甲状腺原氨酸(FT3)、四碘甲状腺原氨酸(T4)、游离四碘甲状腺原氨酸(FT4)的含量水平。其工作原理为向预先包被了甲状腺激素单克隆抗体的酶标孔中加入甲状腺激素,温育;随后加入生物素标记的抗甲状腺激素抗体,再与链霉亲和素-HRP结合,形成免疫复合物,再经过温育和洗涤,去除未结合的酶;然后加入底物A、B,产生蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅与样品中甲状腺激素浓度呈正相关。
1.3.3.2 测定方法
正式测定前,要进行预实验。首先挑选2~3例样品10%的组织匀浆液,稀释成不同浓度(5%、2%、1%、0.5%、0.25%)进行预实验,再选取甲状腺激素含量接近标准曲线中间浓度的组织匀浆液(保证实验测定结果在标准曲线范围内,减小测定误差),并将所有样品稀释至此浓度,进行正式实验。具体操作过程参照ELISA试剂盒说明书进行。T3、T4、FT3和FT4的标准曲线如图1所示。
1.3.4 数据处理
实验结果以10%肝脏组织匀浆液中T3、T4、FT3和FT4的含量表示,每一暴露浓度组均设6个平行,表示为平均数±标准误差(Mean±SD)。采用SPSS17.0统计软件进行分析,利用单因素方差分析(ANOVA)比较不同浓度组的差异,并用最小极差法(LSD)多重比较法判断差异显著性,显著性水平为0.05。当P<0.05时,判定存在显著性差异,图中用*表示;当P<0.01时,判定差异性极显著,图中用**表示。

图1 鱼类组织中甲状腺激素测定的标准曲线Figure 1 Standard curves of thyroid hormones in fish tissues
2 结果与分析
2.1 HBCDs对斑马鱼肝脏中T3和T4的含量的影响
不同HBCDs饲料暴露浓度对斑马鱼肝脏中T3和T4含量的影响如图2所示。斑马鱼暴露实验结束后(56 d),随着暴露浓度的增加,斑马鱼肝脏组织中T3和T4的含量逐渐降低,呈现较明显的剂量-效应关系。与对照组相比,低浓度暴露组肝脏中T3和T4的含量显著降低(P<0.05),中、高浓度暴露组肝脏中T3和T4的含量均极显著降低(P<0.01);HBCDs对高浓度暴露组肝脏中T3和T4的最高抑制率分别达到52.08%和60.15%。
图3表示HBCDs对斑马鱼肝脏中T3/T4比值的影响。从图中可以看出,长期暴露情况下,随着暴露浓度的增加,斑马鱼肝脏组织中T3/T4比值呈现升高的趋势。经56 d暴露后,低浓度暴露组斑马鱼肝脏中T3/T4比值与对照组无统计学意义(P>0.05),而中浓度暴露组和高浓度暴露组中T3/T4比值显著高于对照组(P<0.05)。
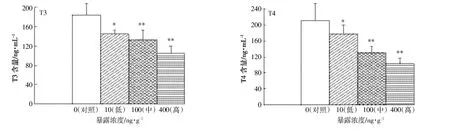
图2 HBCDs对肝脏中T3和T4含量的影响(暴露时间56 d)Figure 2 Effects of exposure to HBCDs on T3 and T4 of liver in zebrafish(exposure for 56 days)

图3 HBCDs对斑马鱼肝脏中T3/T4比值的影响(暴露时间56 d)Figure 3 Effects of exposure to HBCDs on the ratio of T3 to T4 of liver in zebrafish(exposure for 56 days)
2.2 HBCDs对斑马鱼肝脏中FT3和FT4的含量的影响
图4表示不同HBCDs暴露浓度对斑马鱼肝脏组织中FT3和FT4含量的影响。从图4中可以看出,与对照组相比,低浓度暴露组斑马鱼肝脏中FT3的含量水平略有增加,但差异不明显(P>0.05);中浓度暴露组FT3含量极显著低于对照组(P<0.01),抑制率为25.2%;高浓度暴露组FT3含量显著低于对照组(P<0.05)。从剂量效应来看,斑马鱼肝脏组织中FT3的含量水平呈现先升高后降低的趋势,而后随着暴露浓度的升高逐渐趋于与对照组水平相当。从图中可以看出,低浓度暴露组肝脏组织中FT4含量与对照组相比无明显差异(P>0.05),中浓度暴露组和高浓度暴露组中FT4含量水平均极显著低于对照组(P<0.01)。上述结果表明:中浓度暴露组和高浓度暴露组中,HBCDs对斑马鱼肝脏中FT3和FT4均产生明显的抑制作用,其中最高抑制率达到66.7%。
3 讨论
甲状腺激素对鱼类生长发育、生殖繁育及能量代谢等生理过程具有重要的调节与控制作用,鱼类甲状腺受下丘脑-垂体-甲状腺轴的调节,通过下丘脑合成肾上腺释放激素,刺激垂体产生和释放促甲状腺激素,促进甲状腺合成大量T4和少量T3。由于T4能够同血液中的运载蛋白结合,运输至肝脏、脑、肾脏等外周组织中,在脱碘酶的作用下,脱碘转化形成生物活性更强的三碘甲腺原氨酸(T3);一般结合型的激素不具有生物活性,只有游离的激素才能进入细胞,且结合型和游离型激素之间保持动态平衡[24]。研究表明,溴代阻燃剂(PBDEs、HBCDs等)内分泌干扰物均能影响生物体内甲状腺激素水平及转化过程[25]。
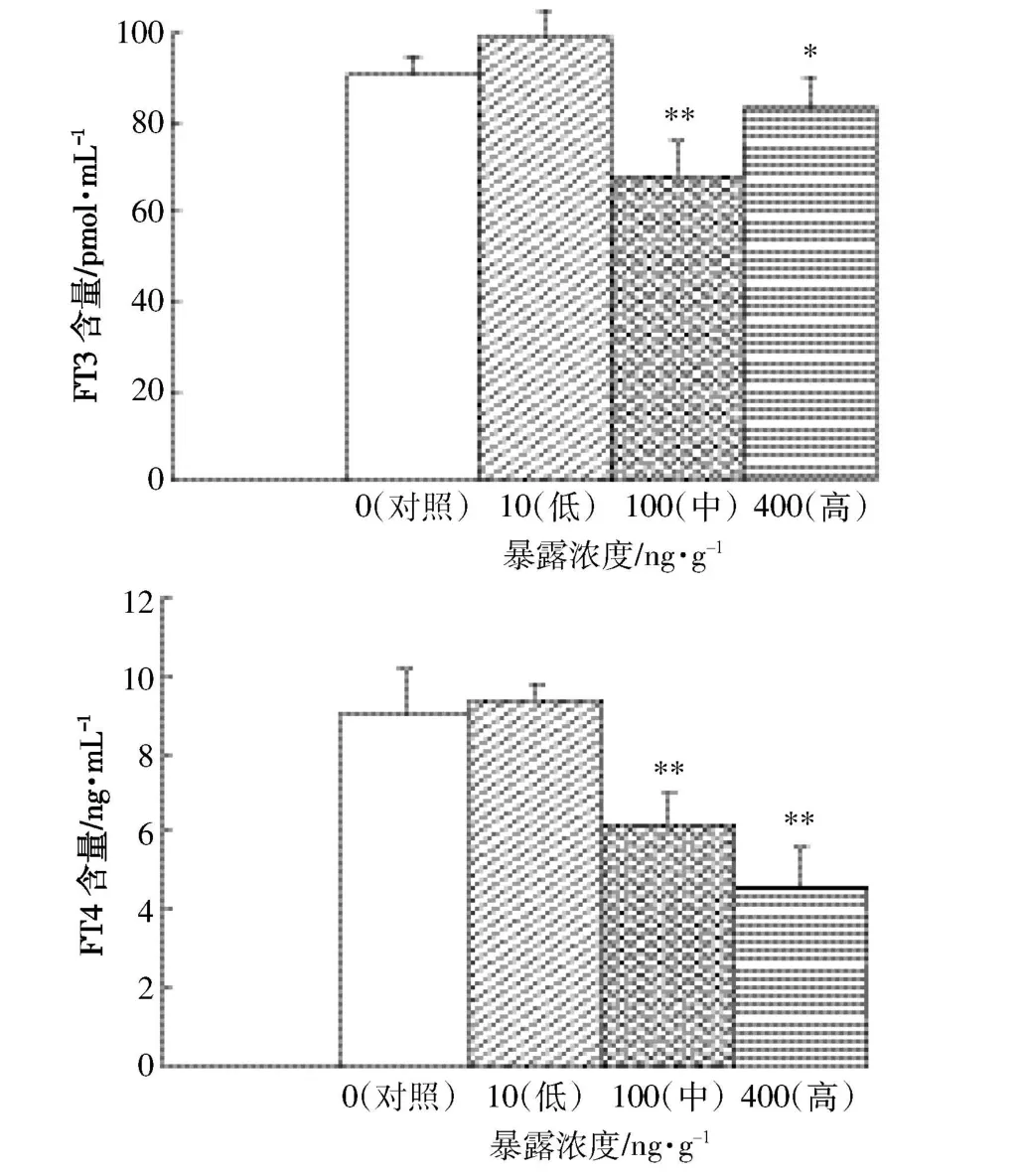
图4 HBCDs对肝脏中FT3和FT4含量的影响(暴露时间56 d)Figure 4 Effects of exposure to HBCDs on FT3 and FT4 of liver in zebrafish(exposure for 56 days)
本研究中,与对照组相比,长期暴露下低浓度HBCDs饲料暴露对斑马鱼肝脏中的T3和T4产生抑制作用,中、高浓度水平HBCDs对斑马鱼肝脏中的甲状腺激素T3和T4产生明显的干扰作用;低浓度组斑马鱼肝脏中T3/T4比值与对照组无明显差异,而中、高浓度组呈现显著升高趋势。这表明,长期暴露下HBCDs可诱导甲状腺激素T4向T3转化。随着暴露浓度的增加,斑马鱼肝脏组织中游离甲状腺激素FT3和FT4的含量均呈现稍有升高后降低的趋势,其中FT3在中浓度暴露组达到最低值,FT4在高浓度暴露组中达到最低值。Palace等[26]在研究HBCDs对虹鳟甲状腺代谢的影响中,发现HBCDs可以减少虹鳟对碘的吸收,加快甲状腺激素的转化效率,从而增加暴露组中甲状腺激素T4的转化速率,促进甲状腺激素T3的合成,影响机体的代谢平衡,与本文研究结果基本一致。刘园园等[27]研究发现,HBCDs暴露42 d后,大鼠血清中TT4、TT3、FT4、FT3浓度随着暴露剂量增大呈现先升高后下降的趋势,其中低剂量组的FT3浓度显著性升高,高剂量组的FT4浓度显著性下降,与本研究甲状腺激素变化趋势基本一致。冀秀玲等[28]研究HBCDs发育期暴露对甲状腺激素内稳态的影响,发现新生大鼠暴露于HBCDs 21 d后血清中TT4、FT4下降而TT3、FT3和TSH升高的趋势,且低剂量暴露组也会对脑发育期新生大鼠产生甲状腺激素干扰,T4和FT4的含量变化与本研究相似,其余指标呈现不同的变化趋势。这可能与受试生物不同相关。Palace等[29]研究了HBCDs异构体对虹鳟血清中FT3和FT4的影响,发现暴露于HBCD的3种异构体56 d后,虹鳟血清中FT4含量降低,FT3含量上升,与本文中FT3的变化趋势相反。这可能由于物种及检测组织不同所导致。在陈海刚等[30]的实验中,发现HBCDs短期暴露,使低、中暴露组红鳍笛鲷幼鱼肝脏中T3和T4的含量显著上升,而高浓度暴露组随时间推移呈现先升高后降低的趋势;肝组织中T3/T4比值低于对照组,呈现明显的剂量-效应关系。这一研究结果与本研究的结果不一致,可能与暴露时间、鱼种类不同有关。
本研究结果表明,摄入饲料暴露HBCDs对鱼类甲状腺激素产生干扰效应,影响甲状腺激素的内稳态水平。本研究中部分研究结果与文献报道结果不一致,可能与暴露时间、受试物种、检测组织、代谢转化等因素有关。
4 结论
(1)饲料长期暴露HBCDs对斑马鱼肝脏中的T3和T4具有显著性影响,随着暴露浓度的增加,T3和T4具有明显抑制作用;中、高浓度组暴露HBCDs对斑马鱼肝脏中T3/T4比值具有显著影响。
(2)与对照组相比,低浓度暴露组HBCDs对斑马鱼肝脏中FT3和FT4的含量影响不明显;而中、高浓度暴露组中HBCDs对斑马鱼肝脏中FT3和FT4的含量水平具有显著影响,呈现明显降低趋势。
(3)通过饲料长期摄入HBCDs,对鱼类甲状腺激素(T3、T4、FT3、FT4)具有干扰效应,干扰甲状腺的调节机制,可能影响脱碘酶的活性而诱导甲状腺激素T4向T3转化,从而影响鱼类的生长发育。
[1]Koch C,Rupp R,Sures B.Review of hexabromocyclododecane(HBCD)with a focus on legislation and recent publications concerning toxicokinetics and dynamics[J].Environmental Pollution,2015,199:26-34.
[2]韩 倩.工业区土壤中六溴环十二烷的污染特征及热转化机理模拟研究[D].广州:中国科学院大学,2014.
HAN Qian.The simulation of thermal transformation of hexabromocyclododecane diastereoisomers and their pollution characteristics in soil samples from industrial areas[D].Guangzhou:University of the Chinese Academy of Sciences,2014.
[3]Mai B,Chen S,Luo X,et al.Distribution of polybrominated diphenyl ethers in sediments of the Pearl River Delta and adjacent South China Sea[J].Environmental Science&Technology,2005,39(10):3521-3527.
[4]Koch C,Rupp R,Sures B.Review of hexabromocyclododecane(HBCD)with a focus on legislation and recent publications concerning toxicokinetics and dynamics[J].Environmental Pollution,2015,199:26-34.
[5]Ueno D,Alaee M,Marvin C,et al.Distribution and transportability of hexabromocyclododecane(HBCD) in the Asia-Pacific region using skipjack tuna as a bioindicator[J].Environmental Pollution,2006,144(1):238-247.
[6]He M J,Luo X J,Yu L H,et al.Diasteroisomer and enantiomer-specific profiles of hexabromocyclododecane and tetrabromobisphenol A in an aquatic environment in a highly industrialized area,South China:Vertical profile,phase partition,and bioaccumulation[J].Environmental Pollution,2013,179(8):105-110.
[7]Li H,Zhang Q,Wang P,et al.Levels and distribution of hexabromocyclododecane(HBCD)in environmental samples near manufacturing facilities in Laizhou Bay area,East China[J].Journal of Environmental Monitoring,2012,14(10):2591-2597.
[8]Jin J,Yang C Q,Wang Y,et al.Determination of Hexabromocyclododecane diastereomers in soil by ultra performance liquid chromatographyelectrospray ion source/tandem mass spectrometry[J].Chinese Journal of Analytical Chemistry,2009,37(4):585-588.
[9]刘艺凯,王景芝,唐建辉,等.莱州湾河流表层沉积物中六溴环十二烷的含量水平、分布及组成特征[J].地球化学,2014,43(1):55-63.
LIU Yi-kai,WANG Jing-zhi,TANG Jian-hui,et al.Levels,distributions and isomer profiles of hexabromocyclododecanes in the riverine sediments of the Laizhou Bay area,East China[J].Geochimica,2014,43(1):55-63.
[10]Feng A H,Chen S J,Chen M Y,et al.Hexabromocyclododecane(HBCD)and tetrabromobisphenol A(TBBPA)in riverine and estuarine sediments of the Pearl River Delta in Southern China,with emphasis on spatial variability in diastereoisomer-and enantiomer-specific distribution of HBCD[J].Marine Pollution Bulletin,2012,64(5):919-925.
[11]Drage D S,Newton S,de Wit C A,et al.Concentrations of legacy and emerging flame retardants in air and soil on a transect in the UK West Midlands[J].Chemosphere,2016,148:195-203.
[12]张艳伟.六溴环十二烷异构体及其对映体的环境分布与生物富集[D].天津:南开大学,2014.
ZHANG Yan-wei.Environmental distribution and bioaccumulation of hexabromocyclododecane diastereomers and enantiomers[D].Tianjin:Nankai University,2014.
[13]Poma G,Binelli A,Volta P,et al.Evaluation of spatial distribution and accumulation of novel brominated flame retardants,HBCD and PBDEs in an Italian subalpine lake using zebra mussel(Dreissena polymorpha)[J].Environmental Science and Pollution Research,2014,21(16):9655-9664.
[14]Xian Q,Ramu K,Isobe T,et al.Levels and body distribution of polybrominated diphenyl ethers(PBDEs) and hexabromocyclododecanes(HBCDs)in freshwater fishes from the Yangtze River,China[J].Chemosphere,2008,71(2):268-276.
[15]王雅静.六溴环十二烷(HBCD)对黑点青鳉仔鱼神经系统和运动影响的研究[D].厦门:厦门大学,2014.
WANG Ya-jing.Effects of hexabromocyclododecane on nervous system and movement ability of Oryzias melastigma larvae[D].Xiamen:Xiamen University,2014.
[16]高永飞.氯化石蜡(CPs)和六溴环十二烷(HBCD)暴露对斑马鱼胚胎发育的毒性效应研究[D].武汉:华中农业大学,2012.
GAO Yong-fei.Toxicity effects on zebrafish larvae following embryonic exposure of chlorinated parffins and hexabromocyclododecanes[D].Wuhan:Central China Agricultural University,2012.
[17]Fernie K J,Marteinson S C,Bird D M,et al.Reproductive changes in American kestrels(Falco sparverius)in relation to exposure to technical hexabromocyclododecane flame retardant[J].Environmental Toxicology and Chemistry,2011,30(11):2570-2575.
[18]Letcher R J.Diet exposure to technical hexabromocyclododecane(HBCD)affects testes and circulating testosterone and thyroxine levels in American kestrels(Falco sparverius)[J].Environmental Research,2011,111(8):1116-1123.
[19]Saegusa Y,Fujimoto H,Woo G H,et al.Transient aberration of neuronal development in the hippocampal dentate gyrus after developmental exposure to brominated flame retardants in rats[J].Archives of Toxicology,2012,86(9):1431-1442
[20]Capone,Francesca,Branchi,et al.Developmental exposure to polybrominated diphenyl ether(PBDE 99)alters thyroid homeostasis and induces neurobehavioural effects in CD-1 mice[J].Minerva Pediatrica,1954,6(2):75-78.
[21]Van-Der-Ven L,Verhoef A D K T,Slob W,et al.A 28-day oral dose toxicity study enhanced to detect endocrine effects of hexabromocyclododecane in Wistar rats[J].Toxicological Sciences,2006,94(2):281-292.
[22]Du M M,Lin L,Yan C,et al.Diastereoisomer-and enantiomer-specific accumulation,depuration,and bioisomerization of hexabromocyclododecanes in zebrafish(Danio rerio)[J].Environmental Science&Technology,2012,46(20):11040-11046.
[23]Law K,Palace V P,Halldorson T,et al.Dietary accumulation of hexabromocyclododecane diastereoisomers in juvenile rainbow trout(Oncorhynchus mykiss) I:Bioaccumulation parameters and evidence of bioisomerization[J].Environmental Toxicology and Chemistry,2006,25(7):1757-1761.
[24]瞿璟琰,施华宏,刘青坡,等.污染物对鱼类的甲状腺激素干扰效应及其作用机制[J].生态毒理学报,2007,2(4):375-380.
QU Jing-yan,SHI Hua-hong,LIU Qing-po,et al.Thyroid hormone disrupting effects of contaminants on fish and their mechanisms of action[J].Asian Journal of Ecotoxicology,2007,2(4):375-380.
[25]杜苗苗,张 娴,颜昌宙.溴系阻燃剂的毒理学研究进展[J].生态毒理学报,2012,7(6):575-584.
DU Miao-miao,ZHANG Xian,YAN Chang-zhou.Advance in researches on toxicology of brominated flame retardants[J].Asian Journal of Ecotoxicology,2012,7(6):575-584.
[26]Palace V,Park B,Pleskach K,et al.Altered thyroxine metabolism in rainbow trout(Oncorhynchus mykiss)exposed to hexabromocyclododecane(HBCD)[J].Chemosphere,2010,80(2):165-169.
[27]刘园园,冀秀玲,沈群辉,等.六溴环十二烷及其复合污染脑发育期暴露对大鼠甲状腺激素代谢过程的影响[J].生态环境学报,2012(9):1614-1619.
LIU Yuan-yuan,JI Xiu-ling,SHEN Qun-hui,et al.Disrupting effects of hexabromocyclododecane(HBCD) and its complex compounds on rat thyroid hormone metabolism after developmental exposure[J].Ecology and Environmental Sciences,2012,21(9):1614-1619.
[28]冀秀玲,刘 洋,刘 芳,等.六溴环十二烷转甲状腺素蛋白结合活性及其发育期暴露的甲状腺激素干扰效应研究[J].环境科学,2010,31(9):2191-2195.JI Xiu-ling,LIU Yang,LIU Fang,et al.Transthyretin-binding activity of hexabromocyclododecanes(HBCDs) and its thyroid hormone disrupting effects after developmental exposure[J].Environmental Sciences,2010,31(9):2191-2195.
[29]Palace V P,Pleskach K,Halldorson T,et al.Biotransformation enzymes and thyroid axis disruption in juvenile rainbow trout(Oncorhynchus mykiss)exposed to hexabromocyclododecane diastereoisomers[J].Environmental Science&Technology,2008,42(42):1967-1972.
[30]陈海刚,孙立伟,张林宝,等.六溴环十二烷短期暴露对红鳍笛鲷幼鱼甲状腺激素T3和T4含量的影响[J].农业环境科学学报,2016,35(7):1257-1263.
CHEN Hai-gang,SUN Li-wei,ZHANG Lin-bao,et al.Effects of short-term exposure to hexabromocyclododecane(HBCD)on T3 and T4 of liver and brain in juvenile crimson snapper(Lutjanus erythopterus)[J].Journal of Agro-Environment Science,2016,35(7):1257-1263.
Thyroid hormone-disrupting effects of hexabromocyclododecane in zebrafish(Danio rerio)
LIU Xiao-yan1,2,3,LIU Shan1,ZHANG Li-juan2,3,HAN Qian4,CHEN Mian-biao2,3,HUANG Chu-shan2,3,WEI Dong-yang2,3,HU Guo-cheng2,3*
(1.Key Laboratory of Subsurface Hydrology and Ecological Effects in Arid Region of Ministry of Education,Chang’an University,Xi’an 710064,China;2.South China Institutes of Environmental Sciences,Ministry of Environmental Protection,Guangzhou 510535,China;3.State Environmental Protection Key Laboratory of Environmental Pollution Health Risk Assessment,Guangzhou 510535,China;4.Shenzhen A-cademy of Environmental Sciences,Shenzhen 518001,China)
Hexabromocyclododecane(HBCD)is a brominated flame retardant,and has become a ubiquitous pollutant of the environment.To explore the thyroid hormone-disrupting effects of long-term dietary exposure to HBCD,adult zebrafish were exposed to different concentrations of the chemical(0,10,100 ng·g-1,and 400 ng·g-1)for 56 days to determine triiodothyronine(T3),tetraiodothyronine(T4),free triiodothyronine(FT3),and free tetraiodothyronine(FT4)levels,and T3/T4 ratios in the liver tissues of zebrafish.The results showed that HBCD disrupted the action of the thyroid hormone in zebrafish.The levels of T3 and T4 in the liver tissues of the zebrafish decreased significantly with increasing concentrations of HBCD.Significant inhibitory effects on FT3 and FT4 were observed in the 100 ng·g-1and 400 ng·g-1exposure groups(P<0.01).Moreover,the T3/T4 ratio in the liver tissues increased with increasing HBCD concentration.This result indicated that HBCD could transform T4 into T3.In summary,our findings showed that HBCD could affect thyroid function and homeostatic levels in zebrafish,and could further influence the growth and development of zebrafish.
hexabromocyclododecane;zebrafish;thyroid hormone;disruption
X503.225
A
1672-2043(2017)11-2192-07
10.11654/jaes.2017-0509
刘小燕,刘 珊,张丽娟,等.六溴环十二烷对斑马鱼的甲状腺激素干扰效应研究[J].农业环境科学学报,2017,36(11):2192-2198.
LIU Xiao-yan,LIU Shan,ZHANG Li-juan,et al.Thyroid hormone-disrupting effects of hexabromocyclododecane in zebrafish(Danio rerio)[J].Journal of Agro-Environment Science,2017,36(11):2192-2198.
2017-04-08 录用日期:2017-07-13
刘小燕(1992—),女,山东聊城人,硕士研究生,研究方向为环境毒理学及水污染控制工程。E-mail:gengjiayanzi@163.com
*通信作者:胡国成 E-mail:huguocheng@scies.org
广东省自然科学基金(2015A030313790,2015A030313863,2014A030310002);环境保护部华南环境科学研究所中央级公益性科研院所基本科研业务专项资助项目
Project supported:The Natural Science Foundation of Guangdong Province,China(2015A030313790,2015A030313863,2014A030310002);The Basic Research Foundation of National Commonwealth Research Institute

