不同纳米材料对As(Ⅲ)的吸附机制
黄 青,林丽娜,李昉峻,3,廉 菲 ,刘仲齐 ,宋正国 *
不同纳米材料对As(Ⅲ)的吸附机制
黄 青1,2,林丽娜2,李昉峻2,3,廉 菲2,刘仲齐2,宋正国2*
(1.沈阳农业大学土地与环境学院,沈阳 110866;2.农业部环境保护科研监测所,天津 300191;3.吉林农业大学资源与环境学院,长春 130118)
为明确不同纳米材料对水中As(Ⅲ)的吸附效果和机制,筛选出经济有效的As污染吸附材料,采用批处理振荡平衡法,研究了多层氧化石墨烯(多层GO)、20 nm羟基磷灰石(P20)、40 nm羟基磷灰石(P40)以及纳米零价铁(nFe)对As(Ⅲ)的吸附差异性。结果表明,不同纳米材料对As(Ⅲ)的吸附能力存在显著差异(P<0.05),吸附容量的大小顺序为多层GO(17.4 mg·g-1)>P20(2.74 mg·g-1)>P40(2.17 mg·g-1)>nFe(0.976 mg·g-1)。其中,多层GO对As(Ⅲ)的吸附效果最好,其饱和吸附量是nFe的17.8倍。通过能量弥散X射线谱(EDS)、X-射线光电子能谱(XPS)、傅里叶红外光谱(FTIR)等对不同纳米材料吸附As(Ⅲ)前后进行分析,证实了多层GO的吸附机制是以单层化学吸附为主;P20、P40、nFe吸附机制为材料表面的聚沉吸附及含氧官能团与As(Ⅲ)发生络合等反应的吸附。实验结果表明多层GO可作为吸附材料用于As(Ⅲ)污染水体的修复。
纳米材料;砷;吸附;氧化石墨烯;羟基磷灰石;纳米零价铁
As(砷)是一种非金属元素,在化学元素周期表中位于第四周期,第ⅤA族,原子序数33。As元素广泛存在于自然界,已有数百种As矿物被发现[1]。自然水体中As的主要形态有砷酸、亚砷酸及其阴离子,还有甲基砷及二甲基砷等有机砷[2],地下水中的As浓度通常在1 mg·L-1以下,长期食用含As污染的水和食物会导致众多健康问题甚至引发癌症[3]。世界卫生组织的饮用水As标准为10.0μg·L-1,自2007年7月1日起,我国实施新国标《生活饮用水卫生标准》(GB 5749—2006),将饮用水中的 As标准限值定为 10.0 μg·L-1。为提高人民健康生活水平,保证饮用水质安全,需要开展高效的除As技术。目前,常用的水环境中去除As的方法主要有膜分离法、离子交换法、混凝沉淀法、电化学法和吸附法。吸附法以其除As效果好、成本低、易于操作等优点而备受关注,吸附材料进而成为了国内外学者的关注热点。纳米材料作为一种新兴的吸附材料,因其较大的吸附容量及多样化的结构越来越受到国内外学者的关注。
目前,国内外已有将纳米材料作为吸附剂用于As的去除的报道[4]。例如磁性氧化石墨烯[5-6]、零价铁[7-8]、磁性纳米铁氧化物[9-11]、纳米羟基磷灰石[12-14]、纳米钛氧化物[11]、纳米氧化铈、纳米球状氧化锆、纳米氧化铜、纳米锰化合物[15-16]。Chai等[9]研究了Fe3O4纳米薄片对水中As的去除,证实了其对水溶液中As(Ⅴ)有较好的去除效果,去除率可达90%。Hott等[2]研究了δ-FeOOH对水中As(Ⅲ)的吸附,得出吸附量为40.0 mg·g-1。吴少林等[17]研究表明,磁性纳米 Fe3O4·ZrO(OH)2对溶液中总 As的吸附量可达 133 mg·g-1。王灿等[5]研究发现石墨烯负载零价纳米铁对As(Ⅲ)的最大吸附量为35.8 mg·g-1。周爽等[15]研究发现纳米级二氧化锰材料可以减少水稻中As的累积量,但不能影响As在水稻各时期各器官内的空间分布,即水稻中As的含量是根>茎>叶。Cantu等[18]研究了不同pH条件下纳米Fe7S8对As(Ⅲ)的吸附效果,在pH=4时吸附效果最好,吸附量可达14.3 mg·g-1。刘闯等[6]发现氧化石墨烯具有良好的吸附性能,且随着pH的升高,其对As(Ⅴ)的吸附性能下降。林丽娜等[19]研究发现生物炭-铁锰氧化物在浓度为0.016 0 g·mL-1时对As(Ⅲ)的去除率可达到82.6%,其吸附过程为内层专性吸附,材料表面的羟基官能团会与As(Ⅲ)发生配体交换和络合反应,从而达到较好的吸附效果。
本文旨在深入探究不同纳米材料对As(Ⅲ)的吸附差异,明确不同纳米材料的吸附效果与机制,筛选出经济有效、易于实施的纳米材料,为水体中As污染控制提供技术依据。
1 材料与方法
1.1 实验材料
多层氧化石墨烯(多层GO,≥96.0%,济宁利特纳米技术有限责任公司)、20 nm羟基磷灰石(P20,99.9%,北京德科岛金)、40 nm羟基磷灰石(P40,99.9%,北京德科岛金)、纳米零价铁(nFe,99.9%,北京德科岛金),采用NaAsO2配置As(Ⅲ)储备液。
1.2 实验仪器
主要仪器有双道原子荧光光度计(AFS-9760型,北京海光仪器有限公司);红外光谱仪(Magna-IR750 FTIR);能谱仪(Genesis Apollo X/XL);比表面积分析仪(Quantachrome,美国);元素分析仪(ElementarVario Macro EL,德国);双层恒温摇床(SKY-2102C)等。
1.3 试验方法
1.3.1 纳米材料的理化性质
通过比表面积分析仪测定不同纳米材料的比表面积及孔径[16],通过电位滴定法[20]测定其零电荷点,用元素分析仪测定纳米材料中的主要组成元素。对材料微区元素种类与含量进行扫描-电镜能谱分析(EDS),获得了纳米材料吸附As(Ⅲ)前后的晶体结构信息[21]。
1.3.2 吸附动力学
配制 500 mL As(Ⅲ)溶液,浓度为 50.0 mg·L-1,分别加入1.00 g纳米材料,冰浴超声分散30 min,置于恒温摇床上,(25±0.5)℃,180 r·min-1振荡,每隔一段时间取样 1.00 mL,所取样品一律用 0.45 μm(Milipore)过滤器过滤,重复3次。用双道原子荧光光度计测定四种纳米材料对As(Ⅲ)的吸附量。
1.3.3 不同用量对纳米材料吸附As(Ⅲ)的影响
配制 20.0 mL 浓度为 10.0 mg·L-1的 As(Ⅲ)溶液,加入不同用量纳米材料(冰浴超声分散30 min),(25±0.5)℃下振荡24 h,3次重复。过滤后用双道原子荧光光度计测定纳米材料对As(Ⅲ)的吸附量。
1.3.4 等温吸附
配制20.0mL一定浓度As(Ⅲ)溶液(5.00~50.0mg·L-1),加入 0.100 g纳米材料(冰浴超声分散 30 min),在(25±0.5)℃下振荡24h,3次重复。过滤后用双道原子荧光光度计测定纳米材料对As(Ⅲ)的吸附量。
1.3.5 不同pH对纳米材料吸附砷的影响
配制20.0 mL浓度为10.0 mg·L-1的As(Ⅲ)溶液,加入0.100 g纳米材料(冰浴超声分散30 min),用HCl和 NaOH 调节pH 至3~9,(25±0.5)℃下振荡 24 h,重复3次。过滤后用双道原子荧光光度计测定纳米材料对As(Ⅲ)的吸附量。
1.3.6 X射线光电子能谱(XPS)分析
采用X射线光源,高压14.0 kV,功率450 W,表征不同纳米材料表面的元素及各元素之间的化学键组成类型。
1.3.7 傅里叶红外光谱(FTIR)分析
将干燥的样品与KBr充分混合并研磨,然后倒入压片器中制成透明薄片,对不同纳米材料在400~4000 cm-1范围内进行傅里叶红外光谱分析。
1.4 数据处理
1.4.1 吸附动力学方程
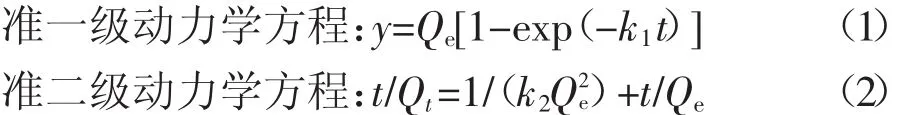
式中:t为吸附时间,min;Qe为平衡吸附量,mg·g-1;Qt为t时刻的吸附量,mg·g-1;k1,k2分别为两方程的系数。
1.4.2 粒子分散模型方程

式中:Kint表示粒子分散速率常数,mg·g-1·min-1/2;Ci表示界面层厚度。1.4.3去除率
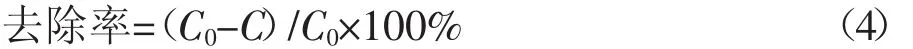
式中:C0为溶液的初始浓度,mg·L-1;C为吸附后溶液的浓度,mg·L-1。
1.4.4 等温吸附方程

式中:Qe表示平衡时吸附量,mg·g-1;Ce表示平衡后溶液中吸附质的质量浓度,mg·L-1;Qm表示 Langmuir吸附等温线的最大吸附容量,mg·g-1;kf、b、n 分别为相应模型中的常数。
数据采用 Excel、SPSS 16.0、Origin 8.5、XPSPEAK 41等软件进行处理。
2 结果与讨论
2.1 不同纳米材料的理化性质
由表1可以看出多层GO的比表面积远大于其他纳米材料,分别是P20的6.92倍,P40的13.2倍,nFe的67.5倍。本研究与张美华[22]、陈曦[23]等采用BET法测得的结果一致,即不同纳米材料比表面积存在较大差异。虽然本研究测得多层GO的比表面积较大,但远低于 GO 的理论值(2630 m2·g-1)[24],说明多层 GO 层积现象较为明显,导致其比表面积下降。羟基磷灰石的零电荷点未检测出是因为其表面始终带负电,朱婷婷[25]也得出了相似结论。
多层 GO 含有 C、O、Na、S等元素(图 1a),其中主要成分是C、O。多层GO有较大的比表面积,为金属离子提供了较多的附着位点,吸附As(Ⅲ)后出现了As吸收峰,其质量百分比为1.97%。此外,C、O的质量浓度均有小幅度下降。P20含有C、O、P、Ca等元素(图 1b),其中以 O、P、Ca居多。吸收 As(Ⅲ)后 O 含量减少,Ca、P含量增多,且图像变清晰,说明导电性增加,As(Ⅲ)的质量百分比为0.470%,相比多层GO少得多。P40所含元素与P20相一致,所吸附As(Ⅲ)的质量百分比为0.410%(图1c),其粒径较P20大,比表面积小于P20,吸附效果略低于P20,说明粒径大小也是影响材料吸附As(Ⅲ)的因素之一。吸附As(Ⅲ)后其导电性也有明显提高。nFe所含元素以C、O、Fe为主,此外还有少量的Mn(图1d)。吸附As(Ⅲ)后颗粒变饱满,一方面是表面附着了As(Ⅲ),另一方面是因为nFe极易聚沉形成团聚体,As(Ⅲ)的质量百分比为0.320%,是四种纳米材料中吸附效果最差的。通过表2可以看出在所选扫描范围内,不同纳米材料中As所占比例大小顺序为多层GO>P20>P40>nFe。
2.2 不同纳米材料的吸附动力学试验
吸附动力学是表明吸附平衡前,吸附质在固、液两相之间的分配规律。不同纳米材料吸附As(Ⅲ)的动力学存在明显差异(图2)。随着时间的延长,纳米材料对As(Ⅲ)的吸附量增加,且不同纳米材料达到吸附平衡的时间基本一致。不同纳米材料对As(Ⅲ)的吸附量在前200 min内均有迅速增加的趋势,此后增幅减小,大约在300 min达到平衡。各纳米材料吸附平衡后的吸附量有明显差异,其中多层GO达到吸附平衡时的吸附量稳定在17.0 mg·g-1左右,其余三种纳米材料均在3.00 mg·g-1以下。有研究[26]证实材料在吸附As(Ⅲ)后的动力学曲线与本研究有相同趋势,但达到吸附平衡的时间略有差异,可能的原因是材料的种类及粒径对吸附平衡时间产生了一定影响。

表1 不同纳米材料的基本理化性质Table 1 The physic-chemical characteristics of different nanomaterials

图1 不同纳米材料吸附As(Ⅲ)前后的EDS图Figure 1 The photo of EDS for As(Ⅲ)by different nanomaterials
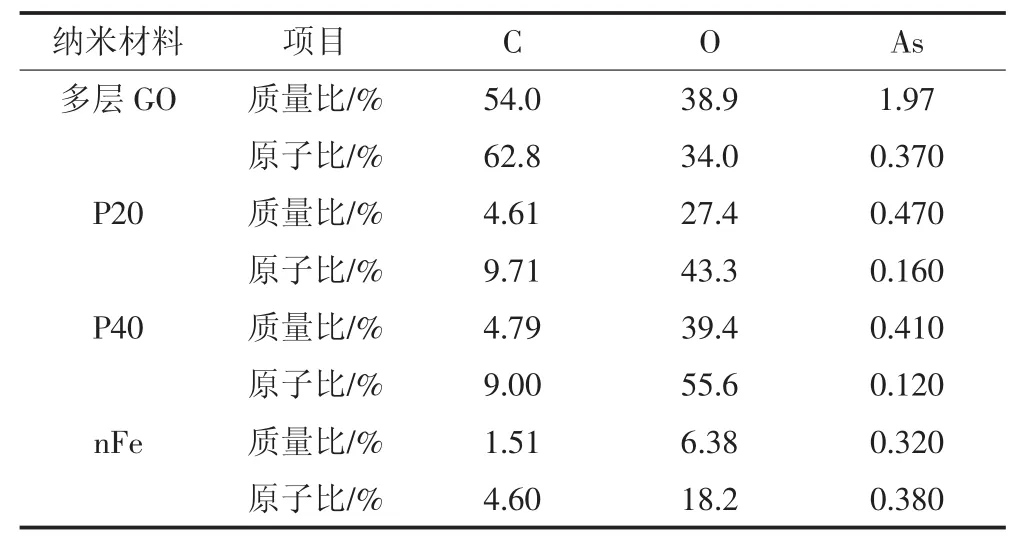
表2 不同纳米材料吸附As(Ⅲ)后的EDS能谱表Table 2 The element content for As(Ⅲ)adsorbed by different nanomaterials
用准一级、二级动力学模型及粒子分散模型对不同纳米材料的动力学吸附过程进行拟合(表3),可以看出准二级动力学模型对不同纳米材料的吸附过程的拟合度较高(R2>0.91),表明该过程限定吸附速率的条件主要是化学吸附过程。且吸附能力大小顺序为多层GO>P20>P40>nFe。
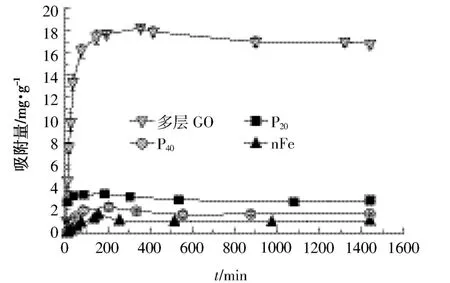
图2 不同纳米材料吸附As(Ⅲ)的动力学曲线Figure 2 The kinetics curve for As(Ⅲ)by different nanomaterials
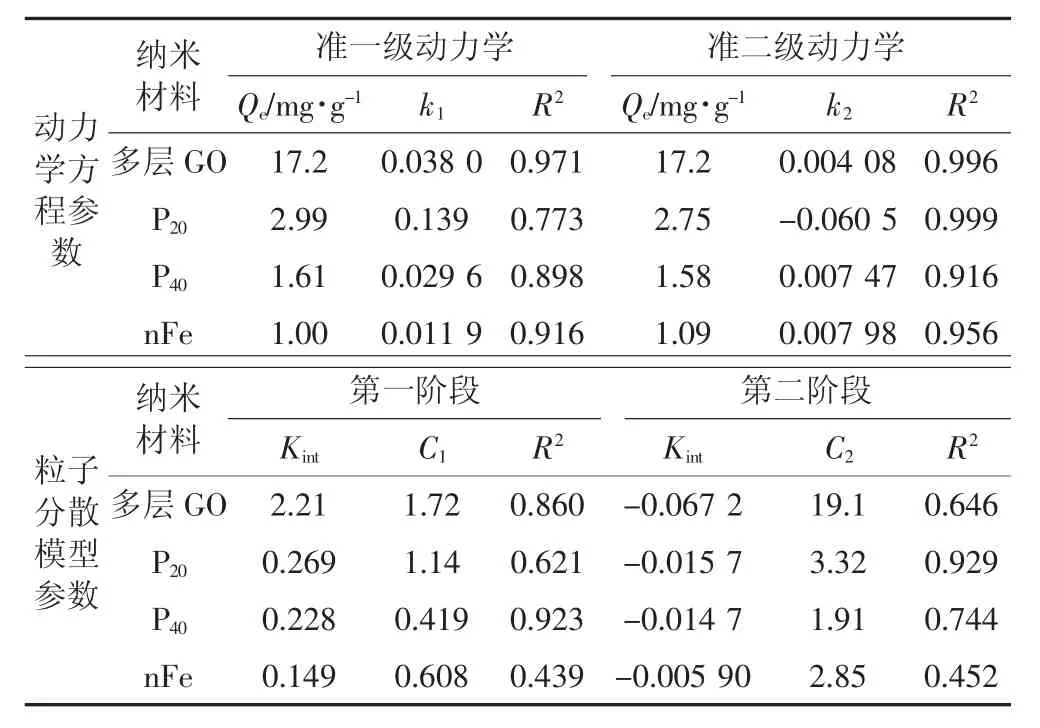
表3 不同纳米材料吸附As(Ⅲ)的动力学方程及粒子分散模型拟合参数Table 3 The kinetics equation and particle dispersion model parameters for As(Ⅲ)
而通过分析粒子分散模型参数发现界面层厚度对重金属吸附也有显著影响。可以看出,纳米材料吸附As(Ⅲ)的过程为多过程吸附,第一阶段其吸附量随着时间的增加而迅速增加,而后产生轻微负增长,最后趋于平衡,说明该吸附过程中包含颗粒内部的分散过程。C2>C1,可知第二阶段的界面层厚度对As(Ⅲ)的吸附影响减弱,说明扩散吸附并不是该吸附过程的唯一控制步骤。
综上所述,不同纳米材料对As(Ⅲ)的吸附过程是相当复杂的过程,包括材料表面的吸附和扩散、材料内部的吸附以及在水溶液中的聚沉平衡等,这与Huang等[26]研究结果一致。
2.3 不同用量条件下的砷吸附试验
不同纳米材料的不同用量对As(Ⅲ)的去除效果存在明显差异(P<0.05)(图3)。四种材料在选取的用量范围内有明显的吸附平衡趋势,在用量为0.800 g左右去除率均不再增大,分别为多层GO 50.2%、P2041.5%、P4023.3%、nFe 21.6%。有研究[8]表明不同材料对As(Ⅲ)的去除率有明显差异,随着吸附时间的增加,去除率均有不同程度的上升。本研究主要分析不同用量纳米材料在吸附时间为24 h时对As(Ⅲ)的去除差异,在相同用量相同吸附时间的条件下,各纳米材料对As(Ⅲ)的去除率大小顺序为多层GO>P20>P40>nFe。
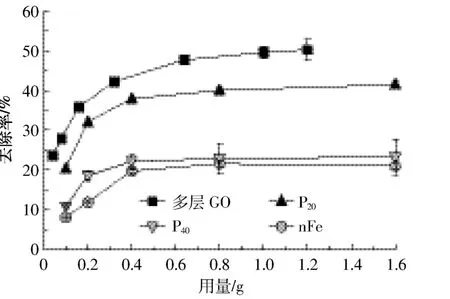
图3 不同纳米材料不同用量的吸附试验Figure 3 Removal rate of As(Ⅲ)adsorbed by different nanomaterials under the influence of different quantity
2.4 等温吸附试验
不同纳米材料对As(Ⅲ)的吸附能力不同(图4),在 As(Ⅲ)的平衡浓度接近 30.0 mg·L-1时,P20、P40、nFe对砷的吸附量接近饱和,其对As(Ⅲ)的吸附量稳定在1.00 mg·g-1左右。而多层GO在As(Ⅲ)的平衡浓度为40.0 mg·L-1以上时仍呈现上升趋势,在所选浓度范围内其对As(Ⅲ)的吸附尚未达到吸附平衡。分别用Langmuir方程和Freundlich方程进行拟合,决定系数R2均在0.920以上,拟合效果较好(表4)。有研究[3]表明Langmuir方程拟合效果普遍优于Freundlich方程,这与表3结果一致,说明各纳米材料对As(Ⅲ)的吸附机制主要是均匀介质表面的单层吸附。不同纳米材料对As(Ⅲ)的饱和吸附量大小顺序为多层GO>P20>P40>nFe。
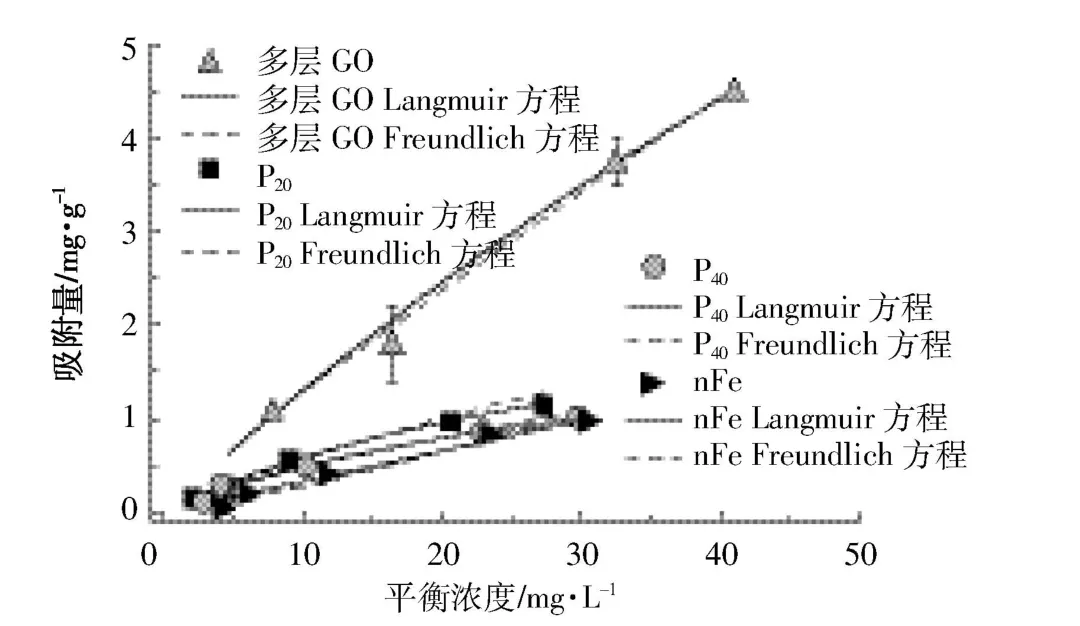
图4 不同纳米材料对As(Ⅲ)的等温吸附曲线Figure 4 Adsorption isotherms of As(Ⅲ)adsorbed by different nanomaterials

表4 Langmuir方程和Freundlich方程拟合参数Table 4 Langmuir equation and Freundlich equation
2.5 不同pH条件下的砷吸附试验
pH是影响As(Ⅲ)在环境中迁移转化的一个非常重要的因素。通过对不同pH条件下的水环境中As(Ⅲ)的吸附,发现不同纳米材料间是有显著差异的(P<0.05)(图 5)。多层 GO 对As(Ⅲ)吸附量随着 pH值的增大呈先增大后减小的趋势,在pH=6时吸附量达到最大,在pH=9时最小,这与Zhou等[21]研究结果一致;P20、P40对 As(Ⅲ)的吸附量呈先下降后上升的趋势;nFe对As(Ⅲ)的吸附量随pH值的变化趋势与多层GO相同,与P20、P40相反。这可能与pH值改变了纳米材料的形态有关,说明各材料的不同形态对As(Ⅲ)的吸附效果不同。P20、P40、nFe的吸附量均保持在0~1.00 mg·g-1,说明与多层GO相比其受pH值影响相对不大,可能的原因是三者对As(Ⅲ)的吸附受静电作用影响较小[27]。
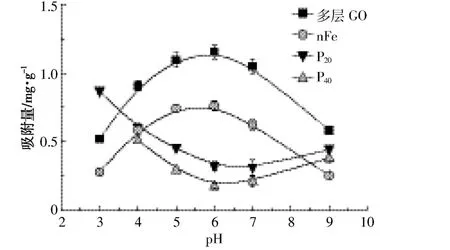
图5 不同pH条件下纳米材料对As(Ⅲ)的吸附量Figure 5 Adsorbing As(Ⅲ)by different nanomaterials under the influence of pH
2.6 XPS分析

Figure 6 The XPS spectra of different nanomaterials on adsorbing As(Ⅲ)
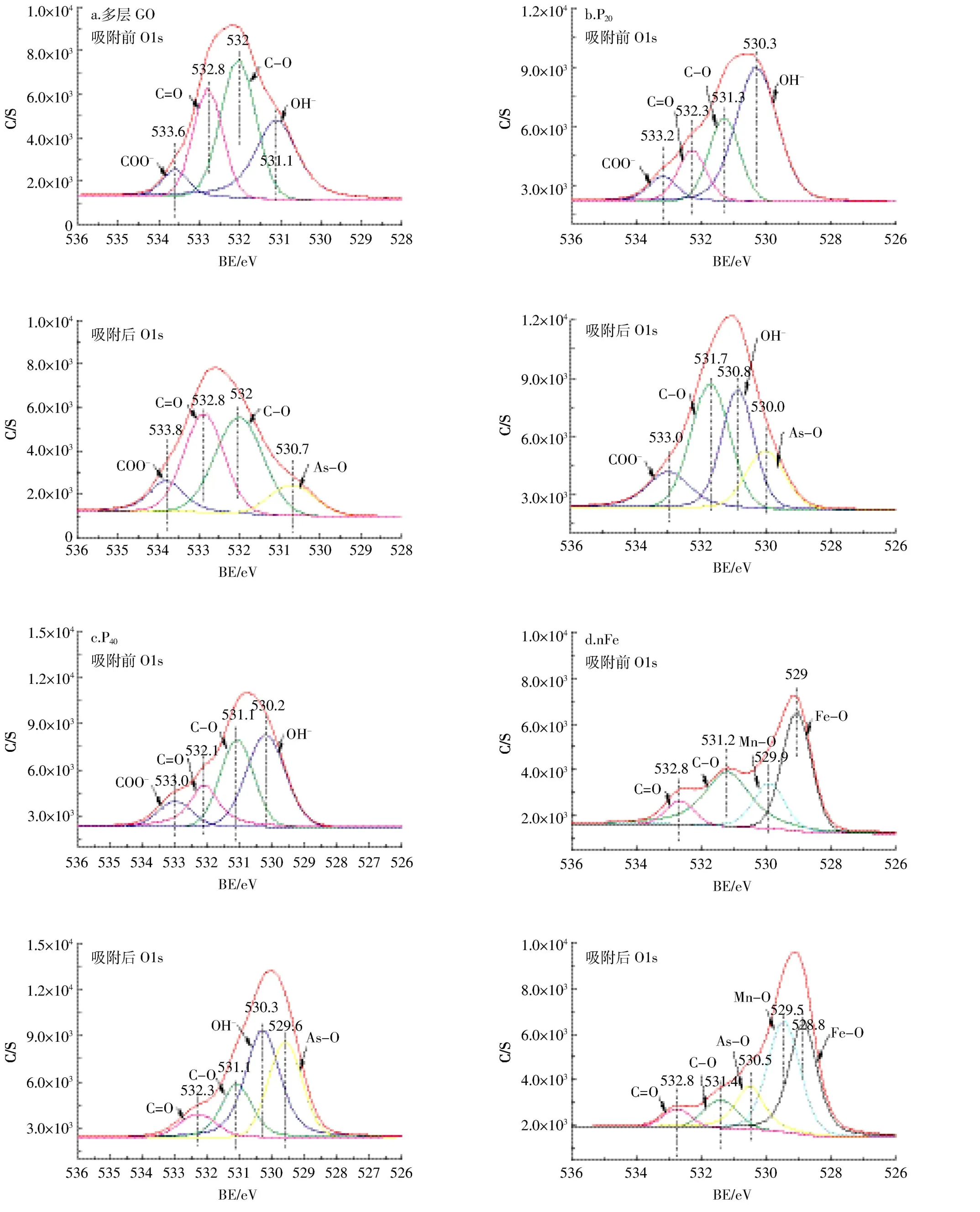
图7 不同纳米材料吸附As(Ⅲ)前后的O1s分峰图Figure 7 The peak figure of oxygen element for As(Ⅲ)by different nanomaterials
多层GO吸附As(Ⅲ)后峰强降低,其余三种纳米材料峰强均有不同程度的升高,其中nFe峰强升高最为明显,P20、P40峰强变化相对不大(图 6)。由 O1s的分峰图(图7)可以看出,多层GO吸附前官能团由左至右依次对应为 COO-、C=O、C-O、OH-,吸附后 OH-消失,并出现As-O[28],说明As可通过氧化反应与OH-的氧结合,从而附存于多层GO中。P20吸附As(Ⅲ)后C=O消失,As-O增加,而P40吸附As(Ⅲ)后则表现为COO-消失,As-O增加,说明As可以与碳氧双键中的氧结合,达到去除As的效果。nFe吸附As(Ⅲ)后表现为C-O、Fe-O减少,Mn-O增加,出现As-O官能团,有研究[19]表明Fe-O为活性官能团,可以通过络合作用包裹夹带As离子形成单齿配位体或双齿配位体,从而提高纳米零价铁对砷的吸附能力。对不同纳米材料吸附As(Ⅲ)后的As3d谱图进行分峰(图8)发现,多层 GO的 As(Ⅴ)、As(Ⅲ)所占比例分别是26.4%和73.6%,与Fantauzzi等[29]的研究结果一致,说明多层GO对As的氧化作用较小。P20与 P40中 As(Ⅴ)、As(Ⅲ)所占比例分别是41.4%、58.6%与45.1%、54.9%,说明羟基磷灰石促进了As(Ⅲ)的氧化。nFe中As(Ⅴ)和As(Ⅲ)所占比例分别是45.3%和54.7%,与其他三种材料相比,nFe对As(Ⅲ)的氧化作用最为明显。
2.7 FTIR分析
对不同纳米材料吸附As(Ⅲ)前后的傅里叶红外光谱图进行对比分析。其中,O-H的伸缩振动区在3400~3700 cm-1处,1832 cm-1处为 C=O,1523 cm-1处为 C=C 键[30]。多层 GO(图 9a)吸附 As(Ⅲ)后,官能团数量普遍增加,但增幅略小,O-H键无明显变化,C=O键数量有一定程度的增加,该现象说明吸附As(Ⅲ)后该材料发生了相应的化学变化,有研究[31]表明引起C=O峰变化的主要原因是羧基之间形成了氢键。P20(图9b)和P40(图9c)在吸附As(Ⅲ)后,3442 cm-1处有明显变化,且波动方向相反,P20羟基数量增加,P40则减小,说明材料的粒径可能会影响吸附As(Ⅲ)后官能团的数量,也说明了表面羟基在吸附过程中起了重要的作用,这与Saha等[31]研究结果相似,但二者的C=O键均无明显变化。nFe(图9d)在吸附As(Ⅲ)后的光谱波动范围较大,不同的官能团有不同的变化趋势,表现为O-H增多,C=O减少,有研究[23]表明零价铁极易发生氧化生成OH-,与本研究结果一致。
3 结论
(1)不同纳米材料所含元素有明显差异,且吸附As(Ⅲ)后As所占比例大小顺序为多层GO>P20>P40>nFe。其中多层GO吸附量(17.4 mg·g-1)远大于其他三种材料,P20对As(Ⅲ)的吸附量是P40的1.26倍,说明纳米材料种类和粒径是影响纳米材料吸附效果的因素。
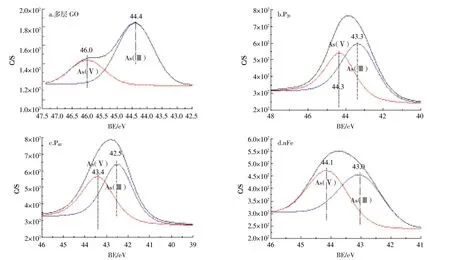
图8 不同纳米材料吸附As(Ⅲ)后的As3d分峰图Figure 8 The peak figure of As after adsorbing As(Ⅲ)by different nanomaterials
(2)不同纳米材料对As(Ⅲ)的吸附过程相当复杂,多层GO的吸附机制是以单层化学吸附为主、多层物化共吸附为辅的吸附反应,P20、P40、nFe吸附机制为材料表面的吸附及含氧官能团与As(Ⅲ)发生络合等反应的吸附。
(3)纳米材料吸附As后,As(Ⅴ)含量小于As(Ⅲ),不同纳米材料表面官能团数量和组成均发生明显变化,表面官能团在吸附过程中起了重要作用。
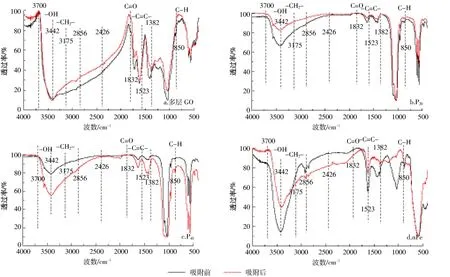
图9 不同纳米材料吸附As(Ⅲ)的FTIR图Figure 9 The FTIR spectra of adsorption of As(Ⅲ)
[1]Islam A,Maity J,Bundschuh J,et al.Arsenic mineral dissolution and possible mobilization in mineral-microbe-groundwater environment[J].J Hazard Mater,2013,262:989-996.
[2]Hott R,Andrade T,Santos M,et al.Adsorption of arsenic from water and its recovery as a highly active photocatalyst[J].Environ Sci Pollut Res Int,2016,23(21):21969-21979.
[3]林丽娜,黄 青,廉 菲,等.腐植酸及pH对生物炭-铁锰氧化物复合材料吸附As(Ⅲ)的影响机理[J].农业环境科学学报,2017,36(2):387-393.
LIN Li-na,HUANG Qing,LIAN Fei,et al.Effect of humic acid and pH on the adsorption of arsenic(Ⅲ)on biochar-ferro manganese oxide composite material[J].Journal of Agro-Environment Science,2017,36(2):387-393.
[4]Onnby L,Svensson C,Mbundi L,et al.Gamma-Al2O3-based nanocomposite adsorbents for arsenic(Ⅴ)removal:Assessing performance,toxicity and particle leakage[J].Sci Total Environ,2014,473/474:207-214.
[5]王 灿.石墨烯负载零价纳米铁去除水中砷的研究[D].广州:华南理工大学,2014.
WANG Can.Removal of As(Ⅲ)and As(Ⅴ)from aqueous solutions using nanoscale zero valent iron-reduced graphite oxide modified composites[D].Guangzhou:South China University of Technology,2014.
[6]刘 闯,黄力群,谢 毅,等.磁性氧化石墨烯同时吸附砷(Ⅴ)和镉的性能研究[J].环境工程,2015,33(S1):165-169.
LIU Chuang,HUANG Li-qun,XIE Yi,et al.Adsorptive behaviors of magnetic graphene oxide nanocomposite towards arsenic(Ⅴ)and cadmium[J].Environmental Engineering,2015,33(S1):165-169.
[7]何 菁,尹光彩,李莲芳,等.骨炭/纳米铁对污染红壤中砷形态和有效性的影响研究[J].农业环境科学学报,2014,33(8):1511-1518.
HE Jing,YIN Guang-cai,LI Lian-fang,et al.Effects of bone char and nano-iron on fractions and availability of arsenic in contaminated red soils[J].Journal of Agro-Environment Science,2014,33(8):1511-1518.
[8]周娟娟,李战军.活性炭/纳米零价铁复合吸附剂的制备及对砷的去除应用[J].环境科学与管理,2012,37(10):106-108.
ZHOU Juan-juan,LI Zhan-jun.Preparation of activated carbon/nano zero-valent iron hybrid absorbents and its application in as removal[J].Environmental Science and Management,2012,37(10):106-108.
[9]Chai D L,Chu Z B,Yang B J,et al.Adsorption of arsenic from aqueous solution with nano-particles of magnetite black[J].Journal of the Chinese Ceramic Society,2011,39(3):419-423.
[10]Pardo T,Martinez-Fernandez D,Fuente C,et al.Maghemite nanoparticles and ferrous sulfate for the stimulation of iron plaque formation and arsenic immobilization in Phragmites australis[J].Environ Pollut,2016,219:296-304.
[11]Beduk F.Superparamagnetic nanomaterial Fe3O4-TiO2for the removal of As(Ⅴ)and As(Ⅲ)from aqueous solutions[J].Environ Technol,2016,37(14):1790-1801.
[12]侯惠娟,吴 兰.羟基磷灰石磁性复合材料用于水中砷(Ⅴ)的吸附[J].化学研究与应用,2011,23(11):1514-1519.
HOU Hui-juan,WU Lan.Iron oxide/hydroxyapatite composite for adsorption of arsenic(Ⅴ)in aqueous system[J].Chemical Research and Application,2011,23(11):1514-1519.
[13]翟倩倩,赵士贵,王孝海,等.仿生纳米含硅羟基磷灰石的合成与表征[J].无机材料学报,2013,28(1):58-62.
ZHAI Qian-qian,ZHAO Shi-gui,WANG Xiao-hai,et al.Synthesis and characterization of bionic nano-silicon-substituted hydroxyapatite[J].Journal of Inorganic Materials,2013,28(1):58-62.
[14]宋正国,唐世荣,丁永祯,等.羟基磷灰石对棕壤和红壤铜吸附的影响[J].生态环境学报,2011,20(1):164-168.
SONG Zheng-guo,TANG Shi-rong,DING Yong-zhen,et al.Effect of hydroxyapatite on copper sorption in brown earth and red soil[J].Ecology and Environmental Sciences,2011,20(1):164-168.
[15]周 爽,彭 亮,雷 鸣,等.纳米级二氧化锰材料阻控土壤砷向水稻迁移的研究[J].环境科学学报,2015,35(3):855-861.
ZHOU Shuang,PENG Liang,LEI Ming,et al.Control of as soil-to-rice transfer(Oryza sativa L.)with nano-manganese dioxide[J].Acta Scientiae Circumstantiae,2015,35(3):855-861.
[16]于志红,黄一帆,廉 菲,等.生物炭-锰氧化物复合材料吸附砷(Ⅲ)的性能研究[J].农业环境科学学报,2015,34(1):155-161.
YU Zhi-hong,HUANG Yi-fan,LIAN Fei,et al.Adsorption of arsenic(Ⅲ)on biochar-manganese oxide composites[J].Journal of Agro-Environment Science,2015,34(1):155-161.
[17]吴少林,马 明,胡文涛.磁性纳米吸附剂Fe3O4·ZrO(OH)2的合成及对水中氟和砷的吸附性能[J].环境工程学报,2013,7(1):201-206.
WU Shao-lin,MA Ming,HU Wen-tao.Fluoride ions and As(Ⅲ/Ⅴ)removal from aqueous solutions using zirconium oxyhydrate embedded Fe3O4nanoparticle[J].Chinese Journal of Environmental Engineering,2013,7(1):201-206.
[18]Cantu J,Gonzalez L,Goodship J,et al.Removal of arsenic from water using synthetic Fe7S8nanoparticles[J].Chem Eng J,2016,290:428-437.
[19]林丽娜,黄 青,刘仲齐,等.生物炭-铁锰氧化物复合材料制备及去除水体砷(Ⅲ)的性能研究[J].农业资源与环境学报,2017,34(2):182-188.
LIN Li-na,HUANG Qing,LIU Zhong-qi,et al.Preparation of biocharferro manganese oxide composite material and properties of removal of arsenic(Ⅲ)from aqueous solution[J].Journal of Agricultural Resources and Environment,2017,34(2):182-188.
[20]刘振中,邓慧萍.负载铁锰氧化物的活性炭除砷酸盐的性能研究[J].哈尔滨工业大学学报,2010,42(8):1317-1322.
LIU Zhen-zhong,DENG Hui-ping.Arsenate removal performance on GAC impregnated with Fe-Mn oxide[J].Journal of Harbin Institute of Technology,2010,42(8):1317-1322.
[21]Zhou Q X,Zheng Z W,Xiao J P,et al.Sensitive determination of As(Ⅲ)andAs(Ⅴ)bymagneticsolidphaseextractionwithFe@polyethyleneimine in combination with hydride generation atomic fluorescence spectrometry[J].Talanta,2016,156/157:196-203.
[22]张美华.羟基磷灰石的制备及其对有机物吸附行为的研究[D].济南:济南大学,2012.
ZHANG Mei-hua.Study on synthesis of hydroxyapatite and their adsorption of organic matter[D].Jinan:University of Jinan,2012.
[23]陈 曦.纳米零价铁及其与微生物联合修复多氯联苯污染土壤[D].浙江:浙江大学,2014.
CHEN Xi.Remediation of polvchlorinated biphenvls contaminated soil by nanoscale zerovalent iron or nZVI-microorganlsm integrated treatment[D].Zhejiang:University of Zhejiang,2014.
[24]Zhu Y,Murali S,Cai W,et al.Graphene and graphene oxide:Synthesis,properties,and applications[J].Adv Mater,2010,22(35):3906-3924.
[25]朱婷婷.不同类型羟基磷灰石的制备及其对重金属离子吸附行为的研究[D].济南:济南大学,2011.
ZHU Ting-ting.Study on synthesis,characterization of different types of hydroxyapatite and their adsorption of heavy metal ions[D].Jinan:U-niversity of Jinan,2011.
[26]Huang L H,Kong J J,Wang W L,et al.Study on Fe(Ⅲ)and Mn(Ⅱ)modified activated carbons derived from Zizania latifolia to removal basic fuchsin[J].Desalination,2012,286:268-276.
[27]王 静.锆基复合纳米材料的设计、制备及其对饮用水中氟、砷吸附性能的研究[D].合肥:中国科学技术大学,2014.
WANG Jing.Preparation and evaluation of zirconium-based materials for fluoride and arsenic removal from water[D].Hefei:University of Science and Technology of China,2014.
[28]Ma Y Q,Qin Y W,Zheng B H,et al.Arsenic release from the abiotic oxidation of arsenopyrite under the impact of waterborne H2O2:A SEM and XPS study[J].Environ Sci Pollut Res,2016,23(2):1381-1390.
[29]Fantauzzi M,Licheri C,Atzei D,et al.Arsenopyrite and pyrite bioleaching:EvidencefromXPS,XRDandICPtechniques[J].AnalBioanal Chem,2011,401(7):2237-2248.
[30]范春辉,马宏瑞,花 莉,等.FTIR和XPS对沸石合成特性及Cr(Ⅲ)去除机制的谱学表征[J].光谱学与光谱分析,2012,32(2):324-329.
FAN Chun-hui,MA Hong-rui,HUA Li,et al.FTIR and XPS analysis of characteristics of synthesized zeolite and removal mechanisms for Cr(Ⅲ)[J].Spectroscopy and Spectral Analysis,2012,32(2):324-329.
[31]Saha S,Sarkar P.Differential pulse anodic stripping voltammetry for detection of As(Ⅲ)by Chitosan-Fe(OH)3modified glassy carbon electrode:A new approach towards speciation of arsenic[J].Talanta,2016,158:235-245.
The mechanism for arsenic(Ⅲ)adsorption from aqueous solutions via different nanomaterials
HUANG Qing1,2,LIN Li-na2,LI Fang-jun2,3,LIAN Fei2,LIU Zhong-qi2,SONG Zheng-guo2*
(1.School of Land and Environment,Shenyang Agriculture University,Shenyang 110866,China;2.Agro-Environmental Protection Institute,Ministry of Agriculture,Tianjin 300191,China;3.School of Resource and Environment,Jilin Agricultural University,Changchun 130118,China)
Batch sorption experiments were conducted to investigate the adsorption of arsenic(Ⅲ)from aqueous solution via multilayer graphene oxide(multilayer GO),20 nm hydroxylapatite(P20),40 nm hydroxylapatite(P40),and nano zerovalent iron(nFe).The results showed significant differences(P<0.05)in the adsorption capacity of the different nanomaterials for arsenic(Ⅲ).The order of absorptivity of these nanomaterials for arsenic(Ⅲ)was multilayer GO(17.4 mg·g-1)>P20(2.74 mg·g-1)>P40(2.17 mg·g-1)>nFe(0.976 mg·g-1).The absorptivity of multilayer GO was 17.8 times that of nFe.Through characterization of the different nanomaterials using Energy-dispersive X-ray Spectroscopy(EDS),X-ray Photoelectron Spectroscopy(XPS),and Fourier Transform Infrared Spectroscopy(FTIR),it was confirmed that the adsorption mechanism of multilayer GO included chemical adsorption and physical adsorption,whereas the adsorption mechanisms of P20,P40,and nFe consisted of coagulation adsorption and complexation of oxygen-containing functional groups.
nanomaterials;arsenic;adsorption;graphere oxide;hydroxylapatite;nano zerovalent iron
X52
A
1672-2043(2017)11-2322-10
10.11654/jaes.2017-0595
黄 青,林丽娜,李昉峻,等.不同纳米材料对As(Ⅲ)的吸附机制[J].农业环境科学学报,2017,36(11):2322-2331.
HUANG Qing,LIN Li-na,LI Fang-jun,et al.The mechanism for arsenic(Ⅲ)adsorption from aqueous solutions via different nanomaterials[J].Journal of Agro-Environment Science,2017,36(11):2322-2331.
2017-04-24 录用日期:2017-07-25
黄 青(1992—),女,山东潍坊人,硕士研究生,主要从事重金属污染土壤的生物化学修复研究。E-mail:953185873@qq.com
*通信作者:宋正国 E-mail:forestman1218@163.com
天津市应用基础与前沿技术研究计划项目(15JCZDJC33900);国家自然科学基金项目(41273136)
Project supported:Tianjin Research Program of Application Foundation and Advanced Technology(15JCZDJC33900);The National Natural Science Foundation of China(41273136)

