虎杖中白藜芦醇的酶法提取工艺研究
陶明宝,鄢玉芬,张乐,陈鸿平,陈林,刘友平
·炮制制剂·
虎杖中白藜芦醇的酶法提取工艺研究
陶明宝,鄢玉芬,张乐,陈鸿平,陈林,刘友平*
目的:优选虎杖中白藜芦醇的酶法提取工艺。方法:采用单因素和正交试验,以白藜芦醇的含量和浸膏得率为评价指标,对白藜芦醇的酶法提取工艺进行优化。结果:酶解法提取白藜芦醇的最佳条件为:酶种类为纤维素酶,酶用量0.6 %,酶解pH=5.0,酶解温度50 ℃,酶解时间36 h,酶解后的样品加入8倍量80 %乙醇,85 ℃(药液微沸)提取3次,每次2 h。原药材中白藜芦醇的含量为0.459 %,经酶解后白藜芦醇含量上升至1.773%,虎杖苷转移率为93.5 %。结论:优选的酶法提取工艺为工业化大生产提供了基础。
虎杖;白藜芦醇;酶法;提取工艺
虎杖为蓼科多年生草本植物虎杖(Polygonum cuspidatumSieb.et Zucc.)的干燥根及根茎,药用历史悠久。具有利湿退黄、清热解毒、散瘀止痛、止咳化痰的功效,主治湿热黄疸,淋浊,带下,风湿痹痛,痈肿疮毒,水火烫伤,经闭,癥瘕,跌打损伤,肺热咳嗽[1]。现阶段虎杖中的化学成分研究已经比较深入[2-3],虎杖中的化学成分主要有茋类化合物、蒽醌类化合物、黄酮类化合物、水溶性多糖、鞣质等成分[4]。以白藜芦醇为代表的茋类化合物具有抗菌、抗炎、 抗肿瘤、抗血栓、抗高血脂及抗氧化等活性[5-8],被广泛用于药品、保健品、化妆品及食品添加剂等行业[9-11]。
目前常用于白藜芦醇提取的方法有有机溶剂提取法、超声波提取法、微波辅助提取、超临界CO2萃取技术、酶解法等。研究表明,有机溶剂提取法操作简便易行、生产成本低,但溶剂消耗量较大、受热时间较长且提取效率不高[12-13]。超声波提取法其产生的空化现象能够加速药材中有效成分的溶出,但超声波提取法尚处于实验室小规模研究阶段,不能用于工业化大规模生产[14-16]。微波辅助提取法具有选择性高、操作时间短等优点,但微波辅助提取法具有明显的热效应且微波泄漏对工作者的身体危害较大[17]。超临界CO2萃取法具有高效、耗能少、绿色环保等优势,但技术含量要求较高,设备运行成本大,故很难投入大工业化生产[18]。采用酶解法提取虎杖中的白藜芦醇,其提取效率较高,但目前的酶解提取工艺中提取药材多为过筛虎杖细粉,工业化生产成本较高,提取溶剂为甲醇、丙酮等毒性较大的溶剂,易造成污染[19-22]。
综上,工业上对虎杖中的白藜芦醇开发力度较大,但现行的工艺和方法存在着含量低、生产周期长、生产成本相对较高、易造成资源浪费和环境污染等问题。酶解法能将白藜芦醇苷转化成白藜芦醇,从而有效提高白藜芦醇的产率且具有条件温和、反应产物较为单一、提取效率高、不易造成有限资源浪费和污染的特点[23-25]。本试验拟在目前酶解法研究的基础上,继续优化酶解法提取工艺,使其具有耗能少、高效、绿色环保、操作简便易行、生产成本低的优势,为酶解法提取虎杖中白藜芦醇的工艺产业化提供基础。
1 仪器与材料
YP1002电子天平(上海越平科学仪器有限公司),SQP型1/1万电子天平(赛多利斯科学仪器(北京)有限公司),PHS-3C型酸度计(上海越平科学仪器有限公司),HH-2数显恒温水浴锅(国华电器有限公司),UPT-I-10T优普系列超纯水器(成都超越科技有限公司),Agilent 1260 高效液相色谱仪(安捷伦科技有限公司),L-550台式低速离心机(长沙湘仪离心机仪器有限公司)。白藜芦醇对照品(11535-200502,供含量测定用,20 mg,中国药品生物制品检定所),虎杖提取用酶、纤维素酶(宁夏和氏璧生物技术有限公司),试剂均为分析纯。虎杖药材购自四川省巴中市,经成都中医药大学严铸云教授鉴定为蓼科属植物虎杖(Polygonum cuspidatum Sieb.et Zucc.)的干燥根和根茎。
2 方法与结果
2.1 白藜芦醇的含量测定
2.1.1 色谱条件 色谱柱:Kromasil-C18(200*4.6 mm,5 µm);流动相:乙腈-0.05 %磷酸水溶液(30∶70);检测波长:305 nm;流速:1 mL⋅min-1;柱温:30 ℃;进样量:10 µL。
2.1.2 对照品溶液配制 取白藜芦醇对照品适量,精密称定,加甲醇制成每1 mL含0.1004 mg的溶液,即得。
2.1.3 白藜芦醇含量测定 取虎杖粉末(过三号筛)约0.5 g,精密称定,置具塞锥形瓶中,精密加入甲醇40 mL,称定重量,在920 W下超声1 h,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,滤渣重复提取1次,合并提取液,取续滤液,即得。按“2.1.1”色谱条件测得白黎芦醇的含量为0.459 %,虎杖苷的含量为3.541 %。
2.1.4 标准曲线的制备 精密吸取白藜芦醇对照品溶液1,5,10,15,20 µL,注入液相色谱仪,按“2.1.1”项下色谱条件进行分析,记录色谱峰面积的积分值,以白藜芦醇进样量(μg)为横坐标(X),以测得峰面积积分值为纵坐标(Y),绘制标准曲线。回归方程为Y=7488.2X+28.986,r=0.9996,线性范围为0.1004~2.0080 μg。
2.1.5 精密度实验 在“2.1.1”项色谱条件下精密吸取同一浓度的白藜芦醇对照品溶液10 µL,连续进样6次,测定峰面积积分值,计算精密度。RSD为0.056 %,表明进样精密度良好。
2.1.6 稳定性实验 取同一样品溶液,分别在0、2、4、6、8、10、12 h测含量,结果样品在12 h内基本稳定,RSD为0.13 %。
2.1.7 重复性实验 精密称取同一批虎杖粉末6份,每份0.5 g,按“2.1.3”项下方法制备和“2.1.1”项下色谱条件进行测定,RSD为1.2 %。
2.1.8 加样回收率 精密称取已知白藜芦醇含量的虎杖粉末6份,每份0.25 g,精密加入浓度为0.4200 mg⋅mL-1白藜芦醇对照品溶液4 mL,按“2.1.3”项下方法制备和“2.1.1”项下色谱条件进行测定,计算回收率。白藜芦醇的平均回收率为103.1 %,RSD为2.3 %。见表1。
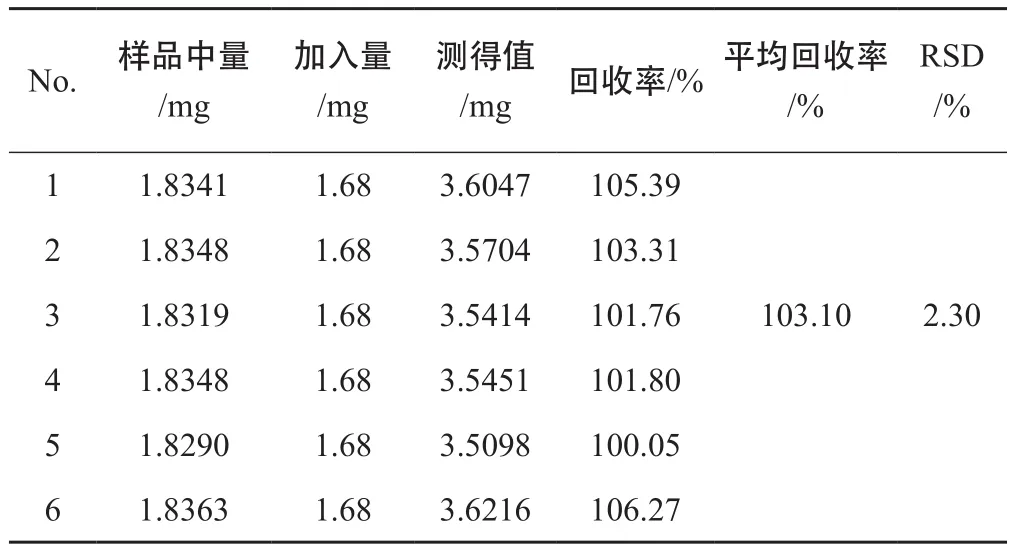
表1 加样回收率
2.2 计算
白藜芦醇的含量(%)=(白藜芦醇的质量/虎杖的质量)×100 %
浸膏得率(%)=(浸膏的质量/虎杖的质量)×100 %
虎杖苷转移率(%)=(被水解的虎杖苷的质量/虎杖药材中虎杖苷的质量)×100 %
2.3 白藜芦醇酶解工艺的优选研究
2.3.1 酶种类的筛选 目前,用于提取白藜芦醇的酶主要有纤维素酶、β-葡萄糖苷酶及多种复合酶。酶解法提取工艺中,纤维素酶酶解白藜芦醇提取率较高,应用广泛[20-21],复合酶中虎杖提取用酶白藜芦醇提取率较高[26]。故本试验主要比较纤维素酶、虎杖提取用酶和不加酶对白藜芦醇含量的影响。取虎杖粗粉50 g,依次为不加酶、加入药材质量0.3 %的纤维素酶、加入药材质量的0.3 %的虎杖提取用酶,所有样品均分别加入200 mL用盐酸调pH=5.0的酸水,50 ℃水浴酶解2 h,酶解后的样品进行醇提。醇提部分:酶解后的样品均分别加入8倍量80%乙醇,50 ℃水浴提取2 h,先粗过滤,再离心(3000 r⋅min-1,10 min),离心后得提取液。精密吸取2 mL提取液用甲醇稀释定容至10 mL,摇匀,滤过,取续滤液,即得,按“2.1.1”项下色谱条件测定白藜芦醇的含量,计算白藜芦醇的含量;精密吸取20 mL提取液至已恒重的蒸发皿中,水浴挥干,105 ℃烘箱烘至恒重,即得浸膏重量,计算浸膏得率。结果见表2。
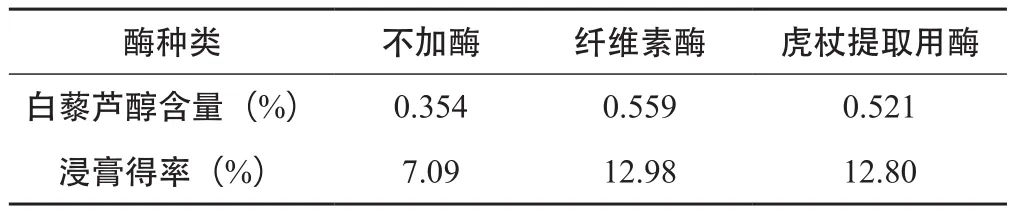
表2 酶种类的筛选(n=3)
由表2可知,酶解法白藜芦醇含量及浸膏得率明显高于不加酶的样品,故选择酶解法;其次,纤维素酶比虎杖提取用酶的白藜芦醇含量和浸膏得率高,故在此试验条件下,最佳的酶种类为纤维素酶。
2.3.2 酶用量的筛选 取虎杖粗粉50 g,依次加入药材质量的0.1 %、0.3 %、0.6 %、1.0 %的纤维素酶,所有样品均分别加入200 mL用盐酸调pH=5.0的酸水,50 ℃水浴酶解2 h,酶解后的样品按“2.2.1”项下醇提部分处理,结果见表3。
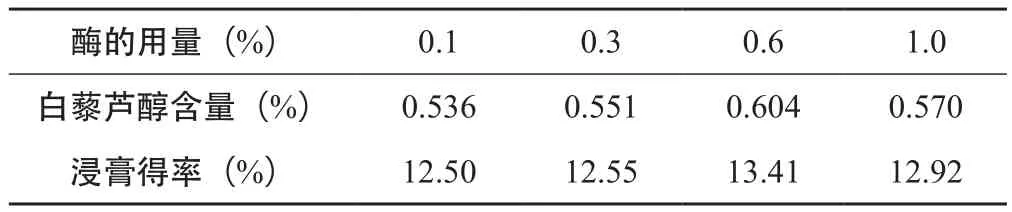
表3 酶用量的筛选(n=3)
由表3可知,白藜芦醇含量和浸膏得率随着酶用量的增加先增大后下降,当酶用量为0.6 %时达到最大值,故在此试验条件下,最佳的酶用量为药材质量的0.6 %。
2.3.3 酶解温度的筛选 取虎杖粗粉50 g,加入药材质量0.6 %的纤维素酶,所有样品均分别加入200 mL用盐酸调pH=5.0的酸水,依次分别30、40、50、60℃水浴酶解2 h,酶解后的样品按“2.2.1”项下醇提部分处理,结果见表4。
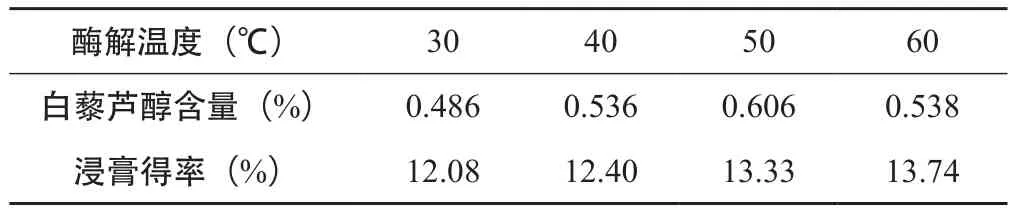
表4 酶解温度的筛选(n=3)
由表4可知,白藜芦醇含量和浸膏得率随着温度的升高先增大后下降,当温度为50 ℃时达到最大值,故在此试验条件下,最佳的酶解温度为50 ℃。
2.3.4 酶解pH值的筛选 取虎杖粗粉50 g,加入药材质量的0.6 %的纤维素酶,依次分别加入200 mL用盐酸调pH=4.0、pH=4.5、pH=4.8、pH=5.0、pH=5.5的酸水,50 ℃水浴酶解2 h,酶解后的样品按“2.2.1”项下醇提部分处理,结果见表5。
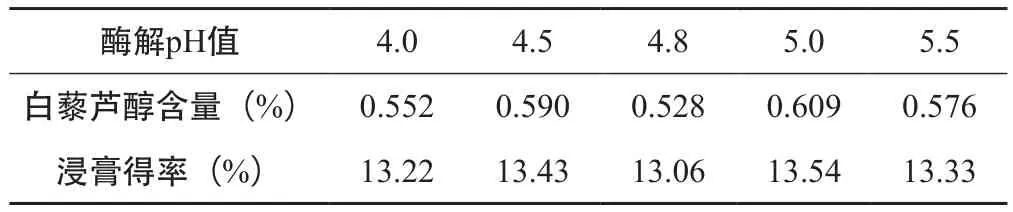
表5 酶解pH值的筛选(n=3)
由表5可知,白藜芦醇含量和浸膏得率随着pH值的升高先增大后下降,当pH=5.0时达到最大值,故在此试验条件下,最佳的酶解pH=5.0。
2.3.5 酶解时间的筛选 取虎杖粗粉50 g,加入药材质量的0.6 %的纤维素酶,所有样品均分别加入200 mL用盐酸调pH=5.0的酸水,依次50 ℃水浴酶解1、2、4、6、12、24、36、42、48 h,酶解后的样品按“2.2.1”项下醇提部分处理,结果见表6。

表6 酶解时间的筛选(n=3)
由表6可知,白藜芦醇的含量随酶解时间的增加先增大后下降,浸膏得率随酶解时间的增加逐渐增大,在12 h至48 h时,浸膏得率变化不大,当酶解时间为36 h时,白藜芦醇含量达到最大值,故在此试验条件下,最佳的酶解时间为36 h。
2.4 白藜芦醇醇提工艺的优选研究
2.4.1 醇提温度的筛选 白藜芦醇为二苯乙烯类化合物,难溶于水,易溶于乙醚、氯仿、甲醇、乙醇、乙酸乙酯、丙酮等有机溶剂[27]。乙醇与其他有机溶剂相比较,具有安全、廉价、绿色环保的优势,结合大工业生产的实际情况,故选择乙醇作为提取溶剂。取虎杖粗粉50 g,加入药材质量的0.6 %的纤维素酶,所有样品均分别加入200 mL用盐酸调pH=5.0的酸水,50 ℃水浴酶解36 h,酶解后的样品均分别加入8倍量80%乙醇,依次50、60、70、85 ℃(微沸状态)提取2 h,先粗过滤,再离心(3000 r⋅min-1,10 min),得提取液。取2 mL提取液用甲醇稀释定容至10 mL,摇匀,滤过,取续滤液,即得,按“2.1.1”项下色谱条件测定白藜芦醇的含量,计算白藜芦醇的含量;精密吸取20 mL提取液至已恒重的蒸发皿中,水浴挥干,105 ℃烘箱烘至恒重,即得浸膏重量,计算浸膏得率。结果见表7。
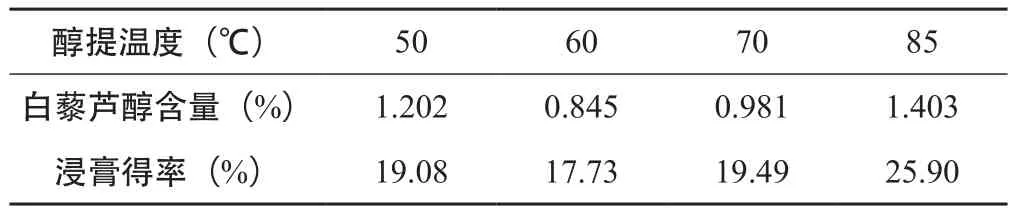
表7 醇提温度的筛选(n=3)
由表7可知,当醇提温度为85 ℃药液呈微沸状态时,白藜芦醇的含量和浸膏得率达到最大值,故在此试验条件下,最佳的醇提温度为85 ℃。
2.4.2 正交试验设计 取虎杖粗粉50 g,加入药材质量的0.6 %的纤维素酶,所有样品均分别加入200 mL用盐酸调pH=5.0的酸水,50 ℃水浴酶解36 h,酶解后的样品进行醇提工艺试验研究,醇提温度为85℃,选取4个因素:A乙醇浓度(%)、B乙醇用量(倍)、C提取时间、D提取次数,每个因素设3个水平,选用L9(34)正交表,以白藜芦醇含量(%)为指标进行试验。因素水平见表8,试验安排及结果见表9,方差分析见表10。
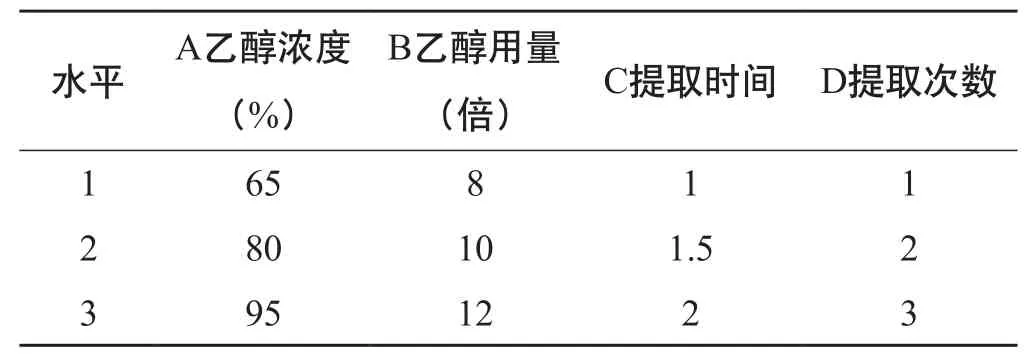
表8 虎杖药材中白藜芦醇醇提工艺正交试验因素水平
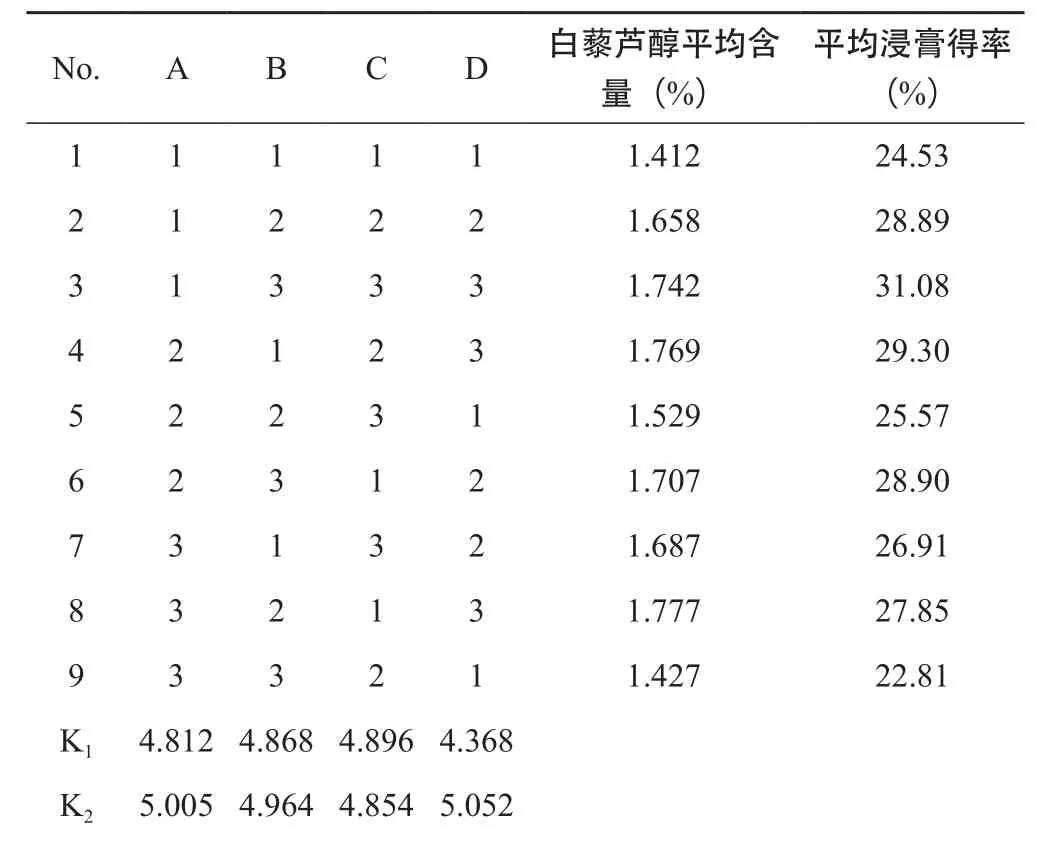
表9 虎杖药材中白藜芦醇醇提工艺正交试验安排及直观分析

K34.891 4.876 4.958 5.288 R0.193 0.096 0.104 0.920

表10 白藜芦醇提取量方差分析
由直观分析可知,影响虎杖中白藜芦醇含量的因素顺序为D>A>C>B。方差分析结果表明因素C,P<0.05,具有显著性影响,故选择C3;因素A、B和D,P>0.05,无显著性影响,结合大工业生产的实际情况,节约经济成本,故选择A2,B1,D3。对浸膏得率进行方差分析,结果表明因素A、B、C和D,P>0.05,均无显著性影响。综上,确定最优工艺条件为A2B1C3D3,即用8倍量80%乙醇提取3次,每次2 h。
2.5 验证试验
称取虎杖粗粉3份,按本实验条件下最佳提取工艺进行验证试验,结果白藜芦醇含量分别为1.766 %,1.775 %,1.779 %,平均含量为1.773 %,RSD值为0.39 %,说明优选的工艺条件稳定可行。
3 结论与讨论
虎杖中白藜芦醇酶法提取的最佳工艺为:取虎杖粗粉50 g,加入药材质量的0.6 %的纤维素酶,再加入200 mL用盐酸调pH=5.0的酸水,50 ℃水浴酶解36 h,酶解后的样品加入8倍量80%乙醇,85 ℃(药液微沸)回流提取3次,每次2 h。
传统的渗漉法、浸提法等具有操作简便易行、生产成本低的优点,但其在提取过程中费时长、溶剂用量大、浸液杂质多且提取率较低,而本试验优化的白藜芦醇酶解法提取工艺具有溶剂用量少(8倍量乙醇)、操作简便、高效、含量(1.773 %)相对较高的优势。
本实验在酶解工艺的优选中,研究发现酶解时间对白藜芦醇含量的影响较为显著,随着酶解时间的延长,白藜芦醇含量上升幅度较大,当酶解时间为36 h时,白藜芦醇含量达到最大值,继续增加酶解时间,白藜芦醇含量变化不大。原因是随着酶解时间的延长,纤维素与细胞壁接触充分,内容物溶出率增加;其次虎杖苷在纤维素酶的作用下被转化成白藜芦醇。目前,虎杖中白藜芦醇的提取工艺中多采用乙酸乙酯、甲醇、丙酮等有毒、易污染环境的有机试剂,且白藜芦醇提取含量仍较低。而本试验采用了安全、无毒、易回收的乙醇作为提取溶剂,具有节约经济成本、产品安全、绿色环保的优势。
目前酶解法所采用的酶种类较多,本试验在前人研究的基础上筛选出了酶解效果较好的纤维素酶和虎杖提取用酶,并进行了进一步的比较研究,结果纤维素酶的酶解效果较好;酶的说明书中酶解条件概括较为笼统,无最佳酶解条件,本试验结合说明书和实际情况对酶解条件进行了优化,使其既能发挥酶的最大效率又能适应大工业化生产。综上,本试验所优化的白藜芦醇酶法提取工艺是工业化生产白藜芦醇较为适宜的方法。
[1] 国家药典委员会.中华人民共和国药典[M].北京∶中国医药科技出版社,2015∶208.
[2] 王昌瑞,徐溢,张子春,等.虎杖的提取分离和纯化技术研究新进展[J].中成药,2012,34(02)∶335.
[3] 孔晓华,周玲芝.中药虎杖的研究进展[J].中医药导报,2009,15(05)∶107.
[4] 李萍.虎杖及其化学成分的质量控制[J].齐鲁药事,2011,30(4)∶232.
[5] Aggarwal BB,Bhardwaj A,Aggarwal RS,et all.Role of resveratrol in prevention and therapy of cancer∶ preclinical and clinical studies[J].Anticancer Research,2004,24(5A) ∶ 2783.
[6] Shankar S,Singh G,Srivastava RK.Chemoprevention by resveratrol∶ molecular mechanisms and therapeutic potential[J].Frontiers in Bioscience,2007,12∶4839.
[7] Chang JS,Liu HW,Wang KC,et all.Ethanol extract of Polygonum cuspidatum inhibits hepatitis B virus in a stable HBV-producing cell line[J].Antiviral Research,2005,66(01)∶29.
[8] Hung LM,Chen JK,Huang SS,et al.Cardioprotective effect of resveratrol, a natural antioxidant derived from grapes[J].Cardiovascular Research,2000,47(03)∶549.
[9] 程梦婷.虎杖中白藜芦醇的研究进展[J].山西农经,2014,(02)∶107.
[10] Rodriguez-Delgado MA,Gonzalez G,Perez-Trujillo JP,et al.Trans-resveratrol in wines from the Canary Islands(Spain).analysis by high performance liquid chromatography[J].Food Chemistry,2002,76(03)∶371.
[11] Kolouchova-Hanzlikova Irena,Melzoch Karel,Filip Vladimir,et al.Rapid method for resveratrol determination by HPLC with electrochemical and UV detections in wines[J].Food-Chemistry,2004,87(01)∶151.
[12] 王利洁,李建利,施明毅,等. 星点设计-效应面法优化虎杖中白藜芦醇的提取工艺[J]. 世界科学技术-中医药现代化,2014,16(05)∶1193.
[13] 尚天翠. 碱提酸沉法提取虎杖中白藜芦醇的研究[J].安徽农学通报,2015,21(01)∶25.
[14] 常永芳,刘志强,冯俊霞,等.虎杖中白藜芦醇的超声提取条件优化[J].江苏农业科学,2012,40(3),241.
[15] Chen BY,Kuo CH,Liu YC,et al.Ultrasonic-Assisted Extraction of the Botanical Dietary Supplement Resveratrol and Other Constituents of Polygonum cuspidatum[J].Journal of Natural Products,2012,75(10)∶1810.
[16] 宋宏新,刘 静,柏红梅,等.酶法转化制备虎杖中的白藜芦醇[J].食品科技,2009,34(9)∶202.
[17] Shengjiu GU,Meibo LI,Tinting ZHAO,et al.Microwaveassisted Extraction of Resveratrol from Polygonum cuspidatum[J].Medicinal Plant,2014,5(01)∶1.
[18] 方耀平,秦郁文,唐富丽,等.均匀设计法优化白藜芦醇超临界CO2流体萃取工艺[J].中国药业,2014,23(10)∶47.
[19] 王林,何宗琴,郑在,等.酶法提取虎杖中白藜芦醇的工艺优化[J].安徽农业科学,2013,41(8)∶3339.
[20] 叶秋雄,黄苇.虎杖中白藜芦醇提取工艺研究[J].现代食品科技,2013,29(6)∶1324.
[21] 周炳贤.从虎杖中酶法提取白藜芦醇的工艺研究[D].重庆大学,2014.
[22] 孙勇民,岳鹍,王芃.复合酶法提取虎杖中白藜芦醇的工艺研究[J].食品研究与开发,2013,34(17)∶34.
[23] 赵鸿宾,陈华国,龚小见,等.酶解法提取虎杖中的白藜芦醇[K].贵州师范大学学报(自然科学版) ,2010,28(2)∶104.
[24] 胡晓佳.虎杖中白藜芦醇提取方法研究及四川五地样品的含量测定[D].四川农业大学,2006.
[25] 曹庸.虎杖中白藜芦醇提取、纯化技术研究[D].湖南农业大学,2001.
[26] 陈蓉蓉,姜华,蒲含林.酶解法制备白藜芦醇的工艺优化[J].中国食品添加剂,2011,(05)∶64.
[27] 周慧恒,杨胜敖,杨秀勋,等.白藜芦醇提取工艺及检测方法研究进展[J].食品与发酵科技,2014,50(05)∶83.
Optimization of enzymatic process of resveratrol in Huzhang
/TAO Ming-bao, YAN Yu-fen, ZHANG Le, CHEN Hongping, CHEN Lin, LIU You-ping//(School of Pharmacy, Chengdu University of Traditional Chinese Medicine; Key Laboratory of Standardization for Chinese Herbal Medicine, Ministry of Education; National Key Laboratory Breeding Base of Systematic Research, Development and Utilization of Chinese Medicine Resources, Chengdu 611137, Sichuan)
Objective:The paper was to optimize the extraction process of resveratrol from Huzhang by enzymatic method.Method:The enzymatic extraction process of resveratrol was optimized by single factor and orthogonal test. The content of resveratrol and the yield of extract were used as evaluation indexes.Result:The optimal conditions for the extraction of resveratrol by enzyme digestion were as follows∶ 0.6 % cellulose, enzymolysis pH 5.0, temperature 50 ℃, time 36 h. Sample after enzymolysis was added 8 times 80 % ethanol and extracted 3 times (2 h each time) at 85 ℃ water bath. The content of resveratrol in Huzhang was 0.459 %, and the content of resveratrol increased to 1.773 % after enzymolysis. The translocation rate of polydatin was 93.5 %.Conclusion:The optimized enzymatic extraction process provides the basis for industrialized production.
Huzhang; resveratrol; enzymatic method; extraction process
R 283
A
1674-926X(2017)06-009-05
四川省中医药管理局扶贫项目(31966501)
成都中医药大学 药学院,中药材标准化教育部重点实验室,四川省中药资源系统研究与开发利用重点实验室—省部共建国家重点实验室培育基地,成都 611137)
陶明宝(1992-),女,在读硕士,从事中药化学成分与质量标准化研究。Tel∶18728431648 Email∶2587578725@qq.com
刘友平(1964-),女,博士生导师,从事中药化学成分与质量标准化研究。Tel∶(028)61800103 Email∶ liuyouping@163.com
2017-06-06
(责任编辑:何瑶)

