葛根素对人胰腺癌PANC-1细胞增殖凋亡的影响
刘银莉,王 营
葛根素对人胰腺癌PANC-1细胞增殖凋亡的影响
刘银莉1,王 营2*
目的探讨葛根素对人胰腺癌细胞株PANC-1的作用及其机制。方法取对数生长期的PANC-1细胞,分别用不同浓度的葛根素(0、50、100、200 μmol/L)干预48 h后,利用CCK-8检测PANC-1细胞增殖水平;Annexinv-FITC/PI双染流式细胞术检测细胞凋亡;Western blot检测Fas、Fas-L、Bax、Bcl-2、Caspase-7表达水平。结果葛根素对胰腺癌PANC-1细胞增殖的抑制呈浓度依赖性;不同浓度的葛根素干预PANC-1细胞48 h后,细胞凋亡率分别为2.47%±0.64%、6.37%±0.71%、8.33%±0.90%、12.40%±1.01%,实验组与对照组相比,差异均有统计学意义(P<0.01);Western blot实验表明,葛根素对胰腺癌PANC-1细胞干预48 h后,随着葛根素浓度的增加,细胞中Fas、Fas-L、Caspase-7、Bax蛋白的表达量上调,Bcl-2的表达量下调,实验组与对照组相比,差异均有统计学意义(P<0.05)。结论葛根素可通过激活Fas/Fas-L信号通路诱导PANC-1细胞增殖抑制和凋亡。
葛根素;PANC-1细胞;增殖;凋亡;Fas/Fas-L
0 引言
胰腺癌是临床上常见的恶性肿瘤,据统计,胰腺癌的死亡率与发病率的比例为0.99∶1。在我国,近十年来胰腺癌的发病率居恶性肿瘤的第6~7位[1]。胰腺癌患者的中位生存时间为3~5个月,1年生存率<10%[2]。该病早期不易发现、无化学预防手段、早期易复发和转移,80%以上的胰腺癌就诊时已无法手术切除。葛根素是从豆科葛属植物野葛、甘葛藤根中提取的一种异黄酮苷成分,临床上主要用于心脑血管疾病,如冠状动脉粥样硬化性心脏病、心绞痛、心肌梗死;缺血性脑血管病,如脑血管痉挛;眼底病,如视网膜动静脉阻塞、视神经萎缩等。近年来发现其在肿瘤方面发挥一定的作用[3-5]。本文以胰腺癌为靶细胞,初步探讨葛根素对人胰腺癌的作用及机制。
1 材料与方法
1.1 药品与试剂 人胰腺癌细胞株PANC-1(徐州医科大学消化科实验室冻存);葛根素(上海源叶生物科技有限公司,批号:B20446,纯度>99%);DMEM培养基(HyClone公司);青霉素、链霉素(美国Gibco公司);DMSO(上海碧云天生物技术研究所);胎牛血清(杭州四季青公司);胰蛋白酶(美国Gibco公司);6孔培养板(美国Thermo公司);96孔培养板(美国Thermo公司);CCK-8试剂盒(微科曼得生物工程有限公司);Annexin V-FITC/P双染细胞凋亡试剂盒(江苏凯基生物公司,货号:KGA107);细胞周期检测试剂盒(江苏凯基生物公司,货号:KGA512);GAPDH抗体(美国CST公司);Fas抗体(美国Affinity公司);Fas-L抗体(美国Affinity公司);Bcl-2抗体(英国Abcam公司);Bax抗体(英国Abcam公司);Caspase-7(美国CST公司);RIPA蛋白裂解液(强)、蛋白酶抑制剂cocktail、Western blot凝胶制备试剂盒、BCA蛋白定量试剂盒(上海碧云天生物技术研究所)。
1.2 仪器 恒温CO2细胞培养箱(德国Heraeus公司);倒置显微镜(日本Olympus公司);SEAC全自动酶标仪(北京西亚克技术有限公司);流式细胞仪(美国Becton Dickinso公司);Western blot电泳仪(美国Bio-Rad公司)。
1.3 方法
1.3.1 细胞培养 将冻存的PANC-1细胞解冻后,置于含有10%胎牛血清的DMEM培养液中,加入青霉素(100 U·mL/L)和链霉素(100 U·mL/L),在37 ℃、5% CO2饱和湿度培养箱中培养。1~2 d更换培养基,观察细胞约80%~90%融合时,用0.25%胰蛋白酶消化传代,取对数生长期的细胞用于实验。
1.3.2 CCK8法检测细胞增殖抑制率 调整细胞悬液浓度为4×104/mL,接种到96孔板,每孔200 μL,24 h后细胞贴壁,弃去培养基,每孔分别加入100 μL不同浓度(0、50、100、200 μmol/L)的葛根素溶液、0.5% DMSO溶剂,每组设5个复孔,并分别以PBS液为空白对照,置于培养箱中培养48 h后,弃上清,每孔加入100 μL培养液和10 μL CCK-8溶液,继续放于培养箱中培养2 h后,使用酶标仪测定在450 nm处每孔的吸光光度值(OD),并根据OD值计算细胞增殖抑制率。细胞增殖抑制率(%)=1-(实验组OD-空白孔OD)/(对照组OD-空白孔OD)。本实验步骤重复3次。
1.3.3 流式细胞术检测细胞凋亡率 取对数生长期的细胞,以2×105/mL的PANC-1细胞密度接种到6孔板,24 h后加入不同浓度的葛根素(0、50、100、200 μmol/L),常规条件(37 ℃、5% CO2饱和湿度)下培养,48 h后收集细胞并用PBS冲洗,根据Annexin V-FITC/PI细胞凋亡检测试剂盒说明书操作,上机测定凋亡率。
1.3.4 Western blot检测Fas/Fas-L信号通路相关蛋白的表达 实验分为4个组:空白对照组,50、100、200 μmol/L葛根素给药组。各组细胞培养48 h后,提取细胞总蛋白,常规行10%SDS-PAGE电泳分离,转移至活化的PVDF膜上,封闭液封闭2 h,加一抗Fas(1∶1 000)、Fas-L(1∶1 000)、Caspase-7(1∶1 000)、Bax(1∶500)、Bcl-2(1∶500)、GAPDH(1∶5 000)4 ℃孵育过夜。TBST溶液洗膜3次,加辣根过氧化物酶标记二抗(1∶8 000),室温孵育l h,ECL法发光显色。GAPDH作为内参照。计算机扫描图像,检测各条带面积灰度值,以各组目的蛋白与自身GAPDH灰度值比值作为各组细胞中蛋白的相对含量。每组样本重复检测3次。
2 结果
2.1 葛根素对胰腺癌PANC-1细胞增殖的影响 CCK-8检测结果显示:溶剂对照组(0.5% DMSO)对胰腺癌PANC-1细胞的抑制作用与空白对照组相比,差异无统计学意义(P<0.05),表明0.5% DMSO对胰腺癌PANC-1无增殖抑制作用。不同浓度的葛根素(0、50、100、200 μmol/L)作用于胰腺癌PANC-1细胞48 h后,细胞增殖抑制率分别为0、13.83%±0.03%、36.94%±0.03%、62.00%±0.08%。见图1。

图1 葛根素对胰腺癌PANC-1细胞增殖的抑制率注:与葛根素0 μmol/L比较,**P<0.01
2.2 葛根素对胰腺癌PANC-1细胞凋亡的影响 流式双染法(Annexin V-FITCI和PI)检测结果见图2、表1。结果显示,经0、50、100、200 μmol/L葛根素处理PANC-1细胞48 h后,随着葛根素药物浓度的增加,PANC-1细胞的凋亡率逐渐增加,实验组与对照组相比,差异均有统计学意义(P<0.05),表明葛根素能够浓度依赖性地诱导胰腺癌PANC-1细胞凋亡。

图2 流式细胞仪检测葛根素对胰腺癌PANC-1细胞的凋亡率(48 h)

表1 葛根素对胰腺癌PANC-1细胞凋亡的影响(48 h,n=3)
注:与葛根素0 μmol/L比较,**P<0.01
2.3 葛根素对PANC-1细胞Fas/Fas-L信号通路的影响 葛根素(0、50、100、200 μmol/L)作用于胰腺癌PANC-1细胞48 h后,Western blot检测结果显示,随着葛根素浓度的增加,胰腺癌PANC-1细胞中Fas、Fas-L、Caspase-7蛋白的表达水平升高,实验组与对照组相比,差异均有统计学意义(P<0.05)。由此推断葛根素诱导PANC-1细胞凋亡可能是通过激活Fas/Fas-L信号通路,上调Fas、Fas-L、Caspase-7蛋白的表达实现的。见图3、表2。
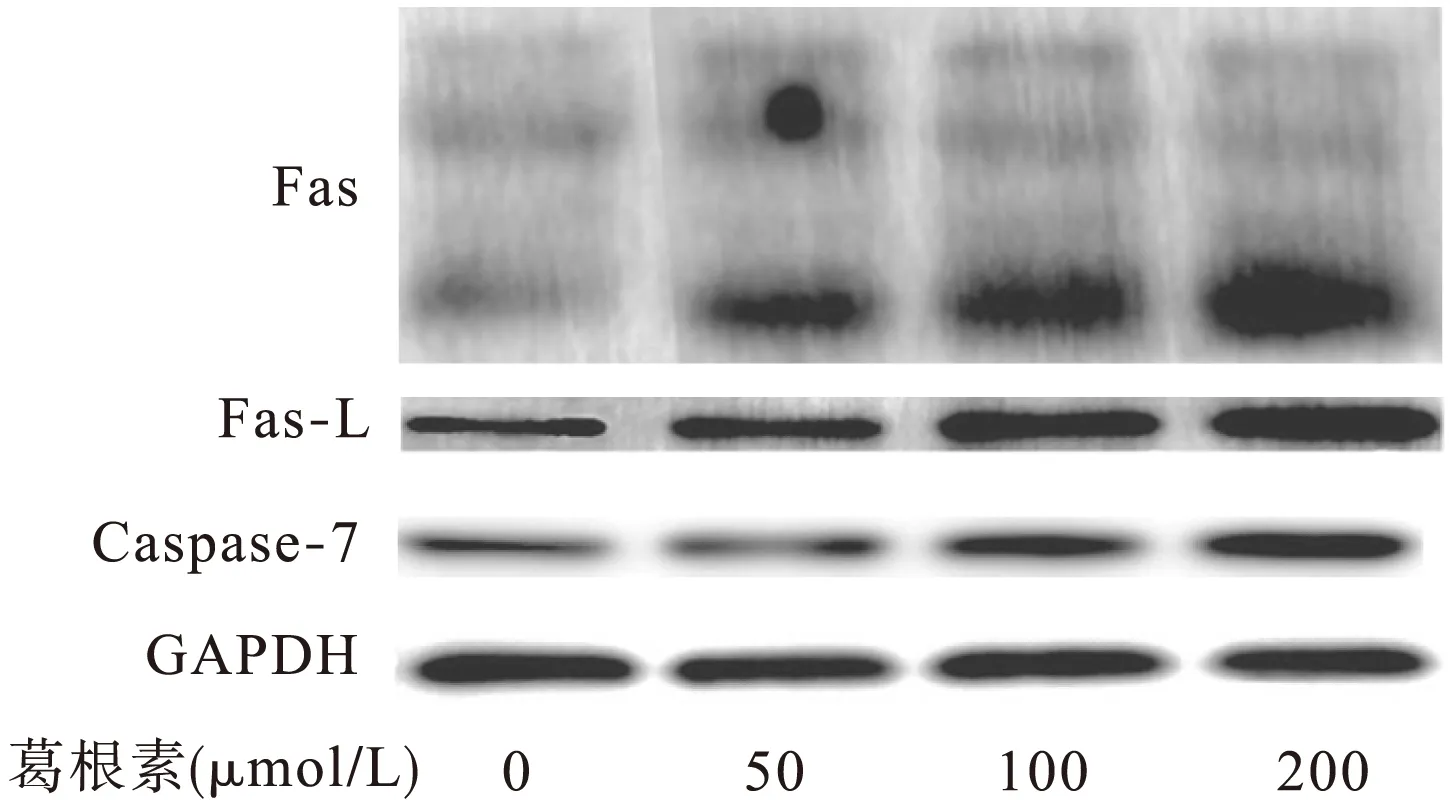
图3 Western blot检测葛根素对胰腺癌PANC-1细胞Fas、 Fas-L、Caspase-7蛋白表达的影响(48 h)
2.4 葛根素对PANC-1细胞Bax和Bcl-2的影响 不同浓度葛根素(0、50、100、200 μmol/L)作用于胰腺癌PANC-1细胞48 h后,Western blot检测结果显示,随着葛根素浓度的增加,胰腺癌PANC-1细胞中Bax蛋白的表达水平增加,Bcl-2蛋白的表达水平下降,实验组与对照组相比,差异有统计学意义(P<0.05)。可见葛根素可以通过调节Bax和Bcl-2蛋白的表达,影响线粒体膜电位的改变,进而诱导细胞凋亡。见图4、表2。

图4 Western blot检测葛根素对胰腺癌PANC-1细胞Bax、 Bcl-2蛋白表达的影响(48 h)
3 讨论
既往大量研究表明,葛根素对多种肿瘤具有抗肿瘤作用,但查阅大量国内外文献可知,葛根素对胰腺癌的抗肿瘤作用尚未见报道,因此,本实验旨在通过体外实验研究葛根素对胰腺癌是否具有抗肿瘤作用。CCK-8法检测结果显示,葛根素对胰腺癌PANC-1细胞具有增殖抑制作用,且具有浓度依赖性;流式细胞术检测结果表明,随着葛根素浓度的增加,细胞凋亡率逐渐升高。
细胞凋亡在肿瘤的发生和发展中具有重要作用,目前研究表明,主要有两条途径涉及凋亡过程:细胞膜上的死亡受体途径和细胞内的线粒体途径[6]。其中,在死亡受体途径中最具代表性的是Fas/Fas-L介导的细胞凋亡,Fas是一种Ⅰ型跨膜蛋白,由325个氨基酸组成,广泛存在于人体各种组织和细胞中。Fas-L是一种Ⅱ型跨膜蛋白,主要表达在细胞毒T淋巴细胞、免疫豁免区和各种肿瘤细胞表面。Fas-L作为Fas的配体,能与Fas结合启动细胞的程序性死亡[7]。研究发现,Fas表达上调可能导致细胞内Fas结构域自发齐聚,和独立的Fas-L结合后引起Fas过表达,从而诱导细胞凋亡[8]。同样,Fas和Fas-L也能够彼此独立地启动凋亡进程。Fas-L本身可以激活细胞内的信号转导途径,导致细胞周期阻滞,从而引起细胞凋亡。此外,Fas或Fas-L上调能增加和受体连接的几率,启动包括Caspase-7、Caspase-3在内的Caspases的级联反应。Caspases是一群结构类似的蛋白酶族,是细胞凋亡信号转导途径的关键效应分子,细胞凋亡程度与其表达水平的高低有关[9]。Caspases蛋白酶类包括凋亡的起始者和执行者,其能够在多个细胞系中被激活[10]。Caspase-7是天冬氨酸特异性半胱氨酸蛋白酶家族成员之一,与Caspase-3共同被认为是凋亡的最终执行者。
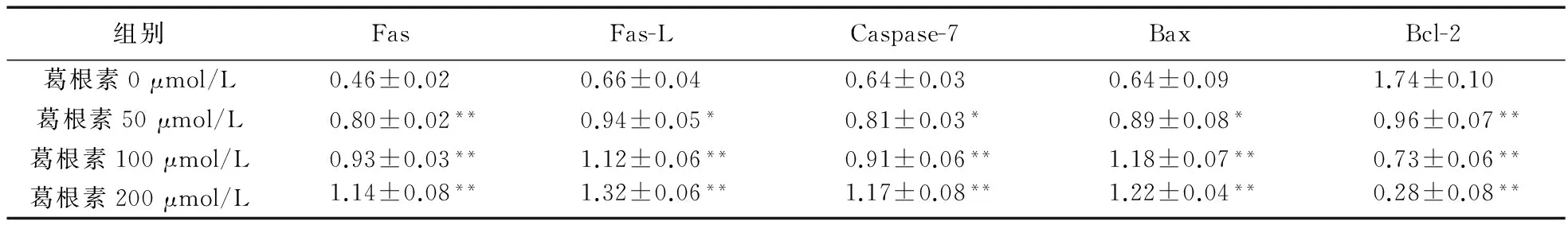
表2 不同浓度的葛根素作用于PANC-1细胞后Fas、Fas-L、Caspase-7、Bax、Bcl-2蛋白表达量与内参比值的变化(48 h,n=3)
注:与葛根素0 μmol/L比较,*P<0.05,**P<0.01
研究表明,Fas-L可以表达在胰腺癌细胞中[11]。李伟良[12]研究发现,葛根素对人早幼粒白血病HL-60细胞Fas、Fas-L蛋白表达具有一定影响,葛根素处理后较处理前人早幼粒白血病HL-60细胞Fas、Fas-L蛋白表达水平明显升高,但无浓度依赖性。因此,我们推测,葛根素可能会对人胰腺癌PANC-1细胞Fas、Fas-L、Caspase-7表达产生影响。本实验采用免疫印迹法检测不同浓度的葛根素作用胰腺癌细胞48 h后Fas、Fas-L、Caspase-7的表达情况,发现随着葛根素浓度的增加,Fas、Fas-L、Caspase-7表达阳性率均明显升高,实验组和对照组相比差异有统计学意义。实验表明,葛根素可能通过上调Fas、Fas-L蛋白表达,激活下游效应因子Caspase-7,从而引起PANC-1细胞凋亡,但其对PANC-1细胞Fas/Fas-L信号通路上游分子的调节靶点与具体机制尚未完全明确,还需进一步研究。
Bcl-2蛋白家族属于线粒体凋亡途径的重要成员[13],Bcl-2和Bax属于Bcl-2蛋白家族。Bcl-2是一种抗凋亡蛋白,可通过调控内质网Ca2+的释放来参与细胞核内外物质转运及膜通透性转换,保持线粒体内、从线粒体中释放,进而抑制细胞凋亡。Bax是一种促凋亡蛋白,与Bcl-2的作用相反,对促进肿瘤细胞的凋亡具有重要作用。研究表明,Bcl-2可与Bax结合,组成异源二聚体,减弱Bax促凋亡作用而抑制凋亡,Bax/Bcl-2比值的升高会引起细胞线粒体膜电位的改变,从而促使细胞凋亡[14-16]。本研究表明,葛根素作用胰腺癌PANC-1细胞48 h后,随着葛根素浓度的增加,Bax蛋白的表达量逐渐增加,Bcl-2蛋白的表达量逐渐下降,差异均有统计学意义。因此,Bax和Bcl-2组成的异源二聚体减少,Bax/Bax同源二聚体增加,Bax/Bcl-2比值升高,从而促进PANC-1细胞的凋亡。
综上所述,葛根素能抑制PANC-1细胞增殖,诱导PANC-1细胞凋亡,并可将细胞周期阻滞于G0/G1期,从而发挥抗胰腺癌的作用。其机制可能与葛根素激活Fas/Fas-L信号通路,上调Fas、Fas-L、Caspase-7、Bax蛋白的表达,下调Bcl-2蛋白的表达有关,但胰腺癌的发生、发展是多因素影响过程,诱导凋亡的机制也是十分复杂的,仍需进一步研究。
[1] 丁雷,张平.胰腺癌治疗的研究进展[J].中国老年学杂志,2014,34(8):2298-2300.
[2] Goldstein D,Carroll S,Apte M,et al.Modern management of pancreatic carcinoma[J].Intern Med J,2004,34(8):475-481.
[3] Wang Y,Ma Y,Zheng Y,et al.In vitro and in vivo anticancer activity of a novel puerarin nanosuspension against colon cancer,with high efficacy and low toxicity[J].Int J Pharm,2013,441(1-2):728-735.
[4] 马小乐,于医瑕,张宇,等.葛根素对人类胃癌细胞MGC-803和AGS增殖与凋亡的影响[J].肿瘤研究与临床,2013,25(9):585-587.
[5] Gan M,Yin X.Puerarin induced in mantle cell lymphoma apoptosis and its possible mechanisms involving multi-signaling pathway[J].Cell Biochem Biophys,2015,71(1):367-373.
[6] Rudner J,Elsaesser SJ,Jendrossek V,et al.Anti-apoptotic Bcl-2 fails to form efficient complexes with pro-apoptotic Bak to protect from Celecoxib-induced apoptosis[J].Biochem Pharmacol,2011,81(1):32-42.
[7] Bień K,Sokoowska J,Bska P,et al.Fas/FasL pathway participates in regulation of antiviral and inflammatory response during mousepox infection of lungs[J].Mediators Inflamm,2015,2015:281613.
[8] Schelling JR,Nkemere N,Kopp JB,et al.Fas-dependent fratricidal apoptosis is a mechanism of tubular epithelial cell deletion in chronic renal failure[J].Lab Invest,1998,78(7):813-824.
[9] Liu H,Wang Z,Nowicki MJ.Caspase-12 mediates carbon tetrachloride-induced hepatocyte apoptosis in mice[J].World J Gastroenterol,2014,20(48):18189-18198.
[10]Zhu YP,Bian XJ,Ye DW,et al.Pseudomonas aeruginosa-mannose-sensitive hemagglutinin inhibits proliferation and induces apoptosis in a caspase-dependent manner in human bladder cancer cell lines[J].Oncol Lett,2013,5(4):1357-1362.
[11]孙洪利,马凯,王宝胜,等.Bcl-2、Fas-L蛋白在胰腺癌及癌旁组织中的表达及意义[J].中国医科大学学报,2005,34(4):337-338.
[12]李伟良.葛根提取物诱导HL-60细胞凋亡的实验研究[D].南京中医药大学,2008.
[13]El-Khattouti A,Selimovic D,Haikel Y,et al.Crosstalk between apoptosis and autophagy:molecular mechanisms and therapeutic strategies in cancer[J].J Cell Death,2013,6:37-55.
[14]Doggui S,Sahni JK,Arseneault M,et al.Neuronal uptake and neuroprotective effect of curcumin-loaded PLGA nanoparticles on the human SK-N-SH cell line[J].J Alzheimers Dis,2012,30(2):377-392.
[15]Scarpi D,Cirelli D,Matrone C,et al.Low molecular weight,non-peptidic agonists of TrkA receptor with NGF-mimetic activity[J].Cell Death Dis,2012,3:e389.
[16]Gu JL,Li J,Zhou ZH,et al.Differentiation induction enhances bortezomib efficacy and overcomes drug resistance in multiple myeloma[J].Biochem Biophys Res Commun,2012,420(3):644-650.
EffectsofpuerarinonproliferationandapoptosisofhumanpancreaticcancerPANC-1cells
LIU Yin-li1,WANG Ying2*
(1.Graduate School of Xuzhou Medical University,Xuzhou 221002,China;2.Affiliated Hospital of Xuzhou Medical University,Xuzhou 221002,China)
ObjectiveTo investigate the effect and mechanism of puerarin on human pancreatic cancer cell line PANC-1.MethodsPANC-1 cells of logarithmic growth phase were treated with different concentrations of puerarin (0,50,100 and 200 μmol/L) for 48 h;CCK-8 was used to detect the proliferation level of PANC-1 cells.Apoptosis was detected by Annexinv-FITC/PI double staining flow cytometry.Western blot was used to detect the expression of Fas,Fas-L,Bax,Bcl-2 and Caspase-7.ResultsPuerarin inhibited the proliferation of pancreatic cancer PANC-1 cells in a concentration-dependent manner.When different concentrations of puerarin interfered PANC-1 cells for 48 h,the apoptosis rate of cells respectively was 2.47%±0.64%,6.37%±0.71%,8.33%±0.90%,and 12.40%±1.01%,the difference between experimental group and control group being statistically significant (P<0.01).Western blot experiment showed that,after the 48 h intervention for PANC-1 of pancreatic cancer cell line,the expression of Fas,Fas-L,Caspase-7 and Bax protein increased with the increase of puerarin concentration,while the expression of Bcl-2 protein decreased,the difference between experimental group and control group being statistically significant (P<0.05).ConclusionPuerarin can induce PANC-1 cell proliferation inhibition;Apoptosis by activating Fas/Fas-L signaling pathway.
Puerarin;PANC-1 cell;Proliferation;Apoptosis;Fas/Fas-L
2017-04-02
1.徐州医科大学研究生学院,江苏 徐州 221002;2.徐州医科大学附属医院,江苏 徐州 221002
*
10.14053/j.cnki.ppcr.201711004

