人参皂苷Rb3治疗心肌梗死的分子生物学研究
周开珩,黄 芸
人参皂苷Rb3治疗心肌梗死的分子生物学研究
周开珩*,黄 芸
目的研究人参皂苷Rb3治疗心肌梗死的分子生物学机制。方法采用PLM腺病毒转染人参皂苷Rb3灌胃后大鼠的心肌细胞,Western blot检测不同环境下人参皂苷Rb3对Ser68表达及细胞外调节蛋白激酶pERK1/2、凋亡抑制蛋白Survivin、MAPK通路p38,以及凋亡蛋白Caspase-3和Caspase-8表达的影响。结果人参皂苷Rb3在缺氧和低糖环境下,可降低Ser68磷酸化表达,提升心脏的收缩供血能力,抑制ERK1/2通过磷酸化形成pERK1/2,缓和pERK1/2对心肌细胞凋亡的加速作用。人参皂苷Rb3还可在缺氧环境下增强凋亡抑制蛋白Survivin的表达。此外,缺氧和低糖环境下,人参皂苷Rb3可以降低MAPK通路重要蛋白p38的表达,并抑制凋亡蛋白Caspase-3和Caspase-8的表达,改善心肌梗死。结论在缺氧和低糖环境下,人参皂苷Rb3对心肌梗死具有积极的治疗作用。
人参皂苷Rb3;心肌梗死;离子通道调节蛋白;pERK1/2;凋亡抑制蛋白
0 引言
人参皂苷Rb3(Ginsenoside Rb3,G-Rb3)是从西洋参茎叶中提取的一种单体皂苷,具有改善神经功能缺损、缩小脑内梗死面积、缓解脑水肿的作用,还可以通过抗氧化损伤对各类缺血损伤进行保护[1]。人参皂苷Rb3还具有抗异丙肾上腺素诱导的大鼠急性心肌损伤及抗AngⅡ诱导的大鼠血管平滑肌细胞增殖的药理作用[2-4]。另外,心肌在缺血再灌注过程的代偿变化引起心室重构,严重时会导致心力衰竭,人参皂苷Rb3可能通过影响心肌梗死不同阶段基质金属蛋白酶的表达,进而抑制心肌Ⅰ、Ⅲ型胶原纤维增生,从而对心肌梗死后心室重构有一定的防治作用。本研究主要探讨人参皂苷Rb3治疗心肌梗死的分子生物学机制。
1 材料与方法
1.1 动物 健康雄性SD大鼠60只,由复旦大学实验动物中心提供,体重180~220 g,正常饮食。
1.2 药品与试剂 人参皂苷Rb3,98%纯度,白色粉末状,溶解于氯化钠注射液中,滤膜滤除菌后使用。
1.3 动物分组、模型制备、给药方法 60只大鼠随机平均分成6组。空白组(Vehicle):10只,氯化钠注射液灌胃,PLM腺病毒转染;缺氧空白组(UN-OD):10只,空白氯化钠注射液灌胃,缺氧环境,PLM腺病毒转染;低糖空白组(UN-GD):10只,空白氯化钠注射液灌胃,低糖环境,PLM腺病毒转染;给药组(G-Rb3):10只,人参皂苷Rb3氯化钠注射液灌胃,PLM腺病毒转染;缺氧给药组(G-Rb3-OD):10只,人参皂苷Rb3氯化钠注射液灌胃,缺氧环境,PLM腺病毒转染;低糖给药组(G-Rb3-GD):10只,人参皂苷Rb3氯化钠注射液灌胃,低糖环境,PLM腺病毒转染。
1.4 大鼠心肌细胞分离、培养 末次给药后,10只空白组(Vehicle)和10只给药组(G-Rb3)大鼠腹腔注射肝素钠1 200 U,15 min后腹腔注射戊巴比妥钠(30 mg/kg),待麻醉后行开胸术,迅速取出心脏,放入无钙台氏液中,经主动脉插管,再将心脏连于Langerdoff灌流装置灌流(37 ℃、95% O2)。先用无钙台氏液灌流,10 min后换成含胶原酶Ⅱ(0.5 mg/mL)和牛血清白蛋白(1 mg/mL)的无钙台氏液灌流,至心脏膨胀变软变白即停止灌流,取左心室游离壁心肌组织,充分剪碎、搅拌。将心肌细胞接种在覆盖有Laminin的玻片上,2 h后更换细胞培养液,去掉不能贴壁的心肌细胞。按上述心肌细胞培养过程,在缺氧(OD)和低葡萄糖(GD)环境下培养UN-OD、UN-GD、G-Rb3-OD和G-Rb3-GD组大鼠,每组10只。
1.5 PLM腺病毒载体的制备 将全长PLM-cDNA亚克隆至带有绿色荧光蛋白(GFP)的pAdTrack-CMV载体质粒。PLM-cDNA与pAdTrack-CMV载体质粒有相同的限制性内切酶位点HindⅢ和EcoRⅠ,PCR反应连接酶切产物,转化感受态大肠杆菌stb13。将转化菌在含有氨苄青霉素和瘟菌素的LA平皿中克隆,挑取单菌落扩增,再行限制性内切酶谱分析、PCR扩增和基因测序鉴定。构建成功后,将重组载体(PLM-pAdtract)转染到心肌细胞中进行后续实验。
1.6 Western blot检测 PLM腺病毒载体转染72 h后(转染效率约为30%),收集心肌细胞,溶解于细胞裂解液中,并提取总蛋白;SDS-PAGE凝胶电泳分离蛋白,再将凝胶上的蛋白转印到PVDF膜上;封闭液封闭2 h,一抗孵育过夜(4 ℃),TBST洗涤10 min,连续洗涤3次,二抗孵育1 h(室温),TBST洗涤10 min,连续洗涤3次;ECL试剂盒显色,图像分析软件(Molecular Dynamics,Sunnyvale,CA)定量分析蛋白条带。
2 结果
2.1 G-Rb3对PLM磷酸化的影响 人参皂苷Rb3对Ser68磷酸化的影响不明显,空白组与给药组磷酸化Ser68表达差异不明显,表达程度与空白组相当。缺氧和低糖环境下磷酸化Ser68表达较空白组显著增强,而人参皂苷Rb3给药后磷酸化Ser68被有效抑制。见图1。
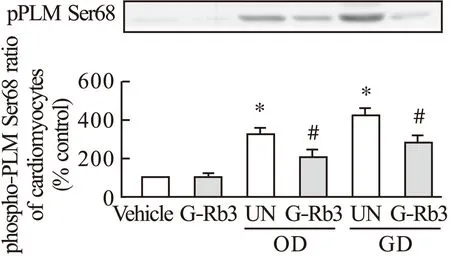
图1 G-Rb3对心肌细胞PLM磷酸化的影响注:*与空白组比较,P<0.05;#与UN组比较,P<0.05
2.2 G-Rb3对ERK1/2磷酸化的影响 磷酸化细胞外调节蛋白激酶pERK1/2的蛋白质印迹表征以及人参皂苷Rb3对心肌细胞pERK1/2磷酸化的影响如图2所示,通常环境下空白组和人参皂苷Rb3给药组pERK1/2表达差异较小,人参皂苷Rb3在正常环境下作用不明显,且与控制组相当。缺氧和低糖环境下空白组pERK1/2表达增强,而人参皂苷Rb3给药组pERK1/2表达有所降低,其影响效果与磷酸化Ser68相似。
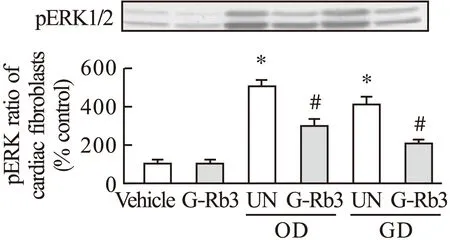
图2 G-Rb3对心肌细胞ERK1/2磷酸化的影响注:*与空白组比较,P<0.05;#与UN组比较,P<0.05
2.3 G-Rb3对Survivin磷酸化、p38、Caspase-3和Caspase-8表达的影响 凋亡抑制蛋白Survivin蛋白质印迹表征人参皂苷Rb3对心肌细胞Survivin磷酸化的影响如图3所示。在正常和低糖环境中,空白组和人参皂苷Rb3给药组Survivin几乎没有表达,而在缺氧状态下Survivin开始表达,人参皂苷Rb3给药组Survivin表达进一步增强。
P38MAPK是细胞内一种重要的信号酶,参与多种胞内信息传递过程,能对广泛的细胞外刺激发生反应。人参皂苷Rb3对心肌细胞p38的影响如图4所示。通常环境下空白组和人参皂苷Rb3给药组p38表达差异较小,人参皂苷Rb3在正常环境下作用不明显,且与空白组相当。缺氧和低糖环境下空白组p38表达增强,而人参皂苷Rb3给药组p38表达有所降低。
Caspase-3、Caspase-8作为Caspase家族中2个重要的成员,是细胞凋亡过程中的关键因子。Caspase-8参与凋亡执行,并诱导Caspase-3的激活,启动细胞凋亡程序。Caspase-3、Caspase-8在缺氧和低糖环境下蛋白表达增强,而人参皂苷Rb3给药组可使其表达降低。见图5、图6。
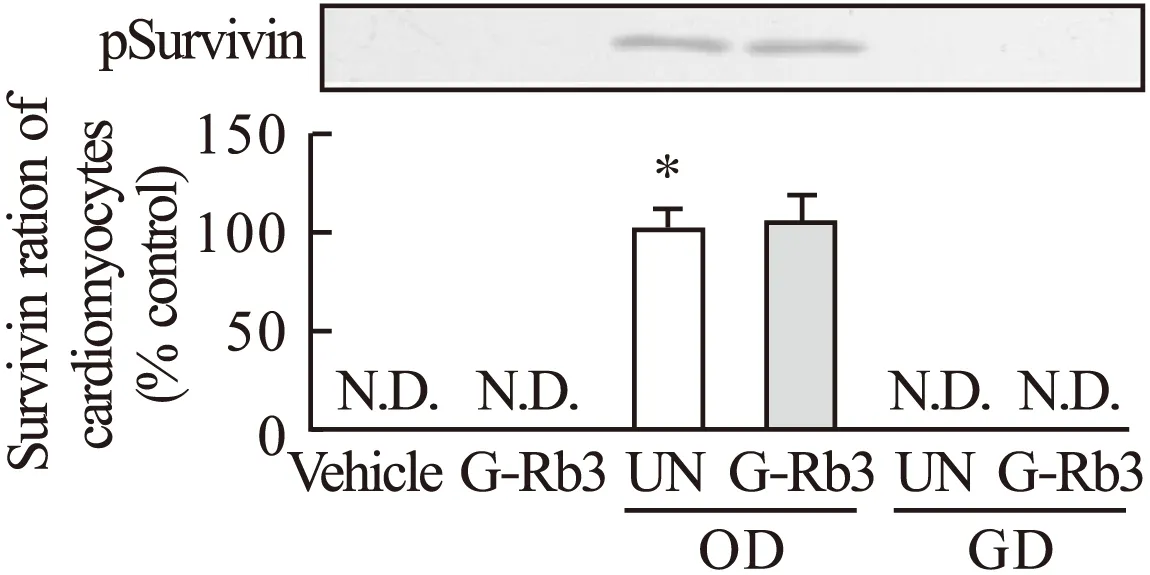
图3 G-Rb3对心肌细胞Survivin磷酸化的影响注:*与空白组比较,P<0.05
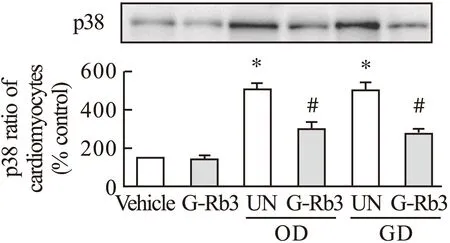
图4 G-Rb3对心肌细胞p38蛋白表达的影响注:*与空白组比较,P<0.05;#与UN组比较,P<0.05

图5 G-Rb3对心肌细胞Caspase-3蛋白表达的影响注:*与空白组比较,P<0.05;#与UN组比较,P<0.05
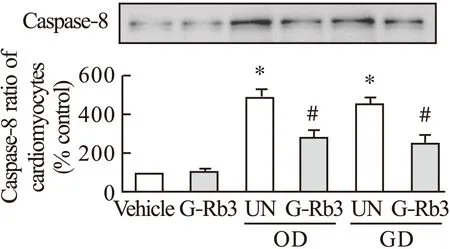
图6 G-Rb3对心肌细胞Caspase-8蛋白表达的影响注:*与空白组比较,P<0.05;#与UN组比较,P<0.05
3 讨论
2000年Sweadner等[5]首次描述了一组离子通道调节蛋白,该组蛋白因N末端都含有PFXYD序列而命名为FXYD蛋白。现已发现的此类蛋白共有12种,FXYD蛋白主要分布在调节溶质和体液的组织器官中,如肾脏、肠道、乳腺、胰腺、肝脏,也分布在具有电活动特性的组织器官中,如心肌、骨骼肌、脑。组成FXYD蛋白的氨基酸中至少含有1个丝氨酸或苏氨酸,表明FXYD蛋白具有潜在的磷酸化位点。Phospholemman(PLM),即FXYD1,是由72个氨基酸组成的跨膜磷酸蛋白[6],其膜外N末端含有17个氨基酸,膜内C末端含有35个氨基酸,跨膜片段含有20个氨基酸,而PFXYD序列位于膜外8~12号位上。PLM广泛分布在心肌细胞膜上,是心肌细胞主要的磷酸化底物,其膜内C末端含有4个磷酸化位点,即62、63、68号位丝氨酸(Ser62/Ser63/Ser68)和69号位苏氨酸(Thr69)[7]。PLM可以被β肾上腺素受体激动剂磷酸化[8-10],同时,它可以调节参与心肌兴奋收缩偶联的多个离子通道,使得其可能成为治疗心脏疾病的一个分子靶点[11-15],目前人参皂苷Rb3对PLM过表达的研究还未见报道。
本文采用PLM腺病毒转染人参皂苷Rb3灌胃后大鼠的心肌细胞作为模型[16-17],用Western blot法检测不同环境下人参皂苷Rb3对Ser68、细胞外调节蛋白激酶ERK1/2、凋亡抑制蛋白Survivin、MAPK通路p38及凋亡蛋白Caspase-3、Caspase-8表达的影响状况。
研究发现,PLM可与心肌细胞膜上钠钾ATP酶(Na+-K+-ATPase,NKA)相连并调节其动力学特性,表现为:PLM通过降低细胞内Na+与NKA亲和力来抑制NKA,使细胞内Na+浓度增加,钠钙交换体(Na+/Ca2+exchanger,NCX)前向转运(Ca2+外流)减弱而逆向转运(Ca2+内流)增强,从而导致细胞内Ca2+浓度增加,心肌细胞收缩力增强。而Ser68磷酸化可使PLM与NKA分离,从而解除PLM对NKA的抑制作用。
PLM对离子通道的调节受生理环境和各种药物的影响。通常环境下人参皂苷Rb3影响Ser68磷酸化效果不明显,空白组与给药组磷酸化Ser68表达差异不明显。缺氧和低糖环境下空白组磷酸化Ser68表达显著增强,使PLM对NKA的抑制减弱,NKA活性增加,导致细胞内Na+浓度降低,NCX前向转运(Ca2+外流)增强,细胞内Ca2+浓度减少,心肌细胞收缩力减弱。而人参皂苷Rb3给药后磷酸化Ser68被有效抑制,可提升心脏的收缩供血能力。
细胞外调节蛋白激酶ERK1/2是一种重要的细胞凋亡调节因子。当ERK1/2通过磷酸化形成pERK1/2时,抗凋亡活性蛋白失去ERK1/2的磷酸化激活而活性降低,从而加速凋亡过程的发生。通常环境下空白组和人参皂苷Rb3给药组pERK1/2表达差异较小,人参皂苷Rb3在正常环境下作用不明显。缺氧和低糖环境下空白组pERK1/2表达增强,使得心肌细胞加速凋亡。而人参皂苷Rb3给药组pERK1/2表达有所降低,一定程度上可减缓细胞凋亡,对心肌细胞起到一定保护作用。因此,人参皂苷Rb3是在恶劣的条件下应对心肌坏死的有效药物。
另一种激素蛋白,凋亡抑制蛋白Survivin,起到和pERK1/2相反的效果。具有非常重要的抗凋亡作用。在正常和低糖环境中,空白组和人参皂苷Rb3给药组Survivin几乎没有表达,而在缺氧状态下Survivin发挥抗凋亡作用,人参皂苷Rb3给药组Survivin表达进一步增强,说明人参皂苷Rb3对缺氧引起的心脏病有积极的治疗作用。有研究认为,在各种应激因素作用下,p38参与心肌梗死后心肌细胞的凋亡过程。本实验发现,在缺氧和低糖状态下,p38开始高表达,人参皂苷Rb3给药组可以抑制其表达水平。另外,在缺氧和低糖状态下,Caspase-3和Caspase-8开始高表达,人参皂苷Rb3给药组可以显著降低缺氧及低糖诱导的Caspase-3和Caspase-8活性升高。
综上所述,人参皂苷Rb3在缺氧和低糖环境下,可降低Ser68磷酸化表达,提升心脏的收缩供血能力;并抑制ERK1/2通过磷酸化形成pERK1/2,缓和pERK1/2对心肌细胞凋亡的加速作用。人参皂苷Rb3还可以在缺氧环境下增强凋亡抑制蛋白Survivin的表达,显著抑制缺氧及低糖诱导的p38、Caspase-3和Caspase-8活性升高,保护心肌细胞。以上结果表明,人参皂苷Rb3对心肌梗死具有积极的治疗作用。然而,由于条件所限,本研究仅通过Western blot法对结果进行了验证,方法单一,后续需进行进一步的验证。
[1] Liu X,Jiang Y,Yu X,et al.Ginsenoside-Rb3 protects the myocardium from ischemia-reperfusion injury via the inhibition of apoptosis in rats[J].Exp Ther Med,2014,8(6):1751-1756.
[2] Wang T,Yu XF,Qu SC,et al.Ginsenoside Rb3 inhibits angiotensin II-induced vascular smooth muscle cells proliferation[J].Basic Clin Pharmacol Toxicol,2010,107(2):685-689.
[3] Yu H,Shi L,Qi G,et al.Gypenoside protects cardiomyocytes against Ischemia-reperfusion injury via the inhibition of mitogen-activated protein kinase mediated nuclear factor kappa B pathway in vitro and in vivo[J].Front Pharmacol,2016,7:148.
[4] 张圳,杨春凤,李玉梅.人参皂苷Re与Rb3治疗小鼠病毒性心肌炎的作用机制研究[J].中国小儿急救医学,2015,22(2):100-103.
[5] Sweadner KJ,Rael E.The FXYD gene family of small ion transport regulators or channels:cDNA sequence,protein signature sequence,and expression[J].Genomics,2000,68(1):41-56.
[6] Hansen T,Tang O,Figtree G,et al.FXYD1 is an endogenous protector against redox-mediated vascular dysfunction[J].Heart Lung Circulation,2016,25:S14-S15.
[7] Zhang JX,Li SD,Liu Y,et al.Traditional Chinese medicine Tongxinluo protects microvascular from arterial spasm induced by norepinephrine in rats mesentery[J].African J Traditional Complem Altern Med,2016,13(3):181-190.
[8] Fuller W,Howie J,McLatchie LM,et al.FXYD1 phosphorylation in vitro and in adult rat cardiac myocytes:threonine 69 is a novel substrate for protein kinase C[J].Am J Physiol Cell Physiol,2009,296(6):C1346-C1355.
[9] Crambert G,Fuzesi M,Garty H,et al.Phospholemman (FXYD1) associates with Na,K-ATPase and regulates its transport properties[J].Proc Natl Acad Sci U S A,2002,99(17):11476-11481.
[10]Dhayan H,Kumar R,Kukol A.Regulation of the cardiac Na+/K+-ATPase by phospholemman[M]//regulation of membrane Na+-K+ATPase.Springer Int Publishing,2016:261-276.
[11]Bossuyt J,Despa S,Han F,et al.Isoform specificity of the Na/K-ATPase association and regulation by phospholemman[J].J Biol Chem,2009,284(39):26749-26757.
[12]Bell JR,Kennington E,Fuller W,et al.Characterisation of the phospholemman knockout mouse heart:depressed left ventricular function with increased Na/K ATPase activity[J].Am J Physiol,2008,294:H613-H621.
[13]Wang J,Gao E,Song J,et al.Phospholemman and beta-adrenergic stimulation in the heart[J].Am J Physiol Heart Circ Physiol,2010,298(3):H807-H815.
[14]Despa S,Tucker AL,Bers DM.Phospholemman-mediated activation of Na/K-ATPase limits [Na]i and inotropic state during beta-adrenergic stimulation in mouse ventricular myocytes[J].Circulation,2008,117(14):1849-1855.
[15]Bers DM.Cardiac excitation-contraction coupling[J].Nature,2002,415(6868):198-205.
[16]张志,于波,李阳,等.Apelin/APJ信号在离体和在体急性心肌缺血时的表达[C]//中华医学会第11次心血管病学术会议论文摘要集,2009.
[17]王东,魏文平,王芳.MicroRNA-214在缺氧所致心肌细胞损伤过程中的作用[J].心脏杂志,2014,26(4):393-396.
MolecularbiologicalmechanismofginsenosideRb3inthetreatmentofmyocardialinfarction
ZHOU Kai-heng1*,HUANG Yun
(Department of Pharmacy,Ningbo City Medical Treatment Center Lihuili Hospital,Ningbo 315040,China)
ObjectiveTo explore the molecular biological mechanism of ginsenoside Rb3 in the treatment of myocardial infarction.MethodsThe cardiac muscle cells from rats with intragastric administration of ginsenoside Rb3 were cultured in different environments and then transfected by PLM-pAdtract.Western blot was used to detect the effects of ginsenoside Rb3 on the expression of Ser68,the extracellular regulated protein kinase pERK1/2,Survivin,p38,Caspase-3 and Caspase-8 in different environments.ResultsGinsenoside Rb3 in the oxygen deprivation and glucose deprivation conditions could reduce the expression of phosphorylated Ser68,improve cardiac systolic blood capacity,inhibit ERK1/2 phosphorylation into pERK1/2,relax the acceleration of pERK1/2 on myocardial cell apoptosis.Ginsenoside Rb3 could also enhance the expression of apoptosis inhibitory protein Survivin in the oxygen deprivation condition.In addition,in the oxygen deprivation and glucose deprivation conditions,ginsenoside Rb3 could reduce the expression of the important protein p38 in MAPK pathway,inhibit the expression of apoptotic proteins Caspase-3 and Caspase-8,and improve myocardial infarction.ConclusionIn the oxygen deprivation and glucose deprivation conditions,ginsenoside Rb3 has a positive therapeutic effect on myocardial infarction.
Ginsenoside Rb3;Myocardical infarction;PLM;pERK1/2;Survivin
2017-04-08
宁波医疗中心李惠利医院药剂科,浙江 宁波 315040
宁波市医学科技计划(2016A31)
*
10.14053/j.cnki.ppcr.201711002

