锌离子和钙离子对槲皮素与牛血清白蛋白结合作用的影响*
李 靖,孙 楠,孙永慧,邹淑君
(黑龙江中医药大学 药学院,黑龙江 哈尔滨 150040)
分析测试
锌离子和钙离子对槲皮素与牛血清白蛋白结合作用的影响*
李 靖,孙 楠,孙永慧,邹淑君*
(黑龙江中医药大学 药学院,黑龙江 哈尔滨 150040)
运用荧光光谱法,分别考察了Zn2+、Ca22+对槲皮素与牛血清白蛋白(BSA)相互作用的影响,两种金属离子是否影响槲皮素对BSA的荧光猝灭作用机理、槲皮素与BSA结合作用常数、结合位点数、作用力类型等。结果表明,Zn2+和Ca2+存在时,不改变槲皮素对BSA的荧光猝灭机理、不改变槲皮素与BSA结合作用的作用力类型、结合位点数基本不变。但Zn2+存在时,会导致槲皮素对BSA的结合常数减小;Ca2+存在时,会导致槲皮素与BSA的结合常数增大。说明两种离子会影响槲皮素的蛋白质结合浓度。
槲皮素;牛血清白蛋白;锌离子;钙离子;结合作用;荧光光谱
小分子药物进入血液后,与血浆中的载体蛋白相结合,从而被转运到靶位点发挥药效。但血液中在小分子药物与血清白蛋白相互结合并被转运的过程中,生物体内的外源或内源金属离子可能会对药物分子与血清白蛋白的相互作用过程产生影响[1]。因此,研究金属离子存在下药物分子与血清白蛋白的相互作用,有助于更确切地了解体内药物与蛋白间的作用关系,是生命科学的重要内容。槲皮素(Quercetin,缩写为Qct,结构式见图1)是许多药用植物中的重要天然药效成分,普遍存在于天然药用植物当中,具有防止血小板凝聚、防治心血管疾病、增强免疫、抗癌、抗菌抗病毒等功能[2,3]。是应用前景很好的小分子药物。Zn2+在生命活动中起着转换物质和交流能量的作用,是构成多种蛋白质必需的成分;Ca2+是形成骨骼和牙齿的主要成分,发挥着从生命产生到调节生理功能的各种作用。药物进入血液中,血液中少量的Zn2+、Ca2+可能对药物小分子实时产生影响。本实验即研究Zn2+、Ca2+对槲皮素与BSA相互作用的影响。
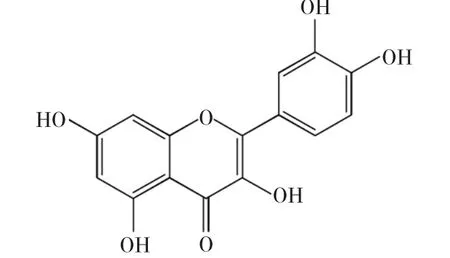
图1 槲皮素的结构式Fig.1 Structure of quercetin
1 实验部分
1.1 仪器与试剂
PB-20型pH计(德国赛多利斯仪器有限公司);RF-5301PC型荧光光度计(日本岛津公司)。
槲皮素(中国药品生物制品检定所);三羟甲基氨基甲烷 (Tris 99.8%上海博宏生物科技有限公司);牛血清白蛋白(BSA 99.8%美国Sigma公司);ZnCl2、CaCl2等试剂均为国产分析纯。实验用水均为二次蒸馏水。
1.2 溶液配制
BSA储备液配制:以Tris-HCl缓冲溶液为溶剂配成 1×10-5mol·L-1溶液(pH 值 7.4,含 0.01mol·L-1NaCl以维持溶液离子强度),置于4℃的冰箱中保存。
槲皮素溶液的配制 称取一定量的槲皮素,加少量甲醇溶解于25mL容量瓶中,再用二次蒸馏水定容至刻度线,得1×10-4mol·L-1的溶液。
金属离子溶液的配制 分别称取一定量的Zn-Cl2、CaCl2,加二次蒸馏水溶解配制成1×10-3mol·L-1的ZnCl2溶液和 5×10-3mol·L-1的 CaCl2溶液。
1.3 实验方法
(1)在9个10mL容量瓶中均加入1×10-5mol·L-1的 BSA 溶液 1mL,再依次加入 0,0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8mL 的槲皮素溶液,用 Tris-HCl缓冲溶液定容至刻度并摇匀。
(2)另在10个10mL容量瓶中均加入1×10-5mol·L-1的BSA溶液1mL,从第2号容量瓶开始,分别加入金属离子溶液(Zn2+、Ca2+)1mL,从第3号容量瓶开始,再依次加入 0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8mL的槲皮素溶液,用Tris-HCl缓冲溶液定容至刻度,摇匀。
(1)、(2)两组溶液分别在 290、300、310K 温度下反应20min。以280nm为激发波长,入射狭缝为5nm,发射狭缝为3nm,在290~450nm范围内扫描荧光光谱。
(3)数据处理参考文献[4]的方法。
2 结果与讨论
2.1 BSA的荧光猝灭光谱
图2是300K下,激发波长为280nm,测定的BSA荧光光谱。
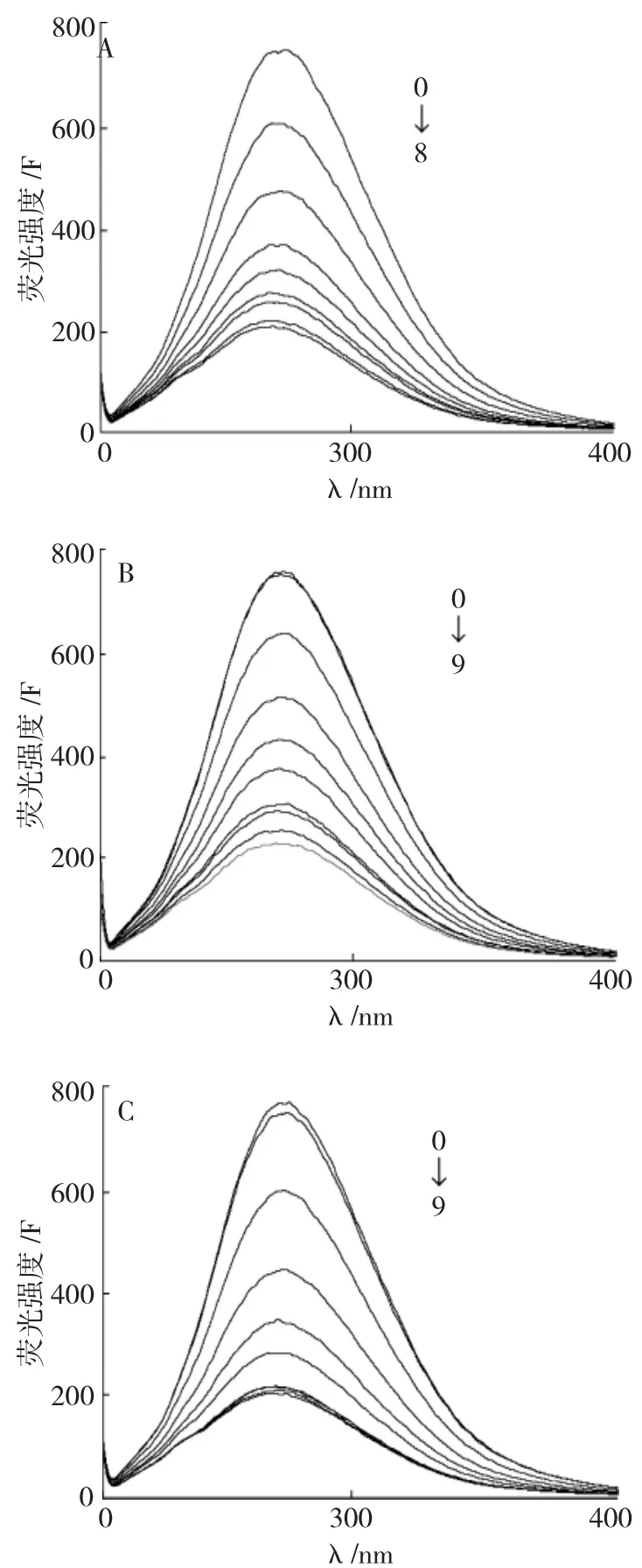
图2 不同情况下槲皮素对BSA的荧光猝灭光谱图Fig.2 Fluorescence quenching spectra of quercetin on BSA under different conditions

图2中A是BSA的浓度不变,槲皮素的浓度逐渐增大时BSA的荧光发射光谱。可见,BSA在343nm处有最大发射峰,槲皮素能够对BSA的荧光产生猝灭作用。随着槲皮素浓度的增加,荧光猝灭峰出现规律性的降低,表明槲皮素与蛋白质分子之间发生了相互作用。且随着槲皮素浓度增大,BSA的荧光光谱逐渐蓝移。Zn2+、Ca2+本身对BSA的荧光几乎没有猝灭作用。图2中B、C分别是在一定浓度的Zn2+、Ca2+存在下,逐步增加槲皮素的浓度,BSA的发射光谱。可见,Zn2+、Ca2+存在下,槲皮素仍能对BSA的荧光产生规律性的猝灭。
2.2 猝灭机理、结合常数和结合位点数
[4]和[5],根据Stern-Volmer方程计算出Zn2+、Ca2+不存在与存在下槲皮素对BSA的动态猝灭常数Ksv和双分子碰撞猝灭速率常数Kq,见表1。槲皮素对BSA的动态猝灭常数Ksv随着温度的升高而降低,符合静态猝灭规律。并且双分子碰撞猝灭速率常数Kq均远大于各类猝灭剂对生物大分子的最大扩散碰撞常数 2.0×1010L·(mol·s)-1,是静态猝灭。Zn2+、Ca2+存在下,槲皮素对BSA的猝灭常数Ksv随温度的升高而降低,猝灭速率常数远大于各类猝灭剂对生物大分子的最大扩散碰撞常数Kq,仍符合静态猝灭规律;且动态猝灭常数比较结果是Ksv(Qct)>Ksv(Qct-Ca2+)>Ksv(Qct-Zn2+),说明Zn2+、Ca2+能不同程度的减弱槲皮素对BSA的荧光猝灭作用,表明两种金属离子可能参与了槲皮素与BSA的相互作用过程。
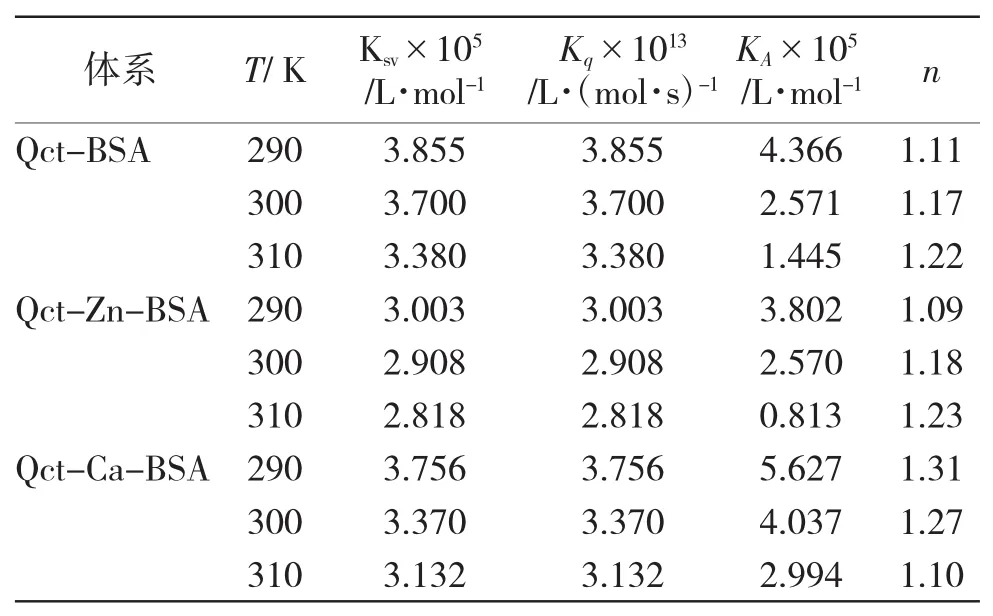
表1 不同情况下槲皮素与BSA相互作用的猝灭常数Tab.1 Quenching constants of interaction of quercetin and BSA under different conditions
当发生静态猝灭,小分子物质与生物大分子之间形成复合物可存在n个结合位点时,可根据线性回归方程lg[(F0/F)-1]=lgKA+nlg[Q]进行计算,结果如表1所示。可以见到随着温度的升高,槲皮素与BSA形成的分子复合物在温度升高时,结合常数降低,稳定性下降,结合常数KA处在105数量级,说明槲皮素与BSA之间属于强结合作用。随着温度的改变,结合位点数基本不变,基本在1左右。Zn2+、Ca2+存在时,结合常数大小为 KA(Qct-Ca2+)>KA(Qct)> KA(Qct-Zn2+),两种金属离子存在下,槲皮素与BSA结合常数均处在104~106数量级,仍属于强结合作用。但是,Ca2+存在时,槲皮素与BSA作用的KA最大,增大了槲皮素的蛋白结合浓度,有助于槲皮素持久缓释发挥药效;Zn2+存在时,槲皮素与BSA作用的KA减小,减小了槲皮素的蛋白结合浓度,可能能够在短期内提高槲皮素药效。Zn2+、Ca2+存在时,槲皮素与BSA结合位点数随略有变化,但不同程不大,仍基本为1左右。
2.3 作用力类型
当温度变化不大时,可以将焓变△H看做一个常数。根据Van't Hoff热力学方程,可以计算出药物与蛋白质作用的热力学参数,不同情况下槲皮素与BSA相互作用的热力学参数见表2。
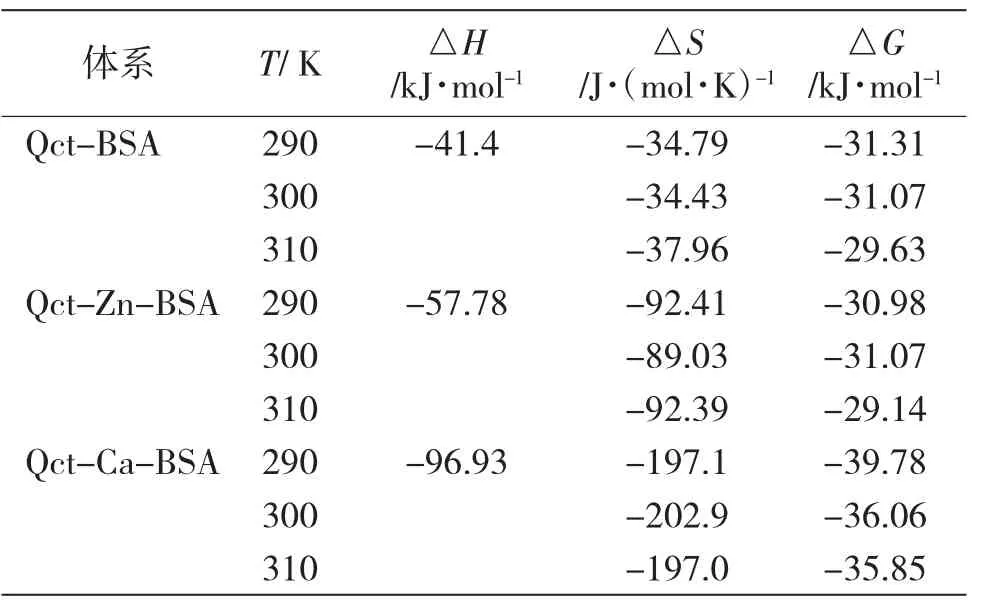
表2 不同情况下槲皮素与BSA相互作用的热力学参数Tab.2 Thermodynamic parameters of interaction of quercetin with BSA under different conditions
可见,△G均为负值,表明不论有无Zn2+、Ca2+存在,槲皮素与BSA的作用过程均为Gibbs自由能降低的自发过程。同时,均有△H<0,说明反应过程是放热过程,温度的升高不利于小分子与蛋白质之间形成复合物,使静态猝灭作用减弱。根据Ross理论,可以判断与BSA相互作用的作用力类型。反应体系的热力学参数均符合ΔH<0、ΔS<0,表明不论有无Zn2+、Ca2+存在,槲皮素与BSA之间主要作用力类型都是氢键和范德华力。
3 结论
槲皮素对BSA具有较强的荧光猝灭作用,与BSA也有较强的结合能力,Zn2+和Ca2+本身对BSA不存在猝灭作用,因此,与BSA之间应该没有强结合能力。
在槲皮素与BSA的混合体系中,Zn2+或Ca2+加入后,不改变槲皮素对BSA的荧光猝灭机理,不论有无Zn2+或Ca2+存在,槲皮素对BSA的荧光猝灭作用都是静态猝灭为主;Zn2+或Ca2+加入后,不改变槲皮素与BSA的作用力类型,对槲皮素与BSA之间的结合位点数不产生大的影响。Ca2+存在时,槲皮素与BSA作用的动态猝灭常数Ksv减小、但结合常数KA是增大的,说明Ca2+可能与槲皮素配位,同时与BSA有一定的结合,Ca2+可能在槲皮素和BSA分子间形成“离子架桥”[6],因此,增强了槲皮素与BSA的结合作用,因此,增大槲皮素的蛋白结合浓度,有助于槲皮素持久缓释发挥药效;Zn2+存在时,槲皮素与BSA作用的Ksv及KA均减小,可能是由于Zn2+与槲皮素配位能力强,从而削弱了槲皮素与BSA的结合作用,从而减小了槲皮素的蛋白结合浓度。该实验结论可为合理药用槲皮素提供理论指导。
参考文献
[1] 蒋新宇,李文秀,陈景文.锌离子存在下槲皮素、杨梅素与牛血清蛋白的结合[J].无机化学学报,2008,28(10):1588-1595.
[2] 吕蔡,张杰.槲皮素的药理作用[J].国外医药(植物药分册),2005,20(3):108-112.
[3] 龚珊,张玉英,俞光第,等.槲皮素镇痛作用的观察[J].中草药,1996,27(10):612-613.
[4] 邹淑君,张蕾,郭迎喜,等.橙皮素铜(II)配合物与牛血清白蛋白作用的研究[J].化学工程师,2015,29(8):5-7.
[5] 徐暘,许树军,张蕾,等.铝离子存在下槲皮素与牛血清白蛋白的相互作用[J].哈尔滨商业大学学报(自然科学版),2016,32(2):150-153.
[6] 邵爽,邱瑾.金属离子对齐多夫定与牛血清白蛋白结合作用的影响[J].物理化学学报,2009,25(7):1342-1346.
Influence of Zn2+and Ca2+on interaction between quercetin and bovine serum albumin*
LI Jing,SUN Nan,SUN Yong-hui,ZOU Shu-jun*
(College of Pharmacy,Heilongjiang University of Chinese Medicine,Harbin 150040,China)
The interaction between quercetin and bovine serum albumin(BSA)was studied in the presence of Zn2+or Ca2+by using fluorescence spectroscopy.Investigate whether the presence of Zn2+or Ca2+has an influence on the fluorescence quenching mechanism of quercetin on BSA,the binding constants between quercetin and BSA,the binding site number and the type of force.The results indicated that Zn2+or Ca2+does not change the mechanism of fluorescence quenching mechanism of quercetin on BSA,does not change the type of force between quercetin and BSA.The number of binding sites is almost unchanged.But when Zn2+is present,the binding constant between quercetin and BSA decreases.And when Ca2+is present,the binding constant between quercetin and BSA will increase.So the two ions affect the protein binding concentration of quercetin.
quercetin;bovine serum albumin;Zn2+;Ca2+;binding reaction;fluorescence spectrometry
R96
A
10.16247/j.cnki.23-1171/tq.20171123
2017-07-20
黑龙江省科学院科学研究基金项目(XKJJ1601)
李 靖(1992-),女,在读硕士研究生,从事药物分析研究。
邹淑君(1974-),女,博士,副教授,从事药物活性及药物分析研究。

