酵母硒和硼联合添加对肉鸡免疫器官组织结构及免疫功能的影响
靳二辉,周金星,任 曼,胡倩倩,金光明,李升和
(安徽科技学院 动物科学学院,安徽 凤阳 233100)
酵母硒和硼联合添加对肉鸡免疫器官组织结构及免疫功能的影响
靳二辉,周金星,任 曼,胡倩倩,金光明,李升和*
(安徽科技学院 动物科学学院,安徽 凤阳 233100)
为研究酵母硒和硼联用对肉鸡免疫器官发育和免疫功能的影响,试验选用健康1日龄AA肉鸡1 200羽,随机分成对照组和处理Ⅰ、Ⅱ、Ⅲ、Ⅳ组,每组6个重复,每个重复40羽。对照组饲喂基础饲粮,处理Ⅰ~Ⅳ组在基础饲粮中添加0.3 mg·kg-1的酵母硒和硼(添加量分别为0、5、10、15 mg·kg-1),试验期42 d。结果显示:1)在21日龄,与对照组相比,处理Ⅱ和Ⅲ组肉鸡法氏囊器官指数,脾小结、动脉周围淋巴鞘和法氏囊小结面积及胸腺皮质厚度均显著(P<0.05)升高;处理Ⅱ组肉鸡血清新城疫病毒(NDV)抗体和干扰素-γ(INF-γ)水平,处理Ⅲ组肉鸡血清白细胞介素-2(IL-2)水平也均显著(P<0.05)升高。2)在42日龄,与对照组相比,处理Ⅱ和Ⅲ组肉鸡胸腺和法氏囊器官指数,脾小结、动脉周围淋巴鞘和法氏囊小结面积,胸腺皮质厚度以及血清NDV抗体和IL-2水平均显著(P<0.05)升高;处理Ⅱ组血清IgG和IFN-γ水平也显著(P<0.05)升高;处理Ⅰ组肉鸡胸腺和法氏囊器官指数及血清IgG水平显著(P<0.05)升高。显微观测可见,处理Ⅱ和Ⅲ组21 d和42 d肉鸡免疫器官组织结构均明显改善,脾脏白髓和红髓结构清晰,胸腺皮质和髓质分界明显,法氏囊小叶数量增多,排列紧密,且处理Ⅰ组肉鸡法氏囊小叶体积也明显增大。结果表明,酵母硒单独补充或与不同剂量的硼联合应用均可在一定程度上促进肉鸡免疫器官的发育,改善其组织结构,增加机体免疫功能,0.3 mg·kg-1酵母硒与5~10 mg·kg-1硼联用促进效果更为明显。
酵母硒;硼;肉鸡;免疫器官;组织结构;免疫功能
微量元素在动物机体生长发育及正常生理功能维持中起着非常重要的作用,摄入量不足或者缺乏可对动物的生产性能、免疫功能、繁殖性能等产生不同程度损害,而在一定的范围内适量补充微量元素则对动物机体诸多生理功能具有明显有益作用[1]。相关研究发现,微量元素的营养状况对于动物机体免疫功能的完整性以及营养、感染和健康之间的相互作用至关重要。微量元素(如硒、锌、铁)的缺乏可对动物机体的免疫活性产生负面影响,进而降低机体抗感染能力,而适量的补充某一种微量元素或者补充具有协同作用的多种微量元素,则能够增强皮肤的免疫屏障功能、免疫细胞的保护功能及B细胞的抗体分泌功能,进而提高动物机体免疫水平及抗病能力[2]。微量元素尤其是有机微量元素对动物机体的诸多有益作用为其在动物养殖生产中的广泛使用及绿色功能性畜禽产品的开发提供了基础,并逐渐引起人们的广泛关注。
硒是动物机体必需的微量元素之一,作为谷胱甘肽过氧化物酶(GSH-Px)的重要组成部分,参与调节机体多种生理功能[3]。适量的补充硒能够增强机体抗氧化功能和免疫功能[4],提高畜禽生产性能和屠宰性能[5],改善肌肉品质[6]。目前,用于饲料添加的硒源包括无机硒和有机硒2种,其中无机硒毒性较大,且不易被机体吸收,而有机硒则具有较高的生物安全性、易吸收性和生物利用效率。酵母硒是一种较好的有机硒产品,在畜牧业生产中被广泛应用。例如,李晓丽等[7]研究发现,日粮中补充0.3~0.4 mg·kg-1酵母硒可显著提高蛋鸡产蛋率和平均蛋重,降低料蛋比。罗霄等[8]研究显示,日粮添加0.3、0.6 mg·kg-1的酵母硒可提高断奶仔猪血清GSH-Px和超氧化物歧化酶(SOD)的活性,降低丙二醛(MDA)含量,增强机体抗氧化功能。于枫等[9]对热应激的研究表明,适量添加酵母硒可改善热应激奶牛血液生理指标,减弱热应激对奶牛产量的影响。王巧莉等[10]对肉鹅的研究显示,日粮中添加酵母硒可升高淋巴细胞转化率和鹅副粘病毒抗体效价,增强机体免疫功能。以上研究表明,日粮添加适量的酵母硒可提高畜禽生产性能、抗氧化功能和免疫功能。
硼是动物机体可能的必需微量元素之一,通过影响多种酶的活性及能量底物的利用,进而调节机体多种生理功能。许多研究发现,适量的补充硼可影响动物机体矿物质代谢,促进骨骼生长发育[11],影响畜禽生长速度和饲料利用率,提高生产性能[12],影响血浆激素水平,调节机体内分泌功能[13],影响机体抗氧化酶活性和细胞因子的分泌,增强机体抗氧化功能和免疫功能[14]。以上研究充分表明,单独适量补充酵母硒或硼对动物机体多种生理功能均可产生有益影响。然而,Stanley等[15]研究发现,日粮中同时添加高剂量的硒和硼能够加重对绿头鸭繁殖性能和幼鸭生长发育的损伤,导致体重下降,孵化成功率和幼鸭体重降低,表明硼和硒之间存在一定的相互作用,两者高剂量的联合添加可对机体产生一定的协同损伤作用。但是,适量的酵母硒和硼联合添加是否会对动物机体产生更好的有益促进效果却未见报道。为此,本试验以酵母硒与不同剂量的硼联合使用,研究其对肉鸡免疫器官发育、血清抗体水平和细胞因子分泌的影响, 旨在从免疫学角度为酵母硒和硼在肉鸡生产中的联合应用提供理论依据。
1 材料与方法
1.1 动物饲养与试验设计
试验选用健康1日龄爱拔益加(AA)肉鸡1 200羽(购自安徽万嘉禽业科技发展有限公司),按照单因素完全随机试验设计分为对照组和处理Ⅰ至Ⅳ组,每组240羽,设6个重复,每个重复40羽。对照组饲喂玉米-豆粕型基础饲粮,基础日粮中硼和硒的含量经某公司检测后分别为2.657 mg·kg-1和0.157 4 mg·kg-1;处理Ⅰ至Ⅳ组在基础饲粮中分别添加0.3 mg·kg-1酵母硒和不同剂量的硼(0、5、10、15 mg·kg-1),试验期42 d。肉鸡采用网上平养,自由采食和饮水,饲养管理参考肉鸡饲养管理要求进行,常规免疫程序接种疫苗。
1.2 基础日粮
基础日粮是根据NRC(1994)推荐的肉仔鸡营养需要配制玉米-豆粕型基础饲粮,基础饲粮组成及营养水平见表1。
1.3 酵母硒和硼
肉鸡饲料和酵母硒由合肥东升牧业有限公司提供,酵母硒中总硒含量经安徽省中医学院测定为670 mg·kg-1,其中有机硒含量在90%以上。硼酸(H3BO3)为分析纯,纯度≥99. 5%,其中硼含量≥17. 4%,购自国药集团化学试剂有限公司。
1.4 样品采集与处理
分别于试验第21天和42天每组随机选取肉鸡60羽(每个重复10羽),禁食不禁水12 h,采用一次性真空采血促凝管(SEKISUI MEDICAL(CHINA) CO.,LTD)进行翅静脉采血,颈静脉放血致死,迅速解剖取胸腺、脾脏、法氏囊,万分之一分析天平称重。血液样品室温静置2 h后,于4 ℃条件下948g离心15 min,分离血清,-70 ℃保存待用。
表1基础饲粮组成及营养水平(风干基础)
Table1Composition and nutrient levels of basal diet (air-dry basis)

原料Ingredients含量Content/%1~3周1-3weeks4~6周4-6weeks营养水平Nutrientlevels含量Content1~3周1-3weeks4~6周4-6weeks玉米Corn58.0062.00粗蛋白质CP/%21.4619.08豆粕Soybeanmeal32.0027.50赖氨酸Lys/%1.211.04鱼粉Fishmeal3.002.00蛋氨酸Met/%0.350.31大豆油Soybeanoil2.003.50代谢能ME/(MJ·kg-1)12.2612.73预混料Premix1)5.005.00钙Ca/%1.101.02合计Total100100总磷TP/%0.590.44
1)每千克预混料(1~3周)提供:VA 240 000 IU,VD354 000 IU,VE 560 IU,VK356 mg,VB116 mg,VB2108 mg,VB618 mg,VB120.25 mg,烟酸 650 mg,泛酸 240 mg,叶酸 12 mg,氯化胆碱 10 g,Cu 100~200 mg,Fe 400 mg,Zn 960~1 200 mg,Mn 960 mg,I 10 mg,Se 5~20 mg; Ca 14%~18%,总P 2.5%,食盐 4%~8%,水分 12% 。每千克预混料(4~6周)提供:VA 200 000 IU,VD350 000 IU,VE 480 IU,VK350 mg,VB116 mg,VB290 mg,VB618 mg,VB120.12 mg,烟酸600 mg,泛酸 240 mg,叶酸 8 mg,氯化胆碱 10 g,Cu 100~200 mg,Fe 400 mg,Zn 960~1200 mg,Mn 960 mg,I 10 mg,Se 5~20 mg,Ca 14%~18%,总 P 2.3%,食盐 4%~8%,水分 12%。
Notes:1)The per kg premix (1-3 weeks) provided the following: VA 240 000 IU, VD354 000 IU, VE 560 IU, VK356 mg, VB116 mg, VB2108 mg, VB618mg, VB120.25 mg, Nicotinic acid 650 mg, Pantothenic acid 240 mg, Folic acid 12 mg, Choline chloride 10 g, Cu 100-200 mg, Fe 400 mg, Zn 720-3 600 mg, Mn 960 mg, I 10 mg, Se 5-20 mg; Ca 14%-18%, total phosphorus 2.5%, sodium chloride 4%-8%, water 12%. The per kg premix (4-6 weeks) provided the following: VA 200 000 IU, VD350 000 IU, VE 480 IU, VK350 mg, VB116 mg, VB290 mg, VB618 mg, VB120.12 mg, Nicotinic acid 600 mg, Pantothenic acid 240 mg, Folic acid 8 mg, Choline chloride 10g, Cu 100-200 mg, Fe 400 mg, Zn 720-3 600 mg, Mn 960 mg, I 10 mg, Se 5-20 mg; Ca 14%-18%, total phosphorus 2.3%, sodium chloride 4%-8%, water 12%.
1.5 免疫器官指数测定
分别于试验第21天和42天每组随机选取肉鸡12羽(每个重复2羽),颈静脉放血致死,拔除羽毛后测定屠体重(精确到0.01 g),迅速分离胸腺、脾脏和法氏囊等免疫器官,吸干器官表面水分,剥离脂肪和无关组织,采用万分之一电子分析天平称重(精确到0.000 1 g)(ME-T,瑞士Mettler-Toledo公司),记录免疫器官质量,并计算免疫器官指数,器官指数=(器官质量/屠体质量)×100%。
1.6 石蜡切片与HE染色
肉鸡免疫器官固定后,经梯度乙醇脱水,二甲苯透明,石蜡包埋,石蜡轮转切片机(RM2235,Leica仪器有限公司,德国)连续横向切片,厚6 μm,每隔30张取2张切片用于HE染色,二甲苯透明,中性树胶封片。每羽肉鸡每个免疫器官分别取20张切片,用麦克奥迪BA410正置显微摄影系统(麦克奥迪厦门医疗诊断系统有限公司)观察,然后每张切片均匀选取5个视野拍照,显微图像分析软件(Image-Pro Plus 6.0)测量每个视野内免疫器官的不同组织学参数。
1.7 血清免疫球蛋白含量测定
肉鸡血清经室温融化后,采用ZY-360全自动血清生化分析仪(上海科华生物工程股份有限公司)测量血清IgA、IgM、IgG含量。
1.8 血清抗体水平和细胞因子含量测定
肉鸡血清经室温融化后,采用ELISA检测试剂盒(美国R&D Systems Inc)测定肉鸡血清新城疫病毒(NDV)抗体水平及白细胞介素-2(IL-2)、白细胞介素-4(IL-4)和干扰素-γ(INF-γ)含量。
1.9 数据统计

2 结果与分析
2.1酵母硒和硼联用对AA肉鸡免疫器官发育的影响
由表2可知,21日龄时,各处理组脾脏和胸腺指数与对照组相比均有所升高,但无显著性差异(P>0.05),且不同处理组之间相比也无显著变化(P>0.05);处理Ⅱ和Ⅲ组法氏囊指数与对照组相比分别升高124.33% 和143.10%(P<0.05),与处理Ⅰ组相比也分别升高89.94%和103.66%(P<0.05),与处理Ⅳ组相比也分别升高65.71% 和79.74%(P<0.05),但处理Ⅱ和Ⅲ组法氏囊指数相比无显著差异(P>0.05)。42日龄时,与对照组相比,处理Ⅱ组脾脏指数升高67.59%(P<0.05),而Ⅰ、Ⅲ和Ⅳ组脾脏指数无显著变化(P>0.05);处理Ⅰ、Ⅱ和Ⅲ组胸腺指数分别升高21.99%、35.92% 和26.91%(P<0.05),而处理Ⅳ组胸腺指数较处理Ⅰ、Ⅱ和Ⅲ组相比分别降低16.69%、30.00% 和21.39%(P<0.05);处理Ⅰ、Ⅱ和Ⅲ组法氏囊指数分别升高36.38%、91.47%和53.53%(P<0.05),且处理Ⅱ组法氏囊指数较处理Ⅰ、Ⅲ和Ⅳ组也分别升高40.40%、24.71%和62.58%(P<0.05),但处理Ⅳ组法氏囊指数较处理Ⅲ组降低30.36%(P<0.05)。
表2酵母硒和硼联用对AA肉鸡免疫器官指数的影响
Table2Combined effects of yeast selenium and boron on immune organs index of AA broilers 10-2

日龄Age/d免疫器官Immuneorgans组别Groups对照组Controlgroup处理Ⅰ组Exp.Ⅰ处理Ⅱ组Exp.Ⅱ处理Ⅲ组Exp.Ⅲ处理Ⅳ组Exp.Ⅳ21脾脏Spleen9.17±0.3711.31±4.2912.36±3.6811.77±2.710.82±2.69胸腺Thymus35.87±8.4638.12±1.5942.95±3.1539.99±9.2837.17±4.32法氏囊BursaofFabricius10.07±0.061b12.02±1.72b22.59±6.04a24.48±1.23a13.62±0.29b42脾脏Spleen9.07±2.03b12.01±2.29ab15.21±0.98a12.33±0.20ab10.23±0.99b胸腺Thymus24.64±0.059b30.06±2.57a33.49±1.68a31.27±1.38a25.76±0.21b法氏囊BursaofFabricius9.62±0.13d13.12±0.61bc18.42±1.55a14.77±0.60b11.33±0.83cd
同行无字母或有相同小写字母表示数据间差异不显著(P>0.05),无相同小写字母表示数据间差异显著(P<0.05)。下表同。
In the same row, the values with no letter or the same letter mean no significant difference (P>0.05), while the values without the same lowercase letter means significant difference (P<0.05). The same as below.
2.2酵母硒和硼联用对AA肉鸡免疫器官组织结构的影响
由图1和表3可见,21日龄时,对照组肉鸡脾脏组织结构正常,脾小结和动脉周围淋巴鞘结构清晰,大小适中(图1-A);胸腺小叶结构清晰,皮质厚度和髓质面积适中,皮质内淋巴细胞密集,髓质内淋巴细胞疏松,可见许多胸腺小体(图1-B);法氏囊组织结构正常,法氏囊小叶较大,法氏囊小结也较大,排列疏松(图1-C)。与对照组相比,处理Ⅰ组肉鸡脾脏淋巴细胞增多,排列紧密,脾小结轮廓清晰,脾动脉周围淋巴鞘和脾小结面积分别增大22.40%和8.06%,但差异不显著(P>0.05);脾索和脾窦变化不大(图1-D);胸腺皮质和髓质分界明显,皮质厚度增加12.93%(P>0.05),边缘淋巴细胞排列密集(图1-E);法氏囊小叶大小无明显变化,但法氏囊小结面积显著增大13.04%(P<0.05)(图1-F)。处理Ⅱ和Ⅲ组肉鸡脾脏白髓结构更加清晰,脾小结数量增多,脾动脉周围淋巴鞘面积分别增大26.95%和25.00%(P<0.05),脾小结面积也分别增大18.21%和22.39%(P<0.05),脾索增粗,脾窦变窄(图1-G和J);胸腺皮质明显增厚,厚度分别增加34.33%和23.75%(P<0.05),髓质面积减小,其内胸腺小体较少(图1-H和K);法氏囊小叶增大,法氏囊小结面积也分别增大45.16%和30.57%(P<0.05),数量明显增多,皮质和髓质分界明显,淋巴细胞排列紧密(图1-I和L)。处理Ⅳ组脾脏组织结构变化不大,脾动脉周围淋巴鞘和脾小结均有所增大(P>0.05),中央动脉增厚,脾窦变宽(图1-M);胸腺皮质和髓质结构清晰,皮质厚度增加11.31%(P<0.05),淋巴细胞排列疏松(图1-N);法氏囊小叶较小,但法氏囊小结数量较多,排列紧密,皮质和髓质分界明显(图1-O)。

A-C,对照组;D-F,处理Ⅰ组;G-I,处理Ⅱ组;J-L,处理Ⅲ组;M-O,处理Ⅳ组;A、D、G、J、M,脾脏(40×);B、E、H、K、N,胸腺(10×);C、F、I、L、O,法氏囊(4×)。图2同A-C, Control group; D-F, Exp. Ⅰ; G-I, Exp. Ⅱ; J-L, Exp. Ⅲ; M-O, Exp. Ⅳ; A, D, G, J and M, Spleen (40×); B, E, H, K and N, Thymus (10×); C, F, I, L and O, Bursa of Fabricius (4×). Fig. 2 is the same图1 酵母硒和硼联用对21 d肉鸡免疫器官组织结构的影响Fig.1 Combined effects of yeast selenium and boron on immune organ microstructure of 21-day-old broilers
由图2和表3可见,42日龄时,对照组肉鸡脾脏、胸腺和法氏囊组织结构正常,但与21日龄相比脾小结和动脉周围淋巴鞘明显增大,胸腺皮质增厚,法氏囊小叶和法氏囊小结也明显增大(图2-A、B和C)。与对照组相比,处理Ⅰ组肉鸡脾脏、胸腺和法氏囊组织结构变化不大,脾动脉周围淋巴鞘有所增大,但差异不显著(P>0.05),其内淋巴细胞排列疏松(图2-D),胸腺皮质厚度变薄,但差异也不显著(P>0.05)(图2-E),法氏囊小结明显增大21.04%(P<0.05),排列紧密(图2-F)。处理Ⅱ和Ⅲ组肉鸡免疫器官组织结构明显改善,脾脏白髓和红髓结构更加清晰,脾小结增多,面积分别增大19.64%和22.62%(P<0.05),脾动脉周围淋巴鞘面积也分别增大42.37%和27.56%(P<0.05),其内淋巴细胞排列紧密,脾索增粗,脾窦明显变窄(图2-G和J);处理Ⅲ组胸腺小叶增大,皮质厚度明显增加20.40%(P<0.05),髓质内淋巴细胞增多(图2-H和K);法氏囊小叶增大,法氏囊小结数量增多,排列紧密,面积分别增大39.08%和36.55%(P<0.05)(图2-I和L)。处理Ⅳ组肉鸡脾脏和法氏囊组织结构无明显变化(图2-M和N),但胸腺皮质厚度有所减小(P>0.05),髓质内淋巴细胞排列疏松,胸腺小体较多(图2-O)。
2.3酵母硒和硼联用对AA肉鸡血清免疫球蛋白含量的影响
由表4可知,21日龄时,对照组与各处理血清IgA和IgM含量相比均无显著变化(P>0.05);各处理组血清IgG含量较对照组均有所升高,但仍无显著差异(P>0.05)。42日龄时,与对照组相比较,处理Ⅲ组血清IgA含量升高14.29%(P<0.05),且处理Ⅲ组血清IgA含量较处理Ⅰ和Ⅱ也分别升高14.29% 和14.29%(P<0.05);处理Ⅱ和Ⅳ组血清IgG含量分别升高41.12% 和35.51%(P<0.05),但各处理组之间相比无显著差异(P>0.05);各处理组血清IgM含量均有所升高,但无统计学意义(P>0.05)。
2.4酵母硒和硼联用对AA肉鸡血清NDV抗体水平的影响
由表5可知,21日龄时,处理Ⅱ组血清NDV抗体水平与对照组和处理Ⅳ组相比分别显著升高22.68% 和20.08%(P<0.05),但与处理Ⅰ和Ⅲ组相比无显著变化(P>0.05)。42日龄时,处理Ⅱ和Ⅲ组血清NDV抗体水平与对照组相比分别升高121.69% 和73.31%(P<0.05),且处理Ⅱ组与处理Ⅰ和Ⅳ组相比较也分别升高63.04% 和47.02%(P<0.05),但处理Ⅱ组与处理Ⅲ组相比较,血清NDV抗体水平无显著变化(P>0.05)。
2.5酵母硒和硼联用对AA肉鸡血清细胞因子含量的影响
由表6可知,21日龄时,处理Ⅲ和Ⅳ组肉鸡血清IL-2水平与对照组相比较分别升高66.92%和38.42%(P<0.05),与处理Ⅱ组相比较分别升高63.25% 和35.37%(P<0.05),且处理Ⅲ组血清IL-2水平与处理Ⅰ相比较也升高39.45%(P<0.05),但处理Ⅰ和Ⅱ组血清IL-2水平与对照组相比较均无显著差异(P>0.05);各处理组肉鸡血清IL-4水平与对照组相比较以及各处理组之间相比较均无显著变化(P>0.05);处理Ⅱ组肉鸡血清INF-γ水平与处理Ⅰ组相比较升高26.88%(P<0.05),但处理Ⅰ组血清INF-γ水平与对照组和处理Ⅲ组相比均无显著差异(P>0.05)。42日龄时,处理Ⅱ和Ⅲ组肉鸡血清IL-2水平与对照组相比较分别升高26.36% 和38.81%(P<0.05),与处理Ⅰ组相比较分别升高26.84% 和39.34%(P<0.05),但是处理Ⅰ组血清IL-2水平与对照组和处理Ⅳ组相比较均无显著差异(P>0.05);各处理组肉鸡血清IL-4水平与对照组相比较以及各处理组之间相比较仍均无显著变化(P>0.05);处理Ⅱ组肉鸡血清INF-γ水平与对照组相比较升高19.98%(P<0.05),与处理Ⅰ、Ⅲ和Ⅳ组相比较分别升高17.54%、27.82% 和29.58%(P<0.05),但对照组血清INF-γ水平处理Ⅰ、Ⅲ和Ⅳ组相比较均无显著差异(P>0.05)。

图2 酵母硒和硼联用对42 d肉鸡免疫器官组织结构的影响Fig.2 Combined effect of yeast selenium and boron on immune organ microstructure of 42-day-old broilers
表3酵母硒和硼联用对AA肉鸡免疫器官组织学参数的影响
Table3Combined effects of yeast selenium and boron on histological parameters of immune organs of AA broilers
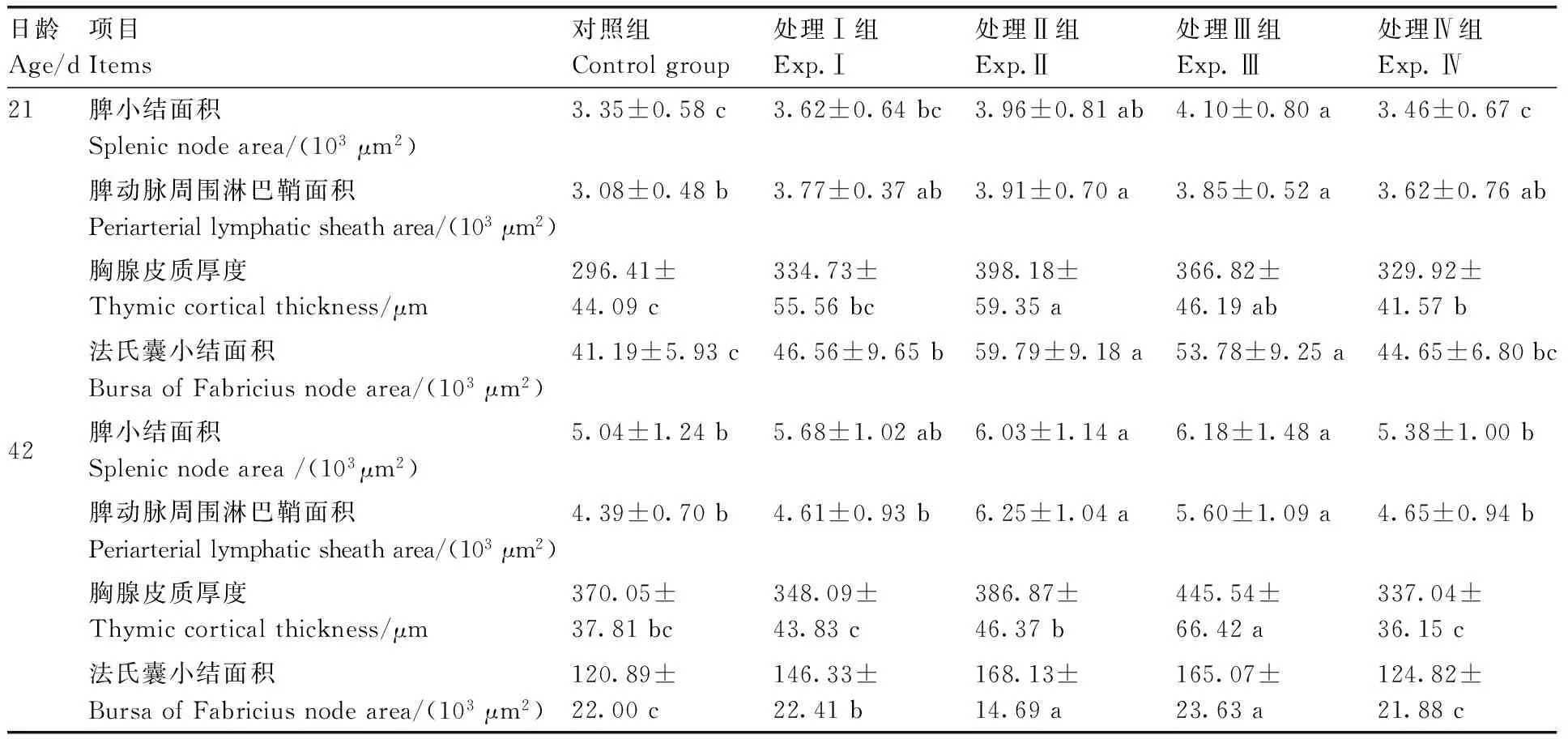
日龄Age/d项目Items对照组Controlgroup处理Ⅰ组Exp.Ⅰ处理Ⅱ组Exp.Ⅱ处理Ⅲ组Exp.Ⅲ处理Ⅳ组Exp.Ⅳ21脾小结面积Splenicnodearea/(103μm2)3.35±0.58c3.62±0.64bc3.96±0.81ab4.10±0.80a3.46±0.67c脾动脉周围淋巴鞘面积Periarteriallymphaticsheatharea/(103μm2)3.08±0.48b3.77±0.37ab3.91±0.70a3.85±0.52a3.62±0.76ab胸腺皮质厚度Thymiccorticalthickness/μm296.41±44.09c334.73±55.56bc398.18±59.35a366.82±46.19ab329.92±41.57b法氏囊小结面积BursaofFabriciusnodearea/(103μm2)41.19±5.93c46.56±9.65b59.79±9.18a53.78±9.25a44.65±6.80bc42脾小结面积Splenicnodearea/(103μm2)5.04±1.24b5.68±1.02ab6.03±1.14a6.18±1.48a5.38±1.00b脾动脉周围淋巴鞘面积Periarteriallymphaticsheatharea/(103μm2)4.39±0.70b4.61±0.93b6.25±1.04a5.60±1.09a4.65±0.94b胸腺皮质厚度Thymiccorticalthickness/μm370.05±37.81bc348.09±43.83c386.87±46.37b445.54±66.42a337.04±36.15c法氏囊小结面积BursaofFabriciusnodearea/(103μm2)120.89±22.00c146.33±22.41b168.13±14.69a165.07±23.63a124.82±21.88c
表4酵母硒和硼联用对AA肉鸡血清IgA、IgG和IgM含量的影响
Table4Combined effects of yeast selenium and boron on IgA, IgG and IgM in serum of AA broilers g·L-1

日龄Age/d项目Items对照组Controlgroup处理Ⅰ组Exp.Ⅰ处理Ⅱ组Exp.Ⅱ处理Ⅲ组Exp.Ⅲ处理Ⅳ组Exp.Ⅳ21IgA0.036±0.0030.034±0.0020.036±0.0020.035±0.0010.035±0.001IgG0.077±0.0130.083±0.0010.084±0.0040.083±0.0070.081±0.002IgM0.030±0.0020.027±0.0010.028±0.0010.028±0.0010.027±0.00442IgA0.035±0.002b0.035±0.002b0.035±0.000b0.040±0.005a0.037±0.001abIgG0.107±0.031b0.136±0.030ab0.151±0.006a0.140±0.000ab0.145±0.010aIgM0.029±0.0010.030±0.0010.029±0.0010.031±0.0020.031±0.003
表5酵母硒和硼联用对AA肉鸡血清NDV抗体水平的影响
Table5Combined effects of yeast selenium and boron on serum NDV level of AA broilers pg·mL-1

日龄Age/d对照组Controlgroup处理Ⅰ组Exp.Ⅰ处理Ⅱ组Exp.Ⅱ处理Ⅲ组Exp.Ⅲ处理Ⅳ组Exp.Ⅳ21423.33±40.07b450.00±7.07ab547.50±64.82a473.75±21.8ab441.25±37.12b42236.25±79.55c321.25±7.66bc523.75±81.91a409.44±62.97ab356.25±13.55bc
表6酵母硒和硼联用对AA肉鸡血清细胞因子含量的影响
Table6Combined effects of yeast selenium and boron on cytokines level in serum of AA broilers ng·L-1

日龄Age/d项目Items对照组Controlgroup处理Ⅰ组Exp.Ⅰ处理Ⅱ组Exp.Ⅱ处理Ⅲ组Exp.Ⅲ处理Ⅳ组Exp.Ⅳ21IL-246.70±5.83c55.90±5.36bc47.75±4.35c77.95±7.84a64.64±5.01abIL-454.70±4.0352.61±3.3056.23±3.5453.02±3.5460.36±0.56INF-γ31.00±2.78ab29.76±2.61b37.76±1.03a34.41±1.84ab34.98±0.29ab42IL-252.54±4.79b52.34±4.47b66.39±2.67a72.93±4.15a62.01±9.45abIL-472.58±2.8771.17±6.1574.09±3.4774.91±0.2471.32±1.22INF-γ39.29±1.96b40.13±1.81b47.14±1.21a36.88±1.71b36.38±3.76b
3 讨论
3.1酵母硒和硼联用对肉鸡免疫器官发育的影响
家禽的免疫器官主要包括胸腺、脾脏和法氏囊,其中胸腺和法氏囊属于中枢免疫器官,其主要功能是培育产生T和B淋巴细胞,两者生长发育的正常对于T和B淋巴细胞的增殖、分化以及细胞和体液免疫功能的维持至关重要。脾脏为机体最重要的外周免疫器官,是机体产生免疫应答的场所,其生长发育的正常对于维持机体免疫反应对抗体内外病原入侵至关重要。相关研究发现,适量的补充酵母硒或硼可对动物机体免疫器官的发育产生促进作用。日粮中添加0.3 mg·kg-1的酵母硒能够显著增加28 d和63 d肉鹅胸腺、脾脏和法氏囊的器官指数,促进中枢和外周免疫器官的生长发育[16]。饮水补充100 mg·L-1的硼可提高6周龄固始鸡脾脏和法氏囊质量及器官指数,显著增加3-6周龄固始鸡胸腺质量和器官指数,并改善胸腺的组织结构[17]。免疫器官质量和指数是其生长发育情况的反映,也可用于评价机体的免疫功能状态[18]。本研究发现,日粮中单独添加酵母硒或酵母硒与5、10 mg·kg-1硼联用均可显著增加42 d肉鸡胸腺、脾脏和法氏囊的器官指数,且酵母硒与5、10 mg·kg-1硼联用还能显著增加21 d肉鸡法氏囊器官指数。这表明酵母硒单独使用或与硼联用均可促进免疫器官的发育,增强机体免疫功能,但酵母硒与适量的硼联用效果更为明显,暗示硒和硼对免疫器官的生长发育可产生一定的协同作用,其主要原因是酵母硒能够改善肠道菌群,提高肠道消化酶的活性,而硼能够促进小肠发育,改善小肠的组织结构,进而增加小肠的吸收功能[19-21],两者联合使用后,硼通过改善肠道的形态结构,为肠道菌群的生长及平衡提供良好的环境,硒又进一步通过调节肠道微生物菌群平衡,增强肠道的吸收能力,这比单独添加酵母硒更加有利于肠道对营养物质的吸收,为免疫器官的生长发育提供充足的营养物质,最终对免疫器官的生长发育产生更好的促进作用。另外,硼的补充对硒的生物学功能也能够产生一定的影响。Hoffman等[22]研究发现,日粮中添加相同剂量的硼与不同剂量的硒,对野鸭的生长、血清生化指标和低蛋白饮食的存活率产生了并不一致的影响,这表明硼与硒之间存在明显的相互作用。但Xu等[23]研究显示,饮食中补充不同剂量的硒对大骨节病患者毛发中硼的水平没有产生影响,暗示补充硒对动物机体吸收和利用硼的影响不明显,这与Hoffman等的研究结果明显有所不同,其原因为何需要进一步研究证实。同时,本研究还发现,酵母硒与15 mg·kg-1硼联用则仅仅显著增加42 d肉鸡法氏囊器官指数,对胸腺和脾脏器官指数的增加不明显,这表明随着硼补充量的增加,酵母硒与硼联用效果有所减弱,其主要原因可能是:一方面硼的摄入增加逐渐影响了机体对饲料中其他微量元素的吸收利用[24],另一方面硼的添加量已经超过动物的最低营养需要量,但还未达到硼对动物的最低毒性剂量[25],这使得机体逐渐对摄入的硼不能完全利用,进而造成硼对肉鸡胃肠功能的有益作用逐渐减弱。
3.2酵母硒和硼联用对肉鸡免疫器官组织结构的影响
器官的生理功能是由相应的组织结构所决定,而组织结构是评价器官发育状况的又一重要指标。在不同器官中,执行功能的组织结构变化可以直接反映该器官的发育状况和功能情况。为此,本研究通过观察肉鸡免疫器官中执行功能的组织结构变化,进一步分析酵母硒和硼联用对免疫器官生长发育和免疫功能的影响。研究发现,酵母硒或硼的适量添加均能够改善动物免疫器官的组织结构。王海娜[26]对小鼠的研究发现,饲料中缺硒可导致小鼠发育迟缓,生殖器官损伤,曲细精管管壁变薄,生精细胞数量减少,而适量的补充酵母硒可明显改善小鼠睾丸组织结构,曲细精管增大,生精细胞增多,排列整齐。陈大伟等[27]研究显示,日粮中补充适量的酵母硒,能够在一定程度上减弱铅中毒对蛋鸡肾脏组织结构的损伤,改善肾脏的病理变化。王珏等[28]对肉鸡的研究也发现,适量的补充中草药酵母硒能够增加胸腺和法氏囊的器官指数,增大胸腺小叶面积和皮质增厚,减少胸腺小体数量,使法氏囊小结体积增大,退化延迟。另外,李升和等[29-30]研究表明,饮水补充适量的硼能够促进3~6周龄固始鸡免疫器官的生长发育,改善组织结构,使脾小结数量增多,体积增大,动脉周围淋巴鞘显著增厚,胸腺小叶增大,皮质增厚,法氏囊皱襞变大,淋巴滤泡增多。本研究也发现,日粮中单独添加0.3 mg·kg-1的酵母硒能够使21 d和42 d肉鸡法氏囊小结明显增大,数量增多,脾小结和动脉周围淋巴鞘面积也有所增大。而0.3 mg·kg-1的酵母硒分别与5、10 mg·kg-1的硼联合补充,则能够显著增加21 d和42 d肉鸡脾小结、脾动脉周围淋巴鞘和法氏囊小结面积及胸腺皮质厚度,使脾小结和法氏囊小结数量增多,脾索增粗,胸腺小叶内淋巴细胞数量增加,这表明酵母硒和硼的联合使用能够更为明显的改善肉鸡免疫器官组织结构,促进其生长发育。其主要原因可能是,适量的补充硼能够改善胃的组织结构,促进胃的发育,有利于饲料中营养物质的消化[31],且经胃吸收的硼还可以调节多种酶的活性,进而影响蛋白质、脂类、碳水化合物和无机盐等营养物质的代谢,这进一步提高了营养物质的易消化性[32]。另外,酵母硒和硼均能够增强机体的抗氧化功能,进而减少体内外因素诱导的淋巴细胞凋亡[10,33],这也为淋巴细胞的增殖发育提供了良好的保护,最终使免疫器官组织结构明显改善。
3.3酵母硒和硼联用对肉鸡免疫功能的影响
动物机体的免疫功能包括特异性免疫和非特异性免疫,特异性免疫反应又包括体液免疫和细胞免疫,体液免疫主要由B淋巴细胞产生抗体来介导,细胞免疫主要由T淋巴细胞及其分泌的细胞因子来介导。T淋巴细胞根据功能不同,可分为辅助性T细胞(CD4+T细胞)、细胞毒性T细胞(CD8+T细胞)、效应T细胞、抑制性T细胞、记忆性T细胞、迟发型变态反应T细胞等[34],其中,CD4+T细胞具有协助体液免疫和细胞免疫的功能。CD4+T细胞根据分泌细胞因子的类型不同又分为Th1和Th2亚型,Th1型细胞主要分泌IL-2、IFN-γ等细胞因子,能够辅助抗体产生,参与细胞免疫和迟发型超敏性炎症反应。Th2型细胞主要分泌IL-4、白细胞介素-6(IL-6)等细胞因子,能够刺激B淋巴细胞增殖并分泌抗体,参与体液免疫[35]。因此,通过检测血清中免疫球蛋白含量、特异性抗体以及Th1和Th2型细胞因子的水平可以直接反映动物机体的免疫功能状态。研究发现,日粮中添加适量的酵母硒可显著增加马血浆狂犬病毒抗体水平以及细胞因子白细胞介素-1(IL-1)、白细胞介素-5(IL-5)和白细胞介素-8(IL-8)的水平[36],提高淋巴细胞转化率,增强机体免疫功能[16]。同样,日粮中适量添加硼,可明显提高猪血清中肿瘤坏死因子-α(TNF-α)和INF-γ的水平[37],增加血液白细胞的数量和分叶核嗜中性粒细胞的比例,提高抗病能力[38]。本研究也发现,单独添加酵母硒或酵母硒与硼联用均可不同程度增加21 d和42 d肉鸡血清IgA、IgG和IgM含量以及NDV抗体和细胞因子IL-2、INF-γ的水平,其中酵母硒与5 mg·kg-1硼联用可显著升高21日龄肉鸡血清NDV抗体以及42日龄肉鸡血清IgG、NDV抗体、IL-2和INF-γ水平,酵母硒与10 mg·kg-1硼联用可显著升高21d肉鸡血清IL-2以及42d肉鸡血清IgA、NDV抗体和IL-2水平,这表明酵母硒与硼联用对机体免疫功能可产生更好的促进作用,这与Fairbrother等[39]的研究结果相一致。Fairbrother等[39]研究发现,增加硒和硼的摄入量可促进反嘴鹬的生长,增加血液和中性粒细胞和淋巴细胞的比例以及淋巴细胞对刀豆A的增殖活性,进而增强机体免疫功能,这表明硼与酵母硒联用对机体免疫功能具有明显的协同促进作用。其可能原因是,一方面硼通过影响机体多种代谢酶的活性促进了硒的利用及硒蛋白的合成,进而提高机体抗氧化酶SOD和GASH-Px的活性,增强机体抗氧化功能,及时清除免疫器官内的氧自由基,减弱脂质过氧化反应,促进淋巴细胞增殖分化[40-41]。另一方面,硼还参与能量底物的代谢,其与烟酰胺腺嘌呤二核苷酸(NAD+)或环腺苷二磷酸(cADP)核糖结合抑制细胞Ca2+释放,进而影响淋巴细胞增殖分化[32]。
4 结论
研究结果表明,酵母硒与适量的硼联用对AA肉鸡的免疫器官发育和免疫功能有明显促进作用,可不同程度增加免疫器官指数、血清IgA和IgG含量、血清NDV抗体以及细胞因子IL-2和INF-γ水平,改善免疫器官组织结构,促进其生长发育,并以0.3 mg·kg-1酵母硒和5~10 mg·kg-1硼的联用效果较好。
[1] 张江. 有机微量元素对家畜免疫、健康、生产和繁殖的影响[J]. 国外畜牧学-猪与禽,2015(2):73-74.
ZHANG J. Effects of organic trace elements on immunity, health, production and reproduction of domestic animals[J].AnimalScienceAbroad:PigsandPoultry, 2015(2):73-74. (in Chinese)
[2] MAGGINI S, WINTERGERST E S, BEVERIDGE S, et al. Selected vitamins and trace elements support immune function by strengthening epithelial barriers and cellular and humoral immune responses[J].BritishJournalofNutrition, 2007, 98(Suppl.1):S29-S35.
[3] BENTON D. Selenium intake, mood and other aspects of psychological functioning[J].NutritionalNeuroscience, 2013, 5(6): 363-374.
[4] 陈国顺,吴劲峰,李冲. 不同来源硒对肉鸡生产性能、免疫功能和抗氧化性能的影响[J]. 中国家禽,2014,36(11):22-25.
CHEN G S, WU J F, LI C. Effect of different selenium sources on production performance, immune function and antioxidant capacity of broilers[J].ChinaPoultry, 2014, 36(11):22-25. (in Chinese with English abstract)
[5] CHEN G, WU J, LI C. Effect of different selenium sources on production performance and biochemical parameters of broilers[J].JournalofAnimalPhysiologyandAnimalNutrition, 2014, 98(4):747-754.
[6] 陈忠法,俞信光,韩泽建. 不同硒源对肉仔鸡生长性能和肉质的影响[J]. 浙江农业学报,2003, 15(4):250-254.
CHEN Z F, YU X G, HAN Z J. Effects of different selenium resources on growth performance and meat quality in broiler[J].ActaAgriculturaeZhejiangensis, 2003, 15(4):250-254. (in Chinese with English abstract)
[7] 李晓丽,何万领,位治国,等. 酵母硒对蛋鸡生产性能、血清生化指标及常规蛋品质的影响[J]. 中国兽医学报,2015,35(11):1838-1839.
LI X L, HE W L, WEI Z G, et al. Effects of yeast-Se on production performance, serum biochemical parameters and egg quality of laying hens[J].ChineseJournalofVeterinaryScience, 2015, 35(11):1838-1839. (in Chinese with English abstract)
[8] 罗霄,方俊,刘刚,等. 日粮中添加酵母硒对断奶仔猪生长性能及抗氧化性能的影响[J]. 饲料工业,2015,36(6):6-10.
LUO X, FANG J, LIU G, et al. Effect of dietary yeast selenium on the growth performance and antioxidant properties of Duroc×Landrace×Yorkshire weaned piglets[J].FeedIndustry, 2015, 36(6):6-10. (in Chinese in Chinese with English abstract)
[9] 于枫,徐海滨,陈凤梅,等. 酵母硒与酵母多糖联合应用对奶牛抗热应激的作用[J]. 动物医学进展,2016,37(1):34-37.
YU F, XU H B, CHEN F M, et al. Effect of selenium yeast combined with yeast polysaccharide on anti-heat stress in dairy cows[J].ProgressinVeterinaryMedicine, 2016, 37(1):34-37. (in Chinese with English abstract)
[10] 王巧莉,王宝维,范永存,等. 酵母硒对肉鹅免疫和抗氧化指标的影响[J]. 动物营养学报,2009,21(3):398-404.
WANG Q L, WANG B W, FAN Y C, et al. Effects of selenium yeast on immune and anti-oxidation indices of geese[J].ActaZoonutrimentaSinica, 2009, 21(3):398-404. (in Chinese with English abstract)
[11] MEHMET B, KAMIL K, ABDULLAH U, et al. Effects of boron supplementation to diets deficient in calcium and phosphorus on performance with some serum, bone and fecal characteristics of broiler chickens[J].AsianAustralasianJournalofAnimalSciences, 2012, 25(2):248-255.
[12] MIZRAK C, YENICE E, CAN M, et al. Effects of dietary boron on performance, egg production, egg quality and some bone parameters in layer hens[J].SouthAfricanJournalofAnimalScience, 2010, 40(3):257-264.
[13] BAKKEN N A, HUNT C D. Dietary boron decreases peak pancreatic in situ insulin release in chicks and plasma insulin concentrations in rats regardless of vitamin d or magnesium status[J].JournalofNutrition, 2003, 133(11):3577-3583.
[14] NAGHII M R, MOFID M, ASGARI A R, et al. Comparative effects of daily and weekly boron supplementation on plasma steroid hormones and proinflammatory cytokines[J].JournalofTraceElementsinMedicineandBiology, 2011, 25(1):54-58.
[15] STANLEY T R, SMITH G J, HOFFMAN D J, et al. Effects of boron and selenium on mallard reproduction and duckling growth and survival[J].EnvironmentalToxicologyandChemistry, 1996, 15(7):1124- 1132.
[16] 王宝维,王娜,葛文华,等. 不同硒源对鹅早期生产性能、屠宰性能、肉品质、肌肉常规养分、免疫与抗氧化功能的影响[J]. 中国农业科学,2011,44(14):3016-3026.
WANG B W, WANG N, GE W H, et al. Effects of different selenium sources on production performance, slaughter performance, meat quality, immune and antioxidant in the early goose[J].ScientiaAgriculturaSinica, 2011, 44(14):3016-3026. (in Chinese with English abstract)
[17] JIN E H, GU Y F, WANG J, et al. Effect of supplementation of drinking water with different levels of boron on the performance and immune organ parameters of broilers[J].ItalianJournalofAnimalScience, 2014, 13(2):24-134.
[18] RIVAS A L, FABRICANT T. Indication of immunodepression in chicken infected various strain of Marek’s disease virus[J].AvianDiseases, 1988, 32(1):1-8.
[19] 刘扬,冯琳,赵波,等. 豆粕替代部分鱼粉饲料中添加核苷酸和有机硒对幼建鲤生长和消化吸收功能的影响[J]. 四川农业大学学报,2012,30(2):238-242.
LIU Y, FENG L, ZHAO B, et al. Effects of nucleotides and organic selenium supplementation on growth and digestive ability of juvenile jian carp (Cyprinuscarpiovar. jian) in diets with partial substitution of fish meal by soybean meal[J].JournalofSichuanAgriculturalUniversity, 2012, 30(2):238-242. (in Chinese with English abstract)
[20] 刘红露,范磊,戴茜茜,等. 面包酵母硒与酪酸梭菌制剂对肉鸡生长、抗氧化和肠道菌群的影响[J]. 浙江农业学报,2015,27(9):1529-1534.
LIU H L,FAN L, DAI X X, et al. Effects ofSaccharomycescerevisiaeselenium andClostridiumbutyricumadditive on growth, antioxidant ability and intestinal microflora[J].ActaAgriculturaeZhejiangensis, 2015, 27(9):1529-1534. (in Chinese with English abstract)
[21] 王珏,李升和,金光明,等. 饮水硼对动物空肠发育的影响[J]. 微量元素与健康研究,2007,24(2):1-4.
WANG J, LI S H, JIN G M, et al. Effect of drinking-boron on jejunum development of animal[J].StudiesofTraceElementsandHealth, 2007, 24(2):1-4. (in Chinese with English abstract)
[22] HOFFMAN D J, SANDERSON C J, LECAPTAIN L J, et al. Interactive effects of arsenate, selenium, and dietary protein on survival, growth, and physiology in mallard ducklings[J].ArchivesofEnvironmentalContaminationandToxicology, 1991, 20(2):163-171.
[23] XU P, ZENG L X, SCHRAUZER G N, et al. Selenium, boron, and germanium deficiency in the etiology of Kashin-Beck disease[J].BiologicalTraceElementResearch, 2000, 77(3):193-197.
[24] 邓俊良,陈俊杰,左之才,等. 硼对铜中毒肉用乌骨鸡肝铜含量及肝功能的影响[J]. 中国兽医学报,2009,29(5):657-660.
DENG J L, CHEN J J, ZUO Z C, et al. Effects of copper content in liver and liver function indexes of black bone broiler by increasing boron anti copper poisoning[J].ChineseJournalofVeterinaryScience, 2009, 29(5):657-660. (in Chinese with English abstract)
[25] 秦俊法. 硼的生物必需性及人体健康效应[J]. 广东微量元素科学,1999(9):1-14.
QIN J F. Biological essentiality of boron and its health effects in humans[J].GuangdongTraceElementsScience, 1999(9):1-14. (in Chinese with English abstract)
[26] 王海娜. 有机硒对小鼠生殖生理功能影响的研究 [D]. 贵阳:贵州大学,2009.
WANG H N. The effect of organic selenium on reproductive physiology function in mouse [D]. Guiyang: Guizhou University, 2009. (in Chinese with English abstract)
[27] 陈大伟,陆俊贤,蒲俊华,等. 铅对蛋鸡肾脏的氧化损伤及酵母硒的保护效应研究[J]. 中国家禽,2014,36(21):27-31.
CHEN D W, LU J X, PU J H, et al. Oxidative damage caused by lead on kidney of layers and protective effect of yeast selenium[J].ChinaPoultry, 2014, 36(21):27-31. (in Chinese with English abstract)
[28] 王珏,黄亚军,梁林,等. 中药富硒酵母对动物中枢免疫器官发育的影响[J]. 微量元素与健康研究,2009,26(2):8-11.
WANG J, HUANG Y J, LIANG L, et al. Effect of Se-enriched yeast cultured in Chinese medicine on development of central immune organ in animal[J].StudiesofTraceElementsandHealth, 2009, 26(2):8-11. (in Chinese with English abstract)
[29] 李升和,范光丽,彭克美,等. 不同硼水平对固始鸡脾发育的影响[J]. 中国兽医科学,2008,38(1):63-67.
LI S H, FAN G L, PENG K M, et al. Effects of different doses of boron on development of spleen in Gushi chicken[J].ChineseVeterinaryScience, 2008, 38(1):63-67. (in Chinese with English abstract)
[30] 李升和,范光丽,顾有方,等. 饮水硼对固始鸡中枢免疫器官发育的影响[J]. 西北农林科技大学学报(自然科学版),2009,37(2):52-58.
LI S H, FAN G L, GU Y F, et al. Effect of drinking boron supplemented on the development of center immune organs in Gushi chickens[J].JournalofNorthwestA&FUniversity(NaturalScienceEdition), 2009, 37(2):52-58. (in Chinese with English abstract)
[31] 李升和,彭克美,马云初,等. 饮水硼对大鼠舌和胃黏膜组织结构的影响[J]. 中国兽医学报,2008,8(11):1329-1334.
LI S H, PENG K M, MA Y C, et al. Effect of drinking boron on structure of lingual mucous membrane and gastricmucosa in rats[J].ChineseJournalofVeterinaryScience, 2008, 8(11):1329-1334. (in Chinese with English abstract)
[32] NIELSEN F H, MEACHAM S L. Growing evidence for human health benefits of boron[J].JournalofEvidence-BasedComplementaryandAlternativeMedicine, 2011, 16(3):169-180.
[33] HU Q, LI S, QIAO E, et al. Effects of boron on structure and antioxidative activities of spleen in rats[J].BiologicalTraceElementResearch, 2014, 158(1):73-80.
[34] WINTER H, VAN DEN ENGEL N K, RÅTTINGER D, et al. Therapeutic T cells induce tumor-directed chemotaxis of innate immune cells through tumor-specific secretion of chemokines and stimulation of B16BL6 melanoma to secrete chemokines[J].JournalofTranslationalMedicine, 2007, 5:56.
[35] GONZALES J R, GRÖGER S, BOEDEKER R H, et al. Expression and secretion levels of Th1 and Th2 cytokines in patients with aggressive periodontitis[J].ClinicalOralInvestigation, 2012, 16(5):1463-1473.
[36] MONTGOMERY J B, WICHTEL J J, WICHTEL M G, et al. Effects of selenium source on measures of selenium status and immune function in horses[J].JournalofEquineVeterinaryScience, 2012, 32(6):352-359
[37] ARMSTRONG T A, SPEARS J W. Effect of boron supplementation of pig diets on the production of tumor necrosis factor-alpha and interferon-gamma[J].JournalofAnimalScience, 2003, 81(10):2552-2561.
[38] 董栅杉. 饮水硼对雌性大鼠血液生理指标的影响[J]. 天津师范大学学报(自然科学版),2015,35(3):130-133.
DONG S S. Effect of drinking boron on blood physiological parameters of female rats[J].JournalofTianjinNormalUniversity(NaturalScienceEdition), 2015, 35(3):130-133. (in Chinese with English abstract)
[39] FAIRBROTHER A, FIX M, O’HARA T, et al. Impairment of growth and immune function of avocet chicks from sites with elevated selenium, arsenic, and boron[J].JournalofWildlifeDiseases, 2015, 30(2):222-233.
[40] 孙春阳,邢焕,栾素军,等. 葡萄糖氧化酶和酵母硒复合添加剂对肉鸡生长性能、抗氧化性能及肉品质的影响[J]. 动物营养学报,2014,26(9):2789-2796.
SUN C Y, XING H, LUAN S J, et al. Effects of compound additive with glucose oxidase and selenium yeast on growth performance, antioxidant capacity and meat quality of broilers[J].ActaZoonutrimentaSinica, 2014, 26(9):2789-2796. (in Chinese with English abstract)
[41] TURKEZ H, GEYIKOGLU F. Boric acid: a potential chemoprotective agent against aflatoxin b1 toxicity in human blood[J].Cytotechnology, 2010, 62(2):157-165.
(责任编辑卢福庄)
Combinedeffectsofyeastseleniumandborononstructureofimmuneorgansandimmunefunctionofbroilers
JIN Erhui, ZHOU Jinxing, REN Man, Hu Qianqian, JIN Guangming, LI Shenghe*
(CollegeofAnimalScience,AnhuiScienceandTechnologyUniversity,Fengyang233100,China)
In order to study the combined effects of yeast selenium and boron on development of immune organ and immune function of broilers, a total of 1 200 one-day-old AA broilers were randomly divided into five groups, the control group and the experimental groups Ⅰ, Ⅱ, Ⅲ and Ⅳ. Each group included 6 pens and 40 birds per pen. The control group was given a basic diet, while experimental groups Ⅰ, Ⅱ, Ⅲ and Ⅳ were given basic diets supplemented with 0.3 mg·kg-1yeast selenium and different doses of boron (0, 5, 10, 15 mg·kg-1) for 42 days, respectively. The results showed as follows: 1) Compared with the control group at 21 days of age, the indexes of bursa of Fabricius and the areas of splenic node, periarterial lymphatic sheath and bursa nodule of Fabricius of broilers in experimental group Ⅱ and Ⅲ were significantly (P<0.05) increased; SerumNewcastlediseasevirus(NDV) antibody and interferon-γ (INF-γ) levels of broilers in experimental group Ⅱ and the serum interleukin-2 (IL-2) contents of broilers in experimental group Ⅲ were also significantly (P<0.05) increased. 2) Compared with the control group at 42 days of age, the indexes of thymus and bursa of Fabricius, and the levels of serum NDV antibody and IL-2, and the areas of splenic node, periarterial lymphatic sheath and bursa nodule of Fabricius of broilers in experimental group Ⅱ and Ⅲ were significantly (P<0.05) increased; the serum IgG and IFN-γ levels of broilers in experimental group Ⅱ were also significantly (P<0.05) increased; The indexes of thymus and bursa of Fabricius and serum IgG levels of broilers in experimental group Ⅰ were significantly (P<0.05) increased. Microscopic observation also showed that at 21 and 42 days of age, the microstructure of immune organs were improved in broilers of experimental group Ⅱ and Ⅲ, such as the structure of white pulp and red pulp of the spleen were clear, the boundary of thymus cortex and medulla was obvious, the node number of bursa of Fabricius were increased and the arrangement was compacted, and the size of bursa of Fabricius lobule also significantly (P<0.05) increased in experimental group Ⅰ. In conclusion, either the alone supplementation of yeast selenium or combined supplementation of yeast selenium and different doses of boron could promote the development of immune organs, improve microstructure and enhance the immune function of broiler to a certain extent, and combined supplementation of 0.3 mg·kg-1yeast selenium and 5-10 mg·kg-1boron had more obvious beneficial effects.
yeas selenium; boron; broiler; immune organ; tissue structure; immune function
靳二辉,周金星,任曼,等. 酵母硒和硼联合添加对肉鸡免疫器官组织结构及免疫功能的影响[J].浙江农业学报,2017,29(11): 1783-1795.
10.3969/j.issn.1004-1524.2017.11.03
2017-04-11
国家自然科学基金(31402154,31502137,31672502);国家星火计划项目(2015GA710015);安徽省教育厅重点项目(KJ2017A505,KJ2016A823);安徽省农业科技成果转化项目(1504032001);安徽科技学院科研基金重点项目(ZRC2016476,ZRC2013354);安徽省第七批“115”产业创新团队项目(皖人才[2014] 4号);安徽科技学院重点建设学科项目(AKZDXK2015A04)
靳二辉(1976—),男,河南汝州人,博士,副教授,主要从事动物解剖与组织学研究。E-mail: jineh@ahstu.edu.cn
*通信作者,李升和,E-mail: lishhe2005@163.com
S831
A
1004-1524(2017)11-1783-13

